2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
尽管洛雷托·贝利尼(1643—1704年)早在1665年就发表了《味觉器官》专著,并且描述了味觉乳头的形态。然而,直到20世纪初,对人的化学感应器官——舌,能感应甜味、酸味、咸味、苦味和鲜味5种基础味觉的研究才系统地开展起来。这5种味道由各不相同的味觉细胞和味觉神经所识别和检测,进一步的研究证实,味觉器官除动物的舌头外,还包括胃肠道等其他部位。总体而言,味觉感应包括两大系统,分别是口腔味觉系统和胃肠道感觉系统[1]。此后,科学家又历时近百年相继鉴定出各种味觉受体,如味觉受体第一家族(taste receptor family 1 member,T1R)的甜味受体T1R2/T1R3,从而建立了各种味道的营养物质与味觉受体之间的相关联系。 在研究过程中,味觉细胞内参与味觉感应的许多重要的下游因子或第二信使又被发现,如味觉G蛋白味蛋白(gustducin,Ggust),并且对它们之间的作用机制有了一定的认识[2]。然而,目前对复杂的味觉信号转导机制的了解还远远不足,仍有待深入研究。有鉴于此,本文综述了5种味觉受体和味觉感应的最新研究进展,并提出了未来相关领域的研究预期,旨在为进一步深入了解味觉感应信号转导机制提供参考。
1 味觉受体的种类对哺乳动物而言,味觉受体通常可以分为甜味受体、苦味受体、酸味受体、咸味受体和鲜味受体5类,下文逐一对这5种味觉受体进行阐述。
1.1 甜味受体T1R2/T1R3是主要的甜味受体,可以对所有的甜味物质做出反应,包括天然糖、人工甜味剂、D-氨基酸和具有强烈甜味的蛋白质[3]。T1R2/T1R3是异源二聚体复合物,其中T1R2和T1R3属于T1R,该家族还包括另一个成员T1R1。T1R属于C类Ⅰ型G蛋白耦联受体(guanosine-binding protein coupled receptor,GPCRs)超家族。GPCRs的结构特点是有1个细胞外氨基末端片段、7个跨膜α螺旋组成的跨膜结构域(seven-transmembrane domain,TMD)、3个胞外环、3个胞质环和1个羧基末端片段,胞外大的捕蝇夹域(venus flytrap domain,VFTD)与小的半胱氨酸富集域(cysteine-rich domain,CRD)相连[2],其中较长的细胞外氨基末端结构域被认为是受体与配体的识别和结合的部位[3]。T1R与钙敏感受体(calcium-sensing receptor,CaR)、V2R信息素受体和代谢型谷氨酸受体(metabotropic glutamate receptor,mGluRs)远缘相关,它们具有相似的结构特点。不同物种之间对甜味物质的敏感性和选择性存在差异,这也源于T1R配体在物种之间的特异性[3]。
钠依赖型葡萄糖转运载体1(sodium-dependent glucose transporter isoform 1,SGLT1)在消化道内也发挥甜味受体的功能,它是糖类物质从肠道进入肠上皮细胞和肠内分泌细胞的主要途径。研究证实,糖和人工甜味剂可以提高野生型小鼠肠上皮细胞SGLT1 mRNA和蛋白质的表达以及对葡萄糖的吸收能力;人工甜味剂作用于肠内分泌细胞的GLUTag细胞后能刺激消化道激素分泌,同时导致SGLT1 mRNA的表达上调;许多哺乳动物肠上皮SGLT1 mRNA的表达直接受消化道内单糖的调控,且不能透过膜的葡萄糖类似物进入肠腔时也会刺激SGLT1 mRNA的表达[4]。
参与感受甜味的受体还包括瞬时受体电势(transient receptor potential,TRP)蛋白,它是构成离子通道的一个大的基因家族,根据序列同源分为6个亚家族(TRPC、TRPV、TRPM、TRPML、TRPP和TRPA),TRP电位离子通道在不同物种不同的感受系统中是必需信号成分,这些物种包括哺乳动物、鱼、果蝇和线虫等,感觉系统包括视觉、味觉、信息素、听觉、触觉、渗透压、热敏性、甜味、苦味和鲜味等,其中,瞬时受体电势通道M5(transient receptor potential channel type melastatin 5,TRPM5)在味觉细胞中大量表达,除了参与甜味感应外,还参与鲜味和苦味感应[5-6]。有研究表明,TRPM5的活性对温度具有强烈的依赖性,正常活化温度为15~35 ℃[7]。
1.2 苦味受体苦味受体属于一个大家族即味觉受体第二家族(taste receptor family 2 member,T2R),由大约30个T2R受体家族成员组成。在大鼠和小鼠基因组有36个真T2R基因,拟基因的数量和位点有微小差异,在人基因组中有25个T2R基因,T2R序列在各个物种之间变异较大。研究发现,小鼠T2R5可以与放线菌酮特异反应,放线菌酮是一种苦味剂,对放线菌酮反应能力不足的小鼠,其T2R5基因存在氨基酸置换,从而显著地改变了受体对放线菌酮的反应能力。此外,人T2R4和小鼠T2R8可与苯甲地那铵和6-N-丙基-2-硫尿嘧啶反应[8]。由于啮齿类动物比人多30%的苦味受体,因而啮齿类动物有更宽的苦味检测谱[4]。苯酸苄铵酰胺(denatonium benzoate,DB)是能被人感知的最苦的物质,研究发现识别DB的有hT2R4、mT2R108、hT2R44和mT2R120等受体[9]。
1.3 酸味受体酸味受体PKD2L1和PKD1L3共存于感知酸味物质的味觉受体细胞中。近年来通过对酸味转导过程的研究,发现了一些候选的酸味受体,如大鼠中感受酸味的离子通道(acid-sensing ion channel,ASIC),但是小鼠无ASIC;超极化活化环核苷酸门控(hyperpolarization-activated cyclic nucleotide-gated,HCN)通道成员HCN1和HCN4亦可能是酸味通道,但使用味蕾切片进行的钙成像试验并不支持该观点,因为HCN的抑制剂铯离子(Cs+)没有阻断味觉细胞受酸刺激时的钙离子(Ca2+)反应;双孔钾离子(K+)通道成员也被提出可能在酸味信号传递过程中起作用;氢离子(H+)门控钙离子通道、钠离子(Na+)/H+交换器和酸钝化K+通道也可能与酸味感应有关[3];其他潜在的酸味受体仍需要进一步研究[5]。
1.4 咸味受体特异性钠盐味觉受体是上皮钠离子通道(epithelial-sodium channel,ENaC),非特异性钠盐味觉受体是辣椒素受体-1非选择性阳离子通道(vanilloid receptor-1 nonselective cation channel,TRPV1)。ENaC是哺乳动物特异性Na+味觉受体,并且大多数哺乳动物会有至少一种非特异性咸味受体即非选择性阳离子受体,如氯化钾(KCl)和氯化铵(NH4Cl)等[10]。多囊性肾病通道(polycystic kidney disease channel)也可能参与咸味的传递[10]。
1.5 鲜味受体研究表明,多种GPCRs与鲜味有关,包括T1R1/T1R3、mGluR1~4和一些互变异构谷氨酸受体,如N-甲基-D-天冬氨酸(NMDA)受体和红藻氨酸受体,且研究发现在体外条件下mGluR4对谷氨酸敏感[11]。嘌呤核苷酸如肌苷单磷酸(inosine-5-monophosphate,IMP)和鸟苷单磷酸(guanosine-5-monophosphate,GMP)本身具有鲜味且是鲜味增强物质,IMP和GMP可选择性地与谷氨酸(Glu)、天冬氨酸和L-2-氨基-4磷甲酸盐反应[2]。
目前研究最深入的鲜味受体是T1R1/T1R3,其与T1R2/T1R3类似,是一个异源二聚体复合物,存在T1R配体物种间特异性[12]。例如,人类T1R1/T1R3与L-Glu和天冬氨酸特异性反应,L-Glu与T1R1/T1R3的结合位点在T1R1的VFTD铰链区,且该区域的5个残基对其结合很重要,人鲜味受体增强剂与T1R1的VFTD相互作用,IMP结合位点靠近T1R1的VFTD开口处,进一步稳定闭合构像。而鼠的T1R1/T1R3具有广谱性,几乎可以识别所有的L-氨基酸,但较之其他氨基酸,T1R1/T1R3对酸性氨基酸的结合能力弱许多[12]。
此外,L-氨基酸可由CaR识别。细胞外CaR是多模式感受器,属于C类GPCRs,可识别几个关键营养成分,特别是Ca2+和L-氨基酸。系统性研究20种标准氨基酸发现,与CaR结合时L-氨基酸比D-氨基酸有效,芳香族氨基酸最强,碱性氨基酸和支链氨基酸无效。用嵌合体受体分析证实氨基酸与CaR在VFTD结合,大鼠mGlu-1受体与CaR的VFTD结合后,仍然可以感受氨基酸,如果CaR的VFTD不完整则不能感受氨基酸[13]。
1.6 味觉信号分子Ggust是一个异源三聚体蛋白,包括α、Gβ3和Gγ13共3个亚基。动物体内和体外试验研究均证实味觉信号传递与Gαgust关联,味觉受体能选择性与味觉受体结合。转导蛋白(transducin,Gt)与Ggust相似,也是异源三聚体G蛋白,参与味觉信号转导。磷脂酶Cβ2(phospholipase Cβ2,PLCβ2)是存在于胞浆膜上的一个关键酶,能催化二磷酸磷脂酰肌醇(phosphatidylinosital biphosphate,PIP2)分解产生1,4,5-肌醇三磷酸(inositol trisphosphate,IP3)和二酰甘油(diacylglycerol,DAG)2个第二信号分子[11]。
2 味觉受体及味觉信号分子的分布味觉受体细胞总体构成哺乳动物味觉系统,对摄取或拒绝食物以保护机体避免有害毒素侵袭,以及选择营养物质起关键作用。舌头上分布的许多小突起,即舌乳头,可分为轮廓状、叶状和菌状乳头以及上颚,舌乳头上的味蕾形似洋葱,每个味蕾含50~100个(物种间有差异)有微绒毛的味觉细胞[3,14],可分为Ⅰ型、Ⅱ型和Ⅲ型细胞[15],这些味觉细胞组成口腔味觉感应;在味觉感应和转导过程中的许多受体和下游信号单元在肠内分泌细胞和刷细胞中表达,内分泌细胞虽然在数量上的比重小于整个肠道的1%,但却可看作身体最大的内分泌器官,可以产生和分泌超过20种激素[16],这些肠内分泌细胞和刷细胞构成了消化道味觉感应的基础[9]。
最初研究发现T1R在人类胚胎肾细胞中有分布,后续研究发现,T1R在味觉组织选择性分布。原位杂交结果显示T1R1和T1R2之间有不同的表达模式,T1R1在味蕾菌状乳头分布较多,T1R2在味蕾轮廓状乳头分布较多[2]。除此之外,T1R在小肠L型内分泌细胞均有表达,同时还存在Ggust 3个亚基、TRPM5和PLCβ2。人类十二指肠L型细胞存在整个味觉信号通路,并且已在胃和胰腺细胞中发现Gαgust[17]。大鼠和小鼠胃肠道细胞提取的mRNA再进行反转录PCR(RT-PCR)获得的转录本序列分析证实Gαgust和Gαt在大鼠和小鼠胃肠道细胞表达,免疫反应性研究也得出相同结果,但Gαgust和Gαt-2在黏膜胃黏膜不同类型的上皮细胞中表达[18],在啮齿类动物胃和十二指肠黏膜中也存在Gαgust和Gαt的转录本。进一步研究发现,Gαgust在胃腺体上部、峡部和表面上皮部表达,胃窦黏膜富含Gαgust而少含Gαt-2[8],Gαgust也在大鼠胃、十二指肠和胰管的刷细胞中表达;在小鼠结肠黏膜,表面上皮的细长细胞和腺状上皮的圆形细胞中也存在Gαgust表达[9]。在小鼠和大鼠的胃,发现表达Ggust的刷细胞明显聚集在所谓的“限制脊”,即角质化胃底和腺体上皮之间,包括食管口;并且,限制脊的大多数刷细胞能表达T1R3,为糖和氨基酸的感知奠定基础[19]。Toko[20]应用免疫组织化学和PCR技术研究肠黏膜发现,T1Rs、Gαgust、PLCβ2和TRPM5等在人和大鼠的胃、小肠和结肠中均有表达,但T1R2在人和小鼠的胃及小鼠结肠不表达。使用能表达增强绿色荧光蛋白的转基因鼠控制TRPM5的启动子发现TRPM5和Gαgust共定位于结肠上皮表层刷细胞,但是这些细胞不表达T1R3或PLCβ2。在十二指肠腺,分别有43%、33%和38%表达TRPM5的细胞表达PLCβ2、T1R3和Gαgust。能共同表达PLCβ2和TRPM5的十二指肠腺细胞在形态学上与肠内分泌细胞相似。研究还发现TRPM5、Gαgust、T1R1和T1R3在十二指肠绒毛刷细胞共定位,但是这些细胞很少表达PLCβ2,这些细胞可能与感受氨基酸有关[11]。SGLT1主要在肠上皮细胞中表达,而酸味受体蛋白通常分布在味觉细胞的基底外侧膜,具体分布有待进一步研究。
T2R成员在小鼠、大鼠、人和的消化道都有表达,也存在于人和啮齿类动物的胰腺。又有研究证实T2R可在大鼠肠内分泌细胞和鼠科肠内分泌细胞系STC-1中表达[21]。
用大鼠和小鼠组织研究发现,除味蕾外,在味受体细胞(taste-receptor cell,TRC)的基底层TRPM5也显著表达,在嗅觉上皮和犁鼻器中具有免疫活性,并且在呼吸道和胃肠道的刷细胞中也有发现。除此之外,最近研究苦味信号通路及其效应与气管之间的关系,发现分布在气管上的刷细胞表达苦味受体及下游信号分子Gα、PLCβ2和乙酰胆碱合成酶[1,22-23]。
CaR广泛分布于胃、小肠、大肠的上皮细胞和神经元等,分别如下:分泌胃酸的胃壁细胞、分泌胃蛋白酶原的胃腺主细胞和分泌黏液的细胞,CaR还在胃窦区分泌胃泌素的细胞中表达;在小肠表达于肠绒毛和隐窝细胞、黏膜下层布氏腺上皮细胞;在结肠,CaR在隐窝细胞顶膜和基底外侧膜均有表达;胰腺腺泡细胞基底膜和胰管细胞顶膜上有表达;胃肠的黏膜下层和肌间神经丛中的神经元也有表达;在肝脏表达还不清楚[13]。
3 味觉受体感应味觉受体与味觉物质结合后开始味觉感应,分子机制相当复杂且不完全清楚[8]。最近的研究结果显示,虽然不同的味觉受体在不同的细胞中表达,但是所有的信号通过相似的通路将味道物质传到细胞导致细胞活化[3,24]。从简单的离子到复杂的结构均可作为刺激物,使细胞膜去极化后释放一系列信号分子,如激素或神经细胞因子,经不同的转导途径作用于细胞或神经[25]。离子刺激(如氨基酸)可直接与离子通道相互作用激活味觉受体细胞,使细胞膜去极化并开启Ca2+电压门控通道,Ca2+进而内流进入细胞,其下游效应如图 1:受体结合活化Gβ3γ13,进而激活PLCβ2,PLCβ2活化产生第二信使IP3和DAG[11]。其中,IP3与Ⅲ型肌醇三磷酸受体(type Ⅲ IP3 receptor,IP3R3)结合,导致细胞内储存区的Ca2+释放以及活化调节Ca2+依赖的一价离子通道TRPM5,TRPM5参与将信号传到味觉细胞和味觉传入神经这一过程,TRPM5可迅速活化和失活,使味觉细胞细胞膜瞬时去极化,Na+内流,释放ATP,ATP作为神经递质,活化味觉传入神经纤维上的嘌呤受体[4,7],将味觉信息传递给味觉神经后,味觉神经再支配味蕾活动。在菌状乳头和上颚中,Gαgust或Gαt激活味觉细胞上的磷酸二酯酶(phosphodiesterase,PDE)降低细胞内环核苷酸(cAMP)浓度,在轮廓状和叶状味蕾中,Gαgust活化也可使cAMP浓度降低,但可能是通过抑制腺苷酸环化酶(adenylyl cylase,AC)来实现,cAMP的靶点目前并不十分清晰,可能在调控磷脂酶C(PLC)途径的敏感性中起作用[14]。当糖作用时Gα可激活AC使cAMP浓度升高,但苦味分子使PDE活化结果导致cAMP和环鸟苷一磷酸浓度降低。酸味细胞内Ca2+升高,可激活基底外侧Na+-H+交换异构体-1(sodium-hydrogen exchanger isoform-1),进而维持酸味反应的强直阶段。感受酸味的细胞一部分会因细胞内pH降低可直接感应酸味,可在酸味神经反应阶段和强直阶段输入信号进而分离转导通路。胃肠道是食物与身体进行物质交换的重要接口,其内部味觉样细胞利用与口腔相同的信号转导系统将营养信息传到迷走神经,进而传往中枢神经系统[1,23],其中,肠-脑轴发挥了关键作用[25]。
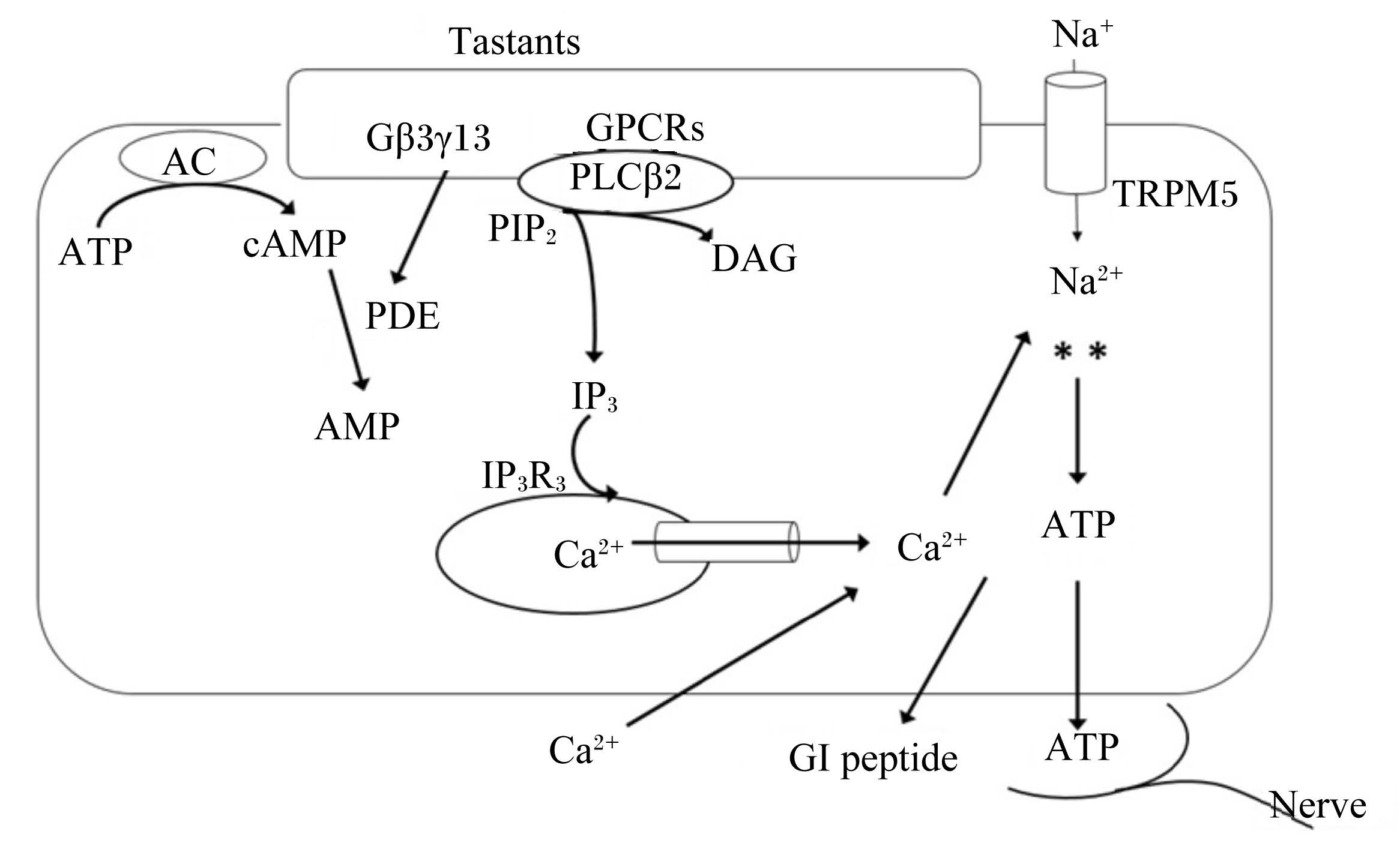
|
Tastants:促味剂;GPCRs:G蛋白耦联受体 guanosine-binding protein coupled receptors;AC:腺苷酸环化酶 adenylyl cylase;PDE:磷酸二酯 phosphodiesterase;PIP2:二磷酸磷脂酰肌醇 phosphatidylinosital biphosphate;PLCβ2:磷脂酶Cβ2 phospholipase Cβ2;DAG:二酰甘油diacylglycerol;IP3R3:Ⅲ型肌醇三磷酸受体 type Ⅲ IP3 receptor;TRPM5:瞬时受体电势通道M5 transient receptor potential channel type melastatin 5;GI peptide:胃肠肽;Nerve:神经。 图 1 细胞内味觉感应 Figure 1 Taste sensing in cells[1] |
目前认为黏膜层肠内分泌细胞作为对腔道内环境改变响应的初级化学受体,可释放信号分子激活神经末梢。胃肠道内的肠内分泌细胞是一类终端分化细胞,与其他上皮细胞混合在一起。它们能对胃肠腔内组分改变做出响应,释放多种信号分子。一类肠内分泌细胞利用其伸向肠腔的微绒毛直接感受组分变化,这种微绒毛被认为是特化的传感器。肠内分泌细胞的化学感应主要通过释放激素来实现,包括胆囊收缩素(cholecystokinin,CCK)、酪酪肽(peptide tyrosine tyrosine,PYY)、神经降压素、胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)、胰高血糖素样肽-2(glucagon-like peptide-2,GLP-2)和葡萄糖依赖促胰岛素释放肽(glucose-dependent insulinotropic peptide,GIP)等,还有饥饿素、食欲素A和5-羟色胺等,这些跟采食量有关,如十二指肠和空肠的I细胞分泌CCK,回肠和结肠的L细胞可分泌GIP-1、GLP-1或PYY;一类肠内分泌细胞主要分布在基底膜,如产组胺肠嗜铬细胞样细胞,它们主要产肽,或进入血液,发挥作用方式类似激素,作用于消化系统的其他部分,或经细胞外液以旁分泌的形式作用于近旁结构,包括神经纤维等。
采用口服和静脉注射2种方式为动物机体补充摄入葡萄糖的研究发现,口服方式更易提高血浆胰岛素浓度,这种效应被称为肠促胰岛素效应,并且发现该效应先由GLP-1介导[26]。GLP-1是一种肠促胰岛素,许多因素可刺激GLP-1的分泌,尤其是营养物质的直接刺激,如碳水化合物和脂肪。GLP-1分泌由甜味受体介导,其中T1R3起关键作用,GLP-1的功能包括提高胰腺胰岛素分泌,降低胰高血糖素释放,影响葡萄糖的运输、代谢和稳衡,延迟胃排空和降低食欲,以减少有毒物质(多为苦味)进入消化道,发挥保护性功能[26-27]。研究发现,敲除Ggust或T1R3的小鼠在摄入碳水化合物后出现肠促胰岛素效应功能异常。从敲除Ggust小鼠分离小肠和肠绒毛发现用葡萄糖处理后存在显著的GLP-Ⅰ分泌缺陷,表明这些肠细胞在感应糖后与激素分泌之间存在局部环路。研究发现,经胃灌服的葡萄糖、半乳糖、果糖、3-O-甲基-D-葡萄糖和α-甲基-D-葡萄糖等进入肠腔后提高了肠上皮SLGT1的表达,刺激大鼠、猪和人分泌GLP-1和GIP,此外,体外条件下添加GIP到肠组织浆膜侧后也能提高肠上皮SGLT1的表达。进一步研究发现葡萄糖和半乳糖进入肠细胞是通过SGLT1,果糖则是通过另一个顶端转运载体葡萄糖转运载体(glucose transporter,GLUT)5,之后经肠细胞基底膜GLUT2被动地从肠细胞进入血液。饮食可调控肠细胞SGLT1的表达,高碳水化合物或糖分充足膳食或添加三氯蔗糖增加甜味的饮用水能提高SGLT1的表达和葡萄糖摄取能力,食物中的糖分刺激味觉信号分子促进肠内分泌细胞激素分泌,这些激素反过来调控肠上皮细胞GLUT2的表达。上述甜味信号分子在消化道内的功能与在口腔中相似,但在消化道内主要是通过体液性介质传导信号而非通过味觉传入神经[17]。
T1R3存在于2种不同的细胞群体,一种是开放型刷细胞,另一种是闭合型产饥饿素内分泌细胞。饥饿素释放细胞可以感受肠腔和血液刺激,可作为感受细胞,亦可作为效应细胞,调节激素释放。在限制脊处开放型刷细胞和产饥饿素内分泌细胞之间是紧密连接的,饮食后血液葡萄糖和游离氨基酸浓度升高会瞬间抑制饥饿素的释放,当血糖水平急剧下降时,机体会提高饥饿素分泌水平来刺激采食以中和低血糖状态。T1R3与监控血液血糖浓度有关,在胰岛B细胞和下丘脑细胞中也有发现。所以,可依赖T1R3调节饥饿素释放,进而调节血清葡萄糖和游离氨基酸浓度[4]。
苦味物质引起肠内分泌细胞STC-1分泌CCK,如DB可引起胞内Ca2+浓度升高并依赖Ca2+流入STC-1细胞,进而打开L型电压敏感型钙通道(VSCCs),刺激CCK释放;亦有研究发现苦味化合物引起大鼠胃排空延迟,产生厌食,PYY也引起厌食反应,在脂肪酸和其他营养物质作用下释放,是采食量的主要调节器[4]。在气管刷细胞中,苦味物质在激活苦味信号通路后促进细胞释放乙酰胆碱,降低呼吸速率[1]。
4 小 结味觉受体广泛表达于舌上皮和胃肠道这2种组织和器官,它们可以感受多种信号包括营养和非营养物、机械因素、微生物、药物和毒物等。舌和胃肠道细胞分子感应在许多基础功能方面起重要的作用,包括采食、消化和吸收、体液调节和启动神经通路等方面,进而可以调控能量摄入、激素分泌和代谢等功能,因此,味觉系统的研究具有重要的科学意义。同时,最新研究发现气管中也存在苦味信号转导,但是,该过程具体如何发生尚不清楚,气管是否存在其他味觉信号通路也不了解。由此可见,味觉受体和味觉信号通路中的许多信号转导分子还有待鉴定,效应细胞和神经通路也需要进一步研究。
此外,对味觉系统的研究也具有重要的临床意义。如苦味成为警惕毒物的重要信号,可以防止动物摄入有毒物质,尤其是对放牧条件下的动物饲养具有实践意义;摄入大量酸味物质会增加动物肺和肾负担,降低口腔中pH,直接造成动物牙釉质脱矿质,间接促进耐酸细菌生长,进而影响动物牙齿健康,降低采食,影响动物生产效率等。因此,通过充分理解营养感应路径及其调控机制,不仅能有效地控制动物采食,而且可为解决动物代谢综合症和营养不良提供饲粮优选方案。
| [1] | IWATSUKI K, UNEYAMA H. Sense of taste in the gastrointestinal tract[J]. Journal of Pharmacological Sciences, 2012 , 118 (2) : 123 –128. DOI: 10.1254/jphs.11R08CP |
| [2] | LI X D. T1R receptors mediate mammalian sweet and umami taste[J]. American Journal of Clinical Nutrition, 2009 , 90 (3) : 733S –737S. DOI: 10.3945/ajcn.2009.27462G |
| [3] | CHANDRASHEKAR J, HOON M A, RYBA N J P, et al. The receptors and cells for mammalian taste[J]. Nature, 2006 , 444 (7117) : 288 –294. DOI: 10.1038/nature05401 |
| [4] | HASS N, SCHWARZENBACHER K, BREER H. T1R3 is expressed in brush cells and ghrelin-producing cells of murine stomach[J]. Cell and Tissue Research, 2010 , 339 (3) : 493 –504. DOI: 10.1007/s00441-009-0907-6 |
| [5] | KASKE S, KRASTEVA G, KÖNIG P, et al. TRPM5,a taste-signaling transient receptor potential ion-channel,is a ubiquitous signaling component in chemosensory cells[J]. BMC Neuroscience, 2007 , 8 (1) : 49 . DOI: 10.1186/1471-2202-8-49 |
| [6] | ISHIMARU Y, INADA H, KUBOTA M, et al. Transient receptor potential family members PKD1L3 and PKD2L1 form a candidate sour taste receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006 , 103 (33) : 12569 –12574. DOI: 10.1073/pnas.0602702103 |
| [7] | TALAVERA K, YASUMATSU K, VOETS T, et al. Heat activation of TRPM5 underlies thermal sensitivity of sweet taste[J]. Nature, 2005 , 438 (7070) : 1022 –1025. DOI: 10.1038/nature04248 |
| [8] | STERNINI C. Taste receptors in the gastrointestinal tract.IV.Functional implications of bitter taste receptors in gastrointestinal chemosensing[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2007 , 292 (2) : G457 –G461. |
| [9] | ROZENGURT E. Taste receptors in the gastrointestinal tract.Ⅰ.Bitter taste receptors and α-gustducin in the mammalian gut[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2006 , 291 (2) : G171 –G177. DOI: 10.1152/ajpgi.00073.2006 |
| [10] | DESIMONE J A, LYALL V. Taste receptors in the gastrointestinal tract Ⅲ.Salty and sour taste:sensing of sodium and protons by the tongue[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2006 , 291 (6) : G1005 –G1010. DOI: 10.1152/ajpgi.00235.2006 |
| [11] | BEZENÇON C, COUTRE J L, DAMAK S. Taste-signaling proteins are coexpressed in solitary intestinal epithelial cells[J]. Chemical Senses, 2007 , 32 (1) : 41 –49. DOI: 10.1093/chemse/bjl034 |
| [12] | TODA Y, NAKAGITA T, HAYAKAWA T, et al. Two distinct determinants of ligand specificity in T1R1/T1R3(the umami taste receptor)[J]. The Journal of Biological Chemistry, 2013 , 288 (52) : 36863 –36877. DOI: 10.1074/jbc.M113.494443 |
| [13] | CONIGRAVE A D, BROWN E M. Taste receptors in the gastrointestinal tract.Ⅱ.L-amino acid sensing by calcium-sensing receptors:implications for GI physiology[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2006 , 291 (5) : G753 –G761. DOI: 10.1152/ajpgi.00189.2006 |
| [14] | KINNAMON S C. Umami taste transduction mechanisms[J]. The American Journal of Clinical Nutrition, 2009 , 90 (3) : 753S –755S. DOI: 10.3945/ajcn.2009.27462K |
| [15] | KIKUT-LIGAJ D, TRZCIELINSKA-LORYCH J. How taste works:cells,receptors and gustatory perception[J]. Cellular and Molecular Biology Letters, 2015 , 20 (5) : 699 –716. |
| [16] | TOLHURST G,REIMANN F,GRIBBLE F M.Intestinal sensing of nutrients[M]//JOOST H G.Appetite control.Berlin Heidelberg:Springer,2012:309-335. |
| [17] | KOKRASHVILI Z, MOSINGER B, MARGOLSKEE R F. Taste signaling elements expressed in gut enteroendocrine cells regulate nutrient-responsive secretion of gut hormones[J]. The American Journal of Clinical Nutrition, 2009 , 90 (3) : 822S –825S. DOI: 10.3945/ajcn.2009.27462T |
| [18] | WU S V, ROZENGURT N, YANG M, et al. Expression of bitter taste receptors of the T2R family in the gastrointestinal tract and enteroendocrine STC-1 cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002 , 99 (4) : 2392 –2397. DOI: 10.1073/pnas.042617699 |
| [19] | HÖFER D, PVSCHEL B, DRENCKHAHN D. Taste receptor-like cells in the rat gut identified by expression of alpha-gustducin[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996 , 93 (13) : 6631 –6634. DOI: 10.1073/pnas.93.13.6631 |
| [20] | TOKO K. Taste sensor[J]. Journal of the Food Hygienic Society of Japan, 2000 , 41 (5) : J336 –J341. |
| [21] | CHANDRASHEKAR J, MUELLER K L, HOON M A, et al. T2Rs function as bitter taste receptors[J]. Cell, 2000 , 100 (6) : 703 –711. DOI: 10.1016/S0092-8674(00)80706-0 |
| [22] | DESHPANDE D A, WANG W C H, MCLLMOYLE E L, et al. Bitter taste receptors on airway smooth muscle bronchodilate by localized calcium signaling and reverse obstruction[J]. Nature Medicine, 2010 , 16 (11) : 1299 –1304. DOI: 10.1038/nm.2237 |
| [23] | TIZZANO M, GULBRANSEN B D, VANDENBEUCH A, et al. Nasal chemosensory cells use bitter taste signaling to detect irritants and bacterial signals[J]. Proceedings of the National Academy of Science of the United States of America, 2010 , 107 (7) : 3210 –3215. DOI: 10.1073/pnas.0911934107 |
| [24] | DEPOORTERE I. Taste receptors of the gut:emerging roles in health and disease[J]. Gut, 2014 , 63 (1) : 179 –190. DOI: 10.1136/gutjnl-2013-305112 |
| [25] | FOURNEL A, MARLIN A, ABOT A, et al. Glucosensing in the gastrointestinal tract:impact on glucose metabolism[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2016 , 310 (9) : G645 –G645. DOI: 10.1152/ajpgi.00015.2016 |
| [26] | EGAN J M, MARGOLSKEE R F. Taste cells of the gut and gastrointestinal chemosensation[J]. Molecular Interventions, 2008 , 8 (2) : 78 –81. DOI: 10.1124/mi.8.2.5 |
| [27] | IAKOUBOV R, LAUFFER L M. T1R3:how to indulge the gut's sweet tooth[J]. American Journal of Physiology-Endocrinology and Metabolism, 2012 , 303 (7) : E813 –E814. DOI: 10.1152/ajpendo.00418.2012 |




