2. 中国科学院亚热带 农业生态研究所, 中国科学院亚热带农业生态过程重点实验室, 长沙 410125
2. Key Laboratory of Agro-Ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China
为了增加年产仔窝数,避免母猪和仔猪疾病交叉感染,增加经济效益,生产上通常对仔猪实行早期断奶(3~4周龄)。然而由于断奶应激影响了仔猪肠道组织的形态结构和消化道的微生态区系平衡、免疫系统和酶系统的发育和健全[1]以及肠道黏膜细胞的更新,断奶仔猪很容易患有“仔猪早期断奶综合征”,具体表现为采食量下降、消化系统紊乱、腹泻、饲料利用率降低、生长滞后等不良现象。
谷氨酰胺(glutamine,Gln)是哺乳动物血浆和母畜乳汁中的一种常见游离氨基酸,是体内许多重要物质(如蛋白质、嘌呤、嘧啶和核苷酸等)合成所需的前体物质,同时也是肠上皮细胞增殖的重要能源物质。因此,Gln在促进肠黏膜的更新和保持肠道结构等方面具有重要意义。
1 Gln在肠道中的代谢 1.1 Gln在肠道中的代谢途径Gln是物质与能量代谢中重要的物质,Gln的氨基氮可以合成嘌呤、嘧啶和氨基糖,碳链和氨基基团可以合成其他氨基酸,如脯氨酸,鸟氨酸和精氨酸(图 1)[1],Gln不仅能进入三羧酸循环氧化供能[2],也可作为肝脏内合成肝糖元的前体物质[3],是肠道利用的主要能源物质[4]。Gln在肠道中的代谢途径如图 1。
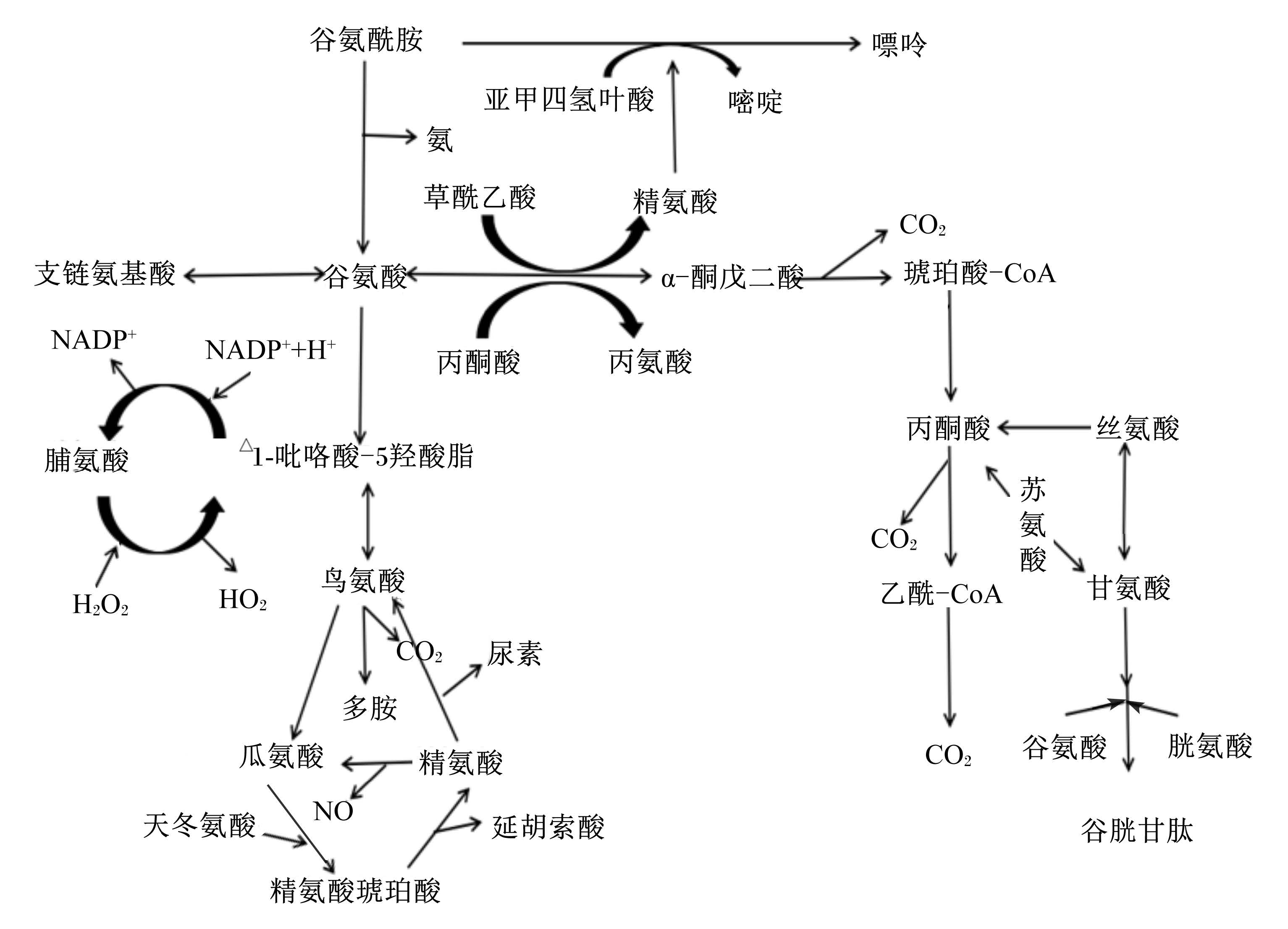
|
NADP+:烟酰胺腺嘌呤二核苷磷酸nicotinamide adenine dinucleotide phosphate;H2O2:过氧化氢hydrogen peroxide;HO2:超氧化氢super oxidation of hydrogen;CO2:二氧化碳carbon dioxide;NO:一氧化氮nitric oxide;琥珀酸-CoA:琥珀酸乙酰辅酶A butanedioic acid-acetyl coenzyme A;乙酰-CoA:乙酰辅酶A aceyl coenzyme A。 图 1 Gln在肠道中的代谢途径 Figure 1 The metabolic pathway of Gln in the intestinal tract[5] |
Gln在肠道中可以合成瓜氨酸、脯氨酸等动物体内重要的氨基酸。瓜氨酸在成年动物的肾脏中又可以合成精氨酸[5],这个过程具有重要的生理意义:1)若给猫、雪貂等动物饲喂不含精氨酸的饲粮,会导致严重的高血氨甚至死亡[6];2)一些幼龄动物肠道中Gln合成瓜氨酸的效率极低,当精氨酸缺乏时会出现生长迟缓的现象[7]。Gln或多肽降解产生的精氨酸可以生成脯氨酸[8],此途径可能也是体内脯氨酸的主要来源[9]。
1.2.2 Gln在肠道中可转化为其他物质断奶仔猪肠道可利用氨、Gln和精氨酸产生尿素[10]。研究表明,肠道中存在能将氨转化为尿素的全部酶[11],但酶的活性很小,因此只有约5%Gln产生的氨可转化为尿素[12]。另外,Gln在转氨基酶作用下可生成鸟氨酸,经过一系列酶促反应,鸟氨酸可以生成多胺[13],多胺具有多种生物活性,有促进上皮细胞成熟和分化的作用,对维持细胞膜结构和功能的完整也起着重要的作用[14]。
1.3 Gln在肠道营养中的研究现状和前景仔猪断奶应激反应会严重影响仔猪的采食量,引起腹泻,致使营养物质的供应不足;且由于肠黏膜细胞代谢强度高、所需能量较多,断奶应激往往会使肠黏膜细胞处于“饥饿状态”,使细胞的正常生理功能受到影响,增殖分化受到抑制,进而导致肠黏膜的萎缩[15]。研究表明,饲粮中添加Gln能够有效促进肠细胞的增殖,防止肠黏膜萎缩,保证肠道结构和功能的完整,起到缓解断奶应激的作用[16]。
研究表明,断奶仔猪饲粮中添加L-谷氨酰胺(L-Gln)会增加十二指肠和空肠的绒毛高度、空肠黏膜谷氨酸草酰乙酸转氨酶的活性、Gln合成酶的mRNA表达水平以及空肠黏膜紧密连接蛋白(occludin)和紧密连接蛋白-1(zonula occludens-1,ZO-1)的mRNA表达水平[17]。另外,饲粮中补充L-Gln会增加血浆中多种氨基酸(如谷氨酸、精氨酸、组氨酸、异亮氨酸、亮氨酸、蛋氨酸、苯丙氨酸和苏氨酸)的浓度以及空肠黏膜离子敏感受体、代谢性谷氨酸受体1、代谢性谷氨酸受体4的mRNA表达水平[18]。以上研究表明,饲粮中补充L-Gln可以改善断奶仔猪空肠的完整性,促进氨基酸受体和转运蛋白的表达,有利于改善空肠营养物质的消化和吸收。
但Gln具有热不稳定性、溶解度低等缺点[19],使Gln在生产中的利用受到限制。Gln二肽是Gln和其他氨基酸形成的一种复合物,与Gln相比具有水溶解度高、稳定性好、吸收率高等优点,在动物生产中有很好的应用前景。常见的Gln二肽有丙氨酰(alanyl,Ala)-Gln(Ala-Gln)和甘氨酰(glycyl,Gly)-Gln(Gly-Gln)[20]。然而,谷氨酰胺二肽也存在工业加工复杂、成本高等问题[21]。
2 Gln对断奶仔猪肠黏膜更新的影响及其机制肠道黏膜处于细胞增殖和凋亡的动态平衡状态,通常肠黏膜更新1次需要3~8 d[22]。Gln的缺乏可加速肠上皮细胞凋亡,并阻碍细胞增殖。这是因为Gln的缺乏可以选择性激活细胞凋亡的关键酶——半胱天冬酶(caspases),半胱天冬酶一旦被激活,就会使细胞内的蛋白质降解,导致细胞死亡[23]。从Gln的代谢特点推测,Gln能够促进肠黏膜细胞增殖的机制主要有以下2点:一是Gln经氧化后为黏膜细胞增殖提供所需的能量;二是Gln可以转化为细胞增殖所需的物质的前体物[24]。
2.1 Gln是肠黏膜的主要能源物质以及嘌呤和蛋白质合成的供氨体研究表明,葡萄糖和Gln在肠道近端提供能量之比为62 : 38[25],说明Gln在肠道供能中起着重要的作用,当Gln供应不足时就会影响肠黏膜细胞的生长发育。在肠黏膜细胞中,1mol Gln氧化后可生成2分子二氧化碳(CO2)和9 mol三磷酸腺苷(ATP),不生成CO2的其他3个碳同样可参与其他能量代谢[26]。另外,Gln在肠道中也可作为合成其他氨基酸的氮源,这主要是因为Gln可以在Gln酶的作用下生成谷氨酸,后者又可在转氨酶的作用下生成丙氨酸、脯氨酸、精氨酸、鸟氨酸等[27]。在嘌呤和嘧啶的合成过程中,Gln不但能够提供能量,更重要的是它可以作为嘌呤和嘧啶合成的前体物质,并且能特异的控制增殖中细胞核苷酸合成的效率[28]。研究表明,Gln可以促进肠道细胞内DNA和RNA的合成,可能是因为Gln可以转化为精氨酸,而精氨酸可以促进生长激素(growth hormone,GH)的分泌[29]。
2.2 Gln抑制细胞凋亡断奶应激会使仔猪肠黏膜细胞过度凋亡,从而破坏肠黏膜的动态平衡,影响肠黏膜的结构和功能,导致肠黏膜屏障功能障碍,使其通透性增加。研究表明,Gln可以抑制肠黏膜细胞的过度凋亡,从而缓解断奶应激和肠道疾病等对肠道屏障功能的影响[30]。细胞的凋亡过程是由相关基因直接控制的,而细胞外部刺激可通过信号传导通路影响这些基因的表达,进而调控细胞的凋亡[31]。哺乳动物体内与细胞凋亡相关的基因主要包括肿瘤坏死因子(tumor necrosis factor,TNF)受体家族成员6(TNF receptor superfamily member 6,Fas)和Fas的配体(Fas ligand,FasL)基因家族以及B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)基因家族等,可以把它们分为促进凋亡基因 和抑制凋亡基因(如Bcl-2等)[32]。细胞凋亡时,线粒体会释放出细胞色素C,使凋亡酶激活因子(apoptptic protease activating facter-1,Apaf-t)激活编码分子质量为32 ku的半胱氨酸蛋白酶-3(cysteine proteinase-3,cas-pase-3)[33],cas-pase-3在细胞凋亡机制中起着至关重要的作用,cas-pase-3表达增加会导致细胞过度凋亡[34]。研究发现,Gln可以抑制肠黏膜细胞cas-pase-3的表达,中断细胞凋亡的信号传导通路,从而减少肠黏膜细胞死亡[35]。
2.3 Gln参与谷胱甘肽(glutathione,GSH)的合成GSH是由谷氨酸、半胱氨酸、甘氨酸这3种氨基酸组成的小分子肽,可在谷胱甘肽过氧化物酶(GSH-Px)的作用下接受过氧化氢(H2O2)的电子,发生自身氧化,从而可以中和体内的自由基,起到抗氧化、减轻过氧化损伤的重要作用[36]。谷氨酸是合成GSH的重要物质,但GSH的合成是在细胞内进行,谷氨酸为强电荷分子,很难通过细胞膜进入细胞内,而Gln易于通过细胞膜,在细胞内经脱氧反应产生谷氨酸,从而参与GSH的合成。当机体处于应激等机体代谢紊乱的状态下,肠黏膜细胞摄取的Gln不足,就会导致GSH合成不足,机体自由基、过氧化物积累过多,影响机体的抗氧化能力,因此补充Gln能够增加体内GSH的含量,使机体抗氧化损伤的能力增强[37]。
2.4 Gln降低促炎症因子和肠道细胞因子介导的免疫细胞因子mRNA的表达水平研究表明,Gln可以降低肠道细胞因子介导的中性粒细胞趋化因子(neutrophilic chemotactic factor,CINC)mRNA的表达水平,CINC虽然有一定的防御功能,可以抗感染,但也可引起感染部位的炎症反应,从而导致机体的免疫功能受损[38]。另外,Gln也能降低肠道TNF的水平。TNF分为TNF-α、TNF-β 2种形式,TNF-α能够影响occludin的分布及其磷酸化水平,是应激、疾病等引起肠黏膜屏障损伤的重要启动因子;而Gln能够促进肠上皮细胞紧密连接,阻止TNF-α引起的occludin表达异常,从而起到保障肠道健康的作用。研究发现,当早产婴儿肠道被细菌感染后,促炎症物质如白介素-8(IL-8)就会过度分泌或表达,IL-8是趋化性细胞因子,能够促进炎症细胞趋化,是炎症疾病的重要介质,能够加速细菌从血液转移到肠道,从而破坏肠道细胞正常的功能[39]。当给早产婴儿补充Gln后,发现IL-8的表达受到抑制,说明Gln能抑制肠道炎症因子的表达,保护肠道健康。
2.5 Gln上调原癌基因c-fos和c-jun的mRNA表达水平,促进肠黏膜细胞分裂增殖c-fos基因是细胞核DNA中的基因片段,可以识别特定的DNA序列来启动细胞的增殖和分化。c-jun基因是一种细胞核中的原癌基因,能在生长因子、促性腺激素和神经递质作用后的几分钟内立即表达[40],因此被称为是“即刻早期基因”,这类基因的表达产物会作用于DNA序列,使DNA的合成发生变化,所以通常会把这类基因的产物看作是细胞增殖的标志。体外试验证明,Gln可以促进小肠黏膜细胞原癌基因c-fos、c-jun的mRNA表达,从而促进肠黏膜细胞的增殖[41]。可能的机制是Gln可刺激肝脏和肠黏膜胰岛素样生长因子-1(insulin-like growth factors,IGF-1)的表达,IGF-1可以激活促分裂原活化蛋白激酶(mitogen-cativated protein kinases,MAPKs)信号通路,促进原癌基因c-fos和c-jun的表达。
3 小 结Gln在动物肠道内有多种作用,如维持肠道结构和功能的完整、加强肠道的免疫功能等,Gln也是肠黏膜细胞主要的供能物质和重要的代谢底物,充分表明探究Gln在仔猪肠道营养以及肠黏膜更新中的作用及机制对缓解断奶仔猪应激反应具有重要的指导意义。但目前有关Gln对断奶仔猪肠黏膜更新的影响及机制的研究不是很深入,Gln能抑制细胞凋亡的具体机制还不是很明确,因此还有很大的研究空间,有待在细胞和分子水平上解决。
| [1] | 王现盟.谷氨酰胺对断奶仔猪肠黏膜形态和细胞能量合成的影响[D].硕士学位论文.杭州:浙江大学,2015. |
| [2] | 郑根华.谷氨酰胺对断奶仔猪的影响及机理研究[D].硕士学位论文.杭州:浙江大学,2004. |
| [3] | CERA K R, MAHAN D C, CROSS R F, et al. Effect of age,weaning and postweaning diet on small intestinal growth and jejunal morphology in young swine[J]. Journal of Animal Science, 1988 , 66 (2) : 574 –584. DOI: 10.2527/jas1988.662574x |
| [4] | SON J, LYSSIOTIS C A, YING H, et al. Glutamine supports pancreatic cancer growth through a KRAS-regulated metabolic pathway[J]. Nature, 2013 , 496 (7443) : 101 –105. DOI: 10.1038/nature12040 |
| [5] | 刘涛.谷氨酰胺对早期断奶仔猪肠道营养与免疫功能影响机理的研究[D].博士学位论文.武汉:华中农业大学,2004. |
| [6] | BRENNAN L, COLESS M, HEWAGE C, et al. 13C NMR analysis reveals a link between L-glutamine metabolism,D-glucose metabolism and γ-glutamyl cycle activity in a clonal pancreatic beta-cell line[J]. Diabetologia, 2003 , 46 (11) : 1512 –1521. DOI: 10.1007/s00125-003-1184-7 |
| [7] | CUMMINGS J H, MACFARLANE G T. Role of intestinal bacteria in nutrient metabolism[J]. Journal of Parenteral and Enteral Nutrition, 1997 , 21 (6) : 357 –365. DOI: 10.1177/0148607197021006357 |
| [8] | 杨俊涛, 王正国, 朱佩芳. 谷氨酰胺对创伤后免疫组织细胞抗氧化能力的影响[J]. 中国病理生理杂志, 1999 , 15 (3) :256 –259. |
| [9] | BOELENS P G, NIJVELDT R J, HOUDIJK A P, et al. Glutamine alimentation in catabolic state[J]. Journal of Nutrition, 2001 , 131 (9) : 2569S –2577S. |
| [10] | HUSBAND A J, GOWANS J L. The origin and antigen-dependent distribution of IgA-containing cells in the intestine[J]. The Journal of Experimental Medicine, 1978 , 148 (5) : 1146 –1160. DOI: 10.1084/jem.148.5.1146 |
| [11] | 蒋宗勇.仔猪早期断奶综合症的研究进展[M]//许振英,张子仪.动物营养研究进展.北京:中国农业科技出版社,1994:101-130. |
| [12] | CALDER P C. Fuel utilization by cells of the immune system[J]. The Proceedings of the Nutrition Society, 1995 , 54 (1) : 65 –82. DOI: 10.1079/PNS19950038 |
| [13] | LUK G D, BAYLIN S B. Polyamines and intestinal growth-increased polyamine biosynthesis after jejunectomy[J]. The American Journal of Physiology, 1983 , 245 (5Pt 1) : G656 –G660. |
| [14] | ELIA M, LUNN P G. The use of glutamine in the treatment of gastrointestinal disorders in man[J]. Nutrition, 1997 , 13 (7/8) : 743 –747. |
| [15] | 霍芳, 付石军, 郭时金, 等. 谷氨酰胺二肽的生理功能及其在断奶仔猪上的应用[J]. 中国饲料, 2013 (22) :15 –18. |
| [16] | GROSSMANN J, MOHR S, LAPENTINA E G, et al. Sequential and rapid activation of select caspases during apoptosis of normal intestinal epithelial cells[J]. The American Journal Physical, 1998 , 274 (6 Pt 1) : 1117 –1124. |
| [17] | BROSNAN J T, BROSNAN M E. Glutamate:a truly functional amino acids[J]. Amino Acids, 2013 , 45 (3) : 413 –418. DOI: 10.1007/s00726-012-1280-4 |
| [18] | ZHANG J, YIN Y, SHU X G, et al. Oral administration of MSG increases expression of glutamate receptors and transporters in the gastrointestinal tract of young piglets[J]. Amino Acids , 45 (5) : 169 –1177. |
| [19] | 张军民, 高振川. 谷氨酰胺对早期断奶仔猪肠粘膜蛋白质、DNA含量和组织形态的影响[J]. 中国农业科学, 2002 , 35 (10) :1264 –1268. |
| [20] | 谢建新, 顾岩, 赵淑民, 等. GH和附加Gln肠外营养联合应用对短肠大鼠小肠黏膜上皮细胞分裂增殖能力的影响[J]. 复旦学报:医学版, 2002 , 29 (3) :165 –168. |
| [21] | 朱翠, 蒋宗勇. 谷氨酰胺对早期断奶仔猪肠黏膜免疫的调节作用[J]. 中国畜牧兽医, 2011 , 38 (8) :10 –16. |
| [22] | CABRERA R A, USRY J L, ARRELLANO C, et al. Effects of creep feeding and supplemental glutamine or glutamine plus glutamate (aminogut) on pre-and post-weaning growth performance and intestinal health of piglets[J]. Journal of Animal Science and Biotechnology, 2013 , 4 (3) : 211 –222. |
| [23] | 杨彩梅, 陈安国. 谷氨酰胺对早期断奶仔猪生产性能和小肠消化酶活性的影响[J]. 中国畜牧杂志, 2015 , 41 (6) :21 –22. |
| [24] | 张继杰, 周安国, 王之盛. 谷氨酰胺对猪肠道形态和功能的影响及其机制[J]. 畜禽业, 2007 (9) :8 –11. |
| [25] | NEWSHOLME P, PROCOPIO J, LIMA M M, et al. Glutamine and glutamate-their central role in cell metabolism and function[J]. Cell Blochemistry and Function, 2003 , 21 (1) : 1 –9. DOI: 10.1002/(ISSN)1099-0844 |
| [26] | 杨彩梅. 谷氨酰胺和甘氨酰 谷氨酰胺对断奶仔猪小肠黏膜的影响[J]. 中国粮油学报, 2006 , 21 (6) :199 –123. |
| [27] | 黄冠庆, 傅伟龙, 高萍, 等. 甘氨酰谷氨酰胺二肽对断奶仔猪生长性能及血液激素水平的影响[J]. 华南农业大学学报:自然科学版, 2003 , 24 (3) :66 –68. |
| [28] | YI G F, CARROLL J A, ALLEE G L, et al. Effect of glutamine and spray-dried plasma on growth performance,small intestinal morphology,and immune responses of Escherichia coli K88+-challenged weaned pigs[J]. Journal of Animal Science, 2005 , 83 (3) : 634 –643. DOI: 10.2527/2005.833634x |
| [29] | MOTOKI T, NAOMOTO Y, HOSHIBA J, et al. Glutamine depletion induces murine neonatal melena with increased apoptosis of the intestinal epithelium[J]. World Journal of Gastroenterology, 2011 , 17 (6) : 717 –726. DOI: 10.3748/wjg.v17.i6.717 |
| [30] | DROZDOWSKI L, THOMSON A B. Intestinal mucosal adaptation[J]. World Journal of Gastroenterology, 2006 , 12 (29) : 4614 –4627. DOI: 10.3748/wjg.v12.i29.4614 |
| [31] | WANG J, CHEN L, LI P, et al. Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation[J]. The Journal of Nutrition, 2008 , 138 (6) : 1025 –1032. |
| [32] | WANG B, WU G, ZHOU Z, et al. Glutamine and intestinal barrier function[J]. Amino Acids, 2015 , 47 (10) : 2143 –2154. DOI: 10.1007/s00726-014-1773-4 |
| [33] | WU G, MEIER S A, KNABE D A. Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs[J]. The Journal of Nutrition, 1996 , 126 (10) : 2578 –2584. |
| [34] | CAMILLERI M, MADSEN K, SPILLER R, et al. Intestinal barrier function in health and gastrointestinal disease[J]. Neurogastroenterology & Motility, 2012 , 24 (6) : 503 –512. |
| [35] | XU C L, SUN R, QIAO X J, et al. Protective effect of glutamine on intestinal injury and bacterial community in rats exposed to hypobaric hypoxia environment[J]. World Journal of Gastroenterology, 2014 , 20 (16) : 4662 –4674. DOI: 10.3748/wjg.v20.i16.4662 |
| [36] | Wise D R, Thompson C B. Glutamine addiction: a new therapeutic target in cancer[J]. Trends in Blochemical Sciences, 2010 , 35 (8) : 427 –433. DOI: 10.1016/j.tibs.2010.05.003 |
| [37] | POTSIC B, HOLLIDAY N, LEWIS P, et al. Glutamine supplementation and deprivation: effect on artificially reared rat small intestinal morphology[J]. Pediatric Research, 2002 , 52 (3) : 430 –436. DOI: 10.1203/00006450-200209000-00021 |
| [38] | YU L C H, WANG J T, WEI S C. Host-microbial interactions and regulation of intestinal epithelial barrier function:from physiology to pathology[J]. World Journal of Gastrointestinal Pathophysiology, 2012 , 3 (1) : 27 –43. DOI: 10.4291/wjgp.v3.i1.27 |
| [39] | SHAW D, GOHIL K, BASSON M D. Intestinal mucosal atrophy and adaptation[J]. World Journal of Gastroenterology, 2012 , 18 (44) : 6357 –6375. DOI: 10.3748/wjg.v18.i44.6357 |
| [40] | ERSOY B, OZBILGIN K, KASIRGA E, et al. Effect of growth hormone on small intestinal homeostasis relation to cellular mediators IGF-I and IGFBP-3[J]. World Journal of Gastroenterology, 2009 , 15 (43) : 5418 –5424. DOI: 10.3748/wjg.15.5418 |
| [41] | XU H, ZHU Q, WANG C A, et al. Effect of dietary alanyl-glutamine supplementation on growth performance,development of intestinal tract,antioxidant status and plasma non-specific immunity of young mirror carp (Cyprinus carpio L[J]. Journal of Northeast Agricultural University:English Edition, 2014 , 21 (4) : 37 –46. DOI: 10.1016/S1006-8104(15)30018-0 |




