2. 南海生物资源开发与利用协同创新中心, 广州 510006
2. South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center, Guangzhou 510006, China
硒在自然界中以无机硒或有机硒的形式存在,长期被误认为是一种有毒物质。1957年,Schwartz等[1]证实硒能预防因硒和/或维生素E缺乏导致的大白鼠的肝坏死。随后人们相继发现硒是参与构成谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的微量元素,其活性中心是硒半胱氨酸,该酶能够把过氧化氢和脂质过氧化产物分别转换成水和脂醇,保护细胞膜和亚细胞膜的多不饱和磷脂免受过氧化损伤[2];同时,硒还能促进动物生长、提高繁殖性能、增强机体免疫力。
不同来源的硒对鱼类的生物效价、利用率和抗应激力的影响不同。Lorentzen等[3]发现摄食添加蛋氨酸硒饲料的大西洋鲑(Salmo salar)肌肉和全鱼的硒含量比摄食添加亚硒酸盐饲料的大西洋鲑高。Wang等[4]研究酵母硒、硒代蛋氨酸和亚硒酸钠对斑点叉尾 (Ictalurus punctatus)的生物效价时发现,与亚硒酸钠相比,酵母硒和硒代蛋氨酸的需要量低、相对生物效价高,鱼体GSH-Px活性及硒在鱼体的沉积量均较高。饲料中添加硒能提高虹鳟(Oncorhynchus mykiss)机体GSH-Px活性,且酵母硒抗应激的效果优于亚硒酸盐[5]。Jaramillo等[6]以杂交条纹鲈(Morone chrysops×M. saxatilis)为试验对象,通过斜率比法发现蛋氨酸硒的生物效价是亚硒酸钠的3.3倍。
军曹鱼(Rachycentron canadum),隶属鲈形目(Perciformes),军曹鱼科(Rachycentridae),军曹鱼属(Rachycentron),亦称海鲡、海龙、海竹鱼等,是大型肉食性鱼类,具有生长速度快、易于驯化摄食人工饲料、肉质鲜美等特点,是我国南方沿海海水网箱养殖的重要品种之一。
目前,仅见军曹鱼对蛋氨酸硒需要量的研究报道,如Liu等[7]指出军曹鱼幼鱼对蛋氨酸硒的需要量是0.788~0.811 mg/kg,未见硒源及硒水平对军曹鱼营养生理影响的研究报道。因此,本试验拟研究饲料中不同硒源和硒水平对军曹鱼幼鱼营养生理作用的影响,旨在为军曹鱼幼鱼营养需要参数数据库的完善及军曹鱼高效配合饲料的研制提供基础数据。
1 材料与方法 1.1 试验设计与试验饲料以脱维酪蛋白为主要蛋白质源,玉米淀粉为糖源,玉米油、鱼油为主要脂肪源,配制基础饲料,基础饲料组成及营养水平见表 1。在基础饲料中分别添加源于亚硒酸钠(购自国药集团化学试剂有限公司)或蛋氨酸硒(购自长沙兴嘉生物工程股份有限公司)的硒,添加水平分别为0(对照)、0.3、0.6、0.9和1.2 mg/kg,配制成9种试验饲料(共用对照饲料),对照饲料中硒水平实测值为0.35 mg/kg,命名为C-0.35;添加亚硒酸钠的4种饲料中硒水平实测值分别为0.68、1.09、1.26、1.65 mg/kg,并分别命名为Se-S-0.68、Se-S-1.09、Se-S-1.26、Se-S-1.65;添加蛋氨酸硒的4种饲料中硒水平实测值分别为0.67、1.02、1.33、1.69 mg/kg,并分别命名为Se-Met-0.67、Se-Met-1.02、Se-Met-1.33、Se-Met-1.69。
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
养殖试验在广东省湛江市南三岛海上浮式鱼排中进行,试验用军曹鱼幼鱼购于广东湛江市英利镇海尾村养殖户。军曹鱼幼鱼暂养2周,期间投喂商品饲料。分组前停食24 h,随机挑选规格一致、健康无病、初始体重为(22.18±0.35) g的试验鱼进行分组,根据试验设计,共分为9个组,每组3个重复,每个重复1个2.5 m×1.2 m×1.4 m的网箱,共27个网箱,每个网箱放养30尾鱼。为减少试验误差,所有网箱均随机摆放。每种试验饲料投喂3个网箱,每天投喂2次(07:00、18:00),日投喂量为试验鱼体重的6%~9%。养殖期间水体温度28~33 ℃,pH 7.6~7.8,盐度29~31,溶氧浓度>6.0 mg/L,试验期10周。养殖海水中硒未检出。
1.3 样品采集和指标测定试验结束禁食24 h后,将各网箱试验鱼全部捞出,丁香酚(1 ∶ 10 000)麻醉后称重计数。每个网箱随机抽取5尾鱼,用2.5 mL的注射器从鱼体围心腔刺入,在心脏动脉球处抽血,置于1.5 mL的Eppendorf管中,4 ℃、4 500 r/min离心10 min,吸取血清保存于-80 ℃冰箱中备用。每个网箱随机抽取5尾鱼解剖后迅速取出肝脏放入防冻管,立即放入液氮罐保存,后转存于-80 ℃冰箱中备用。每个网箱随机抽取8尾鱼,去除内脏后放入沸水中3 min,剥离肌肉,取出脊椎骨,用超纯水冲洗去掉附着的肌肉。处理后的脊椎骨105 ℃烘干,粉碎过80目筛,乙醚抽提12 h去除脂肪,并再次105 ℃烘干[8]。
饲料成分分析:水分含量采用105 ℃常压干燥法测定;粗蛋白质含量采用凯氏定氮法(总氮×6.25)测定;粗脂肪含量采用索氏抽提法测定;粗灰分含量采用550 ℃马弗炉灼烧法测定。
肝脏和血清抗氧化指标测定:GSH-Px、谷胱甘肽还原酶(glutathione reductase,GR)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT)活性和丙二醛(malondialdehyde,MDA)含量采用南京建成生物工程研究所提供的试剂盒测定,样品前处理、试剂配制及测定步骤均严格按照操作说明书执行。
饲料、全鱼、脊椎骨和肝脏中硒水平/含量测定:用硝酸和双氧水充分消解定量样品,用电感耦合等离子体-质谱仪测定硒含量。
1.4 计算公式特定生长率(specific growth rate,SGR,%/d)=
100×(ln试验期末均重- ln试验期初均重)/试验天数;
增重率(weight gain rate,WGR,%)=
100×(试验期末均重-试验期初均重)/试验期初均重;
成活率(survival rate,SR,%)=
100×试验期末鱼尾数/试验期初鱼尾数;
饲料系数(feed conversion rate,FCR)=
总摄食量/(试验期末总重+死亡鱼总重-试验期初总重)。
1.5 统计分析试验结果用平均值±标准误表示,采用SPSS 16.0的一般线性模型(GLM)进行双因素方差分析,模型的主效应分析包括硒源、硒水平及两者之间的交互作用。P<0.05表示差异显著,P<0.01表示差异极显著。
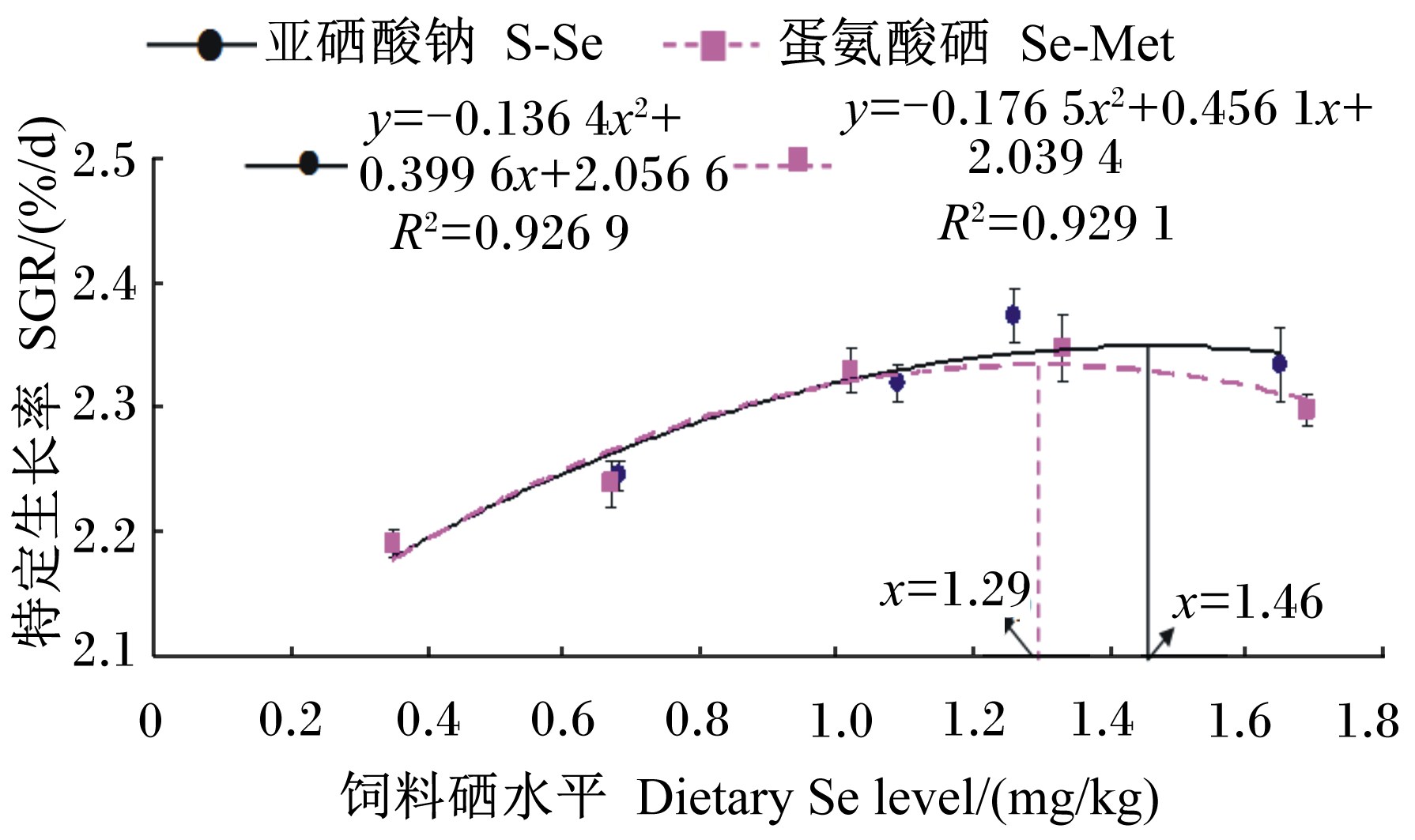
2 结 果 2.1 硒源和硒水平对军曹鱼幼鱼生长性能的影响由表 2可知,硒源对SGR、WGR、FCR和SR均无显著影响(P>0.05);硒水平对SGR和WGR有极显著影响(P<0.01),但对SR和FCR无显著影响(P>0.05)。硒源和硒水平的交互作用对SGR、WGR、FCR和SR均无显著影响(P>0.05)。SGR和WGR随着硒水平的升高先升高后逐渐降低。分别以蛋氨酸硒和亚硒酸钠为硒源,通过二次回归曲线分析得出饲料硒水平分别为1.29和1.46 mg/kg时军曹鱼幼鱼可以获得最大SGR(图 1);以SGR为判据时,军曹鱼幼鱼对蛋氨酸硒的生物利用率相当于亚硒酸钠的1.20倍(蛋氨酸硒:y=0.209x+2.111,R2=0.98;亚硒酸钠:y=0.175x+2.218,R2=0.99;x为饲料硒水平,y为SGR)。
|
|
表 2 硒源和硒水平对军曹鱼幼鱼生长性能的影响 Table 2 Effects of Se source and Se level on growth performance of juvenile cobia |
|
图 1 饲料硒水平与军曹鱼幼鱼特定生长率的关系(2种硒源) Figure 1 Relationships between dietary Se level and SGR of juvenile cobia (2 Se sources) |
由表 3可知,硒源极显著影响肝脏GR、T-SOD、CAT活性和MDA含量及血清T-SOD活性(P<0.01),但对肝脏GSH-Px活性及血清GSH-Px、GR、CAT活性和MDA含量无显著影响(P>0.05)。硒水平极显著影响肝脏GSH-Px、GR活性和MDA含量及血清GSH-Px活性(P<0.01),显著影响血清GR活性(P<0.05),但对肝脏T-SOD、CAT活性及血清T-SOD、CAT活性和MDA含量无显著影响(P>0.05);硒源和硒水平的交互作用对肝脏CAT活性、MDA含量和血清T-SOD活性有显著影响(P<0.05),但对肝脏GSH-Px、GR、T-SOD活性及血清GSH-Px、GR、CAT活性和MDA含量无显著影响(P>0.05)。肝脏和血清GSH-Px活性随着硒水平的升高表现为先升高后稳定的趋势,GR活性则表现为先下降后稳定的趋势。2种硒源中,分别以Se-S-1.26组和Se-Met-1.33组的肝脏GSH-Px活性最高,并均显著高于对照组(C-0.35组)(P<0.05);同时这2组的肝脏GR活性最低,并均显著低于对照组(P<0.05);肝脏CAT活性随着硒水平的升高逐渐升高,在以亚硒酸钠为硒源的组中,Se-S-1.65组肝脏CAT活性显著高于除Se-S-1.26组外的其他3组(P<0.05);在以蛋氨酸硒为硒源的组中,Se-Met-1.69组肝脏CAT活性显著高于其他各组(P<0.05)。各组间血清CAT活性无显著差异(P>0.05)。
|
|
表 3 硒源和硒水平对军曹鱼幼鱼肝脏和血清抗氧化指标的影响 Table 3 Effects of Se source and Se level on antioxidant indices in liver and serum of juvenile cobia |
由表 4可知,硒源极显著的影响脊椎骨硒含量(P<0.01),但对全鱼和肝脏硒含量无显著影响(P>0.05)。硒水平对脊椎骨、全鱼和肝脏硒含量有极显著影响(P<0.01),脊椎骨、全鱼和肝脏硒含量随着饲料硒水平的升高而升高。硒源和硒水平的交互作用对全鱼硒含量没有显著影响(P>0.05),但对肝脏和脊椎骨硒含量有极显著影响(P<0.01)。以全鱼硒含量为判据时,军曹鱼幼鱼对蛋氨酸硒的生物利用率相当于亚硒酸钠的2.90 倍(蛋氨酸硒:y=0.938x+0.052,R2=0.99;亚硒酸钠:y=0.323x+2.252,R2=0.99;x为饲料硒水平,y为全鱼硒含量)。
|
|
表 4 硒源和硒水平对军曹鱼幼鱼组织硒含量的影响 Table 4 Effects of Se source and Se level on Se content in tissues of juvenile cobia |
在本试验中,摄食未添加硒饲料的军曹鱼幼鱼生长缓慢,饲料硒水平对SGR和WGR有极显著影响,但对SR和FCR无显著影响,SGR和WGR随着硒水平的升高先升高后逐渐降低,这表明饲料中硒缺乏或过高都会降低军曹鱼幼鱼的生长性能,这与对黄尾 [9](Seriola lalandi)的研究结果相似。Han等[10]报道,饲料中添加硒能够促进异育银鲫(Carassius auratus gibelio)的生长,饲料硒水平达到1.85 mg/kg后,生长趋于平稳。研究发现,适宜的饲料硒水平能够促进军曹鱼生长,当饲料硒水平达到0.85 mg/kg以上时鱼体生长趋于平稳,组间无显著差异[7]。来源于蛋氨酸硒和亚硒酸钠的硒均能提高点带石斑鱼(Epinephelus malabaricus)的WGR,当饲料硒水平达到0.80 mg/kg后WGR趋于稳定[11]。大黄鱼(Larimichthys croceus)幼鱼WGR随饲料硒水平的升高而增加,当饲料硒水平达到0.27 mg/kg后趋于稳定[12]。鲤鱼(Cyprinus carpio)WGR随饲料中纳 米硒水平的升高而增加,当饲料硒水平达到 1 mg/kg时WGR达到最大值[13]。饲料中高水平(13 mg/kg)硒会对虹鳟造成慢性中毒,表现出生长缓慢、死亡率增高等症状[14]。鱼类对硒的营养需要量与中毒剂量间的范围较窄[15],冷水性鱼类对硒的毒性比温水性鱼类敏感[16]。饲料中一定量的硒可以引起鱼体中毒死亡而没有抑制生长,但也有相反的情况,即抑制生长而没有中毒死亡[17],这可能是与饲料硒的添加形式及添加量,试验动物品种、体重以及试验期、养殖环境等因素有关。
在本试验中,饲料中来自于亚硒酸钠和蛋氨酸硒的硒分别为1.46和1.29 mg/kg时,军曹鱼可获得最大的SGR,高于斑点叉尾 (0.25[2]、0.12 mg/kg[4])、军曹鱼[7](0.85 mg/kg)、大黄鱼[12](0.18 mg/kg)、虹鳟鱼[14](0.38 mg/kg)、点带石斑鱼[18](0.77 mg/kg)、中华绒螯蟹[19](Eriocheir sinensis)(0.51 mg/kg)、杂交条纹鲈[20](0.40 mg/kg)、鲈鱼[21](Lateolabrax japonicus)(0.63 mg/kg),但低于黄尾 [9](5.56 mg/kg)、大口黑鲈(Micropterus salmoide)[22](1.60~1.85 mg/kg),远低于克氏鲑[23](Oncorhynchus clarkii)(9.2 mg/kg)、黑海鳇[24](Huso huso)(11.56 mg/kg),与杂交条纹鲈[6](1.19 mg/kg)、异育银鲫[10](1.18 mg/kg)、鲤鱼[13](1.46 mg/kg)的硒需要量相似。影响鱼类对硒需要量的原因较多,如试验鱼的种类、硒添加形式、水体硒含量、饲料中维生素E含量等。已有报道指出大西洋鲑鱼[3]、斑点叉尾 [4]、石斑鱼[11]和黄尾 [25]对有机硒的利用率比无机硒高。在提高凡纳滨对虾(Litopenaeus vannamei)生长性能和抗氧化能力方面,蛋氨酸硒要优于酵母硒和亚硒酸钠[26]。饲料中的维生素E与硒的交互作用可以影响到鱼类对硒的需要量[18],饲料中的维生素E和硒在鱼体内共同形成抗氧化防御系统,鱼体对维生素E或硒的摄入量减少时,则需要从饲料中补充较高的硒或维生素E[27]。鱼类可以通过鳃和皮肤从水环境中吸收矿物质元素,在斑点叉尾 [2]和虹鳟[14]的试验中,水体的硒含量为0.4~2.5 μg/L,而本试验中养殖海水中未检出硒,这也可能是本试验中军曹鱼幼鱼对硒需要量略高的原因之一。在本试验中,军曹鱼幼鱼对蛋氨酸硒的需要量比亚硒酸钠低,以SGR为评价指标时蛋氨酸硒的生物利用率是亚硒酸钠的1.20倍。Wang等[4]在研究不同硒源(亚硒酸钠、蛋氨酸硒和酵母硒)对斑点叉尾鮰生物效价时发现,斑点叉尾 对有机硒的需要量比无机硒低,蛋氨酸硒的生物效价比亚硒酸钠硒高,在杂交条纹鲈[6]和黄尾 [25]对不同硒源的研究中也得出类似结果。Bell等[28]也认为大西洋鲑对蛋氨酸硒的消化吸收能力比亚硒酸钠高。这些结果与本试验结果相似。
3.2 硒源和硒水平对军曹鱼幼鱼肝脏和血清抗氧化指标的影响在本试验中,硒水平对肝脏和血清GSH-Px和GR活性有显著影响。GSH-Px活性随着硒水平的升高先逐渐升高后趋于稳定,GR活性随着硒水平的升高先逐渐降低后趋于稳定。这表明饲料中添加硒可以提高军曹鱼幼鱼机体的GSH-Px活性,降低GR活性。已有文献报道饲料缺硒会降低斑点叉尾 [4]和黄尾 [25]机体的GSH-Px活性,而军曹鱼[7]和点带石斑鱼[18]机体的GSH-Px活性则随饲料硒水平的升高而升高。Zhu等[22]对大口黑鲈的研究也发现,肝脏GSH-Px活性随着硒水平的升高逐渐升高,而GR活性则随着硒水平的升高逐渐降低,当饲料硒水平大于1.85 mg/kg后达到稳定;Ashouri等[13]研究表明,纳米硒可显著提高鲤鱼肝脏GSH-Px活性。随饲料硒水平的升高,中华绒螯蟹血清、肝胰腺GSH-Px活性及血清GR活性呈先升高后降低趋势,而肝胰腺GR活性则表现为先升高后稳定[19]。在含不同水平羽扇豆蛋白的饲料中添加有机硒可提高尖吻鲈(Lates calcarifer)血浆中GSH-Px活性[29]。饲料硒水平为0~0.4 mg/kg时,鲈鱼的肝脏和血清中GSH-Px活性随着硒水平的升高而升高,而当饲料硒水平为0.8~1.0 mg/kg时,鲈鱼的肝脏和血清中GSH-Px活性则明显下降[30],上述结果与本试验结果一致。
有机硒更能够有效地提高斑点叉尾 [4]和鲤鱼[31]机体的GSH-Px活性。在本试验中,饲料硒添加量到0.9 mg/kg时,蛋氨酸硒组肝脏和血清的GSH-Px活性均高于亚硒酸钠组。Cotter等[20]研究发现,杂交条纹鲈饲料中硒添加量达到0.4 mg/kg时,亚硒酸钠组肝脏GSH-Px活性高于酵母硒组。Bell等[28]研究发现,亚硒酸钠组和半胱氨酸硒组大西洋鲑的血清GSH-Px活性高于蛋氨酸硒组。但也有研究表明有机硒和无机硒与黄尾 [25]红细胞和虹鳟鱼[32]肝脏GSH-Px活性没有直接关系。这也可能源于不同硒源在不同鱼种中的吸收利用途径不同,硒在鱼体的吸收利用和在不同组织中的代谢途径尚不清楚,还需进一步研究。
MDA是脂质氧化产物,经常用作氧化胁迫指标之一[33]。Zhu等[22]对大口黑鲈的研究发现饲料中硒水平对肝脏MDA含量没有显著影响,并认为这是由于饲料中有较多的抗氧化剂(维生素E:400 mg/kg,维生素C:1 000 mg/kg)与活性氧起反应从而掩盖掉硒在体内的抗氧化作用所致。在本试验中,硒水平和硒源的交互作用对肝脏MDA含量有显著影响,对血清MDA含量没有显著影响。亚硒酸钠组和蛋氨酸硒组的肝脏MDA含量均随着饲料中硒水平的升高先下降后升高。这可能与本试验中抗氧化剂(维生素:120 mg/kg,维生素C:350 mg/kg)含量相对较低有关。当饲料中硒达到较高水平时,可能超出了鱼体的需要量,且对鱼体有一定的毒害作用,因此造成鱼体氧自由基代谢紊乱,T-SOD和GSH-Px活性下降,自由基含量升高,MDA含量升高。这与人类硒营养研究中硒生物效应与硒水平的关系相似,即当硒水平在适宜范围内时能够有效地清除生物体内的活性自由基,而当硒水平较高时则会催化产生活性自由基[34]。中华绒螯蟹[19]血清、肝脏中MDA含量及鲈鱼[21]血清中MDA含量随饲料硒水平的升高呈先降低后升高趋势,与本试验结果类似;而凡纳滨对虾血清MDA含量则随饲料硒水平的升高呈逐渐下降趋势[26]。
在鱼体内GSH-Px、T-SOD和CAT共同起作用,清除超氧阴离子、羟自由基和过氧化氢,减少脂质过氧化物的损害。在本试验中,肝脏CAT活性随着硒水平的升高逐渐升高,Se-S-1.65组和Se-Met-1.69组的肝脏CAT活性高于同一硒源的其他组;肝脏T-SOD活性随硒水平的升高先升高后降低,2种硒源中分别以Se-S-1.26组和Se-Met-1.33组肝脏T-SOD活性最高,这表明饲料中添加硒能够提高军曹鱼幼鱼体内CAT和T-SOD的活性。Monteiro等[35]发现饲料补充硒能够提高缺帘鱼(Brycon cephalus)肝脏CAT和T-SOD活性,共同抵抗甲基对硫磷毒性的氧化胁迫,未添加硒组肝脏T-SOD和CAT活性降低。在异育银鲫饲料中添加硒至1 mg/kg时,血清T-SOD活性达到最大值,添加至5 mg/kg时血清T-SOD活性显著降低;饲料中添加硒对异育银鲫血清CAT活性没有产生显著影响,但血清CAT活性有随饲料硒水平的升高而下降的趋势,表明饲料中过量的硒降低了血清CAT和T-SOD活性[10]。鲈鱼血清和肝脏超氧化物歧化酶(SOD)活性随饲料硒水平的升高呈先上升后下降趋势[21]。饲料中添加硒提高了吉富罗非鱼(Oreochromis niloticus)血清中CAT和T-SOD的活性[36]。
3.3 硒源和硒水平对军曹鱼幼鱼组织硒含量的影响硒可在机体内蓄积,当硒摄入量不足时,组织硒能够释放,补充机体生长和代谢需要;当硒摄入过量时,硒通过肝胰脏和肾脏加速积累而出现中毒现象。Han等[10]发现异育银鲫的肝脏和全鱼硒含量随饲料硒添加量的增加而逐渐升高,肌肉硒沉积能力强于肝脏。Lin等[18]发现点带石斑鱼全鱼硒含量随饲料硒添加量的增加而逐渐升高,全鱼硒含量是一个很好衡量硒效价的指标。研究发现军曹鱼的脊椎骨和全鱼硒含量随着饲料硒添加量的增加而逐渐升高,当饲料硒水平分别达到0.793和0.811 mg/kg时趋于稳定[7]。在本试验中,脊椎骨和全鱼硒含量随着饲料硒水平的升高而升高,说明饲料中添加一定量的硒可促进军曹鱼幼鱼脊椎骨和全鱼硒的积累。随饲料硒水平的升高,方格星虫[37](Sipunculus nudus Linnaeus)体壁和虫体硒含量及大黄鱼[12]全鱼、骨骼硒含量表现为先上升后稳定趋势;而中华绒螯蟹[19]肝胰脏、肌肉硒含量与鲈鱼[21]全鱼、肝脏硒含量则表现为不断上升的趋势。黄尾 肝脏和肌肉硒含量随饲料硒水平的升高而极显著的升高,作者认为肝脏和肌肉硒含量可作为饲料硒营养的有效指标[38]。本试验中,硒源和硒水平对军曹鱼幼鱼肝脏硒含量的影响不同,蛋氨酸硒组全鱼和脊椎骨硒含量均高于亚硒酸钠组,当饲料硒添加量为0.6 mg/kg时,亚硒酸钠组肝脏硒含量高于蛋氨酸硒组。Lorentzen等[3]发现大西洋鲑全鱼、肝脏和肌肉的硒含量随饲料硒水平的升高而升高,其中蛋氨酸硒组的全鱼硒含量比亚硒酸钠组高,但当饲料硒添加量达到2 mg/kg时,亚硒酸钠组肝脏硒含量高于蛋氨酸硒组,并认为这2种硒源代谢途径不一样。Rider等[5]研究发现摄食含有机硒饲料的虹鳟幽门盲囊硒含量低于摄食含无机硒饲料的虹鳟,而全鱼、肌肉和鳃盖的硒含量却高于摄食含无机硒饲料的虹鳟。有机硒效价高于无机硒,这可能与硒源的代谢路径相关,亚硒酸钠是遵循硒的常规代谢途径,酵母硒和蛋氨酸硒可能是遵循蛋氨酸的代谢途径[39],蛋氨酸硒能够特异性结合到软组织的蛋白质中,从而提高软组织硒含量[40]。
4 结 论① 以亚硒酸钠和蛋氨酸硒为硒源,通过二次回归曲线分析得出饲料硒水平分别为1.46和1.29 mg/kg时军曹鱼幼鱼可以获得最大SGR。
② 以SGR为判据时,军曹鱼幼鱼对蛋氨酸硒的生物利用率相当于亚硒酸钠的1.20倍;以全鱼硒含量为判据时,军曹鱼幼鱼对蛋氨酸硒的生物利用率相当于亚硒酸钠的2.90倍。
| [1] | SCHWARZ K, FOLTZ C M. Selenium as an integral part of factor 3 against dietary liver degeneration[J]. Journal of the American Chemical Society, 1957 , 79 (12) : 3292 –3293. |
| [2] | GATLIN Ⅲ D M, WILSON R P. Dietary selenium requirement of fingerling channel catfish[J]. The Journal of Nutrition, 1984 , 114 (3) : 627 –633. |
| [3] | LORENTZEN M, MAAGE A, JULSHAMN K. Effects of dietary selenite or selenomethionine on tissue selenium levels of Atlantic salmon (Salmo salar)[J]. Aquaculture, 1994 , 121 (4) : 359 –367. DOI: 10.1016/0044-8486(94)90270-4 |
| [4] | WANG C, LOVELL R T. Organic selenium sources,selenomethionine and selenoyeast,have higher bioavailability than an inorganic selenium source,sodium selenite,in diets for channel catfish (Ictalurus punctatus)[J]. Aquaculture, 1997 , 152 (1/2/3/4) : 223 –234. |
| [5] | RIDER S A, DAVIES S J, JHA A N, et al. Supra-nutritional dietary intake of selenite and selenium yeast in normal and stressed rainbow trout (Oncorhynchus mykiss):implications on selenium status and health responses[J]. Aquaculture, 2009 , 295 (3/4) : 282 –291. |
| [6] | JARAMILLO F, J r, PENG L, GATLIN Ⅲ D M. Selenium nutrition of hybrid striped bass (Morone chrysops×M.saxatilis) bioavailability,toxicity and interaction with vitamin E[J]. Aquaculture Nutrition, 200 , 15 (2) : 160 –165. DOI: 10.1111/j.1365-2095.2008.00579.x |
| [7] | LIU K, WANG X J, AI Q H, et al. Dietary selenium requirement for juvenile cobia,Rachycentron canadum L[J]. Aquaculture Research, 2010 , 41 (10) : e594 –e601. |
| [8] | AOAC.Official methods of analysis of the Association of Official Analytical Chemists[S].16th ed.Arlington,VA:AOAC,1995. |
| [9] | LE K T, FOTEDAR R. Dietary selenium requirement of yellowtail kingfish (Seriola lalandi)[J]. Agricultural Sciences, 2013 , 4 (6A) : 68 –75. |
| [10] | HAN D, XIE S, LIU M, et al. The effects of dietary selenium on growth performances,oxidative stress and tissue selenium concentration of gibel carp (Carassius auratus gibelio)[J]. Aquaculture Nutrition, 2011 , 17 (3) : e741 –e749. DOI: 10.1111/anu.2011.17.issue-3 |
| [11] | LIN Y H. Effects of dietary organic and inorganic selenium on the growth,selenium concentration and meat quality of juvenile grouper Epinephelus malabaricus[J]. Aquaculture, 2014 , 430 : 114 –119. DOI: 10.1016/j.aquaculture.2014.03.048 |
| [12] | 曹娟娟, 张文兵, 徐玮, 等. 大黄鱼幼鱼对饲料硒的需求量[J]. 水生生物学报, 2015 , 39 (2) :241 –249. |
| [13] | ASHOURI S, KEYVANSHOKOOH S, SALATI A P, et al. Effects of different levels of dietary selenium nanoparticles on growth performance,muscle composition,blood biochemical profiles and antioxidant status of common carp (Cyprinus carpio)[J]. Aquaculture, 2015 , 446 : 25 –29. DOI: 10.1016/j.aquaculture.2015.04.021 |
| [14] | HILTON J W, HODSON P V, SLINGER S J. The requirement and toxicity of selenium in rainbow trout (Salmo gairdneri)[J]. The Journal of Nutrition, 1980 , 110 (12) : 2527 –2535. |
| [15] | WATANABE T, KIRON V, SATOH S. Trace minerals in fish nutrition[J]. Aquaculture, 1997 , 151 (1/2/3/4) : 18 –207. |
| [16] | DEFOREST D K, BRIX K V, ADAMS W J. Critical review of proposed residue-based selenium toxicity thresholds for freshwater fish[J]. Human and Ecological Risk Assessment:An International Journal, 1999 , 5 (6) : 1187 –1228. DOI: 10.1080/10807039.1999.10518886 |
| [17] | HAMILTON S J. Review of selenium toxicity in the aquatic food chain[J]. Science of the Total Environment, 2004 , 326 (1/2/3) : 1 –31. |
| [18] | LIN Y H, SHIAU S Y. Dietary selenium requirements of juvenile grouper,Epinephelus malabaricus[J]. Aquaculture, 2005 , 250 (1/2) : 356 –363. |
| [19] | 田文静, 李二超, 陈立侨, 等. 酵母硒对中华绒螯蟹幼蟹生长、体组成分及抗氧化能力的影响[J]. 中国水产科学, 2014 , 21 (1) :92 –100. |
| [20] | COTTER P A, CRAIG S R, MCLEAN E. Hyperaccumulation of selenium in hybrid striped bass:a functional food for aquaculture?[J]. Aquaculture Nutrition, 2008 , 14 (3) : 215 –222. DOI: 10.1111/j.1365-2095.2007.00520.x |
| [21] | 谈枫, 梁萌青, 郑珂珂, 等. 鲈鱼(Lateolabrax japonicus)养殖中期对饲料硒的需求量[J]. 渔业科学进展, 2015 , 36 (3) :93 –100. |
| [22] | ZHU Y, CHEN Y J, LIU Y J, et al. Effect of dietary selenium level on growth performance,body composition and hepatic glutathione peroxidase activities of largemouth bass Micropterus salmoide[J]. Aquaculture Research, 2012 , 43 (11) : 1660 –1668. DOI: 10.1111/j.1365-2109.2011.02972.x |
| [23] | HARDY R W, ORAM L L, MÖLLER G. Effects of dietary selenomethionine on cutthroat trout (Oncorhynchus clarki bouvieri) growth and reproductive performance over a life cycle[J]. Archives of Environmental Contamination and Toxicology, 2010 , 58 (1) : 237 –245. DOI: 10.1007/s00244-009-9392-x |
| [24] | ARSHAD U, TAKAMI G A, SADEGHI M, et al. Influence of dietary L-selenomethionine exposure on growth and survival of juvenile Huso huso[J]. Journal of Applied Ichthyology, 2011 , 27 (2) : 761 –765. DOI: 10.1111/j.1439-0426.2010.01639.x |
| [25] | LE K T, FOTEDAR R. Bioavailability of selenium from different dietary sources in yellowtail kingfish (Seriola lalandi)[J]. Aquaculture, 2014 , 420-421 : 57 –62. DOI: 10.1016/j.aquaculture.2013.10.034 |
| [26] | 李小霞, 陈锋, 潘庆, 等. 硒源对凡纳滨对虾生长、体组成和抗氧化能力的影响[J]. 水产科学, 2016 , 35 (3) :199 –203. |
| [27] | LIN Y H, SHIAU S Y. Mutual sparing of dietary requirements for alpha-tocopherol and selenium in grouper,Epinephelus malabaricus[J]. Aquaculture, 2009 , 294 (3/4) : 242 –245. |
| [28] | BELL J G, COWEY C B. Digestibility and bioavailability of dietary selenium from fishmeal,selenite,selenomethionine and selenocystine in Atlantic salmon (Salmo salar)[J]. Aquaculture, 1989 , 81 (1) : 61 –68. DOI: 10.1016/0044-8486(89)90230-5 |
| [29] | ILHAM, FOTEDAR R, MUNILKUMAR S. Effects of organic selenium supplementation on growth,glutathione peroxidase activity and histopathology in juvenile barramundi (Lates calcarifer Bloch 1970) fed high lupin meal-based diets[J]. Aquaculture, 2016 , 457 : 15 –23. DOI: 10.1016/j.aquaculture.2016.02.003 |
| [30] | 梁萌青, 王家林, 常青, 等. 饲料中硒的添加水平对鲈鱼生长性能及相关酶活性的影响[J]. 中国水产科学, 2006 , 13 (6) :1017 –1022. |
| [31] | JOVANOVIC A, GROUBOR-LAJSIC G, DJUKIC N, et al. The effect of selenium on antioxidant system in erythrocytes and liver of the carp (Cyprinus carpio L.)[J]. Critical Reviews in Food Science and Nutrition, 1997 , 37 (5) : 443 –448. DOI: 10.1080/10408399709527783 |
| [32] | RIDER S A, DAVIES S J, JHA A N, et al. Bioavailability of co-supplemented organic and inorganic zinc and selenium sources in a white fishmeal-based rainbow trout (Oncorhynchus mykiss) diet[J]. Journal of Animal Physiology and Animal Nutrition, 2010 , 94 (1) : 99 –110. DOI: 10.1111/j.1439-0396.2008.00888.x |
| [33] | DOTAN Y, LICHTENBERG D, PINCHUK I. Lipid peroxidation cannot be used as a universal criterion of oxidative stress[J]. Progress in Lipid Research, 2004 , 43 (3) : 200 –227. DOI: 10.1016/j.plipres.2003.10.001 |
| [34] | LEVANDER O A. A global view of human selenium nutrition[J]. Annual Review of Nutrition, 1987 , 7 (1) : 227 –250. DOI: 10.1146/annurev.nu.07.070187.001303 |
| [35] | MONTEIRO D A, RANTIN F T, KALININ A L. The effects of selenium on oxidative stress biomarkers in the freshwater characid fish matrinxã,Brycon cephalus (Günther,1869) exposed to organophosphate insecticide Folisuper 600 BR®(methyl parathion)[J]. Comparative Biochemistry and Physiology:Part C, 2009 , 149 (1) : 40 –49. |
| [36] | 覃希, 黄凯, 刘康, 等. 维生素E和硒对吉富罗非鱼(Oreochromis niloticus)幼鱼生长及血清抗氧化酶活性的影响[J]. 渔业科学进展, 2014 , 35 (4) :77 –84. |
| [37] | 许明珠, 张琴, 童潼, 等. 饲料中硒含量对方格星虫稚虫生长、体成分、组织硒含量及相关酶活性的影响[J]. 动物营养学报, 2015 , 27 (6) :1733 –1739. |
| [38] | LE K T, FOTEDAR R. Toxic effects of excessive levels of dietary selenium in juvenile yellowtail kingfish (Seriola lalandi)[J]. Aquaculture, 2014 , 433 : 229 –234. DOI: 10.1016/j.aquaculture.2014.06.021 |
| [39] | BHANDARI B. Trace elements in human health and disease[J]. Quarterly Medical Review, 1983 , 34 (4) : 1 –33. |
| [40] | SCHRAUZER G N. Selenomethionine:a review of its nutritional significance,metabolism and toxicity[J]. The Journal of Nutrition, 2000 , 130 (7) : 1653 –1656. |




