2. 上海光明荷斯坦牧业有限公司, 上海 200436
2. Shanghai Bright Holstan Co., Ltd., Shanghai 200436, China
酮病是奶牛产后发病率最高的营养代谢性疾病,为弥补能量赤字,奶牛机体发生脂肪动员产生非酯化脂肪酸(NEFA),NEFA不完全氧化转化为酮体,后者超过机体分解能力时就蓄积于体内,当血液中的β-羟丁酸(BHBA)水平达到1.2 mmol/L时就判定为酮病,酮病能损害奶牛机体的防御系统,影响奶牛的免疫反应,降低抗病能力[1-4]。肝脏中NEFA的氧化作用加强,导致了活性氧族(ROS)的增多,促进了氧化应激的发生[5],氧化应激可导致奶牛机体功能紊乱,从而影响奶牛的生产性能[6-7]。硒(Se)是重要的食源性微量元素,主要功能是作为谷胱甘肽过氧化物酶(GPx)的组成成分,而GPx具有抗氧化功能,通过催化还原型谷胱甘肽把体内有害过氧化物还原为无害的羟基化合物,从而保护细胞的结构和正常功能免受过氧化物的损害[8-11]。本试验旨在通过研究饲粮硒含量对酮病奶牛氧化应激的缓解作用及其机制,为硒在改善奶牛产后机体健康及生产性能的广泛应用提供理论依据和数据支持。
1 材料与方法 1.1 试验动物及饲养管理试验动物:胎次为(3.43±0.87) 胎、泌乳天数为(6.33±1.14) d、体重为(644±36) kg、平均泌乳量为(38.42±4.82) kg/d、血浆BHBA水平为(1.50±0.26) mmol/L的荷斯坦奶牛。
饲养管理:双列对尾栓系式饲养,自由饮水。试验参照NRC(2001) 奶牛营养需要并结合生产实践统一配制基础饲粮(表 1)[12],每日饲喂3次(07:00、14:00和21:00) ,每个饲喂点采用管道式挤奶设备挤奶1次。
1.2 试验方法 1.2.1 试验设计试验采用完全随机区组设计,将40头荷斯坦奶牛根据其血浆BHBA水平、体况评分、泌乳量、胎次和泌乳天数随机分成对照组和试验组1、2、3,每组5个重复,每个重复2头牛(分组信息见表 2)。对照组饲喂基础饲粮(饲粮硒含量为0.15 mg/kg DM),试验组1、2、3在基础饲粮中加入亚硒酸钠(Na2SeO3)至饲粮硒含量分别达0.30、0.45和0.60 mg/kg DM。试验分为3期,每期1周。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
于每期试验结束当天晨饲前1 h,用10 mL肝素钠抗凝真空采血管尾静脉采血,取3 mL抗凝全血-20 ℃保存以测定全血中硒含量,剩余抗凝血4 ℃、1 000×g离心10 min,分离血浆并于-20 ℃保存,用于血浆中葡萄糖、BHBA和NEFA水平的测定。
试验第2期结束当天从每组中随机挑选5头牛采集肝组织样品,参照叶耿坪[13]的方法进行样品处理,样品用于测定肝脏中硒含量、抗氧化指标[总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、过氧化氢(H2O2)含量和GPx活性]以及GPx1和GPx4 mRNA的表达。
|
|
表 2 试验牛分组信息 Table 2 Information of trial dairy cows |
全血和肝脏中硒含量的检测参照吴显实[14]的试验方法。
血浆中葡萄糖、BHBA和NEFA水平,以及肝脏中H2O2含量、T-AOC、GPx活性、SOD活性、MDA含量的检测均按照南京建成生物工程研究所生产的试剂盒操作说明进行(试剂盒编号依次为F006、H169、A042、A064、A015、A005、A001和A003) ,均采用分光光度法进行检测。
肝脏中GPx1和GPx4 mRNA的表达采用实时荧光定量PCR检测,以β-肌动蛋白(β-actin)为内参基因,采用2-△△CT方法分析目的基因的相对表达水平,具体操作参照叶耿坪[13]试验中肝组织基因表达的研究方法进行,所用引物序列见表 3。
|
|
表 3 实时荧光定量PCR引物序列 Table 3 Primer sequences used for real-time qPCR |
数据采用SAS 9.2的Mixed模型进行Compound Symmetry Covariance Structure分析,以Duncan氏法进行多重比较,结果以平均值±标准差(mean±SD)表示,判断标准为:P<0.05表示差异显著,0.05≤P<0.10表示具有影响趋势。
2 结果与分析 2.1 饲粮硒含量对酮病奶牛全血和肝脏中硒含量的影响由表 4可知,饲粮硒含量对酮病奶牛全血和肝脏中硒含量均有显著影响(P<0.05) 。与饲粮硒含量为0.15 mg/kg DM时相比,饲粮硒含量达到0.30、0.45和0.60 mg/kg DM时酮病奶牛全血和肝脏中硒含量均显著升高(P<0.05) ;饲粮硒含量为0.45和0.60 mg/kg DM时酮病奶牛全血和肝脏中硒含量无显著性差异(P>0.05) ,但均显著高于饲粮硒含量为0.30 mg/kg DM时(P<0.05) 。
2.2 饲粮硒含量对酮病奶牛血浆中能量代谢指标的影响由表 5可知,饲粮硒含量对酮病奶牛血浆中葡萄糖和BHBA水平无显著影响(P>0.05) ,但显著影响血浆中NEFA水平(P<0.05) 。与饲粮硒含量为0.15 mg/kg DM时相比,饲粮硒含量为0.45和0.60 mg/kg DM时酮病奶牛血浆中NEFA水平均显著降低(P<0.05) ,且与饲粮硒含量为0.30 mg/kg DM时相比,酮病奶牛血浆中NEFA水平均有降低趋势(0.05≤P<0.10) 。
|
|
表 4 饲料硒含量对酮病奶牛全血和肝脏硒含量的影响 Table 4 Effects of dietary Se content on whole blood and liver Se content of ketotic dairy cows |
|
|
表 5 饲粮硒含量对酮病奶牛血浆中能量代谢指标的影响 Table 5 Effects of dietary Se content on plasma energy metabolism indicators of ketotic dairy cows |
由表 6可知,饲粮硒含量对酮病奶牛肝脏中各抗氧化指标均有显著影响(P<0.05) 。与饲粮硒含量为0.15 mg/kg DM时相比,饲粮硒含量为0.30、0.45和0.60 mg/kg DM时酮病奶牛肝脏中T-AOC均显著升高(P<0.05) ;同时,饲粮硒含量为0.45和0.60 mg/kg DM时酮病奶牛肝脏中T-AOC显著高于饲粮硒含量为0.30 mg/kg DM时(P<0.05) 。肝脏中SOD活性变化同T-AOC的变化。与饲粮硒含量为0.15 mg/kg DM时相比,酮病奶牛肝脏中MDA和H2O2含量在饲粮硒含量为0.30、0.45和0.60 mg/kg DM时均显著下降(P<0.05) ;同时,酮病奶牛肝脏中MDA和H2O2含量在饲粮硒含量为0.45和0.60 mg/kg DM时要显著低于饲粮硒含量为0.30 mg/kg DM时(P<0.05) 。与饲粮硒含量为0.15 mg/kg DM时相比,饲粮硒含量为0.30、0.45和0.60 mg/kg DM时酮病奶牛肝脏中GPx活性均显著升高(P<0.05) ;同时,饲粮硒含量为0.45和0.60 mg/kg DM时酮病奶牛肝脏中GPx活性显著高于饲粮硒含量为0.30 mg/kg DM时(P<0.05) 。饲粮硒含量为0.45和0.60 mg/kg DM时酮病奶牛肝脏中各抗氧化指标均无显著性差异(P>0.05) 。
|
|
表 6 饲粮硒含量对酮病奶牛肝脏中抗氧化指标的影响 Table 6 Effects of dietary Se content on liver antioxidant indexes of ketotic dairy cows |
由图 1可知,与饲粮硒含量为0.15 mg/kg DM时相比,酮病奶牛饲粮硒含量达到0.30、0.45和0.60 mg/kg DM时肝脏中GPx1和GPx4 mRNA 的相对表达水平均显著增加(P<0.05) ;饲粮硒含量为0.45和0.60 mg/kg DM时酮病奶牛肝脏中GPx1和GPx4 mRNA的相对表达水平无显著差异(P>0.05) ,但二者与饲粮硒含量为0.30 mg/kg DM时相比有增加的趋势(0.05≤P<0.10) 。
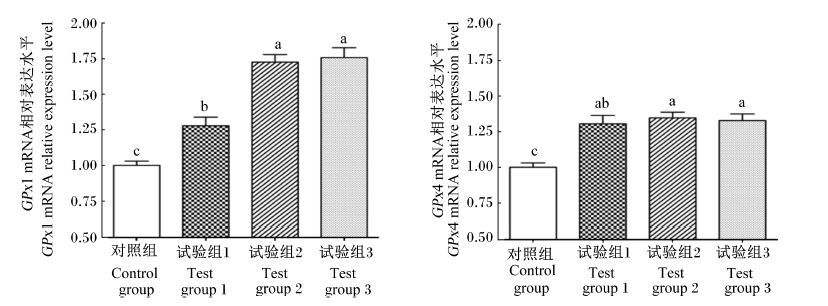
|
数据柱形标注不同小写字母表示差异显著(P<0.05) 。 Date columns with different small letters mean significant difference (P<0.05) . 图 1 饲粮硒含量对酮病奶牛肝脏GPx1和GPx4 mRNA相对表达水平的影响 Figure 1 Effects of dietary Se content on liver GPx1 and GPx4 mRNA relative expression levels of ketotic dairy cows |
硒以硒半胱氨酸的形式参与到硒酶肽链里,且位于酶活性中心,给动物补硒能激活动物体内自身抗氧化系统中的GPx,有效清除机体内的H2O2、有机过氧化物(ROOH)、磷脂氢过氧化物和胆固醇氢过氧化物等[15-16]。酮病奶牛体脂动员产生的NEFA在肝脏中氧化分解,导致ROS增多,从而促进氧化应激的发生[17],氧化应激可导致奶牛机体功能紊乱,进而影响奶牛的生产性能[6-7]。给酮病奶牛饲粮补充硒可激活机体自身抗氧化系统中的GPx活性及其基因的表达,促进催化还原型谷胱甘肽把体内有害过氧化物还原为无害的羟基化合物,从而保护细胞的结构和正常功能免受过氧化物的损害[11]。
本试验中,在硒含量为0.15 mg/kg DM的酮病奶牛饲粮中补充硒能显著提高全血和肝脏中硒含量,与前人得出的结论[18-19]一致,说明0.15 mg/kg DM的硒不足以满足酮病奶牛的需求。当饲粮硒含量达到0.45 mg/kg DM时,全血和肝脏中硒含量均达到最大,再进一步添加硒达到0.60 mg/kg DM时,全血和肝脏中硒含量无显著增加,说明0.45 mg/kg DM的硒是酮病奶牛的最大也是最适硒需求量。与饲粮硒含量为0.15 mg/kg DM时相比,饲粮硒含量为0.45 mg/kg DM时显著提高了酮病奶牛肝脏中T-AOC、SOD活性和GSH-Px活性,显著提高了肝脏中GPx1和GPx4 mRNA的相对表达水平,且显著降低了肝脏中MDA和H2O2含量,充分说明在硒含量为0.15 mg/kg DM的酮病奶牛饲粮中补充硒达到0.45 mg/kg DM时能显著提高酮病奶牛机体的抗氧化能力,同时能降低机体遭受氧化应激的危害。许宗运等[19]也报道,饲粮硒含量为0.45 mg/kg DM时,奶牛有较好的抗氧化能力。此外,与对照组相比,饲粮中添加硒虽然对血浆中葡萄糖和BHBA水平无显著影响,但是能显著降低血浆中NEFA水平,可能是因为补硒减少了肝细胞遭受的氧化应激,较好地保护了肝细胞及其正常生理功能,从而有效维持肝脏的糖异生功能或减少糖异生功能的损失,进而维持和提高糖的合成,减少脂肪动员,最终减少NEFA的生成;亦或是因为补硒减少了肝细胞的氧化应激,从而保证了NEFA的正常代谢,促进NEFA的分解而减少了NEFA的蓄积。
4 结论饲粮硒含量为0.15 mg/kg DM时无法满足酮病奶牛对硒的需求,在本试验基础饲粮中补硒使饲粮硒含量达到0.45 mg/kg DM时能显著提高酮病奶牛的抗氧化能力,进一步增加硒含量抗氧化能力不再增加,确定0.45 mg/kg DM是酮病奶牛的最适硒需求量。
| [1] | 刘鹏, 王霞光, 李艳奇, 等. 奶牛酮病的发病原因及防治措施[J]. 浙江畜牧兽医, 2007 (1) :31 –32. |
| [2] | MCART J A A, NYDAM D V, OSPINA P A, et al. A field trial on the effect of propylene glycol on milk yield and resolution of ketosis in fresh cows diagnosed with subclinical ketosis[J]. Journal of Dairy Science, 2011 , 94 (12) : 6011 –6020. DOI: 10.3168/jds.2011-4463 |
| [3] | 李修明, 张洪友, 袁子国, 等. 奶牛酮病的发病机理研究现状及防治策略[J]. 中国牛业科学, 2008 , 34 (3) :29 –31. |
| [4] | 杨淑萍, 王岩, 王丽坤, 等. 奶牛酮病的发病机制及防制[J]. 畜牧兽医科技信息, 2008 (3) :50 . |
| [5] | MUDROÑ P, REHAGE J, QUALMANN K, et al. A study of lipid peroxidation and vitamin E in dairy cows with hepatic insufficiency[J]. Journal of Veterinary Medicine:Series A, 1999 , 46 (4) : 219 –224. DOI: 10.1046/j.1439-0442.1999.00206.x |
| [6] | MILLER J K, BRZEZINSKA-SLEBODZINSKA E, MADSEN F C. Oxidative stress, antioxidants, and animal function[J]. Journal of Dairy Science, 1993 , 76 (9) : 2812 –2823. DOI: 10.3168/jds.S0022-0302(93)77620-1 |
| [7] | BRZEZINSKA-SLEBODZINSKA E, MILLER J K, QUIGLEY Ⅲ J D, et al. Antioxidant status of dairy cows supplemented prepartum with vitamin E and selenium[J]. Journal of Dairy Science, 1994 , 77 (10) : 3087 –3895. DOI: 10.3168/jds.S0022-0302(94)77251-9 |
| [8] | DANESI F, MALAGUTI M, NUNZIO M D, et al. Counteraction of adriamycin-induced oxidative damage in rat heart by selenium dietary supplementation[J]. Journal of Agricultural and Food Chemistry, 2006 , 54 (4) : 1203 –1208. DOI: 10.1021/jf0518002 |
| [9] | MAGGINI S, WINTERGERST E S, BEVERIDGE S, et al. Selected vitamins and trace elements support immune function by strengthening epithelial barriers and cellular and humoral immune responses[J]. British Journal of Nutrition, 2007 , 98 (Suppl.1) : S29 –S35. |
| [10] | HOFFMANN F W, HASHIMOTO A C, SHAFER L A, et al. Dietary selenium modulates activation and differentiation of CD4+ T cells in mice through a mechanism involving cellular free thiols[J]. The Journal of Nutrition, 2010 , 140 (6) : 1155 –1161. DOI: 10.3945/jn.109.120725 |
| [11] | 蔺文爱, 黄应祥. 微量元素硒及其对奶牛的营养作用[J]. 饲料工业, 2005 , 26 (19) :44 –45. |
| [12] | NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington, D.C.:National Academy Press, 2001. |
| [13] | 叶耿坪.富甘油酵母菌制剂对围产期奶牛能量平衡的影响及机理研究[D].博士学位论文.南京:南京农业大学, 2014:83-100. |
| [14] | 吴显实.富硒益生菌在奶牛生产上的应用效果及其作用机理研究[D].博士学位论文.南京:南京农业大学, 2009:61-70. |
| [15] | GAN F, CHEN X X, LIAO S F, et al. Selenium-enriched probiotics improve antioxidant status, immune function, and selenoprotein gene expression of piglets raised under high ambient temperature[J]. Journal of Agricultural and Food Chemistry, 2014 , 62 (20) : 4502 –4508. DOI: 10.1021/jf501065d |
| [16] | BEHNE D, KYRIAKOPOULOS A. Mammalian selenium-containing proteins[J]. Annual Review of Nutrition, 2001 , 21 (1) : 453 –473. DOI: 10.1146/annurev.nutr.21.1.453 |
| [17] | BIONAZ M, TREVISI E, CALAMARI L, et al. Plasma paraoxonase, health, inflammatory conditions, and liver function in transition dairy cows[J]. Journal of Dairy Science, 2007 , 90 (4) : 1740 –1750. DOI: 10.3168/jds.2006-445 |
| [18] | 张丽娟.酵母硒对奶牛消化、抗氧化和泌乳性能的影响[D].硕士学位论文.乌鲁木齐:新疆农业大学, 2007:14-28. |
| [19] | 许宗运, 张丽娟, 韩俊文. 不同水平酵母硒对奶牛血液抗氧化能力的影响[J]. 动物营养学报, 2007 , 19 (6) :753 –757. |




