2. 河北工程大学农学院, 邯郸 056021;
3. 东北农业大学动物科技学院, 哈尔滨 150030
2. College of Agriculture, Hebei University of Engineering, Handan 056021, China;
3. College of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, China
目前,关于温度对肉鸡影响的研究多集中在32 ℃以上的热应激环境[1-6]。由于湿帘纵向通风技术的成熟应用,高温热应激的情况实属少见,而实际生产中低于32 ℃的偏热环境却经常出现,这同样对肉鸡的各项性能有不利的影响,如生长性能[7]、解偶联蛋白的表达和糖脂代谢[7-8]、肠道微生物菌群的多样性[9]、肠道免疫功能[10]以及不同休息行为时间占比[11]。
相对湿度(RH)作为温热环境的主要因素之一,对肉鸡的影响建立在温度的基础上[12];不同的温度模式,RH会对肉鸡产生不同的影响。有关温度和RH对肉鸡生长性能影响的研究表明,在适温和低温范围内,RH对肉鸡的日增重无显著影响[13-14];在恒定温度32或29 ℃,与低湿(40%)相比,高湿(80%~90%)显著降低了肉鸡的生长率[15-17];当温度突然增加到35、28或30 ℃,RH为60%~65%时,肉鸡的生长率和采食量最高[18-19]。
在应对不利的环境条件时,家禽会进行一系列的调节来维持体热的动态平衡[20],其中涉及体温、呼吸和内分泌等一系列与体热调节相关的生理生化反应[21-25]。热休克蛋白(heat shock protein,HSP)是机体受到应激原刺激后产生的蛋白质,是生物热休克反应的主要标志;在其家族中,热休克蛋白70(HSP70)是最重要的一种蛋白质,其广泛的生物学功能使其成为当今生命科学研究中的热点之一[26-27]。
在我国大部分地区,春夏交接时都会出现温度逐日递增的现象,而RH对递增性偏热环境下肉鸡体热调节及下丘脑HSP70含量的影响还未见报道。鉴此,本试验就RH对递增性偏热环境下肉鸡体热调节及下丘脑HSP70含量的影响进行研究,以期为家禽养殖中适宜RH的确定提供科学依据。
1 材料与方法 1.1 试验设计试验选取同一批出雏、饲养管理一致、体质健壮的21日龄爱拔益加(AA)肉鸡180只转入人工环境控制舱,随机分成3组,每组6个重复,每个重复10只鸡(公母各占1/2)。预试期7 d,温度20 ℃,RH 60%。正试期15 d,28日龄开始试验,将3组的RH分别调整到35%、60%和85%,温度仍为20 ℃;3 d为1周期,共分5个周期,从第2周期开始每周期的第1天将3组的温度均在10:00开始升高3 ℃并在0.5 h内达到稳定。5个周期的温度分别为20、23、26、29和32 ℃。
1.2 试验饲粮采用玉米-豆粕型饲粮,试验所用饲粮为参照NRC (1994)营养需要配制的粉状配合饲粮,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as-fed basis) |
试验鸡均采用平养,所选用的笼具为本实验室研发的单层平养笼具[28],每8只试验鸡饲养面积0.64 m2。试验期间自由采食饮水,24 h光照,常规免疫。
1.4 测定指标和方法 1.4.1 生理指标正试期第15天,即温度升高到32 ℃后48 h时,分别测定各组肉鸡的皮肤温度、体核温度和呼吸频率。皮肤温度的测定方法为:使用红外热成像仪FLIR E4(热分辨率0.07 ℃、精度±2%)对肉鸡头部侧面、小腿(跖)侧面进行垂直拍摄,拍摄距离为0.5 m,每隔3 min拍摄1次,连续拍摄1 h,每只鸡拍摄20张红外照片。通过FLIR Tools软件分析,计量每张照片中鸡冠、小腿、脚蹼、眼睑和耳垂的皮肤温度,取同1只鸡20个数据的平均值作为真实皮肤温度。体核温度的测定方法为:每组随机选取6只肉鸡(每个重复选取1只,公母各占1/2),将数字体温计(Model.JM 6200,分辨率0.01 ℃)5 cm长的探头几乎全部插入直肠,待数值稳定后记录体核温度值,之后每隔5 s记录1次体核温度,共记录4次,取其平均值。呼吸频率的测定方法为:每组随机选取6只肉鸡(每个重复选取1只,公母各占1/2),每隔10 min测定1次,每次测定1 min内肉鸡的呼吸次数,共采集6次,呼吸频率为6次呼吸次数的平均值。
1.4.2 血清酶活性和内分泌指标正试期第15天,即温度升高到32 ℃后48 h时,每组随机选取6只肉鸡(每个重复选取1只,公母各占1/2)翅静脉采血,3 000 r/min离心10 min,取血清于-80 ℃冷冻保存。
血清谷草转氨酶(aspartate transaminase,AST)、碱性磷酸酶(alkaline phosphatase,AKP)、乳酸脱氢酶(lactate dehydrogenase,LDH)和肌酸激酶(creatine kinase,CK)活性以及三碘甲腺原氨酸(3, 5, 3’-triiodothyronine,T3)、甲状腺素(又称四碘甲腺原氨酸,3, 5, 3’, 5’-tetraiodothyronine,T4)和皮质酮(cortisol,CORT)含量采用酶联免疫吸附测定(ELISA)法测定。所用试剂盒均购自南京建成生物工程研究所,测定方法按说明书进行。
1.4.3 下丘脑HSP70的含量正试期第15天,即温度升高到32 ℃后48 h时,每组随机选取6只肉鸡(每个重复选取1只,公母各占1/2),采血后迅速将鸡处死,3 min内剥离取出下丘脑放入速冻管于-80 ℃保存。采用ELISA双抗体夹心法测定下丘脑HSP70的含量。
1.5 数据统计分析试验数据采用SAS 9.2统计软件中的单因子方差分析(one-way ANOVA)程序进行差异显著性检验,采用Duncan氏法进行多重比较检验。试验数据用平均值±标准差表示,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 RH对递增性偏热环境下肉鸡生理指标的影响由表 2可知,RH对为期15 d的20~32 ℃递增性偏热环境下肉鸡的呼吸频率和皮肤温度均有极显著影响(P < 0.01)。其中,85% RH组肉鸡的呼吸频率极显著高于60% RH和35% RH组(P < 0.01),60% RH组的呼吸频率极显著高于35% RH组(P < 0.01);85% RH组肉鸡的体核温度显著高于60% RH组(P < 0.05),而35% RH组的体核温度与60% RH和85% RH组无显著差异(P > 0.05);35% RH组肉鸡小腿和脚蹼的皮肤温度极显著高于60% RH和85% RH组(P < 0.01);35% RH和60% RH组肉鸡鸡冠、耳垂和眼睑的皮肤温度极显著高于85% RH组(P < 0.01)。
|
|
表 2 RH对递增性偏热环境下肉鸡生理指标的影响 Table 2 Effects of relative humidity at gradually increasing temperatures on physiological indices of broiler chickens |
由表 3可知,RH对为期15 d的20~32 ℃递增性偏热环境下肉鸡的血清AKP和CK活性有显著影响(P < 0.05)。其中,85% RH组肉鸡的血清AKP活性显著高于35% RH和60% RH组(P < 0.05),35% RH组的血清AKP活性与60% RH组无显著差异(P > 0.05);35% RH和85% RH组肉鸡的血清CK活性显著高于60% RH组(P < 0.05),35% RH组的血清CK活性与85% RH组无显著差异(P > 0.05)。RH对递增性偏热环境下肉鸡的血清AST和LDH活性无显著影响(P > 0.05)。
|
|
表 3 RH对递增性偏热环境下肉鸡血清酶活性的影响 Table 3 Effects of relative humidity at gradually increasing temperatures on the activities of enzymes in serum of broiler chickens |
由表 4可知,RH对为期15 d的20~32 ℃递增性偏热环境下肉鸡的血清T3、T4和CORT含量有显著影响(P < 0.05)。其中,85% RH组肉鸡的血清T3含量显著高于35% RH组(P < 0.05),60% RH组的血清T3含量与35% RH和85% RH组无显著差异(P > 0.05);35% RH和85% RH组肉鸡的血清T4含量显著高于60% RH组(P < 0.05),35% RH组的血清T4含量与85% RH组无显著差异(P > 0.05);60% RH和85% RH组肉鸡的血清CORT含量极显著高于35% RH组(P < 0.01),60% RH组的血清CORT含量与85% RH组无显著差异(P > 0.05)。
|
|
表 4 RH对递增性偏热环境下肉鸡内分泌指标的影响 Table 4 Effects of relative humidity at gradually increasing temperatures on endocrine indices of broiler chickens |
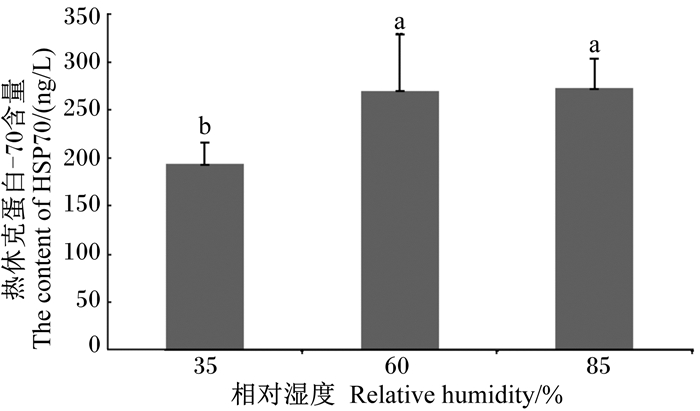
由图 1可知,RH对为期15 d的20~32 ℃递增性偏热环境下肉鸡下丘脑HSP70含量有显著影响(P < 0.05)。其中,35% RH组肉鸡下丘脑HSP70含量显著低于60% RH和85% RH组(P < 0.05),60% RH组的下丘脑HSP70含量与85% RH组无显著差异(P > 0.05)。
|
数据柱标注不同小写字母表示差异显著(P < 0.05),相同字母表示差异不显著(P > 0.05)。 Values columns with different small letters mean significant difference (P < 0.05), while with the same letter superscripts mean no significant difference (P > 0.05). 图 1 RH对递增性偏热环境下肉鸡下丘脑HSP70含量的影响 Figure 1 Effects of relative humidity at gradually increasing temperatures on the content of HSP70 in hypothalamus of broiler chickens |
体核温度和呼吸频率是反映肉鸡热平衡调节的重要生理指标[29]。Yahav[19]用数字温度计测量肉鸡的肛温和皮肤温度(翅下无羽区),研究表明当环境温度持续为28 ℃时,环境RH (40%~45%、50%~55%、60%~65%和70%~75%)对4~8周龄肉鸡的体温无显著影响。林海[30]用红外线点温仪测量肉鸡皮肤温度(胸部、背部、趾部、腿部和翅部)和用热敏电阻测头测量肛温,研究发现在环境温度低于25 ℃时,RH对肉鸡的体温无显著影响。红外热成像技术具有精度高、非接触、非侵入和对研究对象无干扰等诸多优点[23, 31],保证了数据的客观可靠性,现已经逐步应用于禽类皮肤温度的测定[32-36]。本试验研究发现,在为期15 d的20~32 ℃递增性偏热环境下,低湿(35%)时肉鸡的皮肤温度较高,而呼吸频率较低;高湿(85%)时肉鸡的皮肤温度较低,而呼吸频率较高。在高湿情况下,环境中的水分含量较高,肉鸡皮肤表面的含水量较高,阻碍了蒸发散热,肉鸡只能通过加快呼吸来蒸发散热,但过度呼吸使肉鸡处于高负荷状态,不能维持体热调节,故肉鸡的体核温度升高;而低湿情况下,腿部裸露的皮肤温度较高,而呼吸频率较低,这可能是因为低湿有利于肉鸡裸露部位的皮肤蒸发,而水分含量过低,不利于呼吸道蒸发散热。这表明,在为期15 d的20~32 ℃递增性偏热环境下,低湿时肉鸡可能主要通过皮肤蒸发散热来维持体热平衡,而高湿时肉鸡可能主要通过呼吸蒸发散热来维持体热平衡,但是过度呼吸使肉鸡处于高负荷状态,会升高肉鸡的体核温度。
3.2 RH对递增性偏热环境下肉鸡血清酶活性的影响LDH是糖酵解过程中的关键酶,催化丙酮酸产生乳酸,血清中LDH的活性升高与无氧酵解加强密切相关。正常情况下,AST存在于心肌细胞和肝细胞的线粒体内,血清中AST活性极低;应激时细胞线粒体受损,AST逸出细胞进入血液,使得血清中AST活性升高。血清中AST活性升高表明存在肝细胞损伤。本试验研究发现,在为期15 d的20~32 ℃递增性偏热环境下,RH对LDH和AST无显著影响,这表明在本试验条件下,RH应激不会引起肉鸡无氧糖酵解加强和肝细胞损伤。
AKP是一组酶类,在碱性条件下有较高的活性,是体内蛋白质、脂肪分解代谢中重要的酶,动物受到应激时会动员体贮(肌肉)中的糖原、蛋白质和脂肪来分解供能,因此应激时AKP活性升高。本试验研究发现,在为期15 d的20~32 ℃递增性偏热环境下,RH对AKP活性有显著影响,高湿(85%)组肉鸡的血清AKP活性显著高于低湿(35%)和中湿(60%)组。这表明高湿对肉鸡的应激较大,需要动员体内的糖原、蛋白质和脂肪来分解供能,AKP活性较高。CK的主要成分是肌肉同工酶(MM-CK),是动物受到应激的重要特征指标之一。Sandercock等[37]报道认为,温度为32 ℃、RH为75%的环境中应激2 h,肉鸡血浆中CK活性显著升高,表明血液中CK活性升高为肉鸡受到应激的表现。本试验研究发现,在为期15 d的20~32 ℃递增性偏热环境下,与中湿(60%)相比,高湿(85%)和低湿(35%)都会显著升高肉鸡血清中CK活性。这可能是由于低湿和高湿的应激使肉鸡采食量下降,营养摄入不够,肌肉营养不良,导致肌细胞膜功能和通透性受到破坏,肌肉中的CK进入血液,从而使血清中CK活性升高。
3.3 RH对递增性偏热环境下肉鸡内分泌指标的影响甲状腺是调节机体代谢的重要内分泌腺,其分泌的甲状腺激素T3和T4是参与机体糖、脂肪等能量代谢和调节产热的重要激素,是动物常见的应激指标。Yahav等[18]研究发现,当温度为28、30或者35 ℃,RH为40%~75%时,肉鸡的血清T3含量与采食量呈正相关。另有报道认为,在高温高湿条件下,由于散热难度加大,要保持鸡体热平衡,必须通过内分泌途径减少产热,血浆T3含量的下降正是这种调节的体现,也是鸡耐热力增强的标志[38]。而本试验研究发现,在为期15 d的20~32 ℃递增性偏热环境下,高湿(85%)组肉鸡的血清T3含量显著高于低湿(35%)组;高湿(85%)和低湿(35%)组肉鸡的血清T4含量显著高于中湿(60%)组。这一方面可能与试验条件有关,本试验条件是为期15 d的20~32 ℃递增性偏热环境,属于慢性长期递增偏热应激;另一方面,研究表明热应激过程中血液的T3和T4含量随时间的延长而出现波动,呈现并不一致的趋势[39-40]。CORT作为家禽主要的糖皮质激素,参与动员体内储存的能量,为动物抵抗不良应激做准备。一般来说,应激状态会刺激下丘脑-垂体-肾上腺轴分泌糖皮质激素,升高CORT含量来抵抗应激。而本试验研究发现,在为期15 d的20~32 ℃递增性偏热环境下,低湿(35%)组肉鸡的血清CORT含量极显著低于中湿(60%)和高湿(85%)组。这可能是因为,在低湿情况下主要通过皮肤蒸发散热,为物理散热方式,不需要消耗体内能量,产生的应激较少,故可能测得的血清CORT含量较低,而这一具体分子机制尚不清楚,需要进一步深入研究。
3.4 RH对递增性偏热环境下肉鸡下丘脑HSP70含量的影响HSP是由Ritossa等[41]1962年在暴露于高温中的果蝇唾液腺染色体中发现的,是细胞在应激原特别是高温诱导下所产生的一种蛋白质,其中HSP70家族最为重要和保守[42]。应激时,机体进入氧化应激状态,机体活性氧(ROS)含量增加,产生和释放HSP来保护细胞免受ROS的影响[43]。Xie等[44]研究发现,急性和慢性热应激下蛋鸡心脏、肝脏和肌肉组织中HSP的表达水平均上调。许生友[45]在热应激状态下肝脏基因表达谱研究中也发现鸡HSP基因表达水平上调。诸多研究结果表明,HSP的生成与热耐受力呈正相关关系。本试验研究发现,在为期15 d的20~32 ℃递增性偏热环境下,35% RH显著降低肉鸡下丘脑中HSP70含量。这可能是因为,低湿情况下肉鸡主要通过皮肤蒸发散热,为物理散热方式,不需要消耗体内能量,体内产生的ROS含量较低,故HSP70含量可能较低;另外,细胞内游离钙等因素也与HSP70的转录调控有关[46],而这一方面的具体分子机制尚不清楚,需要进一步深入研究。
4 结论在为期15 d的20~32 ℃递增性偏热环境下,与中湿(60%)相比,高湿(85%)显著升高肉鸡的呼吸频率、体核温度、血清AKP和CK活性以及T4含量,显著降低肉鸡的皮肤温度(除脚蹼温度外);低湿(35%)显著升高肉鸡的小腿和脚蹼温度、血清CK活性以及T4含量,显著降低肉鸡的呼吸频率、血清CORT和下丘脑HSP70含量。可见,高湿和低湿对递增性偏热环境下28~42日龄肉鸡体热调节的途径和程度不同。
| [1] | 呙于明, 刘彩霓, 周毓平. 高温应激对肉仔鸡的影响及补铬的效果研究[J]. 畜牧兽医学报, 1998 , 29 (4) :339 –344. |
| [2] | TOYOMIZU M, UEDA M, SATO S, et al. Cold-induced mitochondrial uncoupling and expression of chicken UCP and ANT mRNA in chicken skeletal muscle[J]. FEBS Letters, 2002 , 529 (2/3) : 313 –318. |
| [3] | 韩爱云.热应激对肉鸡淋巴细胞钙信号转导的影响及铬的调控作用[D].博士学位论文.北京:中国农业科学院.2010. |
| [4] | DHABHAR F S, SAUL A N, DAUGHERTY C, et al. Short-term stress enhances cellular immunity and increases early resistance to squamous cell carcinoma[J]. Brain, Behavior, and Immunity, 2010 , 24 (1) : 127 –137. DOI: 10.1016/j.bbi.2009.09.004 |
| [5] | GERAERT P A, PADILHA J C F, GUILLAUMIN S. Metabolic and endocrine changes induced by chronic heatexposure in broiler chickens:growth performance, body composition and energy retention[J]. British Journal of Nutrition, 1996 , 75 (2) : 195 –204. |
| [6] | 尤玉双, 刘继军, 汪明. 冬春季节密闭式鸡舍的通风控制[J]. 中国家禽, 2005 , 27 (6) :4 –9. |
| [7] | 甄龙, 石玉祥, 张敏红, 等. 持续偏热环境对肉鸡生长性能、糖脂代谢及解偶联蛋白mRNA表达的影响[J]. 动物营养学报, 2015 , 27 (7) :2060 –2069. |
| [8] | 苏红光, 张敏红, 冯京海, 等. 持续冷热环境对肉鸡生产性能、糖代谢和解偶联蛋白mRNA表达的影响[J]. 动物营养学报, 2014 , 26 (11) :3276 –3283. |
| [9] | 彭骞骞, 王雪敏, 张敏红, 等. 持续偏热环境对肉鸡盲肠菌群多样性的影响[J]. 中国农业科学, 2016 , 49 (1) :186 –194. |
| [10] | 张少帅, 甄龙, 冯京海, 等. 持续偏热处理对肉仔鸡免疫器官指数、小肠形态结构和黏膜免疫指标的影响[J]. 动物营养学报, 2015 , 27 (12) :3887 –3894. |
| [11] | 胡春红, 张敏红, 冯京海, 等. 偏热刺激对肉鸡休息行为、生理及生产性能的影响[J]. 动物营养学报, 2015 , 27 (7) :2070 –2076. |
| [12] | LIN H, ZHANG H F, DU R, et al. Thermoregulation responses of broiler chickens to humidity at different ambient temperatures.Ⅱ.Four weeks of age[J]. Poultry Science, 2005 , 84 (8) : 1173 –1178. DOI: 10.1093/ps/84.8.1173 |
| [13] | PRINCE R P, WHITAKER J H, MATTERSON L D, et al. Response of chickens to temperature and relative humidity environments[J]. Poultry Science, 1965 , 44 (1) : 73 –77. DOI: 10.3382/ps.0440073 |
| [14] | FREEMAN B M. The domestic fowl in biomedical research:physiological effects of the environment[J]. World's Poultry Science Journal, 1988 , 44 (1) : 41 –60. DOI: 10.1079/WPS19880004 |
| [15] | MILLIGAN J L, WINN P N. The influence of temperature and humidity on broiler performance in environmental chambers[J]. Poultry Science, 1964 , 43 (4) : 817 –824. DOI: 10.3382/ps.0430817 |
| [16] | REECE F N, DEATON J W, KUBENA L F. Effects of high temperature and humidity on heat prostration of broiler chickens[J]. Poultry Science, 1972 , 51 (6) : 2021 –2025. DOI: 10.3382/ps.0512021 |
| [17] | ADAMS R L, ROGLER J C. The effects of dietary aspirin and humidity on the performance of light and heavy breed chicks[J]. Poultry Science, 1968 , 47 (4) : 1344 –1348. DOI: 10.3382/ps.0471344 |
| [18] | YAHAV S, GOLDFELD S, PLAVNIK I, et al. Physiological responses of chickens and turkeys to relative humidity during exposure to high ambient temperature[J]. Journal of Thermal Biology, 1995 , 20 (3) : 245 –253. DOI: 10.1016/0306-4565(94)00046-L |
| [19] | YAHAV S. Relative humidity at moderate ambient temperatures:its effect on male broiler chickens and turkeys[J]. British Poultry Science, 2000 , 41 (1) : 94 –100. DOI: 10.1080/00071660086475 |
| [20] | 张少帅, 张敏红. 风速在家禽热平衡调节中的作用[J]. 动物营养学报, 2015 , 27 (5) :1348 –1354. |
| [21] | LACEY B, HAMRITA T K, LACY M P, et al. Assessment of poultry deep body temperature responses to ambient temperature and relative humidity using an on-line telemetry system[J]. Transactions of the ASAE, 2000 , 43 (3) : 717 –721. DOI: 10.13031/2013.2754 |
| [22] | DE SOUZA J B F, J r., DE ARRUDA A M V, DOMINGOS H G T. Retracted article:regional differences in the surface temperature of naked neck laying hens in a semi-arid environment[J]. International Journal of Biometeorology, 2013 , 57 (3) : 377 –380. DOI: 10.1007/s00484-012-0561-7 |
| [23] | GILOH M, SHINDER D, YAHAV S. Skin surface temperature of broiler chickens is correlated to body core temperature and is indicative of their thermoregulatory status[J]. Poultry Science, 2012 , 91 (1) : 175 –188. DOI: 10.3382/ps.2011-01497 |
| [24] | 陈燕.环境高温与饲粮粗蛋白质水平对肉鸡氮代谢和有害气体生成的影响[D].硕士学位论文.北京:中国农业科学院.2013. |
| [25] | LIN H, JIAO H C, BUYSE J, et al. Strategies for preventing heat stress in poultry[J]. World's Poultry Science Journal, 2006 , 62 (1) : 71 –86. DOI: 10.1079/WPS200585 |
| [26] | KIANG J G, TSOKOS G C. Heat shock protein 70 kDa:molecular biology, biochemistry, and physiology[J]. Pharmacology & Therapeutics, 1998 , 80 (2) : 183 –201. |
| [27] | DAUGAARD M, ROHDE M, JÄÄTTELÄ M. The heat shock protein 70 family:highly homologous proteins with overlapping and distinct functions[J]. FEBS Letters, 2007 , 581 (19) : 3702 –3710. DOI: 10.1016/j.febslet.2007.05.039 |
| [28] | 张敏红, 苏红光, 冯京海, 等.采集用于建立肉鸡生活环境舒适性评价模型数据的方法和专用装置:中国, CN103404447A[P].2013-11-27. http://www.oalib.com/references/19285017 |
| [29] | EGBUNIKE G N. The relative importance of dry-and wet-bulb temperatures in the thermorespiratory function in the chicken[J]. Zentralblatt für Veterin rmedizin Reihe A, 1979 , 26 (7) : 573 –579. |
| [30] | 林海.肉鸡实感温度的系统模型分析及热应激下的营养生理反应[D].博士学位论文.北京:中国农业科学院, 1996. http://d.wanfangdata.com.cn/Thesis_Y214015.aspx |
| [31] | EDGAR J L, NICOL C J, PUGH C A, et al. Surface temperature changes in response to handling in domestic chickens[J]. Physiology & Behavior, 2013 , 119 : 195 –200. |
| [32] | PHILLIPS P K, SANBORN A F. An infrared, thermographic study of surface temperature in three ratites:ostrich, emu and double-wattled cassowary[J]. Journal of Thermal Biology, 1994 , 19 (6) : 423 –430. DOI: 10.1016/0306-4565(94)90042-6 |
| [33] | STEWART M, WEBSTER J R, SCHAEFER A L, et al. Infrared thermography as a non-invasive tool to study animal welfare[J]. Animal Welfare, 2005 , 14 (4) : 319 –325. |
| [34] | YAHAV S, SHINDER D, RUZAL M, et al.Controlling body temperature-the opportunities for highly productive domestic fowl[M]//CISNEROS A B, GIONS B L.Body Temperature Regulation.New York:Nova Science, 2009:65-98. |
| [35] | YAHAV S, LUGER D, CAHANER A, et al. Thermoregulation in naked neck chickens subjected to different ambient temperatures[J]. British Poultry Science, 1998 , 39 (1) : 133 –138. DOI: 10.1080/00071669889510 |
| [36] | YAHAV S, STRASCHNOW A, LUGER D, et al. Ventilation, sensible heat loss, broiler energy, and water balance under harsh environmental conditions[J]. Poultry Science, 2004 , 83 (2) : 253 –258. DOI: 10.1093/ps/83.2.253 |
| [37] | SANDERCOCK D A, HUNTER R R, NUTE G R, et al. Acute heat stress-induced alterations in blood acid-base status and skeletal muscle membrane integrity in broiler chickens at two ages:implications for meat quality[J]. Poultry Science, 2001 , 80 (4) : 418 –425. DOI: 10.1093/ps/80.4.418 |
| [38] | YAHAV S, HURWITZ S. Induction of thermotolerance in male broiler chickens by temperature conditioning at an early age[J]. Poultry Science, 1996 , 75 (3) : 402 –406. DOI: 10.3382/ps.0750402 |
| [39] | 龚远英.肉鸡急性热应激损伤与应激损伤机理的研究[D].硕士学位论文.南京:南京农业大学, 2001. |
| [40] | 宁章勇.肉仔鸡热应激机理的研究[D].硕士学位论文.泰安:山东农业大学, 2002. |
| [41] | RITOSSA F. A new puffing pattern induced by temperature shock and DNP in Drosophila[J]. Experientia, 1962 , 18 : 571 –573. DOI: 10.1007/BF02172188 |
| [42] | TISSIÉRES A, MITCHELL H K, TRACY U M. Protein synthesis in salivary glands of Drosophila melanogaster. Relation to chromosome puffs[J]. Journal of Molecular Biology, 1974 , 84 (3) : 389 –398. DOI: 10.1016/0022-2836(74)90447-1 |
| [43] | DRÖGE W. Free radicals in the physiological control of cell function[J]. Physiological Reviews, 2002 , 82 (1) : 47 –95. DOI: 10.1152/physrev.00018.2001 |
| [44] | XIE J J, TANG L, LU L, et al. Differential expression of heat shock transcription factors and heat shock proteins after acute and chronic heat stress in laying chickens (Gallus gallus)[J]. PLoS One, 2014 , 9 (7) : e102204 . DOI: 10.1371/journal.pone.0102204 |
| [45] | 许生友.鸡耐热性评价与热应激状态下肝脏基因表达谱研究[D].硕士学位论文.合肥:安徽农业大学, 2011. |
| [46] | 孙培明.肉鸡热应激损伤与热休克蛋白70表达的研究[D].博士学位论文.南京:南京农业大学, 2006. |




