2. 浙江省水生生物资源养护与开发技术研究重点实验室, 中国水产科学研究院水生动物繁育与营养重点实验室, 湖州师范学院, 湖州 313000
2. Zhejiang Provincial Key Laboratory of Aquatic Resources Conservation and Development, Key Laboratory of Aquatic Animal Genetic Breeding and Nutrition of Chinese Academy of Fishery Sciences, College of Life Science, Huzhou University, Huzhou 313000, China
秘鲁白鱼粉(粗蛋白质含量为66.69%,粗脂肪含量为9.10%)由浙江璟宝饲料股份有限公司提供。亚麻籽油由莱瑙(上海)国际贸易有限公司提供,LNA含量为50%。以鱼粉和酪蛋白为蛋白质源,配制等氮等脂的LNA含量分别为0(L0,对照)、0.5%(L0.5)、1.0%(L1.0)、1.5%(L1.5)、2.0%(L2.0)和2.5%(L2.5)的半纯化饲料。试验饲料的制作步骤如下:首先将各种原料粉碎过80目筛,按配方准确称量,采用逐级扩大法将维生素、矿物质预混料和诱食剂等微量成分按比例充分混匀,然后加入亚麻籽油、大豆卵磷脂继续搓匀,最后加入水(400 mL/kg)搅拌混匀,用小型饲料造粒机制成粒径为1.0 mm的颗粒饲料,40 ℃烘干至饲料中水分含量达到约10%,密封后置于-20 ℃保存备用。试验饲料组成及营养水平见表 1,试验饲料脂肪酸组成见表 2。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
|
|
表 2 试验饲料脂肪酸组成(占总脂肪酸的百分比) Table 2 Fatty acid composition of experimental diets (n=2, percentage of total fatty acids) |
试验用虾购于湖州邦达生态农业有限公司,暂养1周后,选择健康、体重均匀[(平均体重为(0.12±0.01) g]的日本沼虾1 500尾,随机分为6组,每组5个重复,每个重复50尾,以重复为单位随机放入到体积为300 L的水族箱中,每个水族箱内放置一定量的网片作为躲避物,以减少试验虾互残。试验于2015年7月至2015年9月在浙江省水生生物资源养护与开发技术研究重点实验室进行,每天07:30吸污并换水(换水量约为1/3),试验使用的水源为曝气的自来水,水质条件为:温度25~29 ℃,pH 7.6~8.1,溶氧浓度>6.5 mg/L,总氨氮浓度 < 0.01 mg/L。每日于08:30和16:00各投喂1次饲料,投喂量为虾体重的4%~5%,养殖试验持续8周。
1.3 氨氮胁迫试验8周的养殖试验结束后,每箱随机捞取10尾试验虾,参照Wang等[18]的方法,用氯化铵调节水体总氨氮浓度至36.6 mg/L,进入24 h氨氮胁迫试验。氨氮胁迫试验期间连续充气,保证溶氧浓度≥5.0 mg/L,pH为7.6~8.1,温度为25~29 ℃。
1.4 样品采集养殖试验结束后饥饿1 d后,对各组试验虾称重,并统计存活数。各养殖试验各组及氨氮胁迫试验各组试验虾,均使用解剖器从试验虾的头胸部取出肝胰腺,将虾体和肝胰腺保存于-80 ℃用于后续指标的测定分析。
1.5 指标测定 1.5.1 生长性能指标计算公式

|

|
饲料中粗蛋白质含量的测定采用凯氏定氮法(Kjeltec 2200, FOSS, 丹麦),粗脂肪含量的测定采用索氏抽提法(SoxtecTM 2043, FOSS, 丹麦),粗灰分含量的测定采用马福炉550 ℃灼烧(14 h)法。采用Folch等[19]的方法测定日本沼虾肝胰腺脂肪含量。
1.5.3 脂肪酸组成测定根据常国亮等[20]的方法进行样品脂肪酸组成分析。所用仪器为HP-6890气相色谱仪,毛细管柱型号为Agilent 19091J-413(30.0 mm×0.25 mm)。进样口温度为200 ℃,检测器温度为260 ℃,起始柱温为140 ℃,逐步升高到240 ℃,直到所有组分全部出峰,采用面积百分比法对各脂肪酸成分进行定量。
1.5.4 肝胰腺抗氧化指标测定准确称取肝胰腺约0.5 g,按质量体积比1 : 9加入预冷的0.86%的生理盐水,制成10%的匀浆液,3 500 r/min离心15 min,吸取上清液。根据各种指标的测定方法将上清液稀释成不同浓度,其中上清液中蛋白质含量的测定采用考马斯亮蓝法。所有指标的测定均按照试剂盒(南京建成生物工程研究所生产)说明书进行。脂质过氧化程度通过测定肝胰腺中丙二醛(MDA)含量变化来反映,用硫代巴比妥酸(TBA)法测定肝胰腺中MDA含量。脂质过氧化降解产物中的MDA与TBA缩合形成红色产物,根据颜色变化于532 nm处进行比色;超氧化物歧化酶(SOD)活力的测定采用黄嘌呤氧化酶法,活力单位定义为每毫克组织蛋白质在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个活力单位(U);谷胱甘肽过氧化物酶(GSH-Px)的测定原理为GSH-Px可以促进过氧化氢(H2O2)与还原型谷胱甘肽(GSH)反应生成水(H2O)及氧化型谷胱甘肽(GSSG),通过测定GSH的消耗量进而得出GSH-Px的活力;总抗氧化能力(T-AOC)的测定原理为抗氧化物质能使三价铁离子(Fe3+)还原为二价铁离子(Fe2+),后者可与啡啉类物质形成稳定络合物,通过比色测定其抗氧化能力的高低,活力单位定义为37 ℃时每分钟每毫克组织蛋白质使反应体系的吸光度值每增加0.01时为1个T-AOC单位(U)。
1.5.5 肝胰腺非特异性免疫指标的测定肝胰腺酸性磷酸酶(ACP)和溶菌酶(LYZ)活力的测定均按照试剂盒(南京建成生物工程研究所生产)说明书进行。ACP的测定原理为ACP能分解磷酸苯二钠,产生游离酚和磷酸,酚在碱性溶液中与4-氨基安替吡啉作用经铁氰化钾氧化生成红色醌衍生物,根据红色深浅可以测定ACP活力的高低。LYZ活力的测定原理是LYZ能水解细菌细胞壁上肽聚糖使细菌裂解而使浓度降低,透光度增强,通过透光度变化来推测LYZ的活力。
1.6 统计分析试验结果以平均值±标准差(mean±SD)表示,采用SPSS 19.0对数据进行单因素方差分析(one way ANOVA)后,若差异达到显著水平,则采用Tukey’s法进行多重比较,显著水平为P<0.05。
2 结果 2.1 饲料LNA含量对日本沼虾生长性能的影响由表 3可知,日本沼虾的增重率和特定生长率随饲料LNA含量的增加有先升高后下降的趋势,增重率和特定生长率均以L1.5组最高,但各组间未表现出显著差异(P>0.05)。各组日本沼虾的存活率差异不显著(P>0.05)。饲料LNA含量对日本沼虾饲料系数以及摄食率的影响不显著(P>0.05)。
|
|
表 3 各组日本沼虾的生长性能 Table 3 Growth performance of oriental river prawn (Macrobrachium nipponense) in different groups (n=5) |
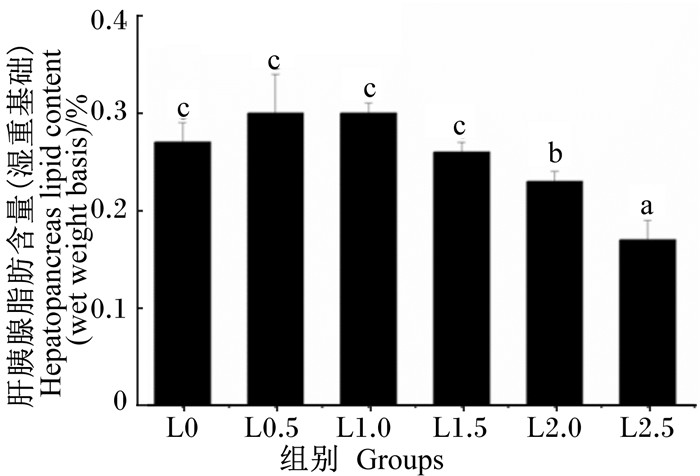
由图 1可知,日本沼虾肝胰腺脂肪含量随饲料LNA含量的增加先升高后下降,在L2.5组达到最低,显著低于其他各组(P < 0.05),但L0、L0.5、L1.0及L1.5组间不存在显著性差异(P>0.05)。
|
图 1 饲料LNA含量对日本沼虾肝胰腺脂肪含量的影响 Figure 1 Effects of dietary LNA content on hepatopancreas lipid content of oriental river prawn (Macrobrachium nipponense) |
由表 4和表 5可知,在肝胰腺和肌肉中,含量最多的是饱和脂肪酸,其次是单不饱和脂肪酸。在肝胰腺中,L0.5组的饱和脂肪酸含量显著高于除L0组外的其余各组(P < 0.05),而L0组的单不饱和脂肪酸含量显著高于其余各组(P < 0.05)。在肌肉中,L1.0组的饱和脂肪酸含量显著高于其余各组(P < 0.05),而L0组的单不饱和脂肪酸含量显著高于其余各组(P < 0.05)。C18 : 3n-3(即LNA)的含量在肝胰腺和肌肉中都随饲料LNA含量的增加而增加。而C20 : 5n-3(即EPA)和C22 : 6n-3(即DHA)含量在肝胰腺和肌肉中都随饲料LNA含量的增加呈先升后降趋势。
|
|
表 4 各组日本沼虾的肝胰腺脂肪酸组成(占总脂肪酸的百分比) Table 4 Hepatopancreas fatty acid composition of oriental river prawn (Macrobrachium nipponense) in different groups (n=3, percentage of total fatty acids) |
|
|
表 5 各组日本沼虾的肌肉脂肪酸组成(占总脂肪酸的百分比) Table 5 Muscle fatty acid composition of oriental river prawn (Macrobrachium nipponense) in different groups (n=3, percentage of total fatty acids) |
由表 6可知,随着饲料LNA含量的增加,日本沼虾肝胰腺SOD、GSH-Px活力和T-AOC基本呈现先升后降的趋势,并均在L1.0组达到最高,其中SOD活力显著高于其余各组(P < 0.05),GSH-Px活力显著高于除L0组外的其余各组(P < 0.05),T-AOC显著高于L1.5、L2.0、L2.5组(P < 0.05)。L0组肝胰腺MDA含量最高,显著高于L0.5、L1.0、L1.5、L2.0、L2.5组(P < 0.05)。在1.5%~2.5%范围内,随着饲料LNA含量的增加,日本沼虾肝胰腺MDA含量有一定的递增趋势。
|
|
表 6 各组日本沼虾的肝胰腺抗氧化指标 Table 6 Hepatopancreas antioxidant indices of oriental river prawn (Macrobrachium nipponense) in different groups (n=3) |
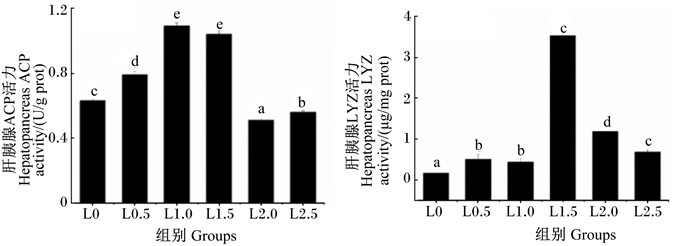
由图 2可知,L0.5、L1.0及L1.5组肝胰腺ACP活力均显著高于L0组(P < 0.05),且以L1.0组的活力最高,但L1.0和L1.5组之间不存在显著性差异(P>0.05)。随着饲料LNA含量的增加,肝胰腺LYZ活力呈先升后降的趋势,在L1.5组达到最高,显著高于其他各组(P < 0.05)。
|
图 2 饲料LNA含量对日本沼虾肝胰腺ACP和LYZ活力的影响 Figure 2 Effects of dietary LNA contents on hepatopancreas ACP and LYZ activities of oriental river prawn (Macrobrachium nipponense) |
由表 7可知,24 h氨氮胁迫后,L0.5、L1.5、L2.0、L2.5组的肝胰腺MDA含量显著低于L0组(P < 0.05),且以L1.5组MDA含量最低,显著低于其余各组(P < 0.05)。肝胰腺SOD活力和T-AOC随着饲料LNA含量的增加呈先上升后下降趋势,L1.5组SOD活力达到最高,显著高于其余各组(P < 0.05),而L1.0组T-AOC达到最高,显著高于其余各组(P < 0.05)。肝胰腺GSH-Px活力以L0组最高,但与L1.0组差异不显著(P>0.05)。
|
|
表 7 氨氮胁迫后各组日本沼虾的肝胰腺抗氧化指标 Table 7 Hepatopancreas antioxidant indices of oriental river prawn (Macrobrachium nipponense) in different groups after ammonia-nitrite stress (n=3) |
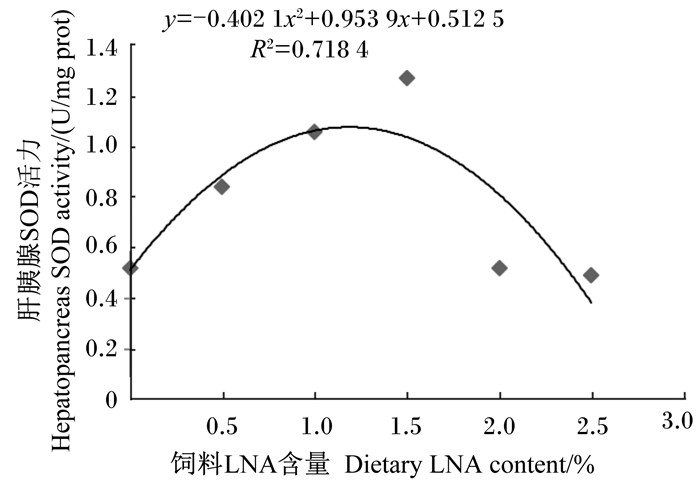
依据表 7的试验结果,以肝胰腺SOD活力(y)为纵坐标,饲料LNA含量(x)为横坐标得到二者之间的一元二次回归方程:y=-0.402 1x2+0.953 9x+0.512 5,R2=0.718 4(图 3),经计算,饲料中LNA的最适含量为1.19%。
|
图 3 日本沼虾肝胰腺SOD活力与饲料LNA含量的回归关系 Figure 3 Regression relation between hepatopancreas SOD activity and dietary LNA content of oriental river prawn (Macrobrachium nipponense) |
研究表明,饲料中添加一定量的LNA可促进鱼类生长,但摄食过量的LNA对生长不仅无促进作用,反而有抑制作用[1]。与这一结果相似,本试验结果也发现饲料中LNA含量为0~1.5%时,日本沼虾的特定生长率和增重率呈升高趋势,但当LNA含量超过1.5%时,其特定生长和增重率有下降趋势。类似的研究结果也在鱼类中发现,如草鱼(Ctenopharyngodon idellus)摄食含0~0.25% n-3 HUFA饲料时生长性能随饲料n-3 HUFA含量的增加而上升,但当饲料n-3 HUFA含量达到0.83%或1.13%时,其生长性能显著下降[21]。此外,对草鱼进行为期3个月的n-3 HUFA饲喂后,进行肝胰脏的转录组学分析,发现n-3 HUFA能够影响36个注释蛋白质代谢相关基因的表达,上调了包括胰蛋白酶、胰凝乳蛋白酶等蛋白质消化基因,RNA、RNA聚合酶Ⅱ核心启动序列和真核翻译起始因子(eIF-4A)等蛋白质翻译基因的表达,下调了泛素蛋白连接酶及泛素等蛋白质分解基因的表达[22],说明饲料中PUFA可能通过节约蛋白质的机制促进生长。
通过二次回归分析发现,日本沼虾获得最大肝胰腺SOD活力时,LNA的需求量为1.19%,高于中国对虾(0.7%~1.0%)[9]和日本对虾(Penaeus japonicas)(1.0%)[23],但低于印度对虾(2.0%)[11]对LNA的需求量。这可能是不同虾类对LNA的代谢率不同,从而导致对LNA需求量存在差异。此外,虾类对LNA的需求量还与饲料的组成、试验虾类规格、投喂次数及试验条件等多种因素有关。
已有研究显示,饲料中添加LNA可降低机体脂肪含量[24]。与该研究结果一致,本研究发现日本沼虾肝胰腺脂肪含量随饲料LNA含量的增加而下降。这与瓦氏黄颡鱼(Pelteobagrus vachelli)机体脂肪含量随饲料LNA含量的增加而下降的研究结果一致[25],但与在草鱼[21]上的研究结果相反,在草鱼上的研究得出,随着饲料n-3 PUFA含量的增加,草鱼机体脂肪含量也随之增加[21]。这可能与草鱼对脂肪的需求量比较低有关。
机体脂肪酸组成基本上与饲料脂肪酸组成是一致的[25-26]。在鲍鱼(Haliotis discus hannai Ino)的研究中发现,饲喂高含量LNA的饲料后,其肌肉LNA含量也随之升高[27]。与该研究结果一致,本试验结果也显示,随着饲料LNA含量的增加,日本沼虾肝胰腺和肌肉中LNA含量也随之增加。此外,日本沼虾肝胰腺和肌肉中EPA和DHA含量随着饲料LNA含量的增加呈先升后降的趋势,这可能与适宜的LNA含量可增强脂肪酸去饱和酶和延长酶的活力,从而促进十八碳PUFA转化成HUPA有关[27-28]。
3.2 饲料LNA含量对日本沼虾抗氧化能力、非特异性免疫性能的影响已有研究表明,瓦氏黄颡鱼肝胰腺非特异性免疫酶活力随饲料LNA含量的增加而增强,然而,当LNA含量超过1%时,其非特异性免疫酶活力显著下调[29]。与该结果一致,本试验结果显示,日本沼虾肝胰腺SOD、GSH-Px活力和T-AOC随饲料LNA含量的增加基本呈现先升后降的趋势,且均在L1.0组达到最高,说明过量的LNA诱发了脂质过氧化,脂质的过氧化能产生众多有毒的活性氧簇(ROS),如超氧阴离子自由基(O2-·)、H2O2和臭氧等。为了清除过多的ROS,SOD将ROS催化为H2O2,从而缓解ROS对机体的损伤[30-32]。在本研究中,日本沼虾肝胰腺SOD活力随饲料LNA含量的增加呈现先升高后降低的趋势,L1.0组显著高于其余各组,但在L0、L0.5、L1.5、L2.0和L2.5组之间并不存在显著性差异。这说明饲料中添加1.0%LNA可增强肝胰腺SOD活力,但PUFA过氧化产物超过该临界值时不能增强SOD活力。T-AOC是机体内抗氧化能力的总体体现,是酶促[SOD、CAT、谷胱甘肽硫转移酶(GST)等]和非酶促(维生素、氨基酸和金属蛋白等)两方面因子抗氧化能力的总和。本试验结果显示,当饲料中LNA含量达到1.0%时,肝胰腺T-AOC达到最大值。与本试验结果相似,潘瑜等[33]也发现,亚麻油替代25%鱼油时鲤鱼(Cyprinus carpio)肝胰脏T-AOC达到最大值。这说明饲料中适宜的LNA含量可以提高机体的抗氧化能力。MDA是氧自由基攻击生物膜中的PUFA引发脂质过氧化作用形成的产物,MDA含量的多少常常可反映机体内脂质过氧化的程度,间接地反映机体细胞受自由基攻击的严重程度,即细胞受损程度。本试验结果显示,L0组肝胰腺MDA含量显著高于其余各组,说明饲料中缺乏LNA可引起一定程度的细胞受损,这可能与机体缺乏必需脂肪酸有关[34]。但是,在1.5%~2.5%范围内,随着饲料LNA含量的增加,日本沼虾肝胰腺MDA含量有一定的递增趋势。这与在褐菖鲉(Sebastiscus marmoratus)中发现的高含量的n-3 HUFA引起机体积累MDA的结果[35]相似。综上所述,以肝胰腺抗氧化能力为判据,认为饲料中LAN的适宜含量为1.0%。
研究还发现,适度的HUFA供应可强化淡水鱼类的免疫力,而过量则有可能造成负面影响[36-37]。因此,本试验测定了肝胰腺中非特异性免疫指标ACP和LYZ活力。ACP能参与对外源生物大分子的降解[38],而且是巨噬细胞溶酶体的水解酶,其活力的提高能增加巨噬细胞清除病原的能力[39]。而LYZ是非特异性免疫反应的媒介,能抵制寄生虫、细菌与病毒的感染[17, 40]。本试验结果显示L1.0组肝胰腺ACP活力显著高于其他各组,而从LYZ活力来看,L1.5组显著高于其余各组。关于n-3 PUFA对机体免疫系统的影响在鱼类中报道较多,各研究结果不尽相同。杨鸢劼等[41]研究发现,黄鳝(Monopterus albus)血清LYZ活力和血细胞吞噬能力随饲料LNA含量的增加而增强,并在LNA含量达到1.55%时达到最高。Li等[5]在瓦氏黄颡鱼的研究中发现,6%亚麻油组的抗体效价显著高于4%和2%亚麻油组。以上结果说明饲料中适宜含量的LNA对机体免疫力有一定的促进作用。
3.3 饲料LNA含量对日本沼虾抗氨氮胁迫能力的影响经过24 h的氨氮胁迫后,L0组的肝胰腺MDA含量均高于其余各组,同时其肝胰腺SOD活力和T-AOC均低于其余各组。这可能与L0组缺乏LNA有关。本试验结果显示,氨氮胁迫后肝胰腺SOD活力和T-AOC均随饲料LNA含量的增加呈先升后降的趋势。赵亚婷等[42]对中华绒螯蟹(Eriocheir sinensis)的研究发现,在低氧胁迫下,饲料中添加适量的DHA显著提高了幼蟹血淋巴中SOD活力,并且降低了MDA含量,与本试验结果类似;但饲料中过量的DHA使血淋巴中MDA含量显著升高,这可能是由于过量的DHA氧化产生了较多的MDA,机体产生的SOD等抗氧化酶难以对其有效保护。但Ji等[21]对草鱼幼鱼的研究发现,饲料中高含量的HUFA能显著提高草鱼幼鱼的肝胰腺SOD活力和MDA含量,说明过量的HUFA能诱发鱼体的氧化应激,在对奥尼罗非鱼(Oreochromis niloticus)的研究中也发现了相似的结果[43]。由此提示,在适宜的脂肪酸含量范围内,随着饲料中PUFA含量的提高,机体的抗氧化性能也随之升高。本试验结果显示,经过24 h的氨氮胁迫后,饲料LNA含量为1.5%时,肝胰腺MAD含量最低,SOD活力和T-AOC最高,由此表明,1.5%LNA能增强机体抗氧化能力,从而改善日本沼虾对氨氮胁迫的应激反应能力。
4 结论①综合考虑饲料LNA含量对生长、抗氧化能力、非特异性免疫性能及抗氨氮胁迫能力的影响,认为日本沼虾饲料中亚麻酸的适宜含量为1.0%~1.5%。
②本试验条件下,通过二次回归分析,认为饲料LNA含量为1.19%时,日本沼虾可获得最高的肝胰腺SOD活力。
致谢: 衷心感谢李景芬、张荣飞、邵仙萍、赵建华等老师以及严超、费嘉诚等同学在试验和论文撰写过程中提供的热心帮助。| [1] | CHEN C Y, SUN B L, GUAN W T, et al. n-3 essential fatty acids in Nile tilapia, Oreochromis niloticus:effects of linolenic acid on non-specific immunity and anti-inflammatory responses in juvenile fish[J]. Aquaculture, 2016 , 450 : 250 –257. DOI: 10.1016/j.aquaculture.2015.08.005 |
| [2] | GEAY F, MELLERY J, TINTI E, et al. Effects of dietary linseed oil on innate immune system of Eurasian perch and disease resistance after exposure to Aeromonas salmonicida achromogen[J]. Fish & Shellfish Immunology, 2015 , 47 (2) : 782 –796. |
| [3] | XU H G, AI Q H, MAI K S, et al. Effects of dietary arachidonic acid on growth performance, survival, immune response and tissue fatty acid composition of juvenile Japanese seabass, Lateolabrax japonicus[J]. Aquaculture, 2010 , 307 (1/2) : 75 –82. |
| [4] | ZUO R T, AI Q H, MAI K S, et al. Effects of dietary n-3 highly unsaturated fatty acids on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irritans)[J]. Fish & Shellfish Immunology, 2012 , 32 (2) : 249 –258. |
| [5] | LI M, CHEN L Q, QIN J G, et al. Growth performance, antioxidant status and immune response in darkbarbel catfish Pelteobagrus vachelli fed different PUFA/vitamin E dietary levels and exposed to high or low ammonia[J]. Aquaculture, 2013 , 406-407 : 18 –27. DOI: 10.1016/j.aquaculture.2013.04.028 |
| [6] | CHEN S, ZHANG H Y, PU H J, et al. n-3 PUFA supplementation benefits microglial responses to myelin pathology[J]. Scientific Reports, 2014 , 4 : 7458 . DOI: 10.1038/srep07458 |
| [7] | WU F C, CHEN H Y. Effects of dietary linolenic acid to linoleic acid ratio on growth, tissue fatty acid profile and immune response of the juvenile grouper Epinephelus malabaricus[J]. Aquaculture, 2012 , 324-325 : 111 –117. DOI: 10.1016/j.aquaculture.2011.10.030 |
| [8] | NRC.Nutrient requirements of fish and shrimp[S].Washington, D.C.:National Academies Press, 2011. |
| [9] | XU X L, JI W J, CASTELL J D, et al. Essential fatty acid requirement of the Chinese prawn, Penaeus chinensis[J]. Aquaculture, 1994 , 127 (1) : 29 –40. DOI: 10.1016/0044-8486(94)90189-9 |
| [10] | SHEWBART K L, MIES W L. Studies on nutritional requirements of brown shrimp-the effect of linolenic acid on growth of Penaeusaztecus[J]. Journal of the World Aquaculture Society, 1973 , 4 (1/2/3/4) : 277 –287. |
| [11] | READ G H L. The response of Penaeus indicus (Crustacea:Penaeidea) to purified and compounded diets of varying fatty acid composition[J]. Aquaculture, 1981 , 24 : 245 –256. DOI: 10.1016/0044-8486(81)90060-0 |
| [12] | FU H T, JIANG S F, XIONG Y W. Current status and prospects of farming the giant river prawn (Macrobrachium rosenbergii) and the oriental river prawn (Macrobrachium nipponense) in China[J]. Aquaculture Research, 2012 , 43 (7) : 993 –998. DOI: 10.1111/are.2012.43.issue-7 |
| [13] | XIU Y J, WU T, MENG X H, et al. Identification and isolation of a spiroplasma pathogen from diseased oriental river prawn, Macrobrachium nipponense, in China:a new freshwater crustacean host[J]. Aquaculture, 2015 , 437 : 270 –274. DOI: 10.1016/j.aquaculture.2014.12.010 |
| [14] | DING Z F, SUN M L, LIU H Y, et al. A new microsporidium, Potaspora macrobrachium n.sp.infecting the musculature of pond-reared oriental river prawn Macrobrachium nipponense (Decapoda:Palaemonidae)[J]. Journal of Invertebrate Pathology, 2016 , 136 : 57 –64. DOI: 10.1016/j.jip.2016.02.006 |
| [15] | DE BOER A A, MONK J M, LIDDLE D M, et al. Fish-oil-derived n-3 polyunsaturated fatty acids reduce NLRP3 inflammasome activity and obesity-related inflammatory cross-talk between adipocytes and CD11b+ macrophages[J]. The Journal of Nutritional Biochemistry, 2016 , 34 : 61 –72. DOI: 10.1016/j.jnutbio.2016.04.004 |
| [16] | ARITA M. Eosinophil polyunsaturated fatty acid metabolism and its potential control of inflammation and allergy[J]. Allergology International, 2016 , 65 : S2 –S5. DOI: 10.1016/j.alit.2016.05.010 |
| [17] | 赵利斌, 王鑫磊, 黄旭雄, 等. 饲料中花生四烯酸水平对凡纳滨对虾免疫相关基因表达及抗菌能力的影响[J]. 水产学报, 2016 , 40 (5) :763 –775. |
| [18] | WANG A L, WANG W N, WANG Y, et al. Effect of dietary vitamin C supplementation on the oxygen consumption, ammonia-N excretion and Na+/K+ ATPase of Macrobrachium nipponense exposed to ambient ammonia[J]. Aquaculture, 2003 , 220 (1/2/3/4) : 833 –841. |
| [19] | FOLCH J, LEES M, SLOANE STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissue[J]. The Journal of Biological Chemistry, 1957 , 226 (1) : 497 –509. |
| [20] | 常国亮, 成永旭, 吴旭干, 等. 中华绒螯蟹白化症、正常肝胰腺组织结构及脂肪酸组成的比较研究[J]. 水生生物学报, 2008 , 32 (5) :687 –693. |
| [21] | JI H, LI J, LIU P. Regulation of growth performance and lipid metabolism by dietary n-3 highly unsaturated fatty acids in juvenile grass carp, Ctenopharyngodon idellus[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2011 , 159 (1) : 49 –56. DOI: 10.1016/j.cbpb.2011.01.009 |
| [22] | TIAN J J, LU R H, JI H, et al. Comparative analysis of the hepatopancreas transcriptome of grass carp (Ctenopharyngodon idellus) fed with lard oil and fish oil diets[J]. Gene, 2015 , 565 (2) : 192 –200. DOI: 10.1016/j.gene.2015.04.010 |
| [23] | KANAZAWA A, TESHIMA S, ENDO M. Requirements of prawn, Penaeus japonicus, for essential fatty acids[J]. Memoirs of Faculty of Fisheries, Kagoshima University, 1979 , 28 : 27 –33. |
| [24] | FRANCIS D S, TURCHINI G M, JONES P L, et al. Effects of dietary oil source on growth and fillet fatty acid composition of Murray cod, Maccullochella peelii peelii[J]. Aquaculture, 2006 , 253 (1/2/3/4) : 547 –556. |
| [25] | LI M, CHEN L Q, LI E C, et al. Growth, immune response and resistance to Aeromonas hydrophila of darkbarbel catfish, Pelteobagrus vachelli (Richardson), fed diets with different linolenic acid levels[J]. Aquaculture Research, 2015 , 46 (4) : 789 –800. DOI: 10.1111/are.12236 |
| [26] | CHAIYAPECHARA S, CASTEN M T, HARDY R W, et al. Fish performance, fillet characteristics, and health assessment index of rainbow trout (Oncorhynchus mykiss) fed diets containing adequate and high concentrations of lipid and vitamin E[J]. Aquaculture, 2003 , 219 (1/2/3/4) : 715 –738. |
| [27] | LI M Z, MAI K S, AI Q H, et al. Effects of dietary grape seed oil and linseed oil on growth, muscle fatty acid composition and expression of putative Δ5 fatty acyl desaturase in abalone Haliotis discus hannai Ino[J]. Aquaculture, 2013 , 406/407 : 105 –114. DOI: 10.1016/j.aquaculture.2013.05.013 |
| [28] | KARTIKASARI L R, HUGHES R J, GEIER M S, et al. Dietary alpha-linolenic acid enhances omega-3 long chain polyunsaturated fatty acid levels in chicken tissues[J]. Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2012 , 87 (4/5) : 103 –109. |
| [29] | LI M, CHEN L, QIN J G, et al. Growth, immune response and resistance to Aeromonas hydrophila of darkbarbel catfish Pelteobagrus vachelli fed diets with different linolenic acids, vitamins C and E levels[J]. Aquaculture Nutrition, 2016 , 22 (3) : 664 –674. DOI: 10.1111/anu.2016.22.issue-3 |
| [30] | FATTMAN C L, SCHAEFER L M, OURY T D. Extracellular superoxide dismutase in biology and medicine[J]. Free Radical Biology and Medicine, 2003 , 35 (3) : 236 –256. DOI: 10.1016/S0891-5849(03)00275-2 |
| [31] | NOZIK-GRAYCK E, SULIMAN H B, PIANTADOSI C A. Extracellular superoxide dismutase[J]. International Journal of Biochemistry & Cell Biology, 2005 , 37 (12) : 2466 –2471. |
| [32] | AKERELE O A, CHEEMA S K. A balance of omega-3 and omega-6 polyunsaturated fatty acids is important in pregnancy[J]. Journal of Nutrition & Intermediary Metabolism, 2016 , 5 : 23 –33. |
| [33] | 潘瑜, 陈文燕, 林仕梅, 等. 亚麻油替代鱼油对鲤鱼生长性能、肝胰脏脂质代谢及抗氧化能力的影响[J]. 动物营养学报, 2014 , 26 (2) :420 –426. |
| [34] | LALL S P.Disorders of nutrition and metabolism[M]//LEATHERLAND J F, WOO P T K.Fish diseases and disorders:2.Non-infectious disorders.2nd ed.Oxfordshire:CAB International, 2010:202-237. |
| [35] | 岳彦峰, 彭士明, 施兆鸿, 等. 饲料n-3HUFA水平对褐菖鲉血清生化指标、主要脂代谢酶活力及抗氧化能力的影响[J]. 海洋渔业, 2013 , 35 (4) :460 –467. |
| [36] | TIAN J J, JI H, OKU H, et al. Effects of dietary arachidonic acid (ARA) on lipid metabolism and health status of juvenile grass carp, Ctenopharyngodon idellus[J]. Aquaculture, 2014 , 430 : 57 –65. DOI: 10.1016/j.aquaculture.2014.03.020 |
| [37] | KHOZIN-GOLDBERG I, COHEN Z, ZILBERG D, et al. Feeding with arachidonic acid-rich triacylglycerols from the microalga Parietochloris incisa improved recovery of guppies from infection with Tetrahymena sp[J]. Aquaculture, 2006 , 255 (1/2/3/4) : 142 –150. |
| [38] | XUE Q G, RENAULT T. Enzymatic activities in European flat oyster, Ostrea edulis, and pacific oyster, Crassostrea gigas, hemolymph[J]. Journal of Invertebrate Pathology, 2000 , 76 (3) : 155 –63. DOI: 10.1006/jipa.2000.4965 |
| [39] | CONG M, SONG L S, WANG L L, et al. The enhanced immune protection of Zhikong scallop Chlamys farreri on the secondary encounter with Listonella anguillarum[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2008 , 151 (2) : 191 –196. DOI: 10.1016/j.cbpb.2008.06.014 |
| [40] | WU C L, YE J Y, GAO J E, et al. The effects of dietary carbohydrate on the growth, antioxidant capacities, innate immune responses and pathogen resistance of juvenile Black carp Mylopharyngodon piceus[J]. Fish & Shellfish Immunology, 2016 , 49 : 132 –142. |
| [41] | 杨鸢劼, 邴旭文, 徐增洪. 不饱和脂肪酸对黄鳝部分非特异性免疫和代谢指标的影响[J]. 中国水产科学, 2008 , 15 (4) :600 –605. |
| [42] | 赵亚婷, 吴旭干, 常国亮, 等. 饲料中DHA含量对中华绒螯蟹幼蟹生长、脂类组成和低氧胁迫的影响[J]. 水生生物学报, 2013 , 37 (6) :1133 –1144. |
| [43] | 甘晖, 李坚明, 冯广朋, 等. 饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响[J]. 上海海洋大学学报, 2009 , 18 (1) :35 –41. |




