DON标准品:粉末状,纯度≥99%(Pribolab,Singapore),购自北京普华仁生物技术开发有限公司,以高压灭菌水稀释。粪便DNA提取试剂盒、2×Taq PCR Master Mix购自天根生化科技(北京)有限公司。
主要仪器:Illumina-MiSeq DNA测序仪(Illumina,美国)、紫外分光光度计(Shimadzu,日本)、Sorvall高速离心机(Thermo,美国)、PCR仪(Bio-Red,美国)、凝胶成像系统(Bio-Red,美国)。
1.2 试验动物与饲养管理BALB/c小鼠40只,6周龄,体重18~22 g,无特定病原体(SPF)级,购自复旦大学实验动物科学部。室温维持(23±2) ℃,相对湿度为40%~70%,光照周期12 h,自由饮水和采食,提供高压灭菌蒸馏水和经1.5~2.5 Mrad钴-60照射除菌的饲料,预饲喂1周。
1.3 试验方法 1.3.1 试验设计将40只小鼠随机分成2组,每组20个重复,每个重复1只小鼠,分笼饲养在无菌隔离器中。分为对照组(灌胃灭菌生理盐水)和DON组(灌胃1.8 mg/kg BW DON),试验剂量设计参考DON对BALB/c小鼠的急性、亚急性毒性结果[15],每只小鼠每天每次灌胃0.2 mL,试验持续28 d。
1.3.2 样品采集试验结束后,固定小鼠,将其尾部提起,用手指轻轻按压小鼠下腹部,采集新鲜粪便后置于1.5 mL高压灭菌离心管中,-80 ℃超低温冰箱保存。
1.3.3 粪便DNA的提取及质量检测每组分别选取3份粪便样品,每份准确称取0.2 g置于2 mL离心管中,采用粪便DNA提取试剂盒提取粪便DNA,紫外分光光度计测定DNA浓度,0.8%琼脂糖凝胶电泳检测纯度,后将DNA样品送上海派生诺生物科技股份有限公司测序分析。
1.3.4 Illumina-MiSeq宏基因组测序 1.3.4.1 16S rDNA V4区PCR反应根据16S rDNA基因的V4区保守序列设计通用引物:上游引物为5′-AYTGGGYDTAAAGNG-3′,下游引物为5′-TACNVGGGTATCTAATCC-3′。为区分每个不同的样本,在通用引物的上游序列前随机添加7个核苷酸碱基的序列标签,即Barcoded-tag,形成Barcoded融合引物。PCR反应体系为:Loading Buffer (10×) 2.5 μL,dNTP 2 μL,DNA模板1 μL,上游引物1 μL,下游引物1 μL,DNA合成酶0.125 μL,ddH2O 17.375 μL。PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,25个循环;72 ℃延伸7 min,4 ℃保存。产物用2%琼脂糖凝胶电泳检测,目标条带用DNA切胶回收试剂盒进行回收,得纯化样本,并用BioTek酶标仪测定各样本浓度并定量。
1.3.4.2 富集并扩增DNA文库每个样品DNA等量混合,采用标准的Illumina TruSeq DNA文库制备试验流程构建所需的宏基因组上机文库,并在Illumina-MiSeq个人基因组分析平台上进行Barcoded Illumina Miseq测序,采用PE250测序策略。试验流程为:通过3′-5′核酸外切酶及聚合酶的共同作用,修复带有突出末端的DNA片段,在修复平整的DNA片段3′末端引入单碱基A,接头的3′末端含有单碱基T,从而保证DNA片段和接头能通过A和T配对连接。利用PCR选择性地富集两端连有接头的DNA片段,同时扩增DNA文库。
1.3.4.3 验证文库、上机测序利用Pico Green和荧光分光光度计定量文库,多样品DNA文库均一化至10 nmol/L后等体积混合,并逐步稀释定量至4~5 pmol/L后上机测序。
1.4 统计分析 1.4.1 测序基本数据处理对经过双端(pair-end)测序的数据进行质量控制,截断或舍弃低质量序列(50个连续碱基平均质量>Q30,不允许有N)。用软件Flash连接通过质量控制的序列,舍弃无法连接的序列。对选择通过的序列进行过滤,过滤原则为:舍弃碱基长度在200~1 000之外的、含有模糊碱基的、含有错配碱基的、连续相同碱基>6,模糊碱基>1的序列,获得最终用于分析的序列。
1.4.2 生物分类及统计分析应用Qiime分析软件,根据序列的相似度,将序列归为多个操作分类单元(operational taxonomic unit, OTU)。Qiime调用Uclust对序列进行聚类,选取每个类最长的序列为代表序列。采用RDP-classifier,以RDP数据库的序列为训练集,对OTU代表序列进行注释。
物种丰度按属层次进行归类计算,先对物种丰度进行log2转换,接着再将转换后的数值与单样品丰度平均值之差除以单样品丰度标准差,完成数据标准化。将数据导入SPSS 19,采用方差分析(ANOVA)、t检验和LSD多重比较法进行统计分析,P<0.05为存在显著性差异。
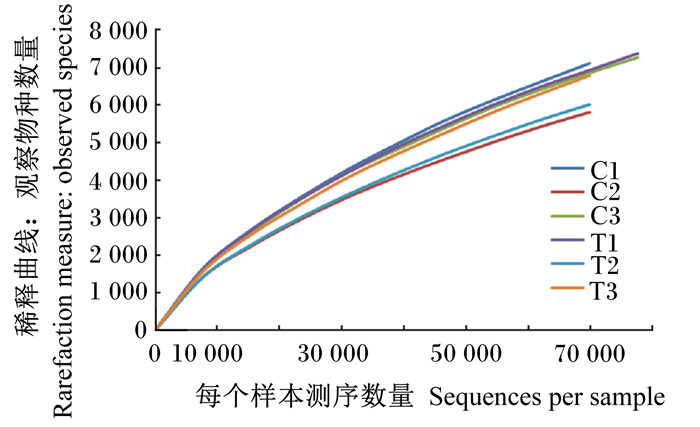
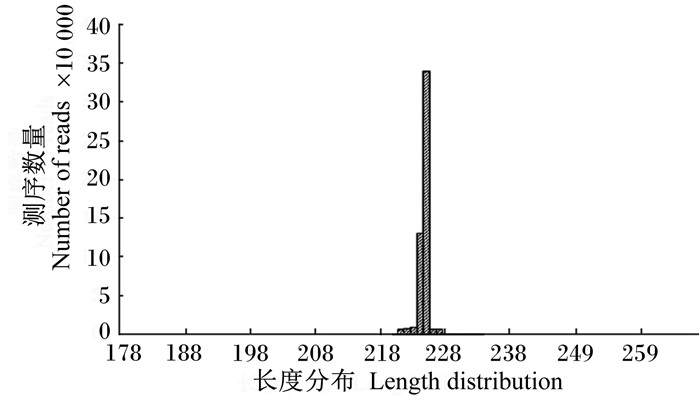
2 结果与分析 2.1 DON对小鼠肠道微生物测序数据的影响表 1结果显示,经过16S rDNA V4区的Illumina Miseq双端测序,对照组和DON组分别获得有效序列86 146.23和84 594.98条,其中优质序列分别为85 843.64和84 305.31条,DON组较对照组检测序列减少,但统计学差异不显著(P>0.05)。反映97%相似度下样品取样深度的稀释曲线见图 1,每个样品均在80 000条左右,表明取样深度一致。所测序列长度集中在178~268 bp之间,平均长度为226 bp,见图 2。
|
图 1 小鼠粪便样本测序序列稀释曲线(相似度:97%) Figure 1 Rarefaction curve of sequenced reads in feces of mice (similarity: 97%) |
|
图 2 测序序列长度分布 Figure 2 Length distribution of sequenced reads |
|
|
表 1 小鼠粪便样本测序数量分析 Table 1 Analysis of sequencing quantities for fecal samples of mice |
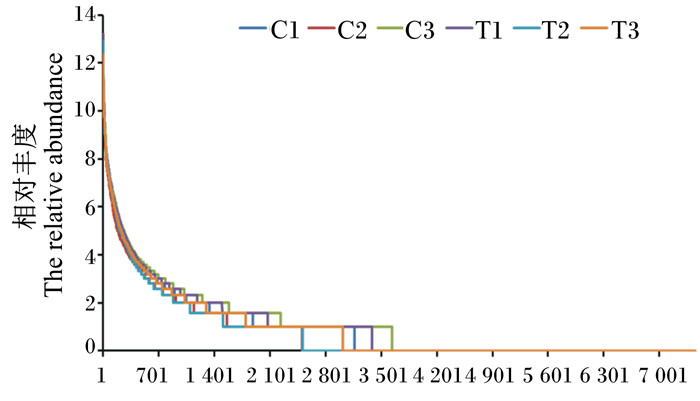
对各样本的OTU丰度大小排序,取log2的对数值作丰度分布曲线图,见图 3,结果发现对照组和DON组样本中物种分布均匀,可用于多样性分析。
|
图 3 小鼠粪便样品样本OTU丰度曲线图 Figure 3 Curves of OTU abundance in fecal samples of mice |
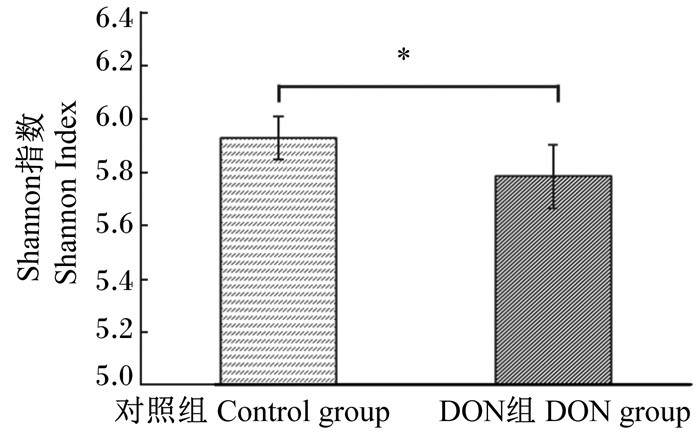
将2组样品所有序列按97%的相似度进行OTU聚类,利用程序运算得到评价微生物Alpha多样性丰度和均度的Shannon指数,见图 4。结果发现,DON组Shannon指数降低,与对照组相比差异显著(P<0.05)。
|
图 4 DON处理后肠道微生物菌群的Shannon指数变化 Figure 4 Change of Shannon diversity indexes of intestinal microbes exposed to DON |
Beta多样性是不同生态系统之间多样性的比较,是物种组成沿环境梯度或在群落间的变化率,用来表示生物种类对环境异质性的反应。经主坐标分析(principal co-ordinates analysis, PCoA)方法分析,见图 5,结果显示DON组与对照组能显著区分,并且菌群结构(蓝色)分布紧凑、相似度高,多样性较对照组降低。
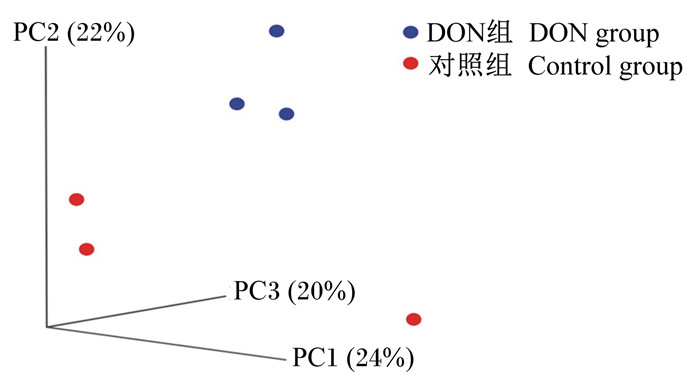
|
图 5 DON处理后肠道微生物Beta多样性变化 Figure 5 Change of beta diversity of intestinal microbes exposed to DON |
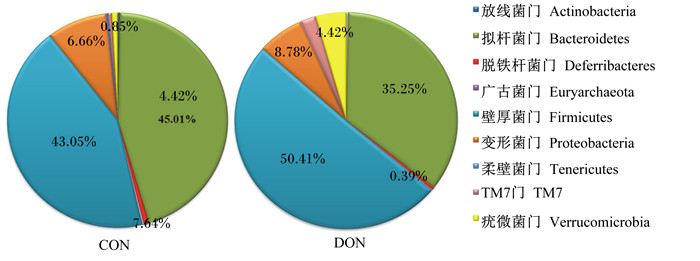
为探讨DON对肠道微生物群落结构和组成的影响,在门和属2个层次上对同类的OTU进行聚类比较研究。表 2和图 4结果显示,在门水平上,拟杆菌门(Bacteroidetes)的物种丰度与对照组相比显著降低(P<0.05),在总群落中的占比由45.01%降低到35.25%;脱铁杆菌门(Deferribacteres)的物种丰度与对照组相比也显著降低(P<0.05),占比由0.76%降低到0.39%。软壁菌门(Tenericutes)的物种丰度也呈降低趋势,与对照组相比差异不显著(P>0.05)。变形菌门(Proteobacteria)的物种丰度与对照组相比显著提高(P<0.05),占比由6.66%提高到8.78%。疣微菌门(Verrucomicrobia)的物种丰度则呈上升趋势,与对照组相比差异不显著(P>0.05)。对照组厚壁菌门(Firmicutes)在总群落中的占比为43.05%,DON组Firmicutes的占比则上升到50.41%,但物种丰度统计学差异不显著(P>0.05)。
|
|
表 2 肠道微生物丰度在门水平的显著性分析 Table 2 Phylum level significance analysis of intestinal microbes |
表 3结果显示,在属的水平上,与对照组相比,DON组显著降低了副类杆菌属(Parabacteroides)、理研菌属(Rikenella)、Algoriphagus、Mucispirillum、嗜甲基菌属(Methylophilus)、Francisella的物种丰度(P<0.05),显著提高了梭菌属(Clostridium)、Robinsoniella、Allobaculum、Akkermansia的物种丰度(P<0.05)。同时,DON组还影响了短杆菌属(Brevibacterium)、粪球菌属(Coprococcus)、Kordiimonas、Pusillimonas、厌氧原体属(Anaeroplasma)的物种丰度,但与对照组相比差异不显著(P>0.05)。
|
|
表 3 肠道微生物在属水平的物种丰度显著性分析 Table 3 Genus level significance analysis of intestinal microbes |
此外,图 6呈现了肠道微生物菌群在属水平的物种间相似性聚类关系(heatmap),结果表明DON组小鼠肠道微生物结构发生改变,与对照组相似性差异显著,与表 3结果一致。
|
图 6 在门水平上粪便微生物分布饼状图 Figure 6 The pie chart of intestinal microbes distributed on phylum level |

|
图 7 DON处理后肠道微生物结构区系图的变化 Figure 7 Change of bacterial distribution of intestinal microbes exposed to DON |
动物肠道中栖居着大量的微生物菌群,不仅与宿主机体之间保持着一种动态平衡,不同菌群之间也存在着一定的比例关系。菌群的稳态对维持机体生长发育、营养消化吸收、免疫拮抗等生理功能都具有重要的影响[12]。本试验应用Illumina-MiSeq高通量测序技术,突破传统的培养方法和以16S rDNA为基础的分子生物学方法,可产生覆盖广、深度深的测序数据,并通过比对或聚类分析,判定微生物群落物种组成的变化,同时挖掘低丰度或未知的细菌,能更加全面、准确地获得敏感菌群信息,对准确判定DON对肠道微生物毒性作用具有重要意义。
3.1 DON对肠道菌群多样性的影响肠道微生物多样性是促进营养物质吸收、维持机体免疫和新陈代谢的基础,多样性降低极易对宿主免疫产生影响,进而影响健康[13]。本研究指出,灌胃DON后小鼠肠道微生物测序数量2组之间没有显著差异,但DON组的有效序列和优质序列均较对照组降低,说明肠道微生物的种类有所减少。此外,DON组反映Alpha多样性丰度和均度的Shannon指数显著降低,PCoA方法分析Beta多样性发现DON组菌群结构分布紧凑,多样性降低。但Waché等[10]和Piotrowska等[14]的研究表明,饲粮添加DON处理不影响猪肠道菌群的丰度和多样性,不同的结果可能是由于检测方法、DON添加剂量和动物的种属等差异引起的。课题组前期研究指出灌胃DON后,肠道氨基酸、矿物元素等营养物质的表观消化率降低,小鼠体重减轻,免疫机能下降[15],推测与DON致小鼠肠道微生物多样性降低有关。
3.2 DON对肠道微生物菌群结构和物种丰度的影响本研究通过Illumina-MiSeq测序技术检测小鼠粪便中微生物菌群结构和组成的变化,结果显示DON处理后小鼠肠道微生物物种丰度发生显著变化,并呈现一定的规律性。人类肠道中的优势菌群分别为Bacteroidetes和Firmicute,在肠道菌群所占的比例约90%以上,小鼠肠道2个菌门的占比为85%[16],本试验中小鼠肠道Bacteroidetes和Firmicutes菌门占80%以上,DON处理后2个优势菌门的总占比没有变化,但Bacteroidetes的物种丰度较对照组显著降低。Bacteroidetes是一类具有促进碳水化合物发酵,参与糖类、胆汁酸和类固醇代谢等功能的菌群[17],Wang等[18]给大鼠灌胃黄曲霉毒素B1能显著抑制肠道中Bacteroidetes相关菌群丰度,在肠道炎症或溃疡时Bacteroidetes的物种丰度也显著降低[19],与本研究结果一致。此外,Deferribacteres的物种丰度降低,Proteobacteria的物种丰度提高。高脂肪饲粮诱导的非酒精性脂肪肝模型小鼠,Proteobacteria的物种丰度也增加,反映肠黏膜完整性的紧密连接蛋白occludin表达降低,提示肠道损伤发生[20]。综合这些结果表明DON可能与黄曲霉毒素、高脂饲粮一样可引起肠道菌群丰度发生改变,进而诱导肠道炎症,引发肠道损伤。
在属的水平,与对照组相比,DON组显著降低了Parabacteroides、Rikenella、Algoriphagus、Mucispirillum、Methylophilus、Francisella的物种丰度。多有研究指出,这些菌属物种丰度的降低与肠道疾病密切相关。Noor等[21]指出溃疡性结肠炎患者比正常人的粪便微生物中Parabacteroides菌属表达水平较低,并推测此菌属的缺失可能与肠道炎症有关。目前肠道中Rikenella的作用还没有明确,但有研究指出Rikenellaceae是肠道内具有保护性功能的菌群[22],本试验Rikenella的物种丰度显著降低,提示DON有抑制肠道有益菌的作用。Mucispirillum作为肠道细菌群落标志物,在肠炎早期或抗生素应用时丰度显著降低[23],与本试验DON使肠道Mucispirillum的物种丰度降低结果相同。推测,小鼠灌胃DON可使肠道Parabacteroides和Mucispirillum炎症敏感菌群以及有益菌Rikenella的物种丰度降低,进而引起肠道炎症发生,导致肠道损伤同时危害机体健康。
此外,DON还降低了肠道中Algoriphagus、Methylophilus和Francisella的物种丰度,由于这些菌属在肠道中的占比较低,分离培养技术不成熟,其功能作用研究也鲜有报道,故有待进一步探索研究。
DON灌胃后显著提高了Clostridium、Robinsoniella、Allobaculum以及Akkermansia的物种丰度,许多研究表明这些菌属的变化也与肠道感染和炎症密切相关。Clostridium是厚壁菌门的一个菌属,包含产气荚膜梭菌、肉毒梭菌等多种致病菌,可产生外毒素,对人和动物都有较强的毒害作用。Piotrowska等[14]给猪饲喂DON污染的饲粮发现结肠内容物中产气荚膜梭菌含量增加,提示DON可诱导肠道中致病菌含量增加。Robinsoniella被认为是临床肠道感染的继发性入侵者,在伤口感染部位或菌血症患者血液均可分离得到[24]。在白细胞介素-10(IL-10)基因敲除的肠炎小鼠模型,肠道Robinsoniella peoriensis的物种丰度也显著提高[25],而本研究肠道微生物中Robinsoniella的物种丰度增加,表明DON有诱发肠道炎症和感染的可能。Allobaculum尽管在肠道微生物中的占比较低,但有研究指出高胆固醇饲粮诱导的肠炎性小鼠肠道中Allobaculumde的物种丰度增加,并且Allobaculum的物种丰度与抗炎因子的表达呈负相关[26]。Zhou等[27]给小鼠灌胃地沟油后肠道黏膜损伤并诱发肠炎,Allobaculum丰度也显著提高,与本研究DON诱导肠道Allobaculum丰度增加结果一致。Akkermansia是近年来研究热门的一个菌属,作为是疣微菌门的优势菌群,约占83%,占总肠道微生物的1%~4%[28],以肠道上皮黏蛋白为碳源和氮源,能削弱肠道黏液屏障的厚度[29-30]。多有研究发现超重或者肥胖者肠道中Akkermansia的物种丰度降低,推测肠道中Akkermansia有减缓脂肪沉积,减轻体重的作用[31-32]。杨俊花等[15]研究发现,小鼠灌胃DON后,体重显著降低。此外,Akkermansia还可干扰宿主黏膜平衡而加剧鼠伤寒沙门氏菌诱发的肠道炎症[33]。推断DON作用使小鼠体重减轻及肠道炎症发生,可能与肠道Akkermansia的物种丰度增加有关。
目前为止,DON致肠道炎症的报道较多,主要集中在DON使肠绒毛高度降低、隐窝减少、肠上皮细胞炎性因子白细胞介素-12(IL-12)和肿瘤坏死因子-α(TNF-α)表达增加等[34-35]。但这些研究均没有涉及肠道微生物菌群的变化,DON致肠道菌群丰度变化是否与肠道炎症有直接的关系,还有待我们进一步验证。此外,鉴于Parabacteroides和Mucispirillum的物种丰度降低和Clostridium、Robinsoniella、Allobaculum、Akkermansia的物种丰度提高与肠道感染、炎症的相关性,故可以将这些菌群丰度的变化作为DON引发肠道炎症、危害肠道健康的菌群标志物。
4 结论① DON灌胃处理后,小鼠肠道微生物菌群丰度减少,Alpha多样性和Beta多样性降低。
②在门水平,与对照组相比,DON组显著降低了Bacteroidetes和Deferribacteres的物种丰度,显著提高Proteobacteria的物种丰度。在属水平,与对照组相比,DON组显著降低Parabacteroides、Rikenella、Mucispirillum的物种丰度,显著提高了Clostridium、Robinsoniella、Allobaculum、Akkermansia的物种丰度。
③肠道中这些菌属丰度的变化与肠道炎症密切相关,提示这些菌属可能是DON引发肠道炎症的菌群标志物。
| [1] | BENNETT J W, KLICH M. Mycotoxins[J]. Clinical Microbiology Reviews, 2003 , 16 (3) : 497 –516. DOI: 10.1128/CMR.16.3.497-516.2003 |
| [2] | WU Q H, LOHREY L, CRAMER B, et al. Impact of physicochemical parameters on the decomposition of deoxynivalenol during extrusion cooking of wheat grits[J]. Journal of Agricultural and Food Chemistry, 2011 , 59 (23) : 12480 –12485. DOI: 10.1021/jf2038604 |
| [3] | 李群伟. 真菌毒素与人类健康[M]. 北京: 人民军医出版社, 2005 . |
| [4] | ROTTER B A, PRELUSKY D B, PESTKA J J. Toxicology of deoxynivalenol (vomitoxin)[J]. Journal of Toxicology and Environmental Health, 1996 , 48 (1) : 1 –34. DOI: 10.1080/009841096161447 |
| [5] | PESTKA J J, SMOLINSKI A T. Deoxynivalenol:toxicology and potential effects on humans[J]. Journal of Toxicology and Environmental Health, Part B, 2005 , 8 (1) : 39 –69. DOI: 10.1080/10937400590889458 |
| [6] | ANTONISSEN G, VAN IMMERSEEL F, PASMANS F, et al.Deoxynivalenol predisposes for necrotic enteritis by affecting the intestinal barrier in broilers[C]//International Poultry Scientific Forum.Atlanta, Georgia:Georgia World Congress Center, 2013:9-10. |
| [7] | AWAD W A, ZENTEK J. The feed contaminant deoxynivalenol affects the intestinal barrier permeability through inhibition of protein synthesis[J]. Archives of Toxicology, 2015 , 89 (6) : 961 –965. DOI: 10.1007/s00204-014-1284-9 |
| [8] | CHO I, BLASER M J. The human microbiome:at the interface of health and disease[J]. Nature Reviews Genetics, 2012 , 13 (4) : 260 –270. |
| [9] | ALI-VEHMAS T, RIZZO A, WESTERMARCK T, et al. Measurement of antibacterial activities of T-2 toxin, deoxynivalenol, ochratoxin a, aflatoxin B1 and fumonisin B1 using microtitration tray-based turbidimetric techniques[J]. Journal of Veterinary Medicine Series A, 1998 , 45 (8) : 453 –458. |
| [10] | WACHÉ Y J, VALAT C, POSTOLLEC G, et al. Impact of deoxynivalenol on the intestinal microflora of pigs[J]. International Journal of Molecular Sciences, 2009 , 10 (1) : 1 –17. |
| [11] | SAINT-CYR M J, PERRIN-GUYOMARD A, HOUÉE P, et al. Evaluation of an oral subchronic exposure of deoxynivalenol on the composition of human gut microbiota in a model of human microbiota-associated rats[J]. PLoS One, 2013 , 8 (11) : e80578 . DOI: 10.1371/journal.pone.0080578 |
| [12] | SHEN J, ZHANG B R, WEI G F, et al. Molecular profiling of the Clostridium leptum subgroup in human fecal microflora by PCR-denaturing gradient gel electrophoresis and clone library analysis[J]. Applied and Environmental Microbiology, 2006 , 72 (8) : 5232 –5238. DOI: 10.1128/AEM.00151-06 |
| [13] | HILDEBRAND F, NGUYEN T L A, BRINKMAN B, et al. Inflammation-associated enterotypes, host genotype, cage and inter-individual effects drive gut microbiota variation in common laboratory mice[J]. Genome Biology, 2013 , 14 (1) : R4 . DOI: 10.1186/gb-2013-14-1-r4 |
| [14] | PIOTROWSKA M, ŚLIZEWSKA K, NOWAK A, et al. The effect of experimental Fusarium mycotoxicosis on microbiota diversity in porcine ascending colon contents[J]. Toxins, 2014 , 6 (7) : 2064 –2081. DOI: 10.3390/toxins6072064 |
| [15] | 杨俊花, 刘峰良, 刘丹, 等. 脱氧雪腐镰刀菌烯醇(DON)致BALB/c小鼠的急性、亚急性和免疫毒性研究[J]. 上海农业学报, 2015 , 31 (3) :12 –18. |
| [16] | BEZIRTZOGLOU E, TSIOTSIAS A, WELLING G W. Microbiota profile in feces of breast-and formula-fed newborns by using fluorescence in situ hybridization (FISH)[J]. Anaerobe, 2011 , 17 (6) : 478 –482. DOI: 10.1016/j.anaerobe.2011.03.009 |
| [17] | SALYERS A A. Bacteroides of the human lower intestinal tract[J]. Annual Review of Microbiology, 1984 , 38 (1) : 293 –313. DOI: 10.1146/annurev.mi.38.100184.001453 |
| [18] | WANG J C, TANG L L, GLENN T C, et al. Aflatoxin B1 induced compositional changes in gut microbial communities of male F344 rats[J]. Toxicological Sciences, 2016 , 150 (1) : 54 –63. DOI: 10.1093/toxsci/kfv259 |
| [19] | SCALDAFERRI F, GERARDI V, LOPETUSO L R, et al. Gut microbial flora, prebiotics, and probiotics in IBD:their current usage and utility[J]. BioMed Research International, 2013 , 2013 : 435268 . |
| [20] | 孙晓琦.加味泽泻汤对NAFLD小鼠肠道微生物干预作用的研究[D].博士学位论文.南京:南京中医药大学, 2015. http://industry.wanfangdata.com.cn/ny/Detail/Thesis?id=Thesis_Y2875922 |
| [21] | NOOR S O, RIDGWAY K, SCOVELL L, et al. Ulcerative colitis and irritable bowel patients exhibit distinct abnormalities of the gut microbiota[J]. BMC Gastroenterology, 2010 , 10 : 134 . DOI: 10.1186/1471-230X-10-134 |
| [22] | COX L M, YAMANISHI S, SOHN J, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences[J]. Cell, 2014 , 158 (4) : 705 –721. DOI: 10.1016/j.cell.2014.05.052 |
| [23] | 邓冠华.抗微生物药长期给药对小鼠肠道微生物组多样性的影响[D].硕士学位论文.广州:南方医科大学, 2013. |
| [24] | FERRARIS L, AIRES J, BUTEL M J. Isolation of Robinsoniella peoriensis from the feces of premature neonates[J]. Anaerobe, 2012 , 18 (1) : 172 –173. DOI: 10.1016/j.anaerobe.2011.11.007 |
| [25] | WOHLGEMUTH S, KELLER S, KERTSCHER R, et al. Intestinal steroid profiles and microbiota composition in colitic mice[J]. Gut Microbes, 2011 , 2 (3) : 159 –166. DOI: 10.4161/gmic.2.3.16104 |
| [26] | LEE S M, HAN H W, YIM S Y. Beneficial effects of soy milk and fiber on high cholesterol diet-induced alteration of gut microbiota and inflammatory gene expression in rats[J]. Food & Function, 2015 , 6 (2) : 492 –500. |
| [27] | ZHOU Z K, WANG Y Y, JIANG Y M, et al. Deep-fried oil consumption in rats impairs glycerolipid metabolism, gut histology and microbiota structure[J]. Lipids in Health and Disease, 2016 , 15 : 86 . DOI: 10.1186/s12944-016-0252-1 |
| [28] | BELZER C, DE VOS W M. Microbes inside-from diversity to function:the case of Akkermansia[J]. The ISME Journal, 2012 , 6 (8) : 1449 –1458. DOI: 10.1038/ismej.2012.6 |
| [29] | MCGUCKIN M A, LINDÉN S K, SUTTON P, et al. Mucin dynamics and enteric pathogens[J]. Nature Reviews Microbiology, 2011 , 9 (4) : 265 –278. DOI: 10.1038/nrmicro2538 |
| [30] | HASNAIN S Z, WANG H Q, GHIA J E, et al. Mucin gene deficiency in mice impairs host resistance to an enteric parasitic infection[J]. Gastroenterology, 2010 , 138 (5) : 1763 –1771. DOI: 10.1053/j.gastro.2010.01.045 |
| [31] | KARLSSON C L J, ÖNNERFÄLT J, XU J, et al. The microbiota of the gut in preschool children with normal and excessive body weight[J]. Obesity, 2012 , 20 (11) : 2257 –2261. DOI: 10.1038/oby.2012.110 |
| [32] | TEIXEIRA T F S, GRZEŚKOWIAK ŁM, SALMINEN S, et al. Faecal levels of Bifidobacterium and Clostridium coccoides but not plasma lipopolysaccharide are inversely related to insulin and HOMA index in women[J]. Clinical Nutrition, 2013 , 32 (6) : 1017 –1022. DOI: 10.1016/j.clnu.2013.02.008 |
| [33] | GANESH B P, KLOPFLEISCH R, LOH G, et al. Commensal akkermansia muciniphila exacerbates Gut inflammation in Salmonella typhimurium-infected gnotobiotic mice[J]. PLoS One, 2013 , 8 (9) : e74963 . DOI: 10.1371/journal.pone.0074963 |
| [34] | VANDENBROUCKE V, CROUBELS S, MARTEL A, et al. The mycotoxin deoxynivalenol potentiates intestinal inflammation by Salmonella typhimurium in porcine ileal loops[J]. PLoS One, 2011 , 6 (8) : e23871 . DOI: 10.1371/journal.pone.0023871 |
| [35] | 邓波, 万晶, 徐子伟, 等. 脱氧雪腐镰刀菌烯醇吸附剂对断奶仔猪生长性能、血清生化指标及肠道形态的影响[J]. 动物营养学报, 2014 , 26 (5) :1294 –1301. |




