2. 江西中医药大学, 南昌 330004
2. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
近年来,随着畜牧业和现代生物技术的发展,养猪业正逐渐成为一个技术密集和资金密集的行业。既要提供优质猪肉,又要不危害环境卫生和人类健康是近年来养猪业要面临的严峻挑战。由于抗生素类饲料添加剂的乱用、滥用,抗生素残留、细菌多重耐药性和环境污染等问题日渐加剧[1-2],人们迫切需要寻找到合适的抗生素替代品。酵母壁多糖作为功能性寡糖类物质,其主要成分为β-葡聚糖和甘露寡糖。大量研究表明,寡糖类物质能够改善肠道菌群结构,并能一定程度上提高机体的免疫性能[3-5]。同样,酵母壁多糖也被证明能够提高畜禽的生长性能和免疫功能,并能改善肠道健康,且无害无残留[6]。但是,它是通过怎样的途径来改善机体肠道健康,对断奶仔猪肠道菌群又有怎样的影响呢?挥发性脂肪酸(VFA)是微生物厌氧发酵过程的重要中间产物,后肠段是仔猪肠道菌群的丰富部位。对于单胃动物,VFA产生的主要部位是结肠,因为结肠内细菌首先与小肠内未消化的复杂碳水化合物接触,发酵活性最强。其次,结肠段比盲肠长,微生物含量相对来说较多[7-8]。本试验旨在研究酵母壁多糖对断奶仔猪肠道VFA和微生物菌群的影响,确定其在断奶仔猪中应用的最适添加水平,并为酵母壁多糖在仔猪饲粮中的科学应用提供理论依据。
1 材料与方法 1.1 试验材料酵母壁多糖来源于拓普生物科技有限公司,其主要成分为甘露寡糖(23.45%)和β-葡聚糖(39.24%),粗蛋白质含量为26.30%、粗灰分含量为3.30%、水分含量为5.35%。
1.2 试验动物和分组设计选取180头遗传背景一致、健康状况良好、胎次和体重接近的21日龄断奶仔猪,采用单因素试验设计方法,按完全随机区组分为4个组,每组5个重复,每个重复9头仔猪。4个组试验猪分别饲喂对照饲粮(未添加酵母壁多糖)、0.15%酵母壁多糖饲粮、0.30%酵母壁多糖饲粮和0.45%酵母壁多糖饲粮。试验期为21 d。
1.3 试验饲粮和营养水平仔猪饲喂玉米-豆粕型饲粮,饲粮配方参照NRC (2012)和我国《猪饲养标准》(NY/T 65-2004)配制,饲粮组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
仔猪饲养于装有高床、漏缝地板、乳头式饮水器的保育舍。试验开始前对猪舍进行彻底清理消毒。试验过程中,每日饲喂仔猪4~5次。所有仔猪自由采食和饮水,其他饲养管理措施、免疫程序按猪场常规管理程序进行。
1.5 样品采集及处理在试验第21天,从每个重复中选取1头接近平均体重且健康状况良好的仔猪,肌内注射4%戊巴比妥钠溶液进行麻醉。待麻醉完全后,采用颈静脉放血的办法将其处死。剖开腹腔,迅速分离结肠,剪取带有食糜的肠段,结扎固定取样部位的两端,包被肠道食糜样后,置于液氮中迅速冷冻,用于结肠VFA含量分析。
另取盲肠中段肠管,两端双线结扎,锡箔纸包被后,用保鲜膜连同棉线一端裹好,另一端贴好标签纸,迅速置于液氮中冷冻后,于-80 ℃保存待测。
1.6 测定指标及方法 1.6.1 结肠VFA含量的测定将样品解冻,参考耿梅梅等[9]方法,准确称取1.0 g结肠内容物于EP管中。加入1 mL超纯水,漩涡振荡致内容物混合均匀。以15 000 r/min离心15 min,转移上清,按体积比9 : 1比例添加25%偏磷酸,冰水浴中处理3 h。然后通过气相色谱仪利用外标法测定各样品中乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸含量,并计算相应总挥发性脂肪酸(TVFA)含量。
1.6.2 盲肠细菌计数盲肠大肠杆菌、沙门氏菌、双歧杆菌、乳酸杆菌和总菌数采用平板培养法测定。取盲肠内容物样品,在无菌操作台内室温解冻。称取盲肠内容物0.5 g于无菌青霉素瓶中,加入灭菌后的生理盐水5 mL,漩涡振荡器上振荡3~5 min,然后用微量移液枪准确吸取稀释液500 μL至盛有4.5 mL生理盐水的无菌青霉素瓶中,振荡1~2 min,制成10-1稀释液,继续重复以上稀释步骤,依次进行10-2~10-6倍比稀释。
将盲肠内容物稀释液分别接种在相应的培养基平皿上。大肠杆菌、乳酸杆菌、沙门氏菌、双歧杆菌和总菌分别使用伊红美兰、MRS、HE、BBL和普通培养基培养,每种指标检测5个稀释梯度,每个梯度3个重复,总菌、大肠杆菌和沙门氏菌于37 ℃恒温有氧培养24 h。双歧杆菌和乳酸杆菌于37 ℃恒温厌氧培养48 h。最后取出培养皿,进行菌落计数。细菌计数结果用1.0 g肠道食糜中细菌数的对数值[lg (CFU/g)]表示。
1.7 数据处理与统计分析所有数据用Excel 2003简单处理后,采用SPSS 17.0软件中单因素方差分析(one-way ANOVA)模型进行方差分析,差异显著再进行Duncan氏法多重比较,用SPSS 17.0中的曲线回归分析(curvilinear regression)进行相关性分析,通过饲粮酵母壁多糖添加水平与各指标之间的二次曲线拟合,确定最佳的回归曲线方程,计算饲粮中酵母壁多糖最适添加水平。各组数据以“平均值±标准误”表示。以P < 0.05为显著性判断标准。
2 结果与分析 2.1 酵母壁多糖对断奶仔猪结肠VFA的影响由表 2可知,与对照组相比,在饲粮中添加0.15%、0.30%和0.45%酵母壁多糖,仔猪结肠内容物乙酸含量分别增加了27.57%、48.71%和34.46%(P < 0.05);添加0.30%和0.45%酵母壁多糖还显著提高了仔猪结肠丙酸、丁酸的含量(P < 0.05);此外,0.45%酵母壁多糖组结肠戊酸含量显著高于对照组(P < 0.05)。从整体上来看,饲粮中添加0.30%和0.45%酵母壁多糖可显著提高仔猪结肠内容物TVFA含量(P < 0.05)。与对照组相比,0.30%和0.45%酵母壁多糖组TVFA分别提高了49.72%和44.42%(P < 0.05)。但0.30%和0.45%酵母壁多糖组之间丙酸、丁酸、戊酸以及TVFA含量差异不显著(P>0.05)。
|
|
表 2 酵母壁多糖对断奶仔猪结肠挥发性脂肪酸的影响 Table 2 Effects of yeast cell wall polysaccharides on VFA in colon of weaned piglets |
通过曲线拟合回归方程分析发现,回肠中乙酸(Y1)和TVFA (Y2)含量与饲粮酵母壁多糖添加水平(X)间均呈二次曲线关系,建立回归方程如下:
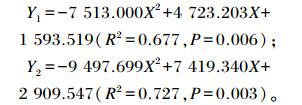
|
由上述回归方程可得,当饲粮中酵母壁多糖添加水平为0.31%时,回肠中乙酸含量值最大;当添加水平为0.39%时,断奶仔猪回肠中TVFA含量值最大。
2.2 酵母壁多糖对断奶仔猪盲肠微生物菌群的影响由表 3可知,各组间盲肠中双歧杆菌、乳酸杆菌和总菌的数量差异不显著(P>0.05)。但饲粮中添加0.15%、0.30%和0.45%的酵母壁多糖后,仔猪盲肠沙门氏菌数分别比对照组降低了6.12%、7.93%和9.09%(P < 0.05)。另外,添加酵母壁多糖显著降低了仔猪肠道大肠杆菌数量(P < 0.05)。
|
|
表 3 酵母壁多糖对断奶仔猪盲肠细菌计数的影响 Table 3 Effects of yeast cell wall polysaccharides on caecum bacterial count of weaned piglets |
通过曲线拟合回归方程分析发现,盲肠中沙门氏菌(Y3)与饲粮酵母壁多糖添加水平(X)间呈二次曲线关系,建立回归方程如下:
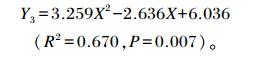
|
由该回归方程可得出,当饲粮中酵母壁多糖添加水平为0.40%时,盲肠中沙门氏菌数量最少。
3 讨论 3.1 酵母壁多糖对断奶仔猪结肠VFA的影响在单胃动物整个消化道中,大肠是微生物含量最丰富的区域[10]。虽然这些微生物产生的内毒素对肠道有害,但是它们维持着肠道微生态平衡,抵御外来微生物的定植,并能激活肠道免疫系统[11],更重要的是这些微生物能将复杂的碳水化合物发酵成VFA[12-13]。体内、体外试验均证实,寡糖可被细菌降解成大量的VFA[14-15]。本研究结果显示,与对照组相比,添加0.30%和0.45%酵母壁多糖能显著提高断奶仔猪TVFA含量。潘晓东[16]研究发现甘露寡糖能显著提高小鼠盲肠内TVFA、丙酸和戊酸的含量。杭苏琴等[15]通过体外法研究甘露寡糖和甜菜汁对肠道微生物发酵的影响,发现甘露寡糖各组回肠中丙酸和丁酸的比例显著高于对照组,甘露寡糖组乙酸比例显著低于对照组。反观本试验结果,酵母壁多糖能显著提高乙酸、丙酸和丁酸的含量,而大肠中微生物能通过利用乳酸和乙酸转化生成丁酸[17],且乳酸完全发酵能产生大量丙酸。因此推测,酵母壁多糖可能能够促进乳酸利用菌的增殖来达到乳酸向丁酸转化的效果。此外本试验还得出,添加0.45%酵母壁多糖能显著提高断奶仔猪结肠戊酸含量。通过结肠中TVFA和乙酸含量与饲粮中酵母壁多糖添加水平得出有效回归方程预测,我们发现,当饲粮中酵母壁多糖含量分别为0.39%和0.31%时,结肠中VFA含量较高。
3.2 酵母壁多糖对断奶仔猪盲肠微生物菌群的影响正常情况下,动物肠道内各菌群相互依存、相互拮抗维持肠道的动态平衡。但外界环境应激(如断奶、温度、转栏等)容易破坏肠道动态平衡,导致肠道微生物菌群之间比例失调。研究证明,仔猪断奶后,肠道乳酸杆菌数量下降,大肠杆菌的比例上升[18-19]。添加抗生素虽能一定程度上改善仔猪腹泻,但同样也会破坏肠道有益菌[20],酵母壁多糖主要含有甘露寡糖和β-葡聚糖,饲粮中的糖类物质对肠道内微生物区系有一定的影响能力[21-22]。早在20多年前,甘露寡糖和果寡糖等功能性寡糖就被证实能改善人体的肠道菌群[23]。前期动物试验也发现,与对照组相比,添加0.15%、0.30%和0.45%酵母壁多糖均能够显著提高断奶仔猪平均日增重和平均日采食量,并有降低仔猪料重比和腹泻率的趋势[24]。本研究结果显示,在断奶仔猪饲粮中添加酵母壁多糖能显著降低盲肠沙门氏菌和大肠杆菌数量。这可能是由于甘露寡糖能够被肠道微生物利用发酵并促进VFA增加,一方面降低肠道pH,使得对酸度敏感的大肠杆菌、沙门氏菌等有害菌群的生长就受到相应地抑制[25];另一方面VFA具有降低氧化还原电位的作用,影响有害菌生长和代谢必须辅酶的氧化还原作用[26],从而抑制致病菌。萨立富[27]关于甘露寡糖对断奶仔猪肠道菌群影响的研究也发现甘露寡糖能够极显著降低了肠道大肠杆菌的数量。此外,研究还发现甘露寡糖能够增强断奶仔猪沙门氏菌和大肠杆菌的抗感染能力[28]。β-葡聚糖对肠道微生物也有一定的调节作用,添加β-葡聚糖提高了肠道中乳酸杆菌、双歧杆菌等有益菌群数量[29]。这与本试验的结果相一致。本试验研究发现,与对照组相比,添加0.15%、0.30%和0.45%酵母壁多糖还能一定程度上增加盲肠内双歧杆菌和乳酸杆菌的数量,但差异不显著。综上试验结果可以得出:酵母壁多糖能够改善肠道菌群结构,促进盲肠内有益菌增殖,抑制有害菌增殖。且通过盲肠中沙门氏菌数与饲粮中酵母壁多糖的回归方程分析发现,酵母壁多糖的添加水平为0.40%时效果最佳。
4 结论①酵母壁多糖可以调节仔猪肠道VFA结构和含量。当饲粮中添加0.30%和0.45%酵母壁多糖时,仔猪结肠乙酸、丙酸、丁酸以及TVFA的含量显著升高。
②酵母壁多糖对改善断奶仔猪肠道菌群结构具有促进作用。当饲粮中添加0.30%和0.45%酵母壁多糖时,仔猪盲肠大肠杆菌和沙门氏菌数量显著降低。
③运用回归方程预测,酵母壁多糖在仔猪饲粮中的适宜添加量为0.31%~0.40%。
| [1] | 赵青, 钟土木, 胡玉敏. 兽药与饲料添加剂残留对人体健康的影响[J]. 中国畜牧杂志, 2005 , 41 (1) :55 –57. |
| [2] | 巩霞, 程学慧. 饲用抗生素抗药性研究:现在与未来[J]. 中国畜牧杂志, 2007 , 43 (22) :26 –32. |
| [3] | 黄鑫玮, 杨莎莎, 刘毅, 等. 壳寡糖对幼建鲤生长性能、脂肪代谢、非特异性免疫功能和肠道健康的影响[J]. 动物营养学报, 2015 , 27 (7) :2106 –2114. |
| [4] | 李梦云, 朱宽佑, 刘延贺, 等. 饲粮中添加果寡糖对初产母猪生产性能, 血清指标及粪便pH、微生物菌群数量和挥发性脂肪酸含量的影响[J]. 动物营养学报, 2015 , 27 (2) :510 –516. |
| [5] | 郭芳, 孙亚楠, 周岩民, 等. 复合寡糖对肉鸡生产性能和免疫器官指数的影响[J]. 家畜生态学报, 2009 , 30 (4) :25 –28. |
| [6] | 周祥, 张双双, 李莉, 等. 酵母多糖的生理功能及其在动物饲养中的应用研究进展[J]. 粮食与饲料工业, 2013 (10) :46 –48. |
| [7] | 连晓蔚.肠道菌群利用几种膳食纤维体外发酵产短链脂肪酸的研究[D].硕士学位论文.广州:暨南大学, 2011. |
| [8] | 李春慧, 孟晓琴, 刘博涛, 等. 活化卵白蛋白对断奶仔猪结肠内SCFA的影响[J]. 浙江农业学报, 2014 (2) :297 –302. |
| [9] | 耿梅梅, 许丽卫, 袁红朝, 等. 气相色谱法测定猪结肠内容物中短链脂肪酸含量[J]. 现代生物医学进展, 2015 , 15 (6) :1010 –1014. |
| [10] | JENSEN B B, JØRGENSEN H. Effect of dietary fiber on microbial activity and microbial gas production in various regions of the gastrointestinal tract of pigs[J]. Applied and Environmental Microbiology, 1994 , 60 (6) : 1897 –1904. |
| [11] | 周梦怡.索拉胶对肠道生理和病理调节作用的研究[D].博士学位论文.南京:南京理工大学, 2014. |
| [12] | 王丽凤.益生菌L. plantarum P-8对肉鸡肠道菌群、肠道免疫和生长性能影响的研究[D].博士学位论文.呼和浩特:内蒙古农业大学, 2014. |
| [13] | SAMUEL B S, SHAITO A, MOTOIKE T, et al. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, Gpr41[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008 , 105 (43) : 16767 –16772. DOI: 10.1073/pnas.0808567105 |
| [14] | CUMMINGS J H, MACFARLANE G T, ENGLYST H N. Prebiotic digestion and fermentation[J]. American Journal of Clinical Nutrition, 2001 , 73 (Suppl.2) : 415S –420S. |
| [15] | 杭苏琴, 毛胜勇, 于卓腾, 等. 体外法评定甘露寡糖和甜菜汁对肠道微生物发酵的影响[J]. 南京农业大学学报, 2007 , 30 (1) :79 –83. |
| [16] | 潘晓东.若干寡糖的功能特性及对肠道生理生态调控机制的研究[D].博士学位论文.杭州:浙江大学, 2009. http://cdmd.cnki.com.cn/Area/CDMDUnitArticle-10335-2009-27.htm |
| [17] | DUNCAN S H, HOLTROP G, LOBLEY G E, et al. Contribution of acetate to butyrate formation by human faecal bacteria[J]. British Journal of Nutrition, 2004 , 91 (6) : 915 –923. DOI: 10.1079/BJN20041150 |
| [18] | CANH T T, SUTTON A L, AARNINK A J, et al. Dietary carbohydrates alter the fecal composition and pH and the ammonia emission from slurry of growing pigs[J]. Journal of Animal Science, 1998 , 76 (7) : 1887 –1895. DOI: 10.2527/1998.7671887x |
| [19] | MATHEW A G, SUTTON A L, SCHEIDT A B, et al. Effect of galactan on selected microbial populations and pH and volatile fatty acids in the ileum of the weanling pig[J]. Journal of Animal Science, 1993 , 71 (6) : 1503 –1509. |
| [20] | BLAKE D P, HILLMAN K, FENLON D R. The use of a model ileum to investigate the effects of novel and existing antimicrobials on indigenous porcine gastrointestinal microflora:using vancomycin as an example[J]. Animal Feed Science and Technology, 2003 , 103 (1/2/3/4) : 123 –139. |
| [21] | SHANMUGASUNDARAM R, SIFRI M, SELVARAJ R K. Effect of yeast cell product (CitriStim) supplementation on broiler performance and intestinal immune cell parameters during an experimental coccidial infection[J]. Poultry Science, 2013 , 92 (2) : 358 –363. DOI: 10.3382/ps.2012-02776 |
| [22] | SHANMUGASUNDARAM R, SIFRI M, SELVARAJ R K. Effect of yeast cell product supplementation on broiler cecal microflora species and immune responses during an experimental coccidial infection[J]. Poultry Science, 2013 , 92 (5) : 1195 –1201. DOI: 10.3382/ps.2012-02991 |
| [23] | TANAKA R, TAKAYAMA H, MOROTOMI M, et al. Effects of Administration of TOS and Bifidobacterium breve 4006 on the human fecal flora[J]. Bifidobacteria and Microflora, 1983 , 2 (1) : 17 –24. DOI: 10.12938/bifidus1982.2.1_17 |
| [24] | 贺琴, 王自蕊, 游金明, 等. 酵母壁多糖对断奶仔猪生长性能和小肠黏膜形态结构的影响[J]. 动物营养学报, 2016 , 28 (11) :3536 –3541. |
| [25] | 杭苏琴.甘露寡糖对断奶仔猪肠道微生物的影响[D].博士学位论文.南京:南京农业大学, 2007. http://www.cnki.com.cn/Article/CJFDTOTAL-HLJX200610037.htm |
| [26] | 吴媛媛, 呙于明, 王忠, 等. 木寡糖对肉仔鸡生长性能、肠道生理学和形态学指标的影响[J]. 中国农业大学学报, 2006 , 11 (4) :42 –46. |
| [27] | 萨立富, 边连全, 潘树德. 甘露寡糖对断奶仔猪生长性能和腹泻率的影响[J]. 动物科学与动物医学, 2005 , 22 (10) :46 –47. |
| [28] | WHITE L A, NEWMAN M C, CROMWELL G L, et al. Brewers dried yeast as a source of mannan oligosaccharides for weanling pigs[J]. Journal of Animal Science, 2002 , 80 (10) : 2619 –2628. DOI: 10.2527/2002.80102619x |
| [29] | 潘树德, 李学俭, 边连全, 等. 酵母β-葡聚糖对断奶仔猪肠道菌群的影响[J]. 饲料工业, 2012 , 33 (12) :21 –23. |




