2. 北京君德同创农牧科技股份有限公司, 北京 100085
2. Beijing Gendone Agricultural Technology Co., Ltd., Beijing 100085, China
目前,鱼类资源枯竭致使鱼粉短缺,价格昂贵,鱼粉掺杂严重,而肉骨粉由于食品安全性问题限制其在动物饲料中的广泛使用,致使我国畜禽饲料中普遍缺乏动物性蛋白质饲料。畜禽食用纯植物性饲粮,生产性能下降。究其原因,可能是动物源性饲料中含有肌酸,而植物源性饲料中不含肌酸[1-2]。肌酸是快速生长的幼龄动物所需营养素[3],其形成的磷酸肌酸同ATP组成了磷酸原供能系统,无需氧气参与,可及时为机体肌肉组织快速生长发育提供能量[4]。动物机体可利用精氨酸、甘氨酸和蛋氨酸内源性合成肌酸[1, 5]。动物通过内源性从头合成的肌酸约占机体所需肌酸的75%[6]。此外,机体每天有大约1.7%的肌酸会非酶促自动以肌酸酐的形式排出体外[1]。再之,由于育种手段的改进,动物肌肉生长发育更快,其对应肌酸的需求相应也加大。因此,动物亟需额外补充肌酸。
外源添加肌酸,由于价格昂贵且不稳定,限制其使用[7]。而且,外源补充肌酸降低L-精氨酸-甘氨酸脒基转移酶基因表达量,抑制了机体内源性肌酸的合成[8-9]。研究发现,外源性补充胍基乙酸(guanidinoacetic acid,GAA)比肌酸在提高组织肌酸负荷方面更有效[10]。已有研究证实,全植物性饲粮添加600 mg/kg GAA可改善肉仔鸡生长性能和提高肉仔鸡胸肉重,且获得了与添加鱼粉处理一致的生长性能[2]。此外,GAA可改善断奶仔猪生产性能[11],改善育肥猪生长性能、胴体品质和肉品质[12-13],改善肉种鸡[11]、鹌鹑[14]繁殖性能,改善建鲤生长性能和能量代谢[15]。可见,GAA作为肌酸的唯一前体物,已经引起了动物营养学家的广泛关注。然而,高剂量GAA及其耐受性的研究相对甚少。因此,本试验旨在以爱拔益加(AA)肉仔鸡为靶动物,研究GAA对其生长性能、血液学指标、脏器指数、组织同型半胱氨酸(homocysteine,HCY)含量和组织形态的影响,以系统评价AA肉仔鸡对GAA的耐受性,为其安全使用提供理论依据。
1 材料与方法 1.1 试验材料试验用GAA源为北京君德同创农牧科技股份有限公司提供的肌源®,其GAA含量≥98%。
1.2 试验动物及设计试验选用540只1日龄平均初始体重为45.13 g的AA肉仔鸡公雏,随机分为5个组,每组6个重复,每个重复18只鸡。5个组试鸡分别饲喂在基础饲粮中添加0、800、1 600、4 000和8 000 mg/kg GAA的饲粮。试验期42 d,分为1~21日龄和22~42日龄2个阶段。
1.3 基础饲粮试验采用玉米-豆粕型基础饲粮,基础饲粮营养水平参考《鸡饲养标准》(NY/T 33—2004),基础饲粮组成及营养水平见表 1。配合饲粮时,GAA用玉米粉进行逐级稀释放大,混匀后与其他原料混合。
|
|
表 1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of basal diets (as-fed basis) |
试验在中国农业大学动物科技学院代谢室进行,试验期为42 d。试验鸡采用3层笼养,自由采食与饮水。每日24 h光照,试验第1周温度控制在34~35 ℃,每周下降2 ℃,最终温度控制在20~26 ℃,相对湿度45%~55%。按照肉仔鸡常规免疫程序免疫和饲养管理,每日观察鸡群健康与精神状况。
1.5 测定指标及方法 1.5.1 生长性能试验开始时,称量肉仔鸡的初始体重,试验的第21和42天每个饲养阶段结束时08:30空腹称重并记录耗料量。计算1~21日龄、22~42日龄和1~42日龄肉仔鸡平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.5.2 血液学指标分别于试验的第21和42天,每组随机取6只鸡(每个重复1只),心脏采集3 mL血液,缓慢注入乙二胺四乙酸二钠(EDTA-Na2)抗凝管中,缓慢颠倒混匀备用,测定血常规指标。血常规指标主要包括:白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白含量(HGB)、红细胞平均体积(MCV)、血小板计数(PLT)和红细胞比容(HCT),采用全自动分析仪(sysmex microcell counter CL-180)测定。另外,采集非抗凝血5 mL,于室温下倾斜放置0.5 h,3 000 r/min离心10 min,制备血清,并将血清转移至2 mL微离心管中,于-20 ℃保存,测定血清生化指标。血清生化指标包括:谷丙转氨酶(ALT)、谷草转氨酶((AST)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、尿素氮(UN)、肌酸酐(CRE)、葡萄糖(GLU)、总胆红素(TBILI),按照试剂盒(中生北控生物科技股份有限公司,北京)操作指南进行测定,所用仪器为全自动生化仪(日立7160型,日立集团,日本)。
1.5.3 脏器指数于试验第42天,每组随机取6只鸡(每个重复1只),屠宰后,取心脏、肝脏、脾脏和肾脏称重,计算各脏器指数。
器官指数=器官鲜重(g)/宰前活重(kg)。
1.5.4 组织HCY分别于试验的第42天,每组随机取6只鸡(每个重复1只)进行屠宰,屠宰后取肝脏、肾脏和胸肌样品,样品匀浆后,采用试剂盒(Axis-Shield Diagnostics Ltd,挪威)测定各组织中HCY含量。
1.5.5 组织形态于试验第42天,对照组以及4 000、8 000 mg/kg GAA组随机取6只鸡(每个重复1只),取肝脏和肾脏组织样品,在10%的福尔马林缓冲液中固定48 h。在Sakura自动脱水机中过夜脱水,包埋,切片厚度为5 μm,再经苏木精-伊红染色,手动盖玻,完成组织切片,用真彩图像分析软件采集图像,观察其组织形态变化。
1.6 统计分析试验数据采用SAS 8.0统计软件中的ANOVA过程进行单因子方差分析,采用Duncan氏法多重比较组间差异显著性,P<0.05为差异显著。
2 结果与分析 2.1 GAA对肉仔鸡生长性能的影响由表 2可见,各组间肉仔鸡各阶段ADFI均无显著差异(P>0.05)。在试验前期(1~21日龄),800~4 000 mg/kg GAA组肉仔鸡ADG显著高于对照组和8 000 mg/kg GAA组(P<0.05),且800 mg/kg GAA组F/G比对照组显著降低(P<0.05)。在试验后期(22~42日龄)和试验全期(1~42日龄),与对照组和8 000 mg/kg GAA相比,800~4 000 mg/kg GAA组肉仔鸡ADG显著提高,F/G显著降低(P<0.05)。然而,对照组和8 000 mg/kg GAA组之间,各阶段ADG、ADFI和F/G无显著差异(P>0.05)。与对照组比较,饲喂添加800~4 000 mg/kg GAA饲粮的肉仔鸡,其21日龄体重分别提高了15.25%、11.86%和8.47%(P<0.05),42日龄体重分别提高了9.50%、8.00%和7.50%(P<0.05)。以上结果表明,饲粮添加800~4 000 mg/kg GAA可有效地提高肉鸡增重速度和饲料利用效率,进而提高肉鸡出栏体重。然而,饲粮添加8 000 mg/kg GAA时,虽不能有效改善肉仔鸡生长性能,但也没有产生显著的不良影响。
|
|
表 2 饲粮中添加GAA对肉仔鸡生长性能的影响 Table 2 Effects of dietary GAA supplementation on growth performance of broilers |
由表 3可见,各组间肉仔鸡21和42日龄血常规各指标(WBC、RBC、HCT、HGB、MCV、PLT)均无显著差异(P>0.05)。该结果表明,饲粮添加800~8 000 mg/kg GAA对21和42日龄肉仔鸡血常规指标无显著不良影响。
|
|
表 3 饲粮中添加GAA对肉仔鸡血常规指标的影响 Table 3 Effects of dietary GAA supplementation on blood routine indices of broilers |
由表 4可见,各组间肉仔鸡21和42日龄血清ALP、ALT、AST活性以及UN、TBILI、GLU、TP、ALB和CRE含量均没有显著差异(P>0.05)。该结果表明,饲粮添加800~8 000 mg/kg GAA对21和42日龄肉仔鸡血清生化指标无显著不良影响。
|
|
表 4 饲粮中添加GAA对肉仔鸡血清生化指标的影响 Table 4 Effects of dietary GAA supplementation on serum biochemical parameters of broilers |
由表 5可见,试验第42天时,各组间肉仔鸡心脏、肝脏、脾脏和肾脏指数均无显著差异(P>0.05)。该结果表明,饲粮添加800~8 000 mg/kg GAA对肉仔鸡的脏器指数无显著不良影响。
|
|
表 5 饲粮中添加GAA对肉仔鸡脏器指数的影响 Table 5 Effects of dietary GAA supplementation on organ indices of broilers |
由表 6可见,试验第42天时,各组间肉仔鸡胸肌、肾脏和肝脏HCY含量均无显著差异(P>0.05)。该结果表明,饲粮添加800~8 000 mg/kg GAA对肉仔鸡的组织HCY含量无显著不良影响。
|
|
表 6 饲粮中添加GAA对肉仔鸡组织HCY含量的影响 Table 6 Effects of dietary GAA supplementation on tissue HCY content of broilers |
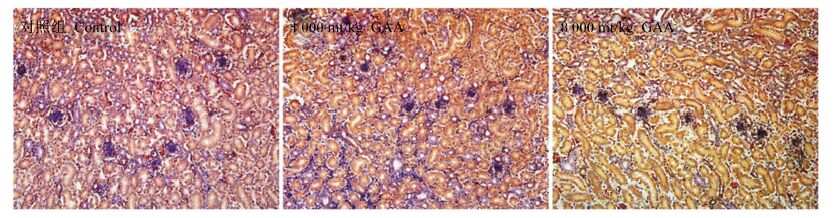
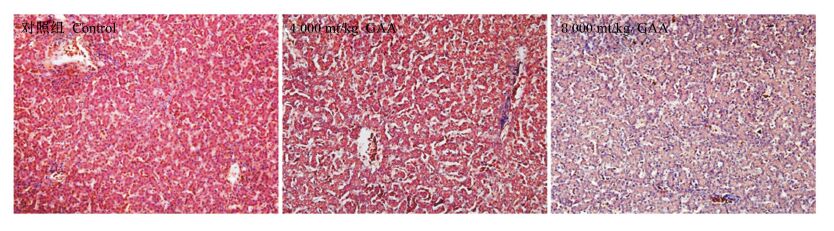
饲粮中添加GAA后肉仔鸡肝脏、肾脏组织形态分别见图 1和图 2。各组肉仔鸡肝脏、肾脏组织切片正常,组间没有显著的变化。
|
图 1 肾脏组织形态结构图 Figure 1 Kidney morphological structure graphs (400×) |
|
图 2 肝脏组织形态结构图 Figure 2 Liver morphological structure graphs (200×) |
目前研究发现,饲粮补充GAA可提高肉仔鸡[2, 16]和育肥猪[13]肌肉组织肌酸含量,同时提高了磷酸肌酸/ATP值。磷酸肌酸/ATP值可反映细胞能量代谢状态,其数值高表明改善细胞能量代谢,可为肌肉组织收缩、细胞运动、合成代谢和离子平衡提供更多及时的ATP[17]。此外,600 mg/kg GAA可节约肉仔鸡209.3 kJ代谢能,并显著降低其F/G[18]。这些研究结果显示,GAA可能是通过改善肌肉组织能量代谢,促进肌纤维的发育,进而改善肉仔鸡的生长性能。机体可通过精氨酸和甘氨酸合成GAA,而饲粮中添加GAA可节约精氨酸和甘氨酸。甘氨酸和精氨酸是肉仔鸡的必需氨基酸。目前,已被证实,在肉仔鸡精氨酸缺乏饲粮中补充GAA可有效节约精氨酸[19]。此外,GAA也可促进类胰岛素生长因子-Ⅰ[2]和胰岛素[20]的分泌,进而促进机体生长。本研究发现,饲粮添加800~4 000 mg/kg GAA提高了AA肉仔鸡ADG,降低了F/G,改善了其生长性能。但从数值上看,8 000 mg/kg GAA组与对照组相比,有更低的ADFI和ADG,没有进一步改善肉仔鸡的生长性能。Tossenberger等[16]研究发现,饲粮添加6 000 mg/kg GAA由于降低了肉仔鸡的采食量,进而显著降低了其体增重,同时发现GAA添加量从600 mg/kg增加至6 000 mg/kg时,肉仔鸡对GAA的真可利用率从76%骤降至46%。总之,肉仔鸡饲粮添加适量GAA后改善了其生长性能可能是由于GAA改善了能量利用率,节约了精氨酸和甘氨酸等必需氨基酸,促进了有利于蛋白质合成的激素分泌。但是,超高剂量添加GAA可能会降低采食量,进而降低日增重。
3.2 GAA对肉仔鸡血常规指标的影响血常规指标作为血液学最基本检查指标,与机体新陈代谢和健康状况密切相关。EFSA[21]先前报道了一项研究,发现饲粮添加1 500 mg/kg GAA既提高了MCV和RBC,这可能是饲粮缺乏除蛋氨酸以外的甲基供体(维生素B12 7.5 μg/kg、叶酸0.5 mg/kg、氯化胆碱100 mg/kg)造成的,同时也发现WBC也降低了。而在最近一项同样的GAA剂量反应研究中发现,饲粮含有足够的甲基供体(维生素B12 20 μg/kg、叶酸1.0 mg/kg、氯化胆碱460 mg/kg)时,对MCV、HGB或WBC无显著影响[11]。本研究发现,GAA对肉仔鸡各项血常规指标无显著影响,这可能与本试验基础饲粮中有足够的甲基供体(维生素B12 0.1 mg/kg、叶酸1.0 mg/kg、氯化胆碱500 mg/kg)有关。
3.3 GAA对肉仔鸡血清生化指标的影响血清ALT、AST和ALP活性可反映肝功能,肝脏受到损伤时,其活性将会高于正常范围。血清TP、ALB和TBILI含量也可用于检测肝脏代谢状况。血液UN和CRE含量可用于反映肾功能。血清UN含量能有效反映机体氨基酸利用状况。CRE作为肌肉肌酸分解代谢产物,其通过尿液排出量与机体肌肉组织重量呈正相关[22]。Tossenberger等[16]发现,饲粮添加600、6 000 mg/kg GAA对肉仔鸡血清TP、ALB、GLU、UN或尿酸含量等均无显著影响,而添加6 000 mg/kg GAA提高了血清CRE含量。但本研究发现,饲粮添加GAA对各项血清生化指标无显著影响。本研究中血清CRE含量没有提高,可能是GAA更大地提高了肌肉组织或者尿液CRE含量。相关研究证实,饲粮添加高剂量GAA可更大程度地提高肌肉组织和尿液中CRE含量,对血清中的CRE含量提高幅度小[16]。
3.4 GAA对肉仔鸡脏器指数的影响脏器指数对健康动物来说相对稳定,其大小的变化能反映器官充血、增生或萎缩及退行性变化等[23]。此外,器官指数也可旁证组织形态学改变的可能性。本研究发现,饲粮添加GAA高达8 000 mg/kg时仍对AA肉仔鸡心脏、肝脏、脾脏和肾脏指数无显著影响。这与本研究添加8 000 mg/kg GAA未引起AA肉仔鸡血常规指标和血清生化指标变化的结果相应。
3.5 GAA对肉仔鸡组织HCY含量的影响饲粮补充GAA提高了机体对甲基供体的需求,而甲基供体不足会提高机体HCY含量[16, 24]。血液HCY是冠状动脉粥样硬化和心肌梗塞的危险指标。肉仔鸡可食性组织中的HCY含量可能会影响人体内血液HCY的含量,因此是耐受性试验中的关注点。本研究发现,饲粮添加高达8 000 mg/kg GAA未引起肉仔鸡胸肌、肾脏和肝脏等组织HCY含量的变化,这可能与基础饲粮中含足够的甲基供体相关。Tossenberger等[16]研究发现,饲粮添加6 000 mg/kg GAA提高了血浆HCY含量,其使用的基础饲粮甲基供体(维生素B12 7.5 μg/kg、叶酸0.5 mg/kg、氯化胆碱100 mg/kg)相对低于本研究。目前研究发现,胆碱、甜菜碱、叶酸和维生素B12等甲基供体可预防由GAA造成血液HCY含量的升高引起的高半胱氨酸血症[25-26]。
3.6 GAA对肉仔鸡组织形态的影响肾脏和肝脏组织是与GAA代谢密切相关的组织。本研究发现,高剂量(4 000和8 000 mg/kg)GAA没有造成肾脏和肝脏组织明显的病变。这与本研究肉仔鸡血液学指标和脏器指数未发生明显变化的结果相一致。
| [1] | WYSS M, KADDURAH-DAOUK R. Creatine and creatinine metabolism[J]. Physiological Reviews, 2000 , 80 (3) : 1107 –1213. |
| [2] | MICHIELS J, MAERTENS L, BUYSE J, et al. Supplementation of guanidinoacetic acid to broiler diets:effects on performance,carcass characteristics,meat quality,and energy metabolism[J]. Poultry Science, 2012 , 91 (2) : 402 –412. DOI: 10.3382/ps.2011-01585 |
| [3] | LEMME A,RINGEL J,STERK A,et al.Supplemental guanidino acetic acid affects energy metabolism of broilers[C]//Proceedings 16th European symposium on poultry nutrition.Strasbourg:[s.n.],2007:339-342. |
| [4] | DE OLIVEIRA J E, UNI Z, FERKET P R. Important metabolic pathways in poultry embryos prior to hatch[J]. World's Poultry Science Journal, 2008 , 64 (4) : 488 –499. DOI: 10.1017/S0043933908000160 |
| [5] | 王连生, 张圆圆, 单安山. 胍基乙酸的体内代谢及在动物生产中的应用[J]. 中国畜牧兽医, 2010 , 37 (6) :13 –16. |
| [6] | BROSNAN J T, WIJEKOON E P, WARFORD-WOOLGAR L, et al. Creatine synthesis is a major metabolic process in neonatal piglets and has important implications for amino acid metabolism and methyl balance[J]. The Journal of Nutrition, 2009 , 139 (7) : 1292 –1297. DOI: 10.3945/jn.109.105411 |
| [7] | BAKER D H. Advances in protein-amino acid nutrition of poultry[J]. Amino Acids, 2009 , 37 (1) : 29 –41. DOI: 10.1007/s00726-008-0198-3 |
| [8] | DA SILVA R P, CLOW K, BROSNAN J T, et al. Synthesis of guanidinoacetate and creatine from amino acids by rat pancreas[J]. British Journal of Nutrition, 2014 , 111 (4) : 571 –577. DOI: 10.1017/S0007114513003012 |
| [9] | MCGUIRE D M, GROSS M D, VAN PILSUM J F, et al. Repression of rat kidney L-arginine:glycine amidinotransferase synthesis by creatine at a pretranslational level[J]. The Journal of Biological Chemistry, 1984 , 259 (19) : 12034 –12038. |
| [10] | MCBREAIRTY L E, ROBINSON J L, FURLONG K R, et al. Guanidinoacetate is more effective than creatine at enhancing tissue creatine stores while consequently limiting methionine availability in Yucatan miniature pigs[J]. PLoS One, 2015 , 10 (6) : e0131563 . DOI: 10.1371/journal.pone.0131563 |
| [11] | EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP). Safety and efficacy of guanidinoacetic acid for chickens for fattening,breeder hens and roosters,and pigs[J]. EFSA Journal, 2016 , 14 (2) : 4394 . |
| [12] | 胡金良, 陈宝玉, 张德福, 等. 胍基乙酸在育肥猪饲养中的应用试验[J]. 广东畜牧兽医科技, 2015 , 40 (5) :15 –17. |
| [13] | LIU Y, LI J L, LI Y J, et al. Effects of dietary supplementation of guanidinoacetic acid and combination of guanidinoacetic acid and betaine on postmortem glycolysis and meat quality of finishing pigs[J]. Animal Feed Science and Technology, 2015 , 205 : 82 –89. DOI: 10.1016/j.anifeedsci.2015.03.010 |
| [14] | MURAKAMI A E, RODRIGUEIRO R J, SANTOS T C, et al. Effects of dietary supplementation of meat-type quail breeders with guanidinoacetic acid on their reproductive parameters and progeny performance[J]. Poultry Science, 2014 , 93 (9) : 2237 –2244. DOI: 10.3382/ps.2014-03894 |
| [15] | 洑琴, 乔丽红, 唐志刚, 等. 胍基乙酸对建鲤生产性能、体成分及肌肉能量代谢关键酶的影响[J]. 中国粮油学报, 2015 , 30 (3) :85 –89. |
| [16] | TOSSENBERGER J, RADEMACHER M, NEMETH K, et al. Digestibility and metabolism of dietary guanidino acetic acid fed to broilers[J]. Poultry Science, 2016 , 95 (9) : 2058 –2067. DOI: 10.3382/ps/pew083 |
| [17] | WALLIMANN T, WYSS M, BRDICZKA D, et al. Intracellular compartmentation,structure and function of creatine kinase isoenzymes in tissues with high and fluctuating energy demands:the ‘phosphocreatine circuit’ for cellular energy homeostasis[J]. Biochemical Journal, 1992 , 281 (1) : 21 –40. DOI: 10.1042/bj2810021 |
| [18] | ABUDABOS A M, SALEH F, LEMME A, et al. The relationship between guanidino acetic acid and metabolisable energy level of diets on performance of broiler chickens[J]. Italian Journal of Animal Science, 2014 , 13 (3) : 548 –556. |
| [19] | DILGER R N, BRYANT-ANGELONI K, PAYNE R L, et al. Dietary guanidino acetic acid is an efficacious replacement for arginine for young chicks[J]. Poultry Science, 2013 , 92 (1) : 171 –177. DOI: 10.3382/ps.2012-02425 |
| [20] | AYNSLEY-GREEN A, ALBERTI K G M M. In vivo stimulation of insulin secretion by guanidine derivatives in the rat[J]. Hormone and Metabolic Research, 1974 , 6 (2) : 115 –120. DOI: 10.1055/s-0028-1093873 |
| [21] | EF SA. Safety and efficacy of guanidinoacetic acid as feed additive for chickens for fattening[J]. The EFSA Journal, 2009 , 7 (3) . DOI: 10.2903/j.efsa.2009.988 |
| [22] | MEADOR C K, KREISBERG R A, FRIDAY J P, J r, et al. Muscle mass determination by isotopic dilution of creatine-14C[J]. Metabolism, 1968 , 17 (12) : 1104 –1108. DOI: 10.1016/0026-0495(68)90089-9 |
| [23] | 向丽华, 陈燕萍, 张智, 等. 24味有毒中药长期毒性实验对大鼠脏器指数的影响[J]. 中国中医基础医学杂志, 2006 , 12 (1) :35 –36. |
| [24] | STEAD L M, AU K P, JACOBS R L, et al. Methylation demand and homocysteine metabolism:effects of dietary provision of creatine and guanidinoacetate[J]. American Journal of Physiology:Endocrinology and Metabolism, 2001 , 281 (5) : E1095 –E1100. |
| [25] | SETOUE M, OHUCHI S, MORITA T, et al. Hyperhomocysteinemia induced by guanidinoacetic acid is effectively suppressed by choline and betaine in rats[J]. Bioscience,Biotechnology,and Biochemistry, 2008 , 72 (7) : 1696 –1703. DOI: 10.1271/bbb.70791 |
| [26] | OSTOJIC S M, NIESS B, STOJANOVIC M, et al. Co-administration of methyl donors along with guanidinoacetic acid reduces the incidence of hyperhomocysteinaemia compared with guanidinoacetic acid administration alone[J]. British Journal of Nutrition, 2013 , 110 (5) : 865 –870. DOI: 10.1017/S0007114512005879 |




