2. 青岛农业大学生命科学学院, 青岛 266109
2. College of Life Science, Qingdao Agricultural University, Qingdao 266109, China
刺参(Apostichopus japonicus)隶属于棘皮动物门(Echinodermata),海参纲(Holothuroidea),仿刺参属(Apostichopus),广泛分布在北纬35°~44°的亚洲沿岸,是典型的温带物种。刺参富含大量黏多糖、胶原蛋白,还有各种人体所需微量元素及维生素等,具有益智明目、补肾益精、延缓衰老、防止动脉硬化、抗肿瘤以及提高人体免疫力等作用,被列为海产品八珍之首。由于具有极高的营养保健、药用功能和经济价值,刺参需求量不断增加,使得刺参的养殖业迅速发展[1-2]。
随着刺参高密度养殖的快速发展及养殖水环境的不断恶化,养殖病害也频繁发生,病害已成为当前制约刺参养殖业健康持续发展的重要因素之一。刺参病害种类多、危害大、突发性强,以抗生素为主的防治措施又将引起细菌抗药性及药物残留等问题,对产品质量安全构成极大的隐患[3-4]。为了解决养殖病害和产品质量安全等诸多问题,研发绿色环保的抗生素替代品以及用于提高免疫力和抗病力的免疫增强剂等已成为刺参养殖病害防控的重点,也是目前研究的热点。
活性酵母制剂作为一种常用的益生素饲料添加剂,在反刍、畜禽和水产动物养殖中广泛应用。酵母菌含有极丰富的蛋白质,其发酵产品富含维生素、矿物质、消化酶、促生长因子以及肽、多种必需氨基酸和脂肪酸,是继动物蛋白质和植物蛋白质后的另一类重要蛋白质来源。这些特殊营养成分可刺激免疫系统的防御能力,减少肠内有毒物质的产生,对机体免疫功能具有促进作用[5-6]。目前有关活性酵母制剂对刺参生长、免疫力与抗病力影响的研究尚未见报道。鉴于此,本试验旨在探讨基于刺参饲料中添加不同水平的活性酵母制剂对刺参生长、免疫力和抗病力的影响,以期为活性酵母制剂在棘皮动物配合饲料中的应用提供科学依据。
1 材料与方法 1.1 材料试验在山东省海洋生物研究院种质资源研究中心鳌山卫实验室进行,试验时间为2015年10—11月。试验用刺参为山东省海洋生物研究院种质资源研究中心培育的健康苗种,初始体重为(4.0±0.1) g;商品配合饲料购自青岛朗格生物技术有限公司,其基本营养成分含量见表 1;活性酵母制剂(粉状)由广东溢多利生物科技股份有限公司提供,主要成分为活性酵母菌及其发酵产品,其活菌数为1.0×1010 CFU/g;攻毒试验所用灿烂弧菌(Vibrio splendidus)由山东省海水养殖病害防治重点实验室提供。
|
|
表 1 商品配合饲料基本营养成分含量(干物质基础) Table 1 Basic nutritional component contents of the commercial formula feed (DM basis) |
试验用刺参随机分为6组,每组设3个重复,每个重复15头刺参,以重复为单位饲养于45 cm×35 cm×30 cm的塑料整理箱中,养殖试验持续6周。以投喂商品配合饲料刺参组为对照组,在商品配合饲料中分别添加0.025%、0.050%、0.100%、0.200%、0.400%的活性酵母制剂,充分混匀后配制成5种试验饲料,分别投喂5组刺参作为试验组。每天16:00投喂饲料l次。试验期间,水体盐度30.2~31.4,pH 8.1±0.2,水温17~20 ℃,连续微量充气,每天全量换水1次,换水前后水温差小于0.5 ℃、盐度差小于0.5。
1.3 样品采集及分析测试方法试验开始前,停止投喂1 d,将每个整理箱内刺参取出称其湿体重,为初始体重,称重时用吸水纸吸干刺参体表水分,避免体表水分所引起的称量误差。6周的养殖试验结束后,停食1 d,然后对每个重复进行计数,称重(终末体重),以计算特定生长率(specific growth rate,SGR)。分别从每个整理箱中随机抽取5头刺参,取体腔液测定其免疫指标。体腔液超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、碱性磷酸酶(ACP)和溶菌酶(LZM)活性均采用南京建成生物工程研究所生产的试剂盒,利用分光光度计测定,其原理、测定方法及酶活性单位定义均参照试剂盒说明书。取样后的各组剩余刺参用于攻毒试验。
1.4 攻毒试验6周的养殖试验结束后进行攻毒试验。将灿烂弧菌用胰蛋白胨大豆肉汤(TSB)培养基28 ℃培养24 h,用无菌生理盐水稀释至1.5×109 CFU/mL(通过预试验得到半数致病量为1×108 CFU/mL),每头刺参通过体壁注射菌悬液0.1 mL。攻毒后各组刺参继续投喂养殖试验时对应的饲料。观察记录攻毒后14 d内刺参的发病情况,统计其累计死亡率。
1.5 计算公式刺参存活率(survival rate,SR)、特定生长率和累计死亡率计算公式如下:
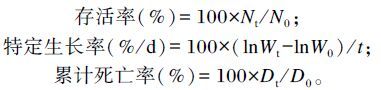
|
式中:N0和Nt分别为刺参初始头数和终末头数;W0和Wt分别为刺参初始体重和终末体重;t为试验天数;D0和Dt分别为攻毒过程中刺参初始头数和累积死亡头数。
1.6 数据统计与分析试验所得数据表示为平均值±标准误(n≥3),用单因素方差分析(one-way ANOVA)和Tukey’s检验进行差异显著性统计分析,以P<0.05作为差异的显著性水平。
2 结果与分析 2.1 饲料中添加活性酵母制剂对刺参生长的影响从表 2可以看出,经过6周的养殖试验,与对照组相比,5个试验组刺参特定生长率均显著高于对照组(P<0.05)。当饲料中活性酵母制剂添加量在0.025%~0.200%时,刺参特定生长率随着活性酵母制剂添加量的增加而升高,在添加量为0.200%时达到最高,为对照组的3.06倍;当活性酵母制剂添加量继续增加至0.400%时,刺参特定生长率稍有下降,为对照组的2.50倍。试验期间,试验组和对照组刺参的存活率均为100%。结果表明,饲料中添加活性酵母制剂能显著提高刺参特定生长率,有效促进刺参生长。
|
|
表 2 饲料中添加活性酵母制剂对刺参存活率及特定生长率的影响 Table 2 Effects of dietary active yeast products on survival rate and specific growth rate of sea cucumber (Apostichopus japonicas Selenka) (n=3) |
饲料中添加不同水平的活性酵母制剂,经6周饲养后,随机取样进行了刺参体腔液免疫指标的测定,结果见表 3。饲料中活性酵母制剂添加量为0.025%~0.200%时,刺参体腔液中SOD活性均有升高,但与对照组相比没有显著差异(P>0.05),当添加量为0.400%时,刺参体腔液中SOD活性最高,显著高于对照组(P<0.05);饲料中添加不同水平活性酵母制剂后,刺参体腔液中CAT活性均显著高于对照组(P<0.05),其中以0.400%活性酵母制剂组的CAT活性最高,达到3.67 U/mL,为对照组的1.96倍;当饲料中活性酵母制剂添加量为0.025%~0.100%时,刺参体腔液中ACP的活性呈现不同程度的升高,但与对照组相比没有显著差异(P>0.05),而当添加量为0.200%~0.400%时,刺参体腔液中ACP活性显著高于对照组(P<0.05),其中以0.400%活性酵母制剂组的ACP活性最高,为1.04 U/dL;饲料中活性酵母制剂添加量为0.025%时,刺参体腔液中LZM活性与对照组相比没有显著差异(P>0.05),当添加量为0.050%~0.400%时,刺参体腔液中LZM活性显著高于对照组(P<0.05),其中以0.400%活性酵母制剂组的LZM活性最高,达到0.50 μg/mL。结果表明,饲料中添加0.025%~0.400%活性酵母制剂能不同程度地提高刺参体腔液中SOD、CAT、ACP和LZM活性。
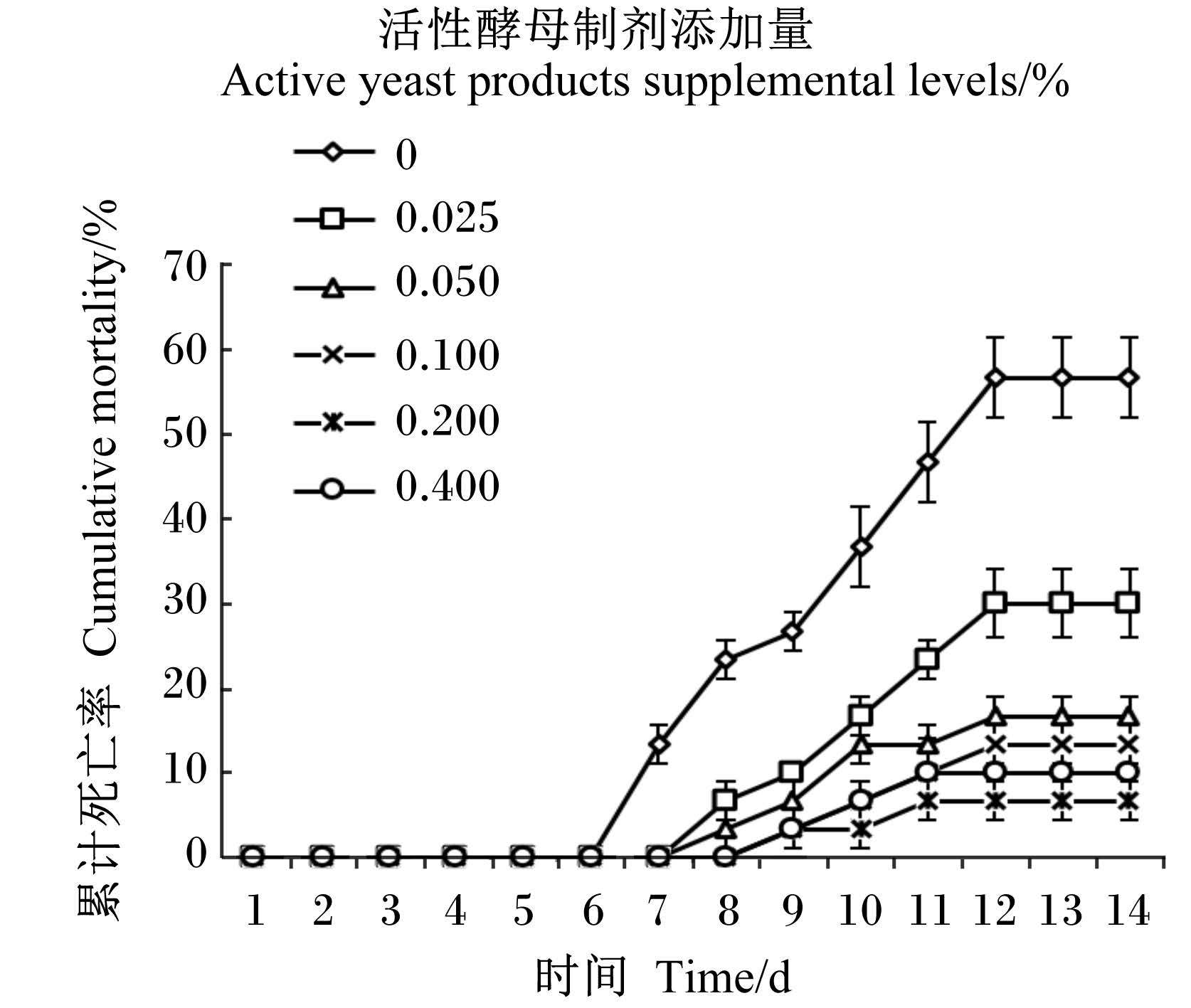
2.3 饲料中添加活性酵母制剂对刺参抗病力的影响刺参经灿烂弧菌人工攻毒4 d后,对照组刺参开始出现不同程度的发病症状,从表观症状观察发现,刺参活力呈现明显下降,身体萎缩,口围肿胀,且有个别刺参出现了排脏现象;攻毒5 d后,发病刺参腹部出现小面积溃疡,至第7天时,发病刺参溃疡处增多,表皮大面积腐烂,并伴有大量黏液,最后死亡。各试验组刺参均比对照组刺参出现病症时间晚,且发病的个体数量少。经灿烂弧菌人工攻毒8 d后,0.025%活性酵母制剂组才开始出现刺参死亡。随后,各组死亡刺参数逐日增加。攻毒14 d后,对照组刺参累计死亡率高达56.67%,明显高于各试验组;5个试验组中,以活性酵母制剂添加量为0.025%时刺参累计死亡率最高,为30.00%;以活性酵母制剂添加量为0.200%时刺参累计死亡率最低,为6.67%(图 1)。由此可知,饲料中添加活性酵母制剂能有效增强刺参抗灿烂弧菌感染能力,降低发病率,减少死亡率。
|
|
表 3 饲料中添加活性酵母制剂对刺参体腔液免疫指标的影响 Table 3 Effects of dietary active yeast products on immune indices in coelomic fluid of sea cucumber (Apostichopus japonicas Selenka) (n=3) |
|
图 1 灿烂弧菌人工攻毒14 d后刺参的累计死亡率 Figure 1 Cumulative mortality of sea cucumber (Apostichopus japonicas Selenka) challenged with Vibrio splendidus after 14 days (n=3) |
酵母细胞中含有丰富的蛋白质、有机物和矿物质等,其中含有16种氨基酸、14种矿物质、17种维生素(不包括维生素A、维生素C、维生素E)以及硒、铁、锌、铬等其他微量元素。酵母细胞壁的主要组成成分是糖类,其含量为35%~60%,其中最主要的是酵母多糖,即甘露寡聚糖和葡聚糖;同时,酵母细胞中还包含有多种色素和未知的生长活性因子,是养殖动物的一种很好的营养源[7]。众多研究表明,酵母生物饲料能有效促进水产动物生长,在饲料中添加酵母培养物能够显著提高草鱼[8]、牙鲆[9]、鱼[10]、异育银鲫[11]、凡纳滨对虾[12]等水产动物的特定生长率,并显著降低饲料系数。张琴等[13]研究发现,饲料中添加酵母硒可显著提高刺参的特定生长率;陈昌福等[14]用添加不同水平活性干酵母的饲料饲喂中华绒螯蟹,结果发现添加活性干酵母对中华绒螯蟹的生长有明显促进作用。本试验结果表明,饲料中添加0.025%~0.400%活性酵母制剂能显著提高刺参的特定生长率,有效促进刺参生长,其原因可能为:活性酵母制剂富含各种营养物质以及多种未知的生长活性因子,为刺参的生长发育提供了较为全面的营养物质;同时,活性酵母菌制剂具有较强的淀粉酶、蛋白酶和脂肪酶活性,可促进机体对营养物质的消化吸收[15];此外,酵母作为活菌前体进入胃肠道后,与肠道内有益菌群共生,并与病原微生物竞争氧气、营养等物质,排斥病原菌在肠道黏膜表面的附着,抑制病原微生物的吸附作用,降低病原菌对肠道的损害,维持肠道健康,更有利于生长,并有效抵御了病原微生物,减少病害发生[16]。
3.2 饲料中添加活性酵母制剂对刺参免疫力的影响刺参除了细胞免疫外还有着多种对抗外界病原及异物的体液免疫,由于刺参只具有非特异性免疫,因此这些免疫指标在刺参体液免疫中起着不可替代的重要作用。CAT和SOD都是生物体清除活性氧、免受细胞氧化伤害的主要抗氧化酶类,在防御机体衰老和生物分子损伤等方面有着极为重要的作用[17]。本试验结果发现,饲料中添加0.025%~0.400%活性酵母制剂后,刺参体腔液中CAT活性显著高于对照组,SOD活性在添加量为0.400%时与对照组有显著差异,说明饲料中添加活性酵母制剂能提高刺参机体的抗氧化能力。ACP是动物体内巨噬细胞溶酶体的标志酶,在酸性条件下,ACP可通过水解作用来破坏掉表面带有磷酸酯的异物,并能修饰或改变细菌等外来异物的表面分子结构组成等,从而加快对异物的吞噬和清除速度,在刺参抵抗疾病、免疫应答及细胞损伤与修复过程中具有一定的生物学意义[18]。本研究中,试验组体腔液中ACP活性均高于对照组,在添加量为0.200%~0.400%时与对照组有显著差异,表明饲料中添加适量的活性酵母制剂能促进刺参对生物磷的代谢能力,从而影响并促进刺参的生长,这与活性酵母制剂能提高刺参特定生长率的结果呈正相关;同时,体腔液中ACP活性的升高也代表了刺参吞噬细胞清除异物能力的提高,即刺参免疫力的提高和抗病力的增强。LZM是一种碱性蛋白酶,广泛存在于生物体各组织和体液中,它通过溶解细菌或作为一种调理素而起到抗菌效果,是无脊椎动物非特异性免疫的主要成分之一[19]。刘宗英[20]研究发现,在中华鳖幼鳖饲料中添加高活性干酵母能提高其血清中LZM的活性;温俊[9]研究表明,饲料中添加复合益生菌与酵母培养物能提高牙鲆血清中LZM的活性。本试验结果发现,饲料中添加0.025%~0.400%活性酵母制剂亦能提高刺参体腔液中LZM的活性,当添加量在0.050%~0.400%时,体腔液中LZM活性均显著高于对照组,这与上述学者的研究结果相一致。
由此可知,饲料中添加活性酵母制剂能有效提高刺参的非特异性免疫力,这可能与活性酵母制剂中含有的β-葡聚糖、甘露寡聚糖等有关。β-葡聚糖能够直接结合并激活巨噬细胞,提高巨噬细胞的吞噬作用,增加细胞因子的释放等。甘露寡聚糖能对病原微生物进行识别、黏附和排除,干扰有害细菌在肠道内定植,减少肠道细菌病,还可有效增加细胞因子的释放,并对毒素具有明显的吸附作用[21]。饲料中添加β-葡聚糖和甘露寡聚糖能有效提高水产动物机体免疫力,从而提高水产动物的抗病力[22-26]。
3.3 饲料中添加活性酵母制剂对刺参抗病力的影响研究表明,酵母源生物饲料对提高水产动物抗病力有十分积极的意义[21, 27]。刘宗英[20]研究发现,饲料中添加高活性干酵母能有效提高中华鳖和中华绒螯蟹的抗病力;陈昌福等[14]亦发现,活性干酵母对中华绒螯蟹的抗病力有增强作用;温俊[9]研究表明,饲料中添加复合益生菌与酵母培养物能提高牙鲆抗病力。通过人工感染病原体的方式检测供试动物对疾病的抵抗力是常用方法,灿烂弧菌是刺参腐皮综合征的致病菌,对刺参养殖危害严重[3]。灿烂弧菌攻毒试验结果表明,饲料中添加活性酵母制剂能明显降低刺参的累计死亡率,表明活性酵母制剂能有效提高刺参抗灿烂弧菌感染能力,这与刺参的非特异性免疫指标有着相似的规律。因此,可以认为刺参摄食活性酵母制剂后通过提高机体的非特异性免疫力,从而增强抵抗病原菌感染的能力。本试验中,以活性酵母制剂添加量为0.200%时刺参累计死亡率最低,仅为6.67%。
4 结 论综上所述,饲料中添加活性酵母制剂可提高刺参的特定生长率,提高刺参体腔液中LZM、SOD、CAT和ACP活性,有效提高刺参的免疫力和抗病力,这说明活性酵母制剂可以作为一种安全高效的饲料添加剂应用于刺参养殖。综合分析刺参的生长、免疫力和抗病力等情况,在刺参养殖过程中,饲料中活性酵母制剂的适宜添加量为0.200%~0.400%。
| [1] | 李成林, 宋爱环, 胡炜, 等. 山东省刺参养殖产业现状分析与可持续发展对策[J]. 渔业科学进展, 2010 , 31 (4) :126 –133. |
| [2] | 王吉桥, 田相利. 刺参养殖生物学新进展[M]. 北京: 海洋出版社, 2012 : 3 -13. |
| [3] | 王印庚, 荣小军, 廖梅杰, 等. 刺参健康养殖与病害防控技术丛解[M]. 北京: 中国农业出版社, 2014 : 1 -2. |
| [4] | 杨红生, 周毅, 张涛. 刺参生物学——理论与实践[M]. 北京: 科学出版社, 2014 : 8 -9. |
| [5] | 胡友军, 林映才, 郑黎, 等. 活性酵母对早期断奶仔猪生产性能和免疫机能的影响[J]. 动物营养学报, 2003 , 15 (4) :49 –53. |
| [6] | 王玲, 蒲万霞, 扎西英派, 等. 活性酵母制剂对早期断乳仔猪腹泻率、生产性能和肠道pH值的研究[J]. 中国兽药杂志, 2008 , 42 (9) :1 –5. |
| [7] | 南瑞青.活性酵母与支链淀粉对犊牛生长发育及血液生理生化指标影响的研究[D].硕士学位论文.太谷:山西农业大学,2013. http://cdmd.cnki.com.cn/Article/CDMD-10113-1013378899.htm |
| [8] | 邱燕.三种微生态制剂对草鱼(Ctenopharyngodon idellus)生长性能、生理机能及肠道黏膜的影响[D].硕士学位论文.苏州:苏州大学,2010. http://cdmd.cnki.com.cn/Article/CDMD-10285-2010168900.htm |
| [9] | 温俊.复合益生菌与酵母培养物对牙鲆(Paralichthys olivaceus)生长、免疫及抗病力的影响[D].硕士学位论文.青岛:中国海洋大学,2007. http://cdmd.cnki.com.cn/Article/CDMD-10423-1014203820.htm |
| [10] | ROBINETTE H R, YOUNG C, 孟 繁伊. 酵母培养物对斑点叉尾幼鱼生长性能的影响[J]. 饲料工业, 2011 , 32 (6) : 25 –27. |
| [11] | 徐磊, 刘波, 谢骏, 等. 酵母培养物对异育银鲫生长、血液生化及免疫的影响[J]. 江苏农业科学, 2010 (6) :371 –374. |
| [12] | 粟雄高, 李小勤, 冷向军, 等. 酵母培养物和芽孢杆菌对凡纳滨对虾生长、蛋白酶活性和免疫性能的影响[J]. 海洋渔业, 2012 , 34 (2) :168 –176. |
| [13] | 张琴, 麦康森, 张文兵, 等. 饲料中添加硒酵母和维生素E对刺参生长、免疫力及抗病力的影响[J]. 动物营养学报, 2011 , 23 (10) :1745 –1755. |
| [14] | 陈昌福, 姚鹃, 肖志猛, 等. 高活性干酵母对中华绒螯蟹生长和抗病力的影响[J]. 长江大学学报:自然科学版, 2005 , 2 (5) :24 –26. |
| [15] | 廖灿青, 陈中平, 王健林, 等. 活性酵母及其培养物对仔猪生产性能和免疫功能的影响[J]. 中国饲料, 2015 (13) :42 –43. |
| [16] | 白晓婷. 酵母类产品在饲料中的研究与应用[J]. 中国饲料, 2005 (2) :8 –10. |
| [17] | 王吉桥, 王志香, 张凯, 等. 饲料中添加蛋氨酸硒对仿刺参幼参存活、生长及免疫指标的影响[J]. 大连海洋大学学报, 2012 , 27 (2) :110 –115. |
| [18] | 秦搏, 陈四清, 常青, 等. 饲料中添加纤维素酶对幼刺参生长性能、消化能力和非特异性免疫力的影响[J]. 动物营养学报, 2014 , 26 (9) :2698 –2705. |
| [19] | 宋坚, 何舟, 程龙, 等. 饲料添加苜蓿草粉对刺参幼参生长、体成分及免疫酶的影响[J]. 草业学报, 2015 , 24 (2) :208 –214. |
| [20] | 刘宗英.高活性干酵母对水产动物非特异性免疫功能和抗病力的影响[D].硕士学位论文.武汉:华中农业大学,2005. http://cdmd.cnki.com.cn/Article/CDMD-10504-2006190925.htm |
| [21] | 许合金, 冯幼, 刘定, 等. β-葡聚糖及其在对虾生产中的应用[J]. 饲料博览, 2013 (3) :28 –31. |
| [22] | 冯幼, 钟文彪, 许合金, 等. 甘露寡糖在水产动物生产中的应用[J]. 饲料博览, 2013 (5) :51 –54. |
| [23] | YU H H, HAN F, XUE M, et al. Efficacy and tolerance of yeast cell wall as an immunostimulant in the diet of Japanese seabass (Lateolabrax japonicus)[J]. Aquaculture, 2014 , 432 : 217 –224. DOI: 10.1016/j.aquaculture.2014.04.043 |
| [24] | MESHRAM S J, MURTHY H S, ALI H, et al. Effect of dietary β-glucan on immune response and disease resistance against Aeromonas hydrophila in giant freshwater prawn,Macrobrachium rosenbergii (de Man.1879)[J]. Aquaculture International, 2015 , 23 (2) : 439 –447. DOI: 10.1007/s10499-014-9824-0 |
| [25] | TORRECILLAS S, MAKOL A, CABALLERO M J, et al. Effects on mortality and stress response in European sea bass,Dicentrarchus labrax (L.),fed mannan oligosaccharides (MOS) after Vibrio anguillarum exposure[J]. Journal of Fish Diseases, 2012 , 35 (8) : 591 –602. DOI: 10.1111/jfd.2012.35.issue-8 |
| [26] | 聂琴, 杨凡, 易建华, 等. 酵母源生物饲料在水产养殖中的应用[J]. 中国饲料, 2015 (15) :35 –40. |
| [27] | 郁欢欢, 周文豪, 曾虹, 等. 酵母培养物在水产动物中的应用及作用机理研究进展[J]. 饲料工业, 2015 , 36 (18) :25 –29. |




