2. 中国农业科学院畜牧研究所, 北京 100193
2. Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
反刍动物瘤胃中含有大量的原虫,原虫在反刍动物的发酵过程中具有重要的作用。原虫通过将淀粉与可溶性糖同化,以聚糊精的形式储存起来,从而降低瘤胃中纤维素的含量,达到稳定pH的作用[1]。同时原虫还能抑制氢气和氨态氮的产生。因此,选择科学、有效的饲料添加剂改变瘤胃原虫区系进而调控瘤胃发酵是提高奶牛饲料转化率,改善乳品质的重要环节。
茶皂素,又称茶皂苷,是一种从茶树种子(茶籽、茶叶籽)中提取的五环三萜类糖甙化合物,由7种配基、4种糖体和2种有机羧酸组成[1]。茶皂素既是天然的表面活性剂,也是天然的反刍动物瘤胃发酵调控剂,有研究表明,茶皂素可以改善反刍动物生产性能[2]。王洪荣等[3]研究报道,在山羊饲粮中添加茶皂素和丝兰皂苷混合物可降低瘤胃液原虫数量、pH及乙酸/丙酸。Zhou[4]研究表明,反刍动物饲粮中添加茶皂素,对瘤胃中总挥发性脂肪酸(TVFA)产量没有显著变化,但是可显著降低甲烷产量。来海良等[5]研究报道,在奶牛饲粮中添加茶皂素可降低原虫的存活率。Hu等[6]通过体外试验表明,在30 mL发酵液中添加8 mg茶皂素,瘤胃中原虫数量减少了79%。严淑红等[7]发现添加20、30、40 g/(头·d)茶皂素组与对照组相比均显著降低了瘤胃中原虫数量,并且随着茶皂素添加水平的增加,瘤胃中原虫数量呈线性和二次降低。目前对茶皂素抑制原虫增殖的报道较多[8-9],但是对其所抑制原虫的种类报道较少,本文将通过聚丙烯酰氨凝胶电泳(DGGE)技术结合18S rDNA序列分析研究茶皂素对奶牛瘤胃原虫区系的影响,揭示茶皂素在瘤胃发酵中作用机制,为茶皂素在奶牛养殖中的应用提供理论依据。
1 材料与方法 1.1 试验材料茶皂素购自浙江东方茶叶有限公司常山分公司,主要活性成分为五环三萜皂甙,其皂甙含量为60.2%,其他成分含量如下:粗蛋白质5.5%,粗纤维26.2%,水分4.1%、粗灰分4.0%,pH为5.0~6.5。
1.2 试验动物与管理本研究于2014年8月至2014年9月在北京三元绿荷奶牛养殖中心南口二分场进行。试验选取12头健康荷斯坦奶牛[体重(550±30) kg,产奶量35 kg/(头·d),胎次2~4],按产奶量、胎次、泌乳期等相近原则随机分为4组,每组3头。试验期间,基础饲粮参考牛场的全混合日粮(TMR)饲喂方案,日饲喂和挤奶各3次(07:30、14:30、21:30),自由运动和饮水。基础饲粮组成及营养水平表见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
各组均饲喂基础饲粮。由于茶皂素适口性差,试验牛不能固定采食,因此选择每天晨饲前口腔灌服茶皂素。预先将20、30、40 g茶皂素分别溶于200 mL水中。各组分别于晨饲前通过口腔灌服0(对照)、20、30、40 g/(头·d)茶皂素。整个试验期共49 d,其中预试期14 d,正试期35 d,每天记录产奶量,正试期内每7 d采集奶样并于晨饲前1 h采集瘤胃液。
1.4 样品采集和测定 1.4.1 乳样采集和测定正试期内每7 d采集奶样,按4:3:3将早、中、晚采集的乳样混匀,送至北京三元奶牛中心,采用LACTOSCAN型全自动超声波乳成分分析仪测定乳成分。
1.4.2 瘤胃液的采集正试期内每7 d晨饲前1 h用口腔采样器采集瘤胃液,过4层纱布过滤后将瘤胃液存入液氮中用于瘤胃发酵指标及瘤胃原虫区系的测定。
1.4.3 瘤胃微生物总DNA的提取采用珠磨-十六烷基三甲基溴化铵(CTAB)法提取瘤胃微生物总DNA[9],取1.5 mL瘤胃液1 000×g离心弃上清液,加入800 μL CTAB和灭菌锆珠(0.3 g 0.1 mm和0.1 g 0.5 mm)后置于珠磨仪上破碎2 min,70 ℃水浴20 min后13 000×g离心10 min,取500 μL上清液与500 μL饱和酚/氯仿/异戊醇(25:24:1)混合后13 000×g离心10 min,取300 μL上清液与280 μL异丙醇混匀后室温静置5 min沉淀DNA,离心后用TE缓冲液溶解DNA,用微量紫外可见分光光度计测定提取的总DNA浓度和纯度,-20 ℃保存。
1.4.4 瘤胃原虫PCR以瘤胃微生物总DNA为模板,利用一对原虫通用引物GC-1617R(带GC夹子)和1320F扩增原虫。引物GC-1617R序列为:5'-CGCCCGCCGCGCCCCGCGCCCGGCCCGCCCCCGCCCGGGGCCAATTGCAAAGATCTATCC-3'(灰底标注为GC夹子)和引物1320F序列为:5'-GGTGGTGCATGGCCG-3'[10]。引物由生工生物工程(上海)股份有限公司合成。
PCR反应体系为50 μL,包括25 μL Premix TaqTM(Ex TaqTM Version 2.0),GC-1617R、1320F各1 μL,模板DNA 1 μL,灭菌双蒸水22 μL。PCR程序:94 ℃预变性4 min;94 ℃变性 30 s,62 ℃退火30 s,72 ℃ 30 s,40个循环;72 ℃ 延伸5 min[11]。用1.5%琼脂糖凝胶电泳检测PCR产物。
1.4.5 瘤胃原虫的DGGE对瘤胃原虫PCR产物进行DGGE分析。DGGE使用8%的丙烯酰胺凝胶,变性梯度(甲酰胺和尿素)为30%~50%;电泳条件为80 V 15 h。电泳结束后,进行GelGreen染色,用凝胶成像仪观察并拍照。
1.4.6 DNA回收及克隆测序从DGGE图谱中选择特异条带切胶后采用煮沸法回收DNA[12]。利用不带GC夹子的引物1617R和1320F进行PCR扩增,扩增产物用TaKaRa MiniBEST Agarose Gel DNA试剂盒纯化后,插入PMD-18T载体并转化入大肠杆菌(E.coli)JM109。挑取阳性克隆经生工生物工程(北京)股份有限公司进行测序,测序所得结果与GenBank中KGHL、KI和RDP数据库的序列进行比对。
1.5 数据统计与分析运用Quantity One软件分析DGGE图谱,采用非加权算术平均法(unweighted pair group method with averaging alogorithm,UPGMA)进行聚类分析。多样性指数计算公式如下:
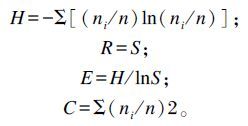
|
式中:H为香农指数(Shannon index);ni为条带i的峰密度值,n为泳道中所有条带的峰密度值之和;R为丰富度指数(richness index);S为总条带数;E为均一性指数(evenness index);C为优势度指数(dominance index)。
使用MEGE 5.10软件制作序列系统发育树,用Excel软件整理试验数据,使用SPSS 17.0软件的one-way ANOVE程序进行单因素方差分析,使用Duncan氏法进行平均值的多重比较,P<0.05为差异显著性判定标准。
2 结 果 2.1 茶皂素对奶牛产奶量和乳成分的影响由表 2可见,20、30 g/(头·d)茶皂素组与对照组相比,产奶量和乳脂校正乳产量均没有显著差异(P>0.05);40 g/(头·d)茶皂素组与对照组相比,显著降低了产奶量和乳脂校正乳产量(P<0.05);随着茶皂素添加水平的增加,产奶量和乳脂校正乳产量呈二次变化,即呈先增加后减少的趋势,其中30 g/(头·d)茶皂素组与对照组相比,产奶量和乳脂校正乳产量分别提高了4.47%和9.63%。20、30、40 g/(头·d)茶皂素组与对照组相比,乳蛋白率、乳脂率、乳尿素氮含量和乳体细胞数均没有显著变化(P>0.05);随着茶皂素添加水平的增加乳脂率呈线性增加(P=0.041)、乳体细胞数呈线性降低(P=0.045);与对照组相比,20、30、40 g/(头·d)茶皂素组的乳脂率分别升高了2.69%、9.43%、12.46%,乳尿素氮含量分别降低了10.65%、5.35%、2.41%,30 g/(头·d)茶皂素组的乳体细胞数降低了7.99%;20、30、40 g/(头·d)茶皂素组与对照组相比乳糖率均显著降低(P>0.05),且随着添加水平的增加,降低程度加大。
|
|
表 2 茶皂素对奶牛产奶量和乳成分的影响 Table 2 Effects of tea saponin on milk yield and milk composition of dairy cows |
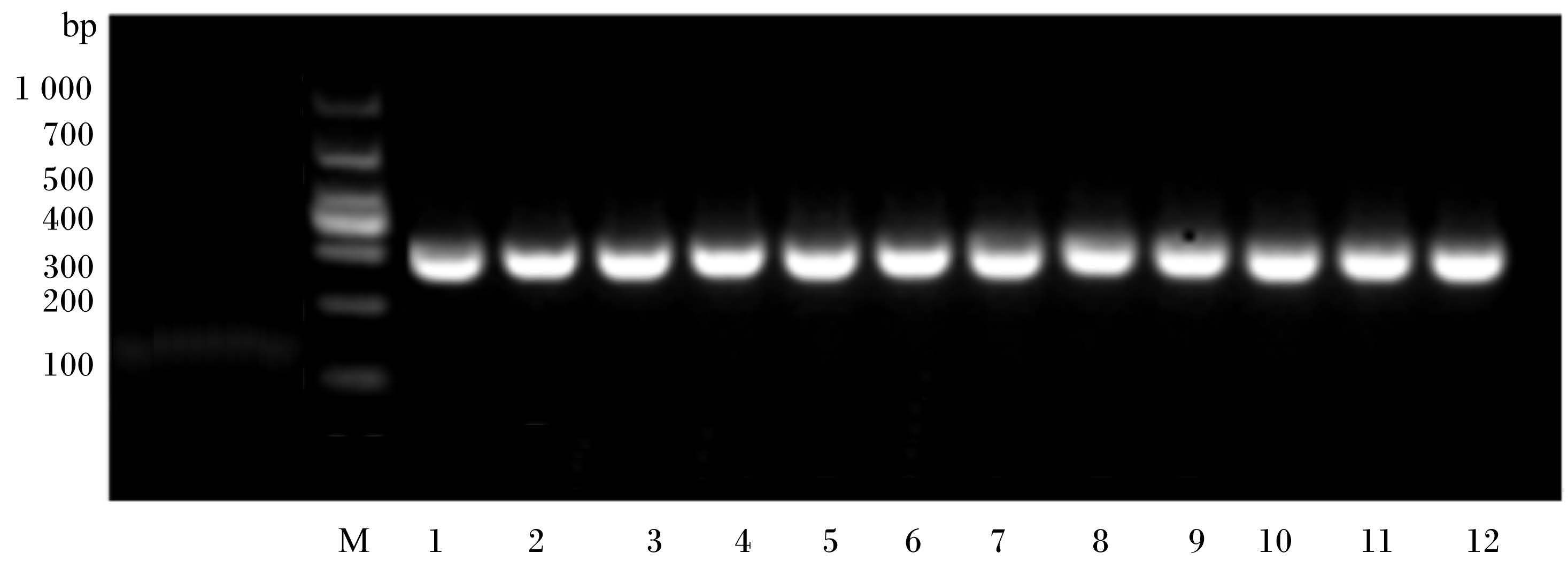
奶牛瘤胃原虫18S rDNA的PCR产物经凝胶电泳检测后所得的电泳图谱如图 1所示。由图可见,扩增条带唯一,大小在290 bp左右,与引物设计片段大小一致。
|
M:DNA分子质量标准;1、2、3:对照组;4、5、6:20 g/(头·d)茶皂素组;7、8、9:30 g/(头·d)茶皂素组;10、11、12:40 g/(头·d)茶皂素组。 M: DNA molecular weight marker,lanes 1,2 and 3: control group; lanes 4,5 and 6: 20 g/(head·d) tea saponin group; lanes 7,8 and 9: 30 g/(head·d) tea saponin group; lanes 10,11 and 12: 40 g/(head·d) tea saponin group. 图 1 瘤胃原虫的PCR扩增产物电泳图谱 Figure 1 Electrophoresis figure of PCR amplification products of rumen protozoa |
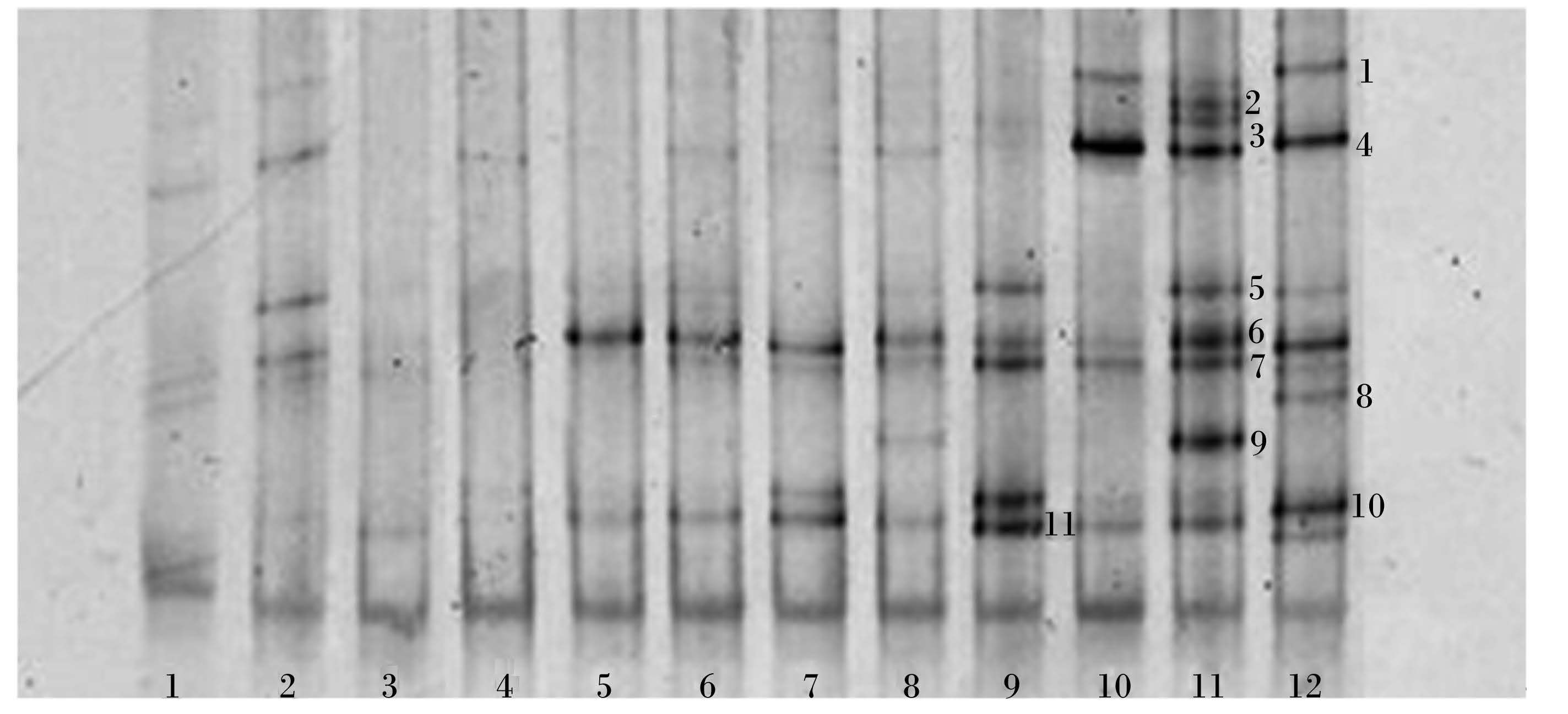
奶牛瘤胃原虫区系18S rDNA的DGGE图谱如图 2所示。由图可见,20、30、40 g/(头·d)茶皂素组的条带数均少于对照组。在DGGE图谱上从上至下将优势条带编号(1~11),部分优势条带在20、30、40 g/(头·d)茶皂素组丰度减弱或者消失。从瘤胃原虫DGGE图谱中显示原有部分优势条带变弱或消失,说明添加茶皂素可以选择性地抑制瘤胃中原虫的生长。
|
1、2、3:40 g/(头·d)茶皂素组;4、5、6:30 g/(头·d)茶皂素组;7、8、9:20 g/(头·d)茶皂素组;10、11、12:为对照组。下图同。 Lanes 1,2 and 3: 40 g/(head·d) tea saponin group; lanes 4,5 and 6: 30 g/(head·d) tea saponin group; lanes 7,8 and 9: 20 g/(head·d) tea saponin group; lanes 10,11 and 12: control group. The same as below. 图 2 瘤胃原虫DGGE图谱 Figure 2 DGGE electrophoresis figure of rumen protozoa |
根据瘤胃原虫DGGE图谱分析所得的结果进一步分析香农多样性指数、丰富度指数、均一性指数、优势度指数,结果如表 3所示。由表可见,30、40 g/(头·d)茶皂素组的丰富度指数和香农多样性指数都显著低于对照组(P<0.05);20 g/(头·d)茶皂素组的丰富度指数和香农多样性指数都低于对照组,但未达到显著差异(P>0.05);随着茶皂素添加水平的增加,香农指数(P=0.003)和丰富度指数(P=0.012)均呈线性降低,丰富度指数同时呈二次降低(P=0.016);30、40 g/(头·d)茶皂素组的优势度指数显著高于对照组(P<0.05),20 g/(头·d)茶皂素组的优势度指数低于对照组,但未达到显著差异(P>0.05);随着茶皂素添加水平的增加,优势度指数呈线性增加(P=0.042);20、30、40 g/(头·d)茶皂素组的均一性指数与对照组相比差异不显著(P>0.05)。
|
|
表 3 茶皂素对奶牛瘤胃原虫多样性指数的影响 Table 3 Effects of tea saponin on rumen protozoa diversity indexes of dairy cows |
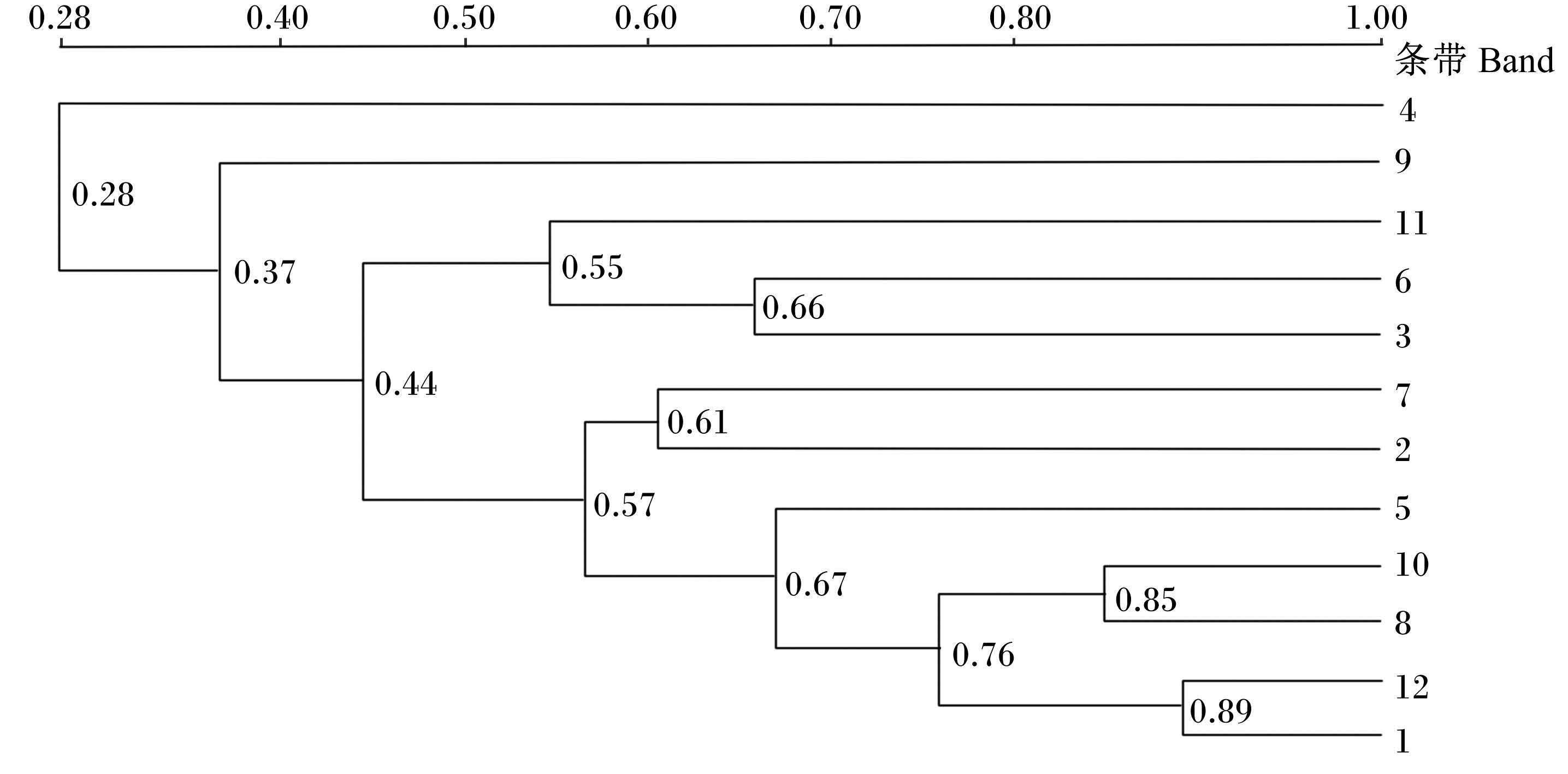
奶牛瘤胃原虫DGGE图谱的相似性指数如图 3所示。由图可见,不同添加水平茶皂素组的瘤胃原虫区系的相似性指数在0.28~0.89,个体间差异相对较大。
|
图 3 瘤胃原虫区系相似性指数 Figure 3 Similarity index of rumen protozoa flora |
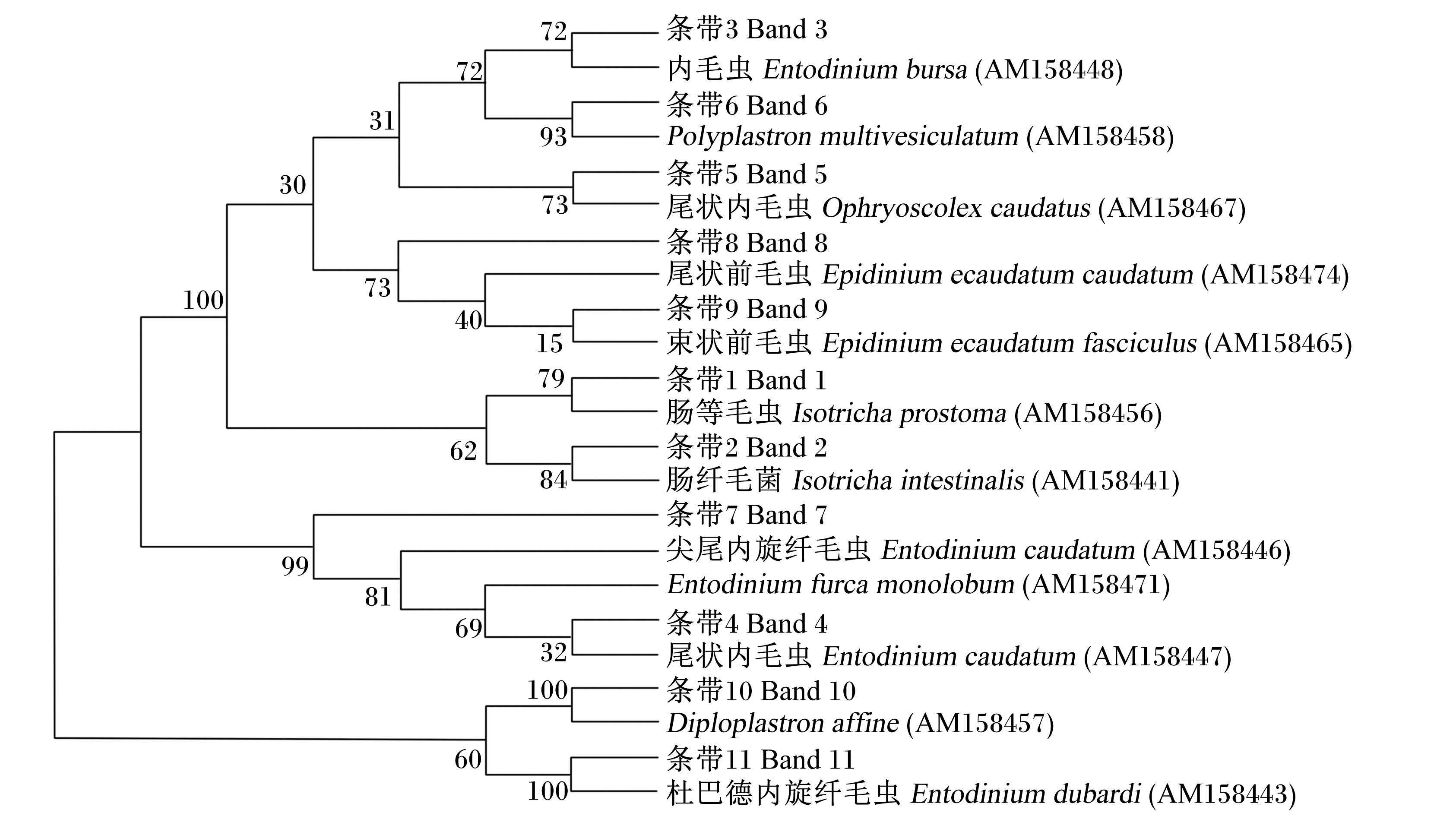
从奶牛瘤胃原虫DGGE电泳中割胶回收的1~11号条带经连接、克隆和测序后,所获得18S rDNA序列进行Blast比对所得结果如表 4所示。由表可见,经测序后所得的序列提交GenBank收录,所得登录号为KU355836~KU355846。使用MEGA 5.10软件将已知原虫序列和克隆的序列进行系统发育进化树分析,结果如图 4所示。由序列比对结果和系统发育进化树可以看出,饲粮中添加茶皂素主要影响前庭亚纲内毛目的原虫。
|
|
表 4 茶皂素对瘤胃原虫DGGE差异条带序列比对结果 Table 4 Effcets of tea saponin on rumen protozoa DGGE differential band sequence alignment results |
|
图 4 瘤胃原虫区系相似性指数 Figure 4 Similarity index of rumen protozoa flora |
严淑红等[7]研究表明,添加不同水平的茶皂素显著降低了瘤胃液pH、氨态氮的浓度,但均未超过正常范围值,且显著提高了微生物蛋白、丙酸和丁酸浓度,但对TVFA和乙酸浓度的影响不显著。
本研究运用DGGE技术结合18S rDNA序列分析技术研究添加茶皂素后奶牛瘤胃原虫的多样性和组成结构的变化。运用DGGE结合18S rDNA序列分析技术主要是因为DGGE存在一定的局限性,但是如果能够与基因克隆、序列分析等方法有效结合则可以获取更完整的信息。有研究表明,添加茶皂素能够降低瘤胃内原虫的数量[13-15]。本研究结果表明,添加茶皂素可以选择性地抑制瘤胃中部分原虫的生长,由序列对比可知,茶皂素主要影响的是前庭亚纲内毛目原虫,可能因为DGGE只能检测优势原虫,所以有很多原虫都没有在图谱中表示出来。进一步分析奶牛瘤胃原虫多样性指数,发现茶皂素对其影响显著,说明茶皂素不仅对瘤胃原虫数量有影响,而且也影响原虫区系的多样性,这可能是因为茶皂素影响了瘤胃细菌的多样性,而细菌和原虫又存在互作作用[16],最终影响了瘤胃原虫的多样性。Wallace等[14]研究表明,茶皂素可以通过与瘤胃原虫表面的胆固醇复合,来杀死瘤胃原虫,所以可能是因为瘤胃原虫表面胆固醇的组成成分不一样,导致茶皂素只能与部分原虫结合,最终改变了瘤胃原虫的多样性。该结果与很多学者的研究结果相似,如陈旭伟[17]研究表明,体外瘤胃发酵中添加不同水平的茶皂素能够抑制瘤胃原虫的生长,并且原虫的种属比例也发生相应变化,其中双毛虫的比例上升而内毛虫的比例下降,添加0.6%的茶皂素与对照组相比差异极显著;与周奕毅[18]的研究结果也相似。
4 结 论饲粮中添加30、40 g/(头·d)茶皂素均可抑制奶牛瘤胃原虫的生长,并且降低瘤胃原虫的多样性。
| [1] | JOHNSON K, HUYLER M, WESTBERG H, et al. Measurement of methane emissions from ruminant livestock using a sulfur hexafluoride tracer technique[J]. Environmental Science & Technology, 1994 , 28 (2) : 359 –362. |
| [2] | WANG J K, YE J A, LIU J X. Effects of tea saponins on rumen microbiota,rumen fermentation,methane production and growth performance-a review[J]. Tropical Animal Health and Production, 2012 , 44 (4) : 697 –706. DOI: 10.1007/s11250-011-9960-8 |
| [3] | 王洪荣, 陈旭伟, 王梦芝. 茶皂素和丝兰皂苷对山羊人工瘤胃发酵和瘤胃微生物的影响[J]. 中国农业科学, 2011 , 44 (8) :1710 –1719. |
| [4] | ZHOU Y Y, MAO H L, JIANG F, et al. Inhibition of rumen methanogenesis by tea saponins with reference to fermentation pattern and microbial communities in Hu sheep[J]. Animal Feed Science and Technology, 2011 , 166-167 : 93 –100. DOI: 10.1016/j.anifeedsci.2011.04.007 |
| [5] | 来海良, 王一义. 茶皂素对湖羊瘤胃培养物发酵的影响[J]. 现代农业科技, 2010 (23) :300,302 . |
| [6] | HU W L, LIU J X, YE J A, et al. Effect of tea saponin on rumen fermentation in vitro[J]. Animal Feed Science and Technology, 2005 , 120 (3/4) : 333 –339. |
| [7] | 严淑红, 赵士萍, 蒋琦晖, 等. 茶皂素对奶牛瘤胃发酵及瘤胃微生物区系的影响[J]. 动物营养学报, 2016 , 28 (8) :2485 –2496. |
| [8] | 苑文珠, 叶均安, 刘建新. 瘤胃原虫对反刍动物的影响[J]. 饲料博览, 2002 (1) :17 –18. |
| [9] | 郭嫣秋.瘤胃产甲烷菌定量检测与微生物菌群调控研究[D].博士学位论文.杭州:浙江大学,2008. http://cdmd.cnki.com.cn/Article/CDMD-10335-2010144109.htm |
| [10] | SYLVESTER J T, KARNATI S K R, YU Z T, et al. Development of an assay to quantify rumen ciliate protozoal biomass in cows using real-time PCR[J]. The Journal of Nutrition, 2005 , 134 (12) : 3378 –3384. |
| [11] | SYLVESTER J T, KARNATI S K R, YU Z, et al. Evaluation of a real-time PCR assay quantifying the ruminal pool size and duodenal flow of protozoal nitrogen[J]. Journal of Dairy Science, 2005 , 88 (6) : 2083 –2095. DOI: 10.3168/jds.S0022-0302(05)72885-X |
| [12] | 陈亮明, 张冬林, 李志辉, 等. PAGE银染和条带回收方法的改进[J]. 中南林业科技大学学报, 2007 , 27 (6) :163 –165. |
| [13] | 郭兴凤, 阮丽红, 谈天. 茶皂苷对大豆蛋白发泡能力影响研究[J]. 河南工业大学学报:自然科学版, 2009 , 30 (3) :12 –15. |
| [14] | WALLACE R J, MCEWAN N R, MCINTOSH F M, et al. Natural products as manipulators of rumen fermentation[J]. Asian-Australasian Journal of Animal Sciences, 2002 , 15 (10) : 1458 –1468. DOI: 10.5713/ajas.2002.1458 |
| [15] | DIAZ A, AVENDANO M, ESCOBAR A. Evaluation of Sapindus saponaria as a defaunating agent and its effects on different rumen digestion parameters[J]. Livestock Research for Rural Development, 1993 , 5 (2) : 5560 . |
| [16] | 付琦.不同精粗比下驱除原虫对绵羊瘤胃微生物区系及饲料降解的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2009. http://cdmd.cnki.com.cn/Article/CDMD-10129-2009131198.htm |
| [17] | 陈旭伟.不同皂苷对山羊瘤胃原虫和细菌种属变化以及纤维降解的影响[D].硕士学位论文.扬州:扬州大学,2009. http://cdmd.cnki.com.cn/Article/CDMD-11117-2009192881.htm |
| [18] | 周奕毅.茶皂素抑制湖羊甲烷生成的微生物学机制研究[D].硕士学位论文.杭州:浙江大学,2009. http://cdmd.cnki.com.cn/Article/CDMD-10335-2010144304.htm |




