2. 乐达 (广州) 香味剂有限公司, 广州 510530
2. Leda (Guangzhou) Perfume Co. Ltd., Guangzhou 510530, China
味觉是指动物口腔内味觉器官化学感受系统对食物的刺激所产生的一种感觉。哺乳动物能够感受到的味觉一般被分为5种,分别是酸、甜、苦、咸和鲜。其中,苦味对于动物来说有着很重要的作用。许多有毒有害物质都具有苦味,当动物接触到具有苦味的饲料时,它们会产生一种强烈的厌恶感,这成为了动物抵御有毒物质入侵体内的重要防御机制[1]。苦味受体 (bitter taste receptors,TAS2Rs) 是一类7次跨膜的G-蛋白偶联受体 (GPCR),味觉受体细胞中苦味的转导主要通过G蛋白及GPCR来完成。本文就TAS2Rs的生物学特征、信号转导机制及苦味剂和苦味抑制剂对苦味受体的影响进行简要综述。
1 TAS2Rs的生物学特征 1.1 结构TAS2Rs是由1条多肽链形成的7个跨膜螺旋结构的GPCR (图 1)[2],含有相应的3个细胞内环和3个细胞外环。在TAS2Rs结构中,跨膜区的保守性最大,其次是胞内区,细胞内的3个环状结构高度保守,是细胞内G蛋白偶联区域,而细胞外的区域变化差异最大,在细胞外有短的N末端结构域,能够表现出明显的多态性,可以和各种苦味物质结合,推测是配体结合区。哺乳动物的苦味受体基因阅读框架都是由1个外显子组成的,但是在长度上不同物种略有区别。例如,犬和小鼠为912 bp,马为906 bp,黑熊为915 bp,而猪达到1 189 bp[3]。TAS2Rs家族成员之间有30%~70%的氨基酸序列是保持一致的。此外,魏成晓[4]研究表明,猪的苦味受体基因与人、小鼠等哺乳动物的结构基本相同。

|
图 1 TAS2Rs的7次跨膜结构 Figure 1 Seven transmembrane structures of TAS2Rs[2] |
TAS2Rs不仅在舌头的味蕾中表达,而且还在动物的其他组织中表达,并表现出不同的生物学功能。研究表明,部分TAS2Rs和同源的α-味导素在人体的气道平滑肌中表达[5]。Shah等[6]证实,在气道的上皮细胞运动纤毛中表达的TAS2Rs能够使纤毛的运动频率加快,这也许是一种保护呼吸道进入毒气的机械防御机制。Wu等[7]还确定了TAS2Rs与已知的配体在胃肠道组织和细胞中表达。结果表明,在胃窦、胃底和十二指肠还有舌部都发现了TAS2R108和TAS2R138,但是在肝、心、肾中没有发现。此外,龋齿类动物特有的TAS2R134在胃和十二指肠与舌部的表达也是相似的。这些都说明TAS2Rs的编码基因在鼠的胃肠道黏膜中表达。此外,Singh等[8]利用实时荧光定量PCR (RT-PCR) 技术在体外培养的C6神经胶质细胞、脑干、小脑、皮层和小鼠脑部的伏隔核中检测出TAS2R104、TAS2R107和TAS2R138的转录文本,还在初级神经元中检测出TAS2R104。
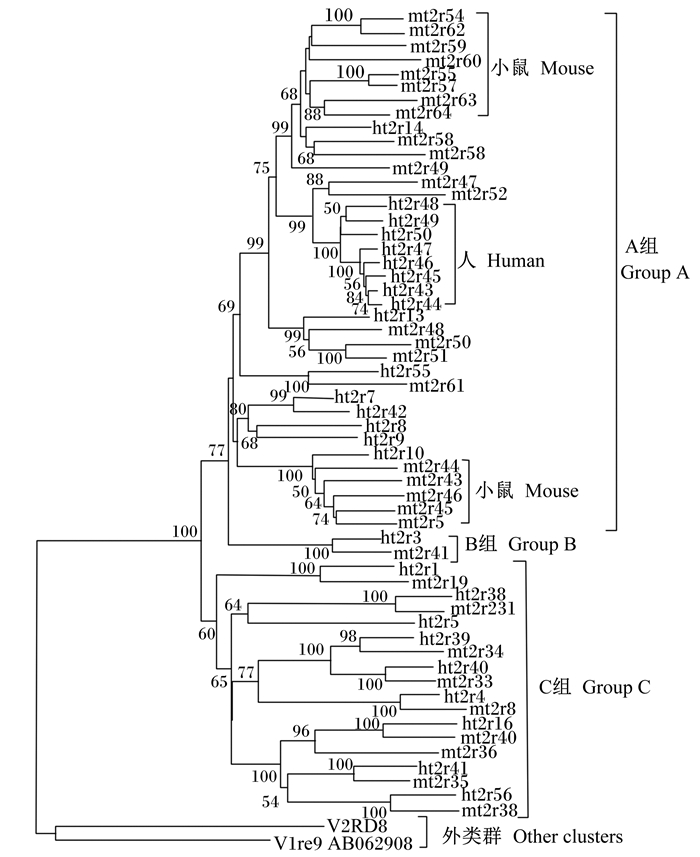
1.3 染色体定位Rozengurt[9]对龋齿类动物的苦味受体基因组进行基于同源性的生物信息筛选,来对其家族相关的序列进行测定。结果表明,它们的苦味受体基因不均匀地分配在3个染色体上。有2个染色体各自包含1个单独基因,而第3个染色体上聚集了剩余的TAS2Rs的真基因和假基因。基于小鼠基因组的同源性和它们在15号、2号和6号染色体中的位置,把小鼠的基因组分成3个小群组。同样,大鼠的36个苦味受体基因也各自的分配到2号、3号、4号染色体上。Behrens等[10]还确定了人类的苦味受体基因组有25个成员。1个基因在5号染色体上,还有9个在7号染色体上的延伸群落,剩余的15个分布在12号染色体的密集群落[11]。人和小鼠的TAS2Rs功能基因系统发育的关系如图 2[12]。此外,Li等[13]研究发现,猪有23个苦味受体基因,牛有34个,狗有15个,而鸡只有3个。苦味受体基因在染色体上的分布并不是无规则的,它们集中在特定的染色体区域,这应该是基因随机复制的结果。
|
图 2 人和小鼠TAS2Rs功能基因的系统发育关系 Figure 2 Phylogenetic relationships of TAS2Rs functional genes in human and mouse[12] |
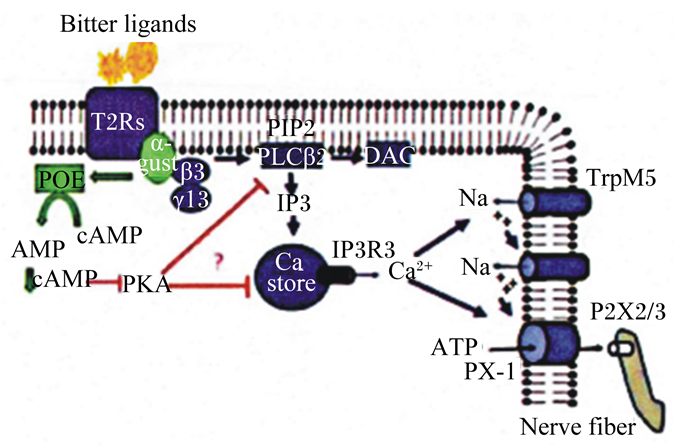
由于苦味物质有很多种化学结构,因此苦味的信号转导途径也应该有很多不同的形式。在TAS2Rs与苦味化合物的反应中,味导素起到了至关重要的作用。TAS2Rs的激活是通过一个含有G蛋白味导素的分路信号通路来促进第二信使的快速变化[9]。而这个异缘三聚体的G蛋白存在由α-亚基和β-γ-亚基分别介导的2条信号转导通路如图 3[14]所示。一种途径是像放线菌酮这样的苦味化合物,能够结合TAS2Rs,从而激活G蛋白的α-亚基,α-亚基通过磷酸二酯酶的激活降低了细胞内环腺苷酸 (cAMP) 的水平。cAMP水平的降低导致cAMP离子通道的抑制作用解除,细胞内储存的Ca2+释放,使Ca2+的浓度增加,细胞膜去极化。另一种途径是一些苦味化合物与TAS2Rs结合后激活G蛋白味导素中β-γ亚基,β-γ亚基刺激肌醇1,4,5-三磷酸 (IP3) 的磷脂酶C β2(PLCβ2) 合成并导致细胞内储存的Ca2+的释放,苦味受体细胞去极化,神经递质释放[15]。研究表明,G蛋白味导素在味觉细胞信号转导中起到了信号级联的作用[16]。此外,苦味物质也能够调节电压敏感离子通道的选通,介导细胞内钙进入细胞。最近的研究表明,一种瞬时感应电位通道[瞬时受体电位阳离子通道亚家族M成员5(TRPM5)]对舌上皮的苦味信号是十分重要的。舌上皮内的苦味物质诱导细胞内Ca2+浓度增加,并引发ATP的释放,从而激活神经纤维上的嘌呤受体,使嘌呤受体控制味觉感官中心信息的编码和集成[17]。
|
Bitter ligands:苦味受体; α-gust:α-亚基α-subunit; β3: β-亚基β-subunit; γ13:γ-亚基γ-subunit; IP3:肌醇1, 4, 5-三磷酸inositol (1, 4, 5) triphosphate; Ca store:钙储存库; IP3R3:肌醇1, 4, 5-三磷酸受体3型inositol 1, 4, 5-tri-sphosphate receptor type 3;TrpM5:瞬时受体电位阳离子通道亚家族M成员5 transient receptor potential cation channel subfamily M member 5;PX-1:PX受体1型PX receptor type 1;P2X2/3:P2X嘌呤受体2/3型P2X purinoceptor type 2/ 3;bitter ligands:苦味配体; PIP2:4, 5-二磷酸磷脂酰肌醇phosphatidylinositol (4, 5) bisphosphate; DAG:二酰甘油di-acylglycerol; PDE:磷酸二酯酶phosphodiesterase; PKA:蛋白激酶A protein kinase A; Nerve fiber:神经纤维。 图 3 苦味受体基因的信号转导示意图 Figure 3 Signal transduction of bitter receptor genes[14] |
一些缺失G蛋白味导素基因的小鼠仍然能够感受到苦味物质,说明还存在一些不依靠G蛋白味导素的苦味物质,能够直接与TAS2Rs发生反应,使离子通道开放而发生反应。另外,奎宁等一些物质能够使K+通道关闭,导致TAS2Rs去极化。最近,通过药理学方法研究发现,苯酸苄铵酰铵 (DB) 能够降低cAMP的水平,同时增加PLCβ2的活性,最终导致细胞内Ca2+浓度增加和激素释放[18]。这说明同一种物质有多种不同的转导途径,它们不是完全独立的,而是彼此之间存在一定的关系。
3 苦味剂对TAS2Rs的影响 3.1 单宁单宁存在于大量的饲料和牧草中,具有苦涩味,是最常见的一种抗营养因子。单宁是水溶性化合物,可以分为2类:缩合单宁和水解单宁。缩合单宁作为一种抗营养因子,对动物尤其是反刍动物有抗营养作用。这种抗营养作用存在剂量效应,低浓度的缩合单宁对动物能产生一定的正面营养作用,但高浓度会导致抗营养作用。研究发现,缩合单宁会抑制动物食物摄入量。此外,其对反刍动物的饲粮蛋白质或其他饲粮成分、消化酶和氮供应的内源性蛋白流失均产生络合作用,缩合单宁对反刍动物的其他部位还有一定的毒性[19]。因此,减缓单宁抗营养作用十分重要。水解单宁是一种有毒性作用的单宁。研究表明,水解单宁影响了十二指肠的形态学特征,体现在增加了绒毛高度、黏膜厚度和绒毛周长,而小肠的其他部分没有受到影响[20]。单宁减少了细胞的有丝分裂和细胞凋亡,但单宁对肝脏没有不利的影响。
不同种类的单宁能够与不同的TAS2Rs结合。表儿茶素是一种缩合单宁的前体,能够与TAS2R4、TAS2R5以及TAS2R39结合。水解单宁五没食子酰葡萄糖 (pentagalloylglucose,PGG) 能与TAS2R5和TAS2R39产生反应。原花青素三聚体作为一种缩合单宁,只能与TAS2R5结合。单宁是苦味物质中第1个对TAS2R5具有高效应的天然激动剂,也就是说,它能使TAS2R5的mRNA大量表达[21]。
3.2 苯硫脲 (PTC)PTC是一种呈白色晶体,有刺激性气味的毒性物质。由于具有硫氰酸盐 (NC=O) 的分子结构,从而产生苦味。Mani等[22]用16头猪进行试验,将它们均分为饲喂含有1 mmol PTC饲粮的组群和正常组群,结果2个组群的饲粮消耗量没有差异,这说明PTC对猪仍然有较好的适口性,而饲喂含PTC饲粮的猪的胃容量明显更高。通过对2个群组猪胃肠道食糜滞留情况的比较发现,饲喂含PTC饲粮的组群与正常组群相比食糜滞留现象更明显。饲喂含PTC饲粮的猪在饮食后45 min胃容量降低了30%。这些数据说明PTC苦味化合物能够减慢胃排空速度。对猪的空肠前端营养物运输进行测量,发现葡萄糖、赖氨酸和谷氨酰胺的运输量在饲喂含PTC饲粮的组群增加了250%。
研究表明,PTC能够与TAS2R38结合,从而使TAS2R38的mRNA表达量增加,并将苦味信号传到大脑皮层。这是因为TAS2R38的4个单倍型基因中TAS2R38PAV、TAS2R38AVI、TAS2R38AAI 3个基因型和TAS2R38PVV与PTC的反应有很大的不同。Tan等[23]通过将PTC与TAS2R38的4个单倍型基因绑定来预测它们的结合位点。结果表明,PTC能够和前3个单倍型基因在残基262位置上形成氢键,但与TAS2R38PVV单倍型基因不能形成氢键。上述说明,TAS2R38的第3~6个跨膜螺旋之间的氢键相互作用可以激活通过配体结合信号的受体,而PTC在残基262处形成的氢键参与了苦味的形成过程。
3.3 大豆异黄酮大豆异黄酮广泛存在于含有大豆的能量饲料中,并具有一定的苦涩味道,这种味道使动物对含有大豆的能量饲料产生一定的反感。然而,大豆异黄酮在结构上类似于哺乳动物的雌激素。因此,可以作为雌激素的激动剂或拮抗剂。Roland等[24]研究发现,大豆异黄酮能够与TAS2R14和TAS2R39结合,并与2个氢键供体位点,1个氢键受体部位和2个芳香环结构有关,使得受体能够表达从而产生了苦味。
3.4 其他不同的苦味物质能够与一种或多种TAS2Rs结合,并增加TAS2Rs mRNA的表达。饲料中还有一些苦味物质,如一些含有豆科植物的饲料中有苦味的生物碱,它们对动物饲料具有一定的抗氧化作用。白菜等十字花科植物中含有苦味芥子油苷,给奶牛饲喂过多的该物质会发生中毒现象[25]。低浓度的这些物质对动物能产生一定的保健作用,但高浓度会导致中毒甚至死亡。因此,抑制饲料中苦味的产生尤为重要。
4 苦味抑制剂对TAS2Rs的影响 4.1 氨基酸及其衍生物氨基酸衍生物和肽类是已知的苦味掩盖剂,然而,无论是作用于受体水平上的化合物,还是细胞内味觉信号级联的组成部分,它们的掩盖机制都没有进行阐述。之前的研究表明,L-鸟氨酰-β-丙氨酸 (OA) 能掩盖钾盐中的苦味,γ-氨基丁酸 (GABA) 能掩盖奎宁、咖啡因、可可和巧克力的苦味[26]。Pydi等[27]利用分子模型引导突变的方式,首先对TAS2R4中奎宁的结合位点进行预测。接着,对75个氨基酸衍生物与TAS2R4的配体结合位点进行对接。包括GABA和OA在内的大约19个氨基酸衍生物的结合亲和力都在预测范围内。N (α)-苄氧羰基-L-色氨酸甲酯和N,N-双 (羧甲基)-L-赖氨酸 (BCLM) 是结合亲和力最高的2种氨基酸衍生物。这2种氨基酸衍生物以及GABA和OA被选择作为它们的配体进行特异性竞争分析。通过竞争性Ca2+运动分析表明,只有GABA和BCLM展现拮抗剂活性,而另2个不能抑制TAS2R4。
GPCR的组成性激活突变用于药理工具将配体分为中性拮抗剂和反激动剂2种[28-29]。中性拮抗剂是一种对基底受体活性无效的化合物,而反激动剂往往降低受体活性。研究表明,BCLM能够降低受体活性,抑制TAS2Rs mRNA的表达,而GABA没有影响[27]。这使得GABA成为氨基酸衍生物和肽类化合物中第1个内源性苦味受体拮抗剂,并作为一种安全、低毒性的饲料添加剂,广泛应用于动物饲料添加剂中来消除饲料中的苦味。而BCLM则是第1个具有反激动剂特性的拮抗剂,可用来掩盖苦味。
4.2 单磷酸腺苷 (adenosine monophos-phate, AMP) 及其类似物AMP及其类似物能掩盖动物饲料的苦味,这些苦味抑制剂包含:5′-AMP、5′-二磷酸腺苷、5′-单磷酸胸苷、5′-琥珀酸腺苷、5′-ATP、3′-AMP等[30]。而AMP对苦味的抑制作用最佳,AMP也是首个被发现对苦味有抑制作用的腺苷酸化合物。它对DB、烟碱、咖啡因等多种苦味化合物都有不同程度的抑制作用。
Margolskee等[31]通过研究发现,AMP能够附着在苦味受体细胞上,抑制了TAS2Rs mRNA的表达,并通过降低味觉神经转导水平从而降低了苦味知觉。AMP作为苦味控制剂、风味增强剂、矫味剂等可应用于饲料中消除苦味,为动物增添福利。
4.3 磷脂酸 (phosphatidic acid, PA) 及其复合物一般的苦味化合物都是疏水性基团,而磷脂是典型的疏水性物质,因此它能对TAS2Rs进行屏蔽,从而起到竞争抑制苦味的作用。国外早就应用卵磷脂或脑磷脂等脂质抑制苦味,但效果不太理想。研究表明,在磷脂类化合物中,PA对苦味的抑制作用最强。PA对苦味的抑制作用源于它能够吸附苦味物质并对TAS2Rs进行掩蔽。当苦味物质进入口腔,能够优先与PA结合从而降低TAS2Rs与苦味物质结合, 从而抑制苦味的产生。Nakamura等[32]研究表明,1%的PA作用于0.1 mol/L的盐酸奎宁上,使其苦味下降81.7%,而掩蔽作用占45.6%。大麦胚芽、玉米胚芽、大豆、蛋黄等中都含有PA,但含量稀少。因此,PA通常以卵磷脂为原料,利用磷脂酶D酶促水解得到。
4.4 4-(2, 2, 3-三甲基环戊基) 丁酸[4-(2, 2, 3-trimethylcyclopentyl) butanoic acid, GIV3727]GIV3727是一种小分子苦味受体拮抗剂,能够抑制糖精和安赛蜜中的苦味物质与TAS2R31的反应。同时,它还能够抑制5种其他的TAS2Rs,包括对苦味感受十分重要的TAS2R43。Slcak等[33]通过构建TAS2R31和TAS2R43同源模型和β-肾上腺素的晶体结构研究发现,GIV3727与TAS2Rs的反应主要取决于TAS2Rs中2个临位组的残基。GIV3727能够使这2个残基对应位点发生突变,并提高受体对拮抗剂的选择性,使GIV3727在结合位点与TAS2Rs结合,从而降低TAS2Rs mRNA的表达量,减少苦味。
4.5 其他此外,还有一些物质能够与苦味物质竞争TAS2Rs的结合,如环糊精、果聚糖、单宁酸等,通过优先与TAS2Rs膜表面反应,调控TAS2Rs通道,抑制苦味分子与TAS2Rs反应,达到降低苦味的同时,还不使其他味觉受体对酸、甜、咸与氨基酸鲜味的感知产生影响。
5 小结TAS2Rs作为一种味觉受体,不仅在舌头的味蕾中表达,而且还在动物的气道平滑肌、胃肠道、小脑和睾丸中表达。目前发现,苦味的信号转导途径至少有3种,这是由于苦味物质有很多种化学结构。但是,作为一种会使动物厌恶的物质,抑制饲料中苦味物质与TAS2Rs结合,从而提高适口性是十分重要的。因此,深入研究苦味受体阻断剂对提高动物采食量以及改善动物福利具有重要意义。
| [1] | MEYERHOF W, BATRAM C, KUHN C, et al. The molecular receptive ranges of human TAS2R bitter taste receptors[J]. Chemical Senses, 2010, 35(2): 157–170. DOI: 10.1093/chemse/bjp092 |
| [2] | 胡玲玲, 施鹏. 苦味受体基因家族功能和演化研究的最新进展[J]. 科学通报, 2009, 54(17) :2472–2482. |
| [3] | 钟源, 潘阳, 侯文海, 等. 黑熊苦味受体TAS2R2基因的分子克隆与序列分析[J]. 野生动物学报, 2014, 35(4) :407–413. |
| [4] | 魏成晓. 长白猪TAS2R1基因克隆及序列分析[J]. 猪业科学, 2015, 32(12) :102–104. |
| [5] | EINSTEIN R, JORDAN H, ZHOU W Y, et al. Alternative splicing of the G protein-coupled receptor superfamily in human airway smooth muscle diversifies the complement of receptors[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(13): 5230–5235. DOI: 10.1073/pnas.0801319105 |
| [6] | SHAH A S, BEN-SHAHAR Y, MONINGER T O, et al. Motile cilia of human airway epithelia are chemosensory[J]. Science, 2009, 325(5944): 1131–1134. DOI: 10.1126/science.1173869 |
| [7] | WU S V, CHEN M C, ROZENGURT E. Genomic organization, expression, and function of bitter taste receptors (T2R) in mouse and rat[J]. Physiological Genomics, 2005, 22(2): 139–149. DOI: 10.1152/physiolgenomics.00030.2005 |
| [8] | SINGH N, VRONTAKIS M, PARKINSON F, et al. Functional bitter taste receptors are expressed in brain cells[J]. Biochemical and Biophysical Research Communications, 2011, 406(1): 146–151. DOI: 10.1016/j.bbrc.2011.02.016 |
| [9] | ROZENGURT E. Taste Receptors in the Gastrointestinal tract Ⅰ.Bitter taste receptors and α-gustducin in the mammalian gut[J]. American Physiological Society, 2006, 291(2): G171–G177. |
| [10] | BEHRENS M, MEYERHOF W. Gustatory and extragustatory functions of mammalian taste receptors[J]. Physiology & Behavior, 2011, 105(1): 4–13. |
| [11] | PRONIN A N, TANG H X, CONNOR J, et al. Identification of ligands for two human bitter T2R receptors[J]. Chemical Senses, 2004, 29(7): 583–593. DOI: 10.1093/chemse/bjh064 |
| [12] | SHI P, ZHANG J Z, YANG H, et al. Adaptive diversification of bitter taste receptor genes in mammalian evolution[J]. Molecular Biology and Evolution, 2003, 20(5): 805–814. DOI: 10.1093/molbev/msg083 |
| [13] | LI D Y, ZHANG J Z. Diet Shapes the evolution of the vertebrate bitter taste receptor gene repertoire[J]. Molecular Biology and Evolution, 2014, 31(2): 303–309. DOI: 10.1093/molbev/mst219 |
| [14] | VANDENBEUCH A, KINNAMON S C. Why do taste cells generate action potentials?[J]. Journal of Biology, 2009, 8: 42. DOI: 10.1186/jbiol138 |
| [15] | MARGOLSKEE R F. Molecular mechanisms of bitter and sweet taste transduction[J]. Journal of Biology Chemistry, 2002, 277(1): 1–4. DOI: 10.1074/jbc.R100054200 |
| [16] | HE W, DANILOVA V, ZOU S Y, et al. Partial rescue of taste responses of α-gustducin null mice by transgenic expression of α-transducin[J]. Chemical Senses, 2002, 27(8): 719–727. DOI: 10.1093/chemse/27.8.719 |
| [17] | SCOTT K. Taste recognition:food for thought[J]. Neuron, 2005, 48(3): 455–464. DOI: 10.1016/j.neuron.2005.10.015 |
| [18] | KIM K S, EGAN J M, JANG H J. Denatonium induces secretion of glucagon-like peptide-1 through activation of bitter taste receptor pathways[J]. Diabetologia, 2014, 57(10): 2117–2125. DOI: 10.1007/s00125-014-3326-5 |
| [19] | BHAT T K, KANNAN A, SINGH A, et al. Value addition of feed and fodder by alleviating the antinutritional effects of tannins[J]. Agricultural Research, 2013, 2(3): 189–206. DOI: 10.1007/s40003-013-0066-6 |
| [20] | BILIĆ-ŠOBOT D, KUBALE V, ŠKRLEP M, et al. Effect of hydrolysable tannins on intestinal morphology, proliferation and apoptosis in entire male pigs[J]. Archives of Animal Nutrition, 2016, 70(5): 378–388. DOI: 10.1080/1745039X.2016.1206735 |
| [21] | SOARES S, KOHL S, THALMANN S, et al. Different phenolic compounds activate distinct human bitter taste receptors[J]. Journal of Agricultural and Food Chemistry, 2013, 61(7): 1525–1533. DOI: 10.1021/jf304198k |
| [22] | MANI V, HOLLIS J, GABLER N K. Bitter compounds decrease gastric emptying and influence intestinal nutrient transport[J]. Aniaml Industry Roport, 2012, 658(57): R2725–R2728. |
| [23] | TAN J, ABROL R, TRZASKOWSKI B, et al. 3D Structure prediction of TAS2R38 bitter receptors bound to agonists phenylthiocarbamide (PTC) and 6-n-propylthiouracil (PROP)[J]. Journal of Chemical Information and Modeling, 2012, 52(7): 1875–1885. DOI: 10.1021/ci300133a |
| [24] | ROLAND W S, VINCKEN J P, GOUKA R J, et al. Soy isoflavones and other isoflavonoids activate the human bitter taste receptors hTAS2R14 and hTAS2R39[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 11764–11771. DOI: 10.1021/jf202816u |
| [25] | 李磊, 周昇昇. 苦味植物化合物和苦味修饰剂的研究进展[J]. 食品工业, 2014, 35(6) :213–217. |
| [26] | LEY J P. Masking bitter taste by molecules[J]. Chemosensory Perception, 2008, 1(1): 58–77. DOI: 10.1007/s12078-008-9008-2 |
| [27] | PYDI S P, SOBOTKIEWICZ T, BILLAKANTI R, et al. Amino acid derivatives as bitter taste receptor (T2R) blockers[J]. Journal of Biological Chemistry, 2014, 289(36): 25054–25066. DOI: 10.1074/jbc.M114.576975 |
| [28] | BYLUND D B, TOEWS M L. Quantitative versus qualitative data:the numerical dimensions of drug action[J]. Biochemical Pharmacology, 2014, 87(1): 25–39. DOI: 10.1016/j.bcp.2013.07.027 |
| [29] | CHAKRABORTY R, BHULLAR R P, DAKSHINAMURTI S, et al. Inverse agonism of SQ 29, 548 and ramatroban on thromboxane A2 receptor[J]. PLoS One, 2014, 9(1): 85937–85960. DOI: 10.1371/journal.pone.0085937 |
| [30] | 王伟江, 郑建仙. 天然苦味抑制剂的研究与应用[J]. 中国调味品, 2006(2) :13–16. |
| [31] | MARGOLSKEE R F, DING M.Inhibitors of the bitter taste response:US, USRE40594[P].2008. |
| [32] | NAKAMURA T, TANIGAKE A, MIYANAGA Y, et al. The effect of various substances on the suppression of the bitterness of quinine-human gustatory sensation, binding, and taste sensor studies[J]. Chemical and Pharmaceutical Bulletin, 2002, 50(12): 1589–1593. DOI: 10.1248/cpb.50.1589 |
| [33] | SLACK J P, BROCKHOFF A, BATRAM C, et al. Modulation of bitter taste perception by a small molecule hTAS2R antagonist[J]. Current Biology, 2010, 20(12): 1104–1109. DOI: 10.1016/j.cub.2010.04.043 |




