2. 河北工程大学农学院, 邯郸 056021;
3. 东北农业大学动物科技学院, 哈尔滨 150030
2. College of Agriculture, Univerity of Engineering, Handan 056021, China;
3. College of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, China
急性短期高温严重影响肉鸡福利与生产。在我国春夏之交时,经常出现环境温度骤然升高的现象,导致肉鸡生长性能降低,抵抗力下降,维持能量需求增加[1-2]。Quinteiro-Filho等[3]研究表明,36 ℃急性应激10 h,肉鸡的生长性能降低。Zulkifli等[4]研究表明,36 ℃急性应激3 h,肉鸡体核温度显著升高。Parker等[5]研究表明,火鸡在28日龄时,37.8 ℃条件下,采食量显著下降,体温显著升高。目前国内外相关的研究主要集中在32 ℃及以上高温环境。线粒体是细胞内氧化磷酸化和形成ATP的主要场所。禽类解偶联蛋白 (avUCP) 是解偶联蛋白家族的一员,位于线粒体内膜,作为质子通道驱散氧化吸收时形成的氢离子 (H+) 梯度,降低了线粒体膜电位差,从而增加呼吸产热,阻止ATP的形成,对维持动物体温平衡有重要意义。目前关于环境温度对肉鸡胸肌和肝脏avUCP mRNA表达量研究的报道较少。本课题组研究发现,持续偏热和间歇性偏热 (26和31 ℃) 影响肉鸡的体核温度、酸碱平衡、生长性能以及糖脂代谢,且不同偏热程度对肉鸡影响程度不同[6-7]。由此可见,偏热环境已经对于肉鸡各方面产生影响。目前肉鸡品种追求快速生长和大块胸肌产量,但是肉鸡心血管系统、呼吸系统与之不匹配,肉鸡易受外界环境的刺激,敏感性降低[8]。然而有关急性偏热环境温度23~32 ℃对肉鸡行为、生理、血清生化指标、avUCP mRNA表达量的影响未见报道。
因此,本试验研究不同急性偏热温度 (20、23、26、29、32 ℃) 对于肉鸡行为、生理、血清生化指标和avUCP mRNA表达量的影响,以期分别找出影响肉鸡行为、生理、血清生化指标及avUCP mRNA表达量的起点偏热温度,为肉鸡热舒适评价和温度骤变时肉鸡饲养环境的调控提供科学依据。
1 材料与方法 1.1 试验动物与试验设计试验选取26日龄、体重 (1 635±123) g的健康爱拔益加 (AA) 肉鸡100只,随机分为5个组 (20、23、26、29、32 ℃组),每个组20只鸡 (公母各占1/2)。肉鸡适应期为7 d,温度为20 ℃,相对湿度为60%。34日龄时,环控舱温度在1 h内分别调整到20、23、26、29、32 ℃,相对湿度为60%,维持设定温度2 h。
1.2 试验饲粮与饲养管理试验动物在中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室昌平试验基地人工气候试验舱内进行,温度、相对湿度自动控制 (精度分别为±1 ℃、±7%)。试验肉鸡采用平养,所用笼具为本实验室研发的单层平养笼具[9],试验期间自由采食与饮水,全天24 h的光照,进行常规饲养及免疫。采用玉米-豆粕型饲粮,所用饲粮为参照NRC (1994) 营养需要配制的粉状配合饲料,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平 (饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as-fed basis) |
本试验采用目标取样法。结合Ericsson等[10]和Bokkers等[11]行为分类方法,确定观察活动行为 (采食、饮水、站立) 和休息行为 (坐着、伸展、俯伏) 项目,见表 2。
|
|
表 2 肉鸡行为类别及其定义 Table 2 Behavior of posture categories and their definition |
试验前,每个组随机挑选6只鸡 (公母各占1/2),并在背部用无毒丙烯染料做标记。试验在变温开始 (08:00) 时录像,连续记录3 h。采用目标取样法,将存储视频用The Observer XT (Version 7.0, Noldus lnformation Technologly BV, Wageningen, Netherland) 软件协助统计每只目标鸡各姿势活动行为、休息行为发生的次数。选取各个组温度达到后的30 min,每隔10 s,记录每个组6只鸡各种行为发生次数。数据记录整个过程中为同一人观察,观察各组的1个重复后,再进行下一重复的观察。
1.3.2 生理指标体核温度的测定:每个组随机选择5只鸡,在舱内温度稳定后的2~3 h内,利用微型温度数据记录仪DS1922L (分辨率0.062 5 ℃,精度±0.05 ℃) 检测体核温度,每隔5 min检测1次。
呼吸频率的测定:每个组选取6只鸡,每隔10 min采集1次,每次测量每只鸡1 min的呼吸次数,共采集6次,每只鸡呼吸频率为6次呼吸次数的平均值。
皮温的采集和分析采用日本红外成像仪InfReCH2640。操作步骤为:使用红外热成像仪对准试验鸡的头部、小腿垂直拍摄,拍摄距离为0.5 m,每隔3 min拍摄1次,连续拍摄1 h,每只鸡拍摄20张,红外照片通过FLIR TOOIS分析,计量每张照片中鸡冠、小腿、脚蹼、眼睑、耳垂的温度,取同20个数据的平均值进行统计。
1.3.3 血清生化指标维持设定温度2 h,每个组随机选取6只 (公母各占1/2) 肉鸡翅静脉采血10 mL,3 000 r/min离心10 min取上清液,-80 ℃冷冻保存,待测。血清葡萄糖 (GLU)、总胆固醇 (TC)、甘油三酯 (TG) 试剂盒购于中生北控股份有限公司,采用比色法,具体操作按照说明书进行,所用仪器为日本日立7160全自动生化分析仪 (日立公司)
1.3.4 胸肌、肝脏avUCP mRNA表达量肉鸡34日龄急性偏热处理2 h后立即放血,迅速采集胸肌、肝脏样品,置液氮中冻存,随后放-80 ℃冰箱保存,用于测定avUCP mRNA表达量。
组织avUCP mRNA表达量测定步骤:1) 用超纯RNA提取试剂盒 (CWbio.Co.Ltd,Cat#CW0581) 提取组织样本中总RNA;2) 反转录,用HiFi-MMLVcDNA第1链合成试剂盒 (CWbio.Co.Ltd, Cat#CW0744) 进行反转录,试验操作按产品说明书进行;3) 实时定量荧光PCR,用ABI7500型荧光定量PCR仪,采用2-△△CT法进行数据的相对定量分析。
引物设计如下。
目的基因avUCP引物:上游为5′-ATCGGGCTCTACGACTCTGT-3′;下游为5′-TGTGTCCTTGATGAGGTCGT-3′;扩增片段长度为327 bp。
内参基因甘油醛-3-磷酸脱氢酶 (GAPDH) 引物:上游为5′-AACTTTGGCATTGTGGAGGG-3′;下游为5′-ACGCTGGGATGATGTTCTGG-3′;扩增片段长度为130bp。
1.4 数据处理及统计分析试验数据采用SAS 9.1统计软件进行单因素方差分析 (one-way ANOVA),同时采用Duncan氏法多重比较进行差异显著性分析,以P < 0.05为差异显著水平。
2 结果 2.1 急性偏热环境温度对于肉鸡活动行为的影响由表 3可知,急性偏热处理2 h,与20 ℃组相比,29、32 ℃组肉鸡的采食次数显著降低 (P < 0.05),23、26、29、32 ℃组肉鸡的饮水次数无显著差异 (P>0.05),23、26、29、32 ℃组肉鸡的站立次数显著降低 (P < 0.05)。
|
|
表 3 急性偏热环境温度对肉鸡活动行为的影响 Table 3 Effects of acute moderate ambient temperature on activity behaviors of broilers |
由表 4可知,急性偏热处理2 h,与20 ℃组相比,26、29、32 ℃组肉鸡坐着休息次数显著降低 (P < 0.05),23、26、32 ℃组肉鸡伸展休息次数显著升高 (P < 0.05),29、32 ℃组俯伏休息次数显著升高 (P < 0.05)。
|
|
表 4 急性偏热环境温度对肉鸡休息行为的影响 Table 4 Effects of acute moderate ambient temperature on resting behaviors of broilers |
由表 5可知,急性偏热处理2 h,与20 ℃组相比,26、29、32 ℃组肉鸡的体核温度、呼吸频率显著升高 (P < 0.05),23、26、29、32 ℃组鸡冠皮温、耳垂皮温、小腿皮温、脚蹼皮温显著升高 (P < 0.05),26、29、32 ℃组肉鸡眼睑皮温显著升高 (P < 0.05)。
|
|
表 5 急性偏热环境温度对于肉鸡生理指标的影响 Table 5 Effects of acute moderate ambient temperatures on physiological indices of broiers |
由表 6可知,急性偏热处理2 h,与20 ℃组相比,29、32 ℃组血清GLU含量显著降低 (P < 0.05),26、29、32 ℃组血清TG含量显著降低 (P < 0.05),23、26、29、32 ℃组肉鸡血清TC含量无显著差异 (P>0.05)。
|
|
表 6 急性偏热环境温度对于肉鸡糖脂代谢相关血清生化指标的影响 Table 6 Effects of acute moderate ambient temperatures on serum biochemical indices of broilers |
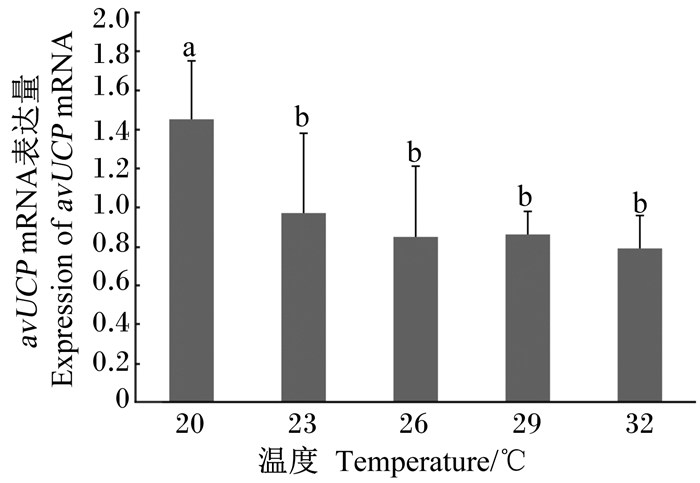
由图 1可知,急性偏热处理2 h,23、26、29、32 ℃组肉鸡胸肌avUCP mRNA表达量显著低于20 ℃组 (P < 0.05)。
|
数据标注不同小写字母表示差异显著 (P < 0.05)。下图同。 Values columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 急性偏热环境温度对肉鸡胸肌avUCP mRNA表达量的影响 Figure 1 Effects of acute moderate ambient temperatures on expression of avUCP mRNA in pectoral of broilers |
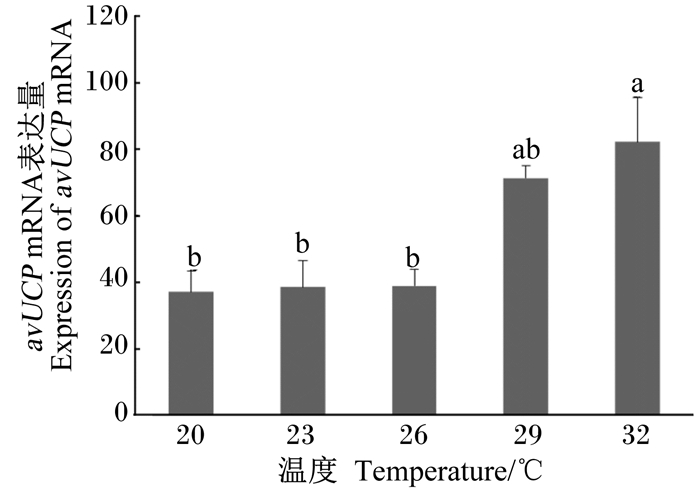
由图 2可知,急性偏热处理2 h,32 ℃组肉鸡肝脏avUCP mRNA表达量显著高于20 ℃组 (P < 0.05)。
|
图 2 急性偏热环境温度对肉鸡肝脏avUCP mRNA相表达量的影响 Figure 2 Effects of acute moderate ambient temperatures on expression of avUCP mRNA in liver of broilers |
Pereira等[12]研究表明,行为指标可反映肉鸡热舒适状态。李梦涵等[13]研究表明,雏鸡在40 ℃条件下急性处理2 h,雏鸡的饮水量显著升高,站立和采食次数显著降低。Bozakova等[14]研究表明,在28、34 ℃时,鸭子站立和行走时间减少,休息时间增多。El-Shafaei等[15]研究表明,7周龄的鸭子在高温环境下,站立的行为时间百分比显著减少。本试验结果表明,与20 ℃组相比,急性偏热环境温度刺激下,29和32 ℃组肉鸡的采食次数显著降低,这可能是因为随着环境温度的升高,抑制采食中枢导致采食次数减少;29 ℃组肉鸡的饮水次数明显增多,这表明29 ℃时肉鸡体表和呼吸道蒸发散热增加;23、26、29、32 ℃组肉鸡的站立次数显著降低,表明23 ℃起肉鸡开始减少活动行为,降低动物的热负荷,来维持体温平衡。
Mack等[16]研究表明,32.6 ℃组蛋鸡展翅、休息行为增多,运动行为减少。胡春红等[17]研究表明,18、22、26、30 ℃条件下应激1、3 d,26、30 ℃组肉鸡坐着休息时间显著减少,俯伏休息时间显著增多,26 ℃组伸展休息时间无显著影响,30 ℃组伸展休息时间显著升高。本试验结果得出,与20 ℃组相比,23、26、29、32 ℃组肉鸡伸展休息次数显著升高,这表明23 ℃时开始肉鸡休息姿势行为调节,通过增加伸展行为展开翅膀裸出腋下无羽区或伸出腿部以扩大散热面积;26、29和32 ℃组肉鸡坐着休息次数显著降低,表明急性偏热环境温度导致肉鸡休息行为质量下降;29和32 ℃组俯伏休息次数显著升高,表明肉鸡通过增加俯伏行为加快散热。
研究表明,体核温度、呼吸频率和皮肤温度能够准确反映肉鸡应激的强度以及舒适情况[18-20]。Toyomizu等[21]研究表明,36、38 ℃热处理30、60 min,引起体核温度的升高,体核温度最大值分别达到44和46 ℃。张少帅等[22]研究表明,26 ℃急性应激2 h,肉鸡体核温度达到41.27 ℃。本试验研究结果表明,与20 ℃组相比,26 ℃组肉鸡的体核温度显著升高,达到41.86 ℃。在急性偏热环境温度下肉鸡的物理和化学调节不能维持热平衡,动物体热遭到破坏,导致体内蓄热增加,肉鸡的体核温度显著升高。家禽没有汗腺,禽类通过加快呼吸、加大肺通气量以增加呼吸道的蒸发散热,维持体热平衡。韩爱云等[23]研究表明,肉鸡35 ℃急性应激3 h,肉鸡的呼吸频率极显著高于对照组。Toyomizu等[21]研究表明,肉鸡38 ℃急性应激1 h,肉鸡的呼吸频率从61次/min升到261次/min。Wang等[24]研究表明,公鸡在38 ℃时应激4 h,呼吸频率显著升高,并且研究表明随着体核温度的升高,呼吸频率逐渐增加。呼吸频率的增多,有利用肉鸡散热,维持体温平衡。本试验研究结果表明,与20 ℃组相比,26、29和32 ℃组分别使肉鸡呼吸频率每分钟增加34、81、83次,且随着环境温度的升高,肉鸡的每分钟呼吸次数显著增加。
张少帅等[22]研究报道,肉鸡31 ℃时,应激2 h,肉仔鸡的脸部和小腿温度极显著升高,呼吸频率极显著升高。周莹等[7]研究表明,26 ℃、85%的高相对湿度造成肉鸡耳垂、鸡冠皮温、小腿皮温、脚蹼皮温显著升高。Lin等[25]研究表明,肉鸡在35 ℃、相对湿度为60%条件下,胸部的温度显著升高。本研究发现,急性偏热处理2 h,23、26、29和32 ℃组肉鸡鸡冠皮温、眼睑皮温、小腿皮温、脚蹼皮温显著高于20 ℃组,26、29和32 ℃组耳垂皮温显著高于20 ℃组。结果表明,急性偏热环境温度下,肉鸡急性处理2 h,肉鸡的呼吸频率和皮温显著升高,表明在23 ℃时,肉鸡开始行为、皮温调节,体核温度正常,26 ℃时行为、皮温调节不足以维持体热平衡,体核温度升高,呼吸频率增加。
3.3 急性偏热环境温度对肉鸡血清生化指标的影响血清GLU的含量反映了动物能量代谢的状况。糖类是动物体内的重要能源物质,也是动物机体正常情况下的主要供能物质,动物体内能量的70%来自GLU的分解代谢[26]。高温环境抑制肉鸡体内代谢,使代谢产物下降并且导致肉鸡的采食量下降,营养摄入不足,进而动用体内贮备的营养物质,并加速分解代谢以满足机体所需的能量和物质供应,导致血液中GLU、总脂肪和蛋白质含量的下降[27]。目前,关于环境温度对肉鸡的血清GLU含量的研究比较多,但报道结果不一致。郑卓失[28]研究表明,急性应激肉鸡血清GLU含量显著升高。傅玲玉等[29]研究报道,36 ℃急性热处理,蛋鸡的血清GLU含量显著下降。Vecerek等[30]研究表明,肉鸡血清GLU含量随着环境温度的升高显著下降。仲庆振等[31]研究表明,8周龄的仔鹅,持续40 ℃,热应激2、4、6 h,仔鹅血清GLU的含量随着应激时间的延长显著升高。Lin等[32]报道,32 ℃急性应激3、6 h,肉鸡血清GLU含量无显著差异。本试验研究结果表明,急性偏热处理2 h,与20 ℃组相比,29和32 ℃组肉鸡血清GLU含量显著降低,这很可能是由于急性偏热应激初期肉鸡迅速动用能量以对付应激,而此时机体还来不及通过动员糖原或糖异生途径补充GLU所致。对于不同环境温度下血清GLU含量的不同的原因,可能是血清GLU含量变化与鸡日龄和应激强度有关。
血清TC、TG含量反映机体脂类代谢水平。Kouba等[33]等研究发现,31 ℃持续处理,育肥猪血清TG含量极显著升高。唐丽等[34]研究表明,急性短期高温29 ℃,处理4 h,肉鸡血清TG含量显著降低。刘梅[35]研究表明,急性热应激使肉鸡血清中TG含量显著增加。本试验的研究结果表明,急性偏热处理2 h,与20 ℃组相比,26、29和32 ℃组显著降低了血清TG含量,23、26、29、32 ℃组肉鸡血清TC含量无显著差异。这些结果表明急性偏热环境温度不同程度上影响了肉鸡的脂类代谢水平。急性偏热初期机体能维持TG含量的稳定。随着急性偏热程度的不同,肉鸡需要更多的能量,贮存的脂肪在酶的催化分解为TG和脂肪酸。TG在肝脏被利用,经过磷酸化和脱氢处理而进入糖的氧化分解途径来功能,或者转为GLU,所以导致血清TG含量下降。
3.4 急性偏热环境温度对肉鸡胸肌和肝脏avUCP mRNA表达量的影响avUCP位于线粒体内膜,作为质子转运体将内膜外侧H+运回膜内侧,降低物质氧化过程形成的H+电化学梯度,使氧化过程与腺苷二磷酸 (ADP) 磷酸化过程脱偶联,能量不形成ATP而以热能的形式散发,增加能量的消耗[36]。avUCP与动物的能量代谢及脂类代谢相关,具有调节能量代谢的作用,热量损失显著地增加了动物的基础代谢率,增加了动物的维持能量需要[37]。Wang等[38]研究表明,急性冷应激造成肉鸡腓肠肌avUCP mRNA表达量升高,且随着处理时间的延长呈升高趋势。Taouis等[39]研究表明,40 ℃急性应激24 h,肉鸡胸肌avUCP mRNA表达量显著降低。本试验研究表明,急性偏热处理2 h,23、26、29、32 ℃组肉鸡胸肌avUCP mRNA表达量显著低于20 ℃组。这一研究结果与Mujahid等[40-41]研究得出的34 ℃急性应激18 h后肉鸡胸肌的avUCP mRNA表达量显著降低的结果一致。在高温环境下,线粒体呼吸链解偶联作用受到抑制,减少了细胞能量以热能的形式散发和机体产热。
研究发现,avUCP基因在肝脏、骨骼肌组织广泛存在表达[42-43]。Gasparino等[44]研究报道,34 ℃时热处理24 h对鹌鹑肝脏avUCP mRNA表达量无显著影响。Qin等[45]研究表明,肉仔鸡冷暴露12 ℃,急性应激6 h,肉鸡肝脏的解偶联蛋白2(UCP2) mRNA表达量显著增加,这表明UCP2 mRNA在肝脏的表达可能受冷应激的影响。本试验研究结果表明,急性偏热处理2 h,32 ℃组肉鸡肝脏avUCP mRNA表达量显著增高,与肉鸡胸肌avUCP mRNA表达量显著降低结果相反,肝脏avUCP mRNA表达量显著增高的具体原因有待进一步探究。
综合以上结果可以发现,急性偏热环境温度23 ℃时肉鸡不仅启动物理调节,如站立次数减少、伸展增多、皮温升高,而且启动化学调节,如avUCP mRNA表达量降低,产热减少。这表明23 ℃已达到肉鸡临界温度上限。
4 结论本研究饲养条件下,急性偏热处理2 h,23 ℃时肉鸡就已启动化学调节,26 ℃时体核温度升高。23 ℃可以作为偏热温度的起点。
| [1] | KLEIBER M. The fire of life:an introduction to animal energetics[M]. 2nd ed. New York: Krieger Publishing Co., 1975: 453. |
| [2] | SINURAT A P, BALNAVE D, MCDOWELL G H. Growth performance and concentrations of thyroid hormones and growth hormone in plasma of broilers at high temperatures[J]. Australian Journal of Biological Sciences, 1987, 40(4): 443–450. DOI: 10.1071/BI9870443 |
| [3] | QUINTEIRO-FILHO W M, RIBEIRO A, FERRAZ-DE-PAULA V, et al. Heat stress impairs performance parameters, induces intestinal injury, and decreases macrophage activity in broiler chickens[J]. Poultry Science, 2010, 89(9): 1905–1914. DOI: 10.3382/ps.2010-00812 |
| [4] | ZULKIFLI I, DASS R T, NORMA M T C. Acute heat-stress effects on physiology and fear-related behaviour in red jungle fowl and domestic fowl[J]. Canadian Journal of Animal Science, 1999, 79(2): 165–170. DOI: 10.4141/A98-022 |
| [5] | PARKER J T, BOONE M A, KNECHTGES J F. The effect of ambient temperature upon body temperature, feed consumption, and water consumption, using two varieties of turkeys[J]. Poultry Science, 1972, 51(2): 659–664. DOI: 10.3382/ps.0510659 |
| [6] | 甄龙, 石玉祥, 张敏红, 等. 持续偏热环境对肉鸡生长性能、糖脂代谢及解偶联蛋白mRNA表达的影响[J]. 动物营养学报, 2015, 27(7) :2060–2069. |
| [7] | 周莹, 彭骞骞, 张敏红, 等. 相对湿度对间歇性偏热环境下肉鸡体温、酸碱平衡及生产性能的影响[J]. 动物营养学报, 2015, 27(12) :3726–3735. |
| [8] | YAHAV S, SHINDER D, TANNY J, et al. Sensible heat loss:the broiler's paradox[J]. World's Poultry Science Journal, 2005, 61(3): 419–434. DOI: 10.1079/WPS200453 |
| [9] | 张敏红, 苏红光, 冯京海, 等.采集用于建立肉鸡生活环境舒适性评价模型数据的方法和专用装置:中国, CN103404447A[P].2013-11-27. |
| [10] | ERICSSON M, FALLAHSHAROUDI A, BERGQUIST J, et al. Domestication effects on behavioural and hormonal responses to acute stress in chickens[J]. Physiology & Behavior, 2014, 133: 161–169. |
| [11] | BOKKERS E A M, KOENE P. Behaviour of fast-and slow growing broilers to 12 weeks of age and the physical consequences[J]. Applied Animal Behaviour Science, 2003, 81(1): 59–72. DOI: 10.1016/S0168-1591(02)00251-4 |
| [12] | PEREIRA D F, NÄÄS I A. Estimating the thermoneutral zone for broiler breeders using behavioral analysis[J]. Computers and Electronics in Agriculture, 2008, 62(1): 2–7. DOI: 10.1016/j.compag.2007.09.001 |
| [13] | 李梦涵, 吴锦华, 汪威, 等.热应激雏鸡几种行为变化的初步观察[C]//2013海南省第五届生命科学联合学术会议论文汇编.海口:海南省微生物学会, 2013:1. |
| [14] | BOZAKOVA N A, STOYANCHEV K T, POPOVA-RALCHEVA S, et al. Behavioral study of mule ducks with subclinical muscular dystrophy under ecological comfort and stress conditions[J]. Bulgarian Journal of Agricultural Science, 2012, 18(4): 511–518. |
| [15] | EL-SHAFAEI H E, SHARAF M M, RASHED R R. The effect of different intervention strategies to alleviate heat stress on behavior, performance and some blood parameters of growing Muscovy ducks[J]. Alexandria Journal of Veterinary Sciences, 2016, 48(2): 69–76. DOI: 10.5455/ajvs. |
| [16] | MACK L A, FELVER-GANT J N, DENNIS R L, et al. Genetic variations alter production and behavioral responses following heat stress in 2 strains of laying hens[J]. Poultry Science, 2013, 92(2): 285–294. DOI: 10.3382/ps.2012-02589 |
| [17] | 胡春红, 张敏红, 冯京海, 等. 偏热刺激对肉鸡休息行为、生理及生产性能的影响[J]. 动物营养学报, 2015, 27(7) :2070–2076. |
| [18] | HERBORN K A, GRAVES J L, JEREM P, et al. Skin temperature reveals the intensity of acute stress[J]. Physiology & behavior, 2015, 152: 225–230. |
| [19] | YANAGI T, XIN H W, GATES R S. A research facility for studying poultry responses to heat stress and its relief[J]. Applied Engineering in Agriculture, 2002, 18(2): 255–262. |
| [20] | GILOH M, SHINDER D, YAHAV S. Skin surface temperature of broiler chickens is correlated to body core temperature and is indicative of their thermoregulatory status[J]. Poultry Science, 2012, 91(1): 175–188. DOI: 10.3382/ps.2011-01497 |
| [21] | TOYOMIZU M, TOKUDA M, MUJAHID A, et al. Progressive alteration to core temperature, respiration and blood acid-base balance in broiler chickens exposed to acute heat stress[J]. The Journal of Poultry Science, 2005, 42(2): 110–118. DOI: 10.2141/jpsa.42.110 |
| [22] | 张少帅, 甄龙, 张敏红, 等. 急性偏热处理对肉仔鸡体热调节功能的影响[J]. 动物营养学报, 2016, 28(2) :402–409. |
| [23] | 韩爱云, 左晓磊, 姚清国, 等. 急性高温对肉鸡生理状态及细胞免疫的影响[J]. 江苏农业科学, 2012, 40(4) :215–217. |
| [24] | WANG S H, CHENG C Y, TANG P C, et al. Differential gene expressions in testes of L2 strain Taiwan country chicken in response to acute heat stress[J]. Theriogenology, 2013, 79(2): 374–382. DOI: 10.1016/j.theriogenology.2012.10.010 |
| [25] | LIN H, ZHANG H F, JIAO H C, et al. Thermoregulation responses of broiler chickens to humidity at different ambient temperatures.Ⅰ.One week of age[J]. Poultry Science, 2005, 84(8): 1166–1172. DOI: 10.1093/ps/84.8.1166 |
| [26] | 邹思湘. 动物生物化学[M]. 4版. 北京: 中国农业出版社, 2005: 138-139. |
| [27] | ZHANG Z Y, JIA G Q, ZUO J J, et al. Effects of constant and cyclic heat stress on muscle metabolism and meat quality of broiler breast fillet and thigh meat[J]. Poultry Science, 2012, 91(11): 2931–2937. DOI: 10.3382/ps.2012-02255 |
| [28] | 郑卓失. 减轻家禽热应激的添加剂研究进展[J]. 中国畜牧杂志, 1992, 28(4) :56–58. |
| [29] | 傅玲玉, 周庆堂, 章怀云, 等. 高温对产蛋鸡的血液生化反应[J]. 中国畜牧杂志, 1988(6) :12–15. |
| [30] | VECEREK V, STRAKOVA E, SUCHY P, et al. Influence of high environmental temperature on production and haematological and biochemical indexes in broiler chickens[J]. Czech Journal of Animal Science, 2002, 47(5): 176–182. |
| [31] | 仲庆振, 王丹, 孙泽威, 等. 急性热应激期间鹅血清生化指标和相关激素变化规律的研究[J]. 中国畜牧杂志, 2013, 49(17) :74–77. |
| [32] | LIN H, DECUYPERE E, BUYSE J. Acute heat stress induces oxidative stress in broiler chickens[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2006, 144(1): 11–17. |
| [33] | KOUBA M, HERMIER D, LE DIVIDICH J. Influence of a high ambient temperature on lipid metabolism in the growing pig[J]. Journal of Animal Science, 2001, 79(1): 81–87. DOI: 10.2527/2001.79181x |
| [34] | 唐丽.热应激对肉种母鸡繁殖性能、相关生理生化和分子指标的影响[D].硕士学位论文.北京:中国农业科学院, 2013. |
| [35] | 刘梅. 急性热应激对肉仔鸡生长性能及脂肪代谢的影响[J]. 动物营养学报, 2011, 23(5) :862–868. |
| [36] | RICQUIER D, BOUILLAUD F. The uncoupling protein homologues:UCP1, UCP2, UCP3, StUCP and AtUCP[J]. Biochemical Journal, 2000, 345(2): 161–179. DOI: 10.1042/bj3450161 |
| [37] | BUSIELLO R A, SAVARESE S, LOMBARDI A. Mitochondrial uncoupling proteins and energy metabolism[J]. Frontiers in Physiology, 2015, 6: 36. |
| [38] | WANG J T, ZHANG X J, XU S W. Effects of cold stress on energy metabolism in the chicken[J]. Chinese Journal of Applied Physiology, 2009, 25(2): 172–176. |
| [39] | TAOUIS M, DE BASILIO V, MIGNON-GRASTEAU S, et al. Early-age thermal conditioning reduces uncoupling protein messenger RNA expression in pectoral muscle of broiler chicks at seven days of age[J]. Poultry Science, 2002, 81(11): 1640–1643. DOI: 10.1093/ps/81.11.1640 |
| [40] | MUJAHID A, SATO K, AKIBA Y, et al. Acute heat stress stimulates mitochondrial superoxide production in broiler skeletal muscle, possibly via downregulation of uncoupling protein content[J]. Poultry Science, 2006, 85(7): 1259–1265. DOI: 10.1093/ps/85.7.1259 |
| [41] | MUJAHID A, AKIBA Y, TOYOMIZU M. Acute heat stress induces oxidative stress and decreases adaptation in young white leghorn cockerels by downregulation of avian uncoupling protein[J]. Poultry Science, 2007, 86(2): 364–371. DOI: 10.1093/ps/86.2.364 |
| [42] | RICQUIER D, MIROUX B, CASSARD-DOULCIER A M, et al. Contribution to the identification and analysis of the mitochondrial uncoupling proteins[J]. Journal of Bioenergetics and Biomembranes, 1999, 31(5): 407–418. DOI: 10.1023/A:1005488105076 |
| [43] | EVOCK-CLOVER C M, POCH S M, RICHARDS M P, et al. Expression of an uncoupling protein gene homolog in chickens[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2002, 133(2): 345–358. |
| [44] | GASPARINO E, DEL VESCO A P, VOLTOLINI D M, et al. The effect of heat stress on GHR, IGF-Ⅰ, ANT, UCP and COXⅢ mRNA expression in the liver and muscle of high and low feed efficiency female quail[J]. British Poultry Science, 2014, 55(4): 466–473. DOI: 10.1080/00071668.2014.925090 |
| [45] | QIN B, SUN W Y, XIA H Z, et al. Effects of cold stress on mRNA level of uncoupling protein 2 in liver of chicks[J]. Pakistan Veterinary Journal, 2014, 34(3): 309–313. |




