2. 河套学院农学系, 临河 015000
2. Department of Agronomy, Hetao College, Linhe 015000, China
沙葱 (Allium mongolicum Regel) 隶属于百合科葱属,又名蒙古韭,是深受草原人民喜爱的食用及药用植物[1]。沙葱主要分布于我国新疆、青海、甘肃、宁夏、陕西、内蒙古等地,在蒙古国的南部戈壁地区和东西伯利亚地区也有分布[2]。沙葱作为草原地区的特色植物,具有独特的风味及药用价值,所以被人们誉为“菜中灵芝”[3]。沙葱中含有丰富的氨基酸、微量元素、蛋白质、脂肪、纤维等[4-5],并且这些营养物质含量均高于其他草原植物[6]。食用沙葱后可降血压、开胃及提高机体的免疫能力[7]。近年来,有关黄酮类化合物对机体免疫调节方面的研究报道逐渐增多。王洪武等[8]发现,淫羊藿总黄酮可提高环隣酰胺所致免疫低下小鼠的免疫细胞数量。姜黄素可抑制Epstein-Barr病毒诱导的人B细胞的恶性增殖[9]。表没食子儿茶素没食子酸酯 (EGCG) 抑制前列腺癌细胞株的生长,并促进其凋亡[10]。黄酮类化合物作为沙葱中重要的活性成分之一[11],具有较强的抗癌、抗肿瘤作用和增强机体免疫功能。沙葱黄酮可增强小鼠体液免疫和细胞免疫功能[12],也具有体外抗菌、抗氧化的作用[11]。机体T细胞是免疫调节中的主要细胞,其过度的增殖与活化都会使机体产生疾病[13-14],所以细胞转化是T细胞发挥作用的关键环节,其中细胞周期是细胞转化的必经之路,细胞周期的变化影响着细胞的转化与增殖[15]。目前沙葱黄酮的提取工艺、结构以及其相关抗氧化能力等活性已被阐明,但对沙葱黄酮的免疫调节功能的研究,尤其对机体淋巴细胞转化及凋亡的研究尚不多见。因此,本试验在饲粮添加沙葱黄酮饲喂肉羊,旨在探究沙葱黄酮对肉羊外周血淋巴细胞转化率及凋亡率的影响,从而验证沙葱黄酮对舍饲肉羊机体是否有免疫调节作用。
1 材料与方法 1.1 材料 1.1.1 沙葱黄酮的制备试验所用沙葱总黄酮由本实验室制备,其提取最佳工艺借鉴萨茹丽[11]的方法。提取方法选择超声波法,提取时间15 min,提取温度40 ℃,乙醇浓度为75%,料液比为1 : 30,沙葱总黄酮得率为12.85 mg/g,为黄色粉末,难溶于水。根据萨茹丽[11]的结构鉴定,其结构中有单糖、3′, 4′-环氧基-7-0-5-甲氧基黄酮醇、7-0-5, 4′-二甲氧基-3氧基羟基黄酮、糖类、卢丁、木犀草素-5′-0-糖葡萄糖-4-羟基苯丙酸、异槲皮苷糖类、金合欢素及黄酮类物质。
1.1.2 试验动物与试验设计试验选取60只6月龄左右、(39.9±3.2) kg的小尾寒羊为动物模型,采用单因素多水平完全区组试验设计,按照出生月龄相近、体重相近的原则,随机分为4组 (每组15只羊),即对照组、试验1组、试验2组、试验3组。对照组饲喂基础饲粮,试验1组、试验2组、试验3组采用逐步混匀法,分别在基础饲粮中添加11、22、33 mg/kg的沙葱总黄酮。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平 (风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验组沙葱总黄酮的添加量是根据前期试验结果确定的,即瘤胃液中添加22 mg/kg沙葱总黄酮能提高绵羊瘤胃微生物发酵参数的产气量、pH及氨态氮、菌体蛋白、挥发性脂肪酸浓度,并发挥其最佳作用[16]。本试验以此结果为参考,选择了11、22、33 mg/kg 3个不同添加量。
1.1.3 试验动物管理及试验样品采集试验期共75 d,其中预试期15 d,在预试期对试验羊进行驱虫、消毒、防疫。正试期60 d,每天06:00、18:00进行饲喂,先粗后精,自由饮水。
正试期第60天,分别从对照组及3个试验组随机挑选5只羊,晨饲前空腹颈静脉无菌采血5 mL,装入5 mL肝素钠抗凝采血管中,低温带回实验室,做后续试验。
1.1.4 试剂及仪器RPMI-1640细胞培养液、胎牛血清均购自Gibco公司;淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司;双抗 (青霉素钠、硫酸链霉素) 购自Invitrogen公司;刀豆蛋白A (ConA) 购自Sigma公司;杜氏磷酸盐缓冲液 (DPBS) 购自Hyclone公司;其他试剂有:噻唑蓝 (MTT)、二甲基亚砜 (DMSO)、RNA酶 (RNase A)、聚乙二醇辛基苯基醚 (Triton X-100,Sigma公司)、细胞凋亡检测试剂盒 (TransDetectTM Annexin V-EGFP/PI Cell Apoptosis Detection Kit,Transgen公司)。
主要设备有:生物安全柜 (AC2-4S1,ESCO公司)、37 ℃恒温CO2培养箱 (HEPA class 100,Thermo公司)、倒置相差显微镜 (IX71,Olympus公司)、全自动多功能酶标仪 (Synergy H4,BIOTEK公司)、水平垂直离心机、流式细胞仪 (BD公司)。
1.2 方法 1.2.1 饲粮营养水平饲粮营养水平参考张丽英[17]的方法测定。粗蛋白质含量的测定选择凯氏定氮法进行操作。采用范氏 (Van Soest) 洗涤纤维分析法测定中性洗涤纤维 (NDF) 和酸性洗涤纤维 (ADF) 含量。通过高锰酸钾滴定法测定钙含量。磷含量用钼黄比色法进行测定。
1.2.2 肉羊外周血淋巴细胞的分离将血液在22~26 ℃ 400×g垂直离心10 min,并将离心后的血液取出,弃掉上层血浆。之后在下层血液中加入等体积的DPBS,吹打混匀,稀释血液。将稀释过的5 mL血液缓慢加入到装有4 mL淋巴细胞分离液的离心管中,用垂直离心机在22 ℃条件下以800×g离心40 min。将离心管取出,用移液枪吸取第2层的白细胞层,装入15 mL离心管中。收集的白细胞中加入5倍体积的DPBS,混匀后,以800×g离心5 min。经过2次重复清洗后弃上清,获得白细胞沉淀。将收集好的白细胞置于含有5%胎牛血清和1%双抗的RPMI-1640细胞培养液中待用。
1.2.3 肉羊外周血淋巴细胞转化率和细胞周期的测定肉羊外周血淋巴细胞转化率的测定方法采用MTT法,即从外周血淋巴细胞液取100 μL接种到96孔板中,再加入10 μg/mL ConA 100 μL,于37 ℃ 5% CO2条件下培养48 h。培养结束前4 h,每孔加入5 mg/mL MTT 20 μL,置培养箱中再孵育4 h之后,取出细胞液,弃上清液,每孔加入150 μL DMSO,振荡摇匀,用酶标仪在570 nm处测定吸光度值 (OD570 nm),按以下公式计算淋巴细胞转化率。

|
从外周血淋巴细胞液取100 μL接种到96孔板中,再加入10 μg/mL ConA 100 μL,于37 ℃ 5% CO2条件下培养12 h,吸出培养基,用DPBS清洗细胞2次,并收集细胞,用1 mL染色液 (10 mg/mL的RNA酶100 μL,1 mg/mL的碘化丙啶 (PI) 500 μL,聚乙二醇辛基苯基醚25 μL,DPBS 9.4 mL) 重悬细胞,染色15 min后,立即用流式细胞仪检测细胞周期。
1.2.4 肉羊外周血淋巴细胞凋亡率的测定将外周血淋巴细胞悬浮液置于离心管中以800×g离心5 min,弃去培养液,用预冷的DPBS进行2次漂洗细胞后弃上清,收集细胞。在细胞中加入100 μL预冷的膜联蛋白V (Annexin V) 结合缓冲液,重悬细胞。加入5 μL Annexin V-增强绿色荧光蛋白 (EGFP) 和5 μL PI,轻轻混匀。混匀之后,在室温条件下 (22~25 ℃) 避光反应15 min后加入400 μL预冷的Annexin V结合缓冲液,轻轻混匀,将样品避光放置于冰上,1 h之内用流式细胞仪进行检测,从仪器上读取淋巴细胞凋亡率。
1.3 数据分析数据分析使用SAS 9.0软件统计分析,数据进行单因素方差分析,用Duncan氏法进行组间比较,以“平均值±标准差”表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析 2.1 沙葱黄酮对肉羊外周血淋巴细胞转化率的影响由表 2可见,试验1组及试验2组的外周血淋巴细胞转化率高于对照组,但是差异不显著 (P>0.05)。试验3组的外周血淋巴细胞转化率最高,并显著高于对照组 (P < 0.05)。
|
|
表 2 沙葱总黄酮对肉羊外周血淋巴细胞转化率的影响 Table 2 Effects of flavonoids from Allium mongolicum Regel on lymphocyte transformation ratio in peripheral blood of meat sheep (n=5) |
图 1为流式细胞仪检测的外周血淋巴细胞细胞周期。由图 2可见,饲粮添加沙葱黄酮后对肉羊外周血淋巴细胞有一定的影响,试验组的G0/G1期细胞比例高于对照组,其中试验3组最高,但各组间差异不显著 (P>0.05)。S期细胞比例较G0/G1期大幅降低,试验组S期细胞比例高于对照组,并且试验3组的显著高于其他各组 (P<0.05)。G2/M期时,细胞比例高于S期,并且试验3组的G2/M期细胞比例最高,显著高于其他各组 (P<0.05)。由此可看出,饲粮添加沙葱黄酮后对肉羊外周血淋巴细胞G0/G1期细胞比例无显著影响,而饲粮添加33 mg/kg沙葱黄酮能够显著提高S期细胞比例,并显著促进细胞周期向G2/M期转化,促进细胞分裂。也就是说沙葱黄酮进入机体后可促进动物淋巴细胞DNA的修复,从而维持机体淋巴细胞周期的进程,促进淋巴细胞细胞转化。
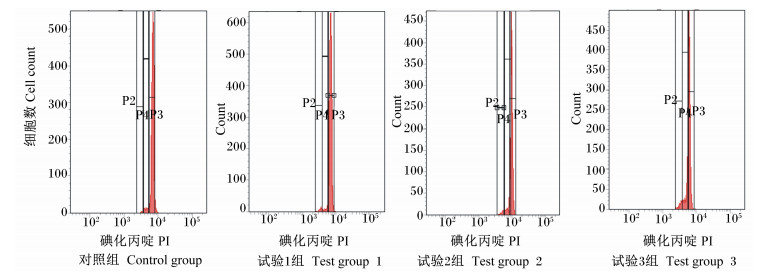
|
P2:G0/G1期,P3:S期,P4:G2/M期。 P2: G0/G1 phase, P3: S phase, P4: G2/M phase. 图 1 流式细胞仪检测肉羊外周血淋巴细胞细胞周期 Figure 1 Cell cycle of lymphocyte in peripheral blood of meat sheep detected by flow cytometry |
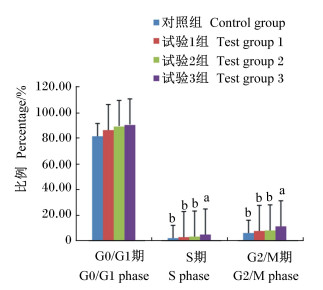
|
数据柱形标注不同小写字母表示差异显著(P<0.05)。 Data columns with different small letter superscripts mean significant difference (P<0.05). 图 2 沙葱总黄酮对肉羊外周血淋巴细胞细胞周期的影响 Figure 2 Effects of flavonoids from Allium mongolicum Regel on cell cycle of lymphocyte in peripheral blood of meat sheep |
图 3、图 4、图 5分别为经流式细胞仪检测的未染色的外周血淋巴细胞,单染EGFP后的外周血淋巴细胞和单染PI后的外周血淋巴细胞。
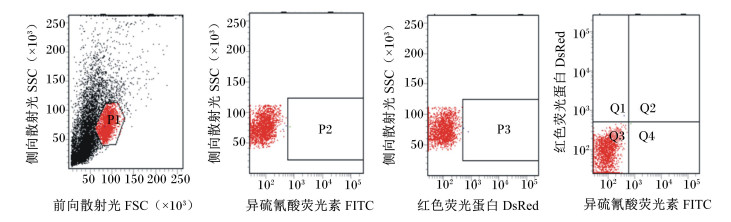
|
P1:淋巴细胞群,P2:未染色区域,P3:红色荧光蛋白区域,Q1:死亡细胞区域,Q2:凋亡细胞区域,Q3:活细胞区域,Q4:早期凋亡细胞区域。 P1: lymphocytes, P2: un-strained area, P3: area of DsRed, Q1: dead cell area, Q2: apoptosis cell area, Q3: live cell area, Q4: early apoptosis cell area. 图 3 流式细胞仪检测未染色肉羊外周血淋巴细胞 Figure 3 The un-strained lymphocyte in peripheral blood of meat sheep detected by flow cytometry |
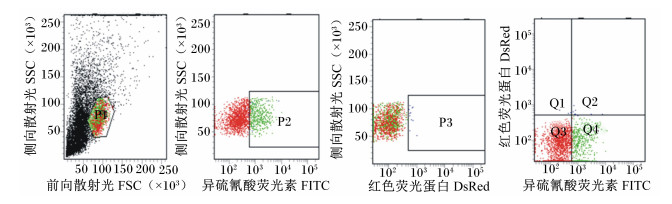
|
P1:淋巴细胞群,P2:EGFP染色区域,P3:红色荧光蛋白区域,Q1:死亡细胞区域,Q2:凋亡细胞区域,Q3:活细胞区域,Q4:早期凋亡细胞区域。 P1: lymphocytes, P2: EGFP-strained area, P3: area of DsRed, Q1: dead cell area, Q2: apoptosis cell area, Q3: live cell area, Q4: early apoptosis cell area. 图 4 流式细胞仪检测单染EGFP后的肉羊外周血淋巴细胞 Figure 4 EGFP-stained lymphocyte in peripheral blood of meat sheep detected by flow cytometry |
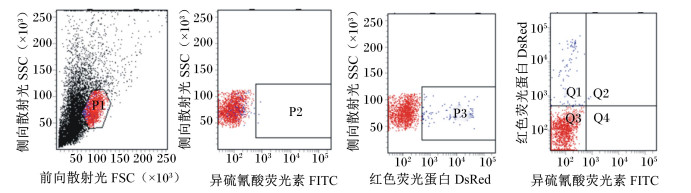
|
P1:淋巴细胞群,P2:PI染色区域,P3:红色荧光蛋白区域,Q1:死亡细胞区域,Q2:凋亡细胞区域,Q3:活细胞区域,Q4:早期凋亡细胞区域。 P1: lymphocytes, P2: PI-strained area, P3: area of DsRed, Q1: dead cell area, Q2: apoptosis cell area, Q3: live cell area, Q4: early apoptosis cell area. 图 5 流式细胞仪检测单染PI后的肉羊外周血淋巴细胞 Figure 5 PI-strained lymphocyte in peripheral blood of meat sheep detected by flow cytometry |
由表 3可看出,饲粮添加沙葱黄酮对肉羊外周血淋巴细胞凋亡率有一定的影响,试验3组的凋亡率显著高于其他各组 (P < 0.05),试验2组显著高于对照组和试验1组 (P < 0.05),对照组高于试验1组,但是差异不显著 (P>0.05)。
|
|
表 3 沙葱总黄酮对肉羊外周血淋巴细胞凋亡率的影响 Table 3 Effect of flavonoids from Allium mongolicum Regel on lymphocyte apoptosis ratio in peripheral blood of meat sheep (n=5) |
淋巴细胞在体外培养时,受到刺激物的刺激可表现为细胞体积增大,代谢旺盛,蛋白质和核酸合成上升,即淋巴细胞的转化和增殖,此现象称为淋巴细胞转化。淋巴细胞转化率的高低可以反映机体的免疫水平。淋巴细胞转化率是评价机体免疫功能的重要指标之一。
当机体免疫系统受到外来抗原刺激后会通过细胞转化和增殖等反应来保证机体正常生理功能[18]。Geetha等[19]证明,沙棘叶及沙棘果乙醇提取物能够抑制由重铬酸钾 (Kr6+) 引起的细胞凋亡和阻止Kr6+与ConA导致的细胞增殖,从而起到免疫调节作用。刘荣珍等[20]发现,沙棘颗粒可提高ConA诱导的小鼠脾淋巴细胞转化率。幼犬饲粮添加0.3%茶多酚可提高淋巴细胞转化率,并在整个试验期内均保持较高水平,从而提高免疫能力[21]。也有研究发现,不同剂量的蒙药总黄酮可显著提高小鼠淋巴细胞转化率,并促进小鼠免疫力[22]。本试验结果表明,饲粮添加33 mg/kg沙葱黄酮肉羊外周血淋巴细胞转化率最高,其值均显著高于对照组,饲粮添加11和22 mg/kg沙葱黄酮肉羊的淋巴细胞转化率虽然高于对照组,但其差异不显著。细胞转化和增殖是一个很复杂的生物学过程,这与细胞周期的正常运行有密切的关系[23]。细胞周期分为有丝分裂期和分裂间期,而标准的细胞周期可划分为4个不同时期,即G1期、S期、G2期和M期[24]。黄酮类化合物可影响病态细胞和正常细胞的细胞周期进展,如山奈酚可抑制小鼠T淋巴细胞进入细胞分裂期[25];鹰嘴豆芽素A对BALB/c小鼠T细胞的活化、增殖以及细胞周期有一定的免疫抑制作用[26],而沙葱黄酮促进细胞增殖的原因可能与沙葱黄酮中的免疫相关活性成分相关。由本试验的结果看,饲粮添加沙葱黄酮后对肉羊外周血淋巴细胞的细胞周期有一定的影响,通过流式细胞仪检测后发现,33 mg/kg沙葱黄酮组显著提高S期和G2/M期的细胞比例。
3.2 沙葱黄酮对肉羊外周血淋巴细胞凋亡率的影响细胞凋亡又称之为程序性死亡,当生理或病理刺激时都可引起细胞凋亡,它是正常细胞自发的死亡过程[27]。细胞凋亡与细胞死亡是2个完全不同的概念,凋亡是由机体自身基因决定的细胞自身破坏过程,则细胞死亡为受到外界刺激后引起的细胞死亡[28]。在个体发育过程中细胞有丝分裂固然是十分重要的事件,但同时细胞凋亡也是不可缺少。多细胞生物个体的正常发育、自稳平衡以及抵御外界多种干扰等方面,细胞凋亡起着不容忽视的作用,尤其是淋巴细胞的克隆选择过程中,细胞凋亡起着关键的作用。机体通过细胞凋亡将不再需要的细胞清除,从而不引起炎症反应。鸡豆黄素A及芒柄花黄素可通过激活芳香烃受体而诱导细胞凋亡[29]。高剂量的毛橘红总黄酮可显著降低酒精性肝损伤大鼠的干细胞凋亡率,从而起到了对肝损伤的治疗作用[30]。本试验结果发现,饲粮添加沙葱黄酮对肉羊外周血淋巴细胞凋亡有促进作用,其中22及33 mg/kg沙葱黄酮的影响最大。
4 结论饲粮中添加11~33 mg/kg沙葱黄酮可促进肉羊外周血淋巴细胞转化,并使细胞向DNA合成期转化,促进细胞分裂,对细胞凋亡有显著促进作用,以添加33 mg/kg沙葱黄酮的效果最佳。
| [1] | 陈山, 满良, 金山. 蒙古高原民族植物学[J]. 植物科学进展, 2000(3) :245–251. |
| [2] | 陈山. 中国草地饲用植物资源[M]. 沈阳: 辽宁民族出版社, 1994: 431. |
| [3] | 蒋涛, 敖长金. 沙葱的研究进展[J]. 现代农业科技, 2008(9) :10–11. |
| [4] | 斯琴巴特尔, 刘新民. 蒙古韭的营养成分及民族植物学[J]. 中国草地, 2002, 24(3) :52–54. |
| [5] | 巴俊杰, 张春丽, 高建萍, 等. 沙葱营养成分分析[J]. 内蒙古农业大学学报, 2002, 23(4) :114–115. |
| [6] | 敖长金. 沙葱化学成分及其生物学功能研究进展[J]. 饲料工业, 2010, 31(18) :1–5. |
| [7] | 木其尔, 敖长金, 萨茹丽, 等. 沙葱总黄酮对肉羊抗氧化能力的影响[J]. 动物营养学报, 2016, 28(6) :1823–1831. |
| [8] | 王洪武, 贾亮亮, 徐媛青, 等. 淫羊藿总黄酮对环磷酰胺致免疫低下小鼠的免疫调节作用[J]. 天津医药, 2010, 38(12) :1068–1071. |
| [9] | RANJAN D, SIQUIJOR A, JOHNSTON T D, et al. The effect of curcumin on human B-cell immortalization by Epstein-Barr virus[J]. The American Surgeon, 1998, 64(1): 47–51. |
| [10] | LEE S C, CHAN W K, LEE T W, et al. Effect of a prodrug of the green tea polyphenol (-)-epigallocatechin-3-gallate on the growth of androgen-independent prostate cancer in vivo[J]. Nutrition and Cancer, 2008, 60(4): 483–491. DOI: 10.1080/01635580801947674 |
| [11] | 萨茹丽.沙葱黄酮提取工艺优化、结构鉴定及其相关生物活性研究[D].博士学位论文.呼和浩特:内蒙古农业大学, 2014. |
| [12] | 赵春艳.沙葱中黄酮类化合物的分离纯化、结构鉴定及其对小鼠免疫抗氧化机能影响的研究[D].博士学位论文.呼和浩特:内蒙古农业大学, 2008. |
| [13] | FERENCZI K, BURACK L, POPE M, et al. CD69, HLA-DR and the IL-2R identify persistently activated T cells in psoriasis vulgaris lesional skin:blood and skin comparisons by flow cytometry[J]. Journal of Autoimmunity, 2000, 14(1): 63–78. DOI: 10.1006/jaut.1999.0343 |
| [14] | LECKIE M J, JENKINS G R, KHAN J, et al. Sputum T lymphocytes in asthma, COPD and healthy subjects have the phenotype of activated intraepithelial T cells (CD69+ CD103+)[J]. Thorax, 2003, 58(1): 23–29. DOI: 10.1136/thorax.58.1.23 |
| [15] | 李林, 曾耀英, 黄秀艳, 等. 黄芩苷对小鼠T淋巴细胞体外增殖和细胞周期的影响[J]. 细胞与分子免疫学杂志, 2009, 25(1) :75–78. |
| [16] | 包玲玲.沙葱黄酮类化合物对绵羊瘤胃发酵、内环境参数及纤维素降解的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学, 2015. |
| [17] | 张丽英. 饲料分析及饲料质量检测技术[M]. . |
| [18] | 陈清华, 刘祝英, 贺建华. 牛膝多糖对仔猪淋巴细胞增殖作用和细胞因子分泌量的影响[J]. 动物营养学报, 2008, 20(6) :712–717. |
| [19] | GEETHA S, RAM M S, SINGH V, et al. Effect of seabuckthorn on sodium nitroprusside-induced cytotoxicity in murine macrophages[J]. Biomed & Pharmacother, 2002, 56(9): 463–467. |
| [20] | 刘荣珍, 李凤文, 苏爱荣, 等. 沙棘对小鼠免疫调节作用的实验研究[J]. 中国热带医学, 2005, 5(9) :1950–1951. |
| [21] | 徐玮, 王利华, 聂宁. 茶多酚对幼犬淋巴细胞转化率的影响[J]. 饲料工业, 2009(1) :58–59. |
| [22] | 晨阳, 杨丽敏, 陶格斯, 等. 蒙药总黄酮对淋巴细胞转化和巨噬细胞吞噬功能的影响[J]. 山东医药, 2010, 50(4) :45–46. |
| [23] | 王雯婕, 陈剑, 刘小勇, 等. 白藜芦醇对视网膜色素上皮细胞增殖的影响[J]. 中国病理生理杂志, 2014, 30(10) :1839–1844. |
| [24] | 汤明惠, 张兴夫, 丹妮, 等. 甘氨酸对奶牛乳腺上皮细胞增殖与凋亡的影响[J]. 动物营养学报, 2014, 26(8) :2162–2168. |
| [25] | 慕静静, 曾耀英, 黄秀艳, 等. 山奈酚对小鼠T淋巴细胞体外活化、增殖和细胞周期的影响[J]. 细胞与分子免疫学杂志, 2009, 25(12) :1106–1108. |
| [26] | 林长乐, 曾耀英, 曾祥凤, 等. 鹰嘴豆芽素A对小鼠T淋巴细胞体外活化增殖和细胞周期的影响[J]. 暨南大学学报:医学版, 2007, 28(2) :115–119. |
| [27] | OUYANG L, SHI Z, ZHAO S, et al. Programmed cell death pathways in cancer:a review of apoptosis, autophagy and programmed necrosis[J]. Cell Proliferation, 2012, 45(6): 487–498. DOI: 10.1111/cpr.2012.45.issue-6 |
| [28] | GUERTLER P, BRAND I C, MEYER H H D, et al. Feeding genetically modified maize (MON810) to dairy cows:comparison of gene expression pattern of markers for apoptosis, inflammation and cell cycle[J]. Journal für Verbraucherschutz und Lebensmittelsicherheit, 2012, 7(3): 195–202. DOI: 10.1007/s00003-012-0778-8 |
| [29] | MEDJAKOVIC S, JUNGBAUER A. Red clover isoflavones biochanin A and formononetin are potent ligands of the human aryl hydrocarbon receptor[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2007, 108(1/2): 171–177. |
| [30] | 肖凤霞, 邓韬, 邓少东, 等. 毛橘红总黄酮对酒精性肝损伤大鼠肝细胞凋亡的影响[J]. 广东药学院学报, 2012, 28(3) :316–318. |




