2. 广东温氏食品集团有限公司, 新兴 527400
2. Guangdong WENS Group Co., Ltd., Xinxing 527400, China
木聚糖是半纤维素的一种,由β-D-吡喃型木糖单元通过1,4-糖苷键相连而成。饲粮中的木聚糖可增加消化道食糜黏度,影响营养物质的消化吸收,促进肠道有害微生物的繁殖,从而增加动物发病率[1]。木聚糖酶可以降解饲粮中的木聚糖,从而降低食糜黏度,促进有益菌的增殖,减少有害微生物的定植,维持肠道正常菌群结构,消除木聚糖的不利影响。不同来源木聚糖酶的理化性质和酶促反应可能存在较大差异,于旭华等[2]测定了6种木聚糖酶的酶学特性,发现其最适温度和最适pH以及高温耐受性存在差异。为提高酶制剂催化水解作用的高效性,冯定远[3]提出组合酶的概念,利用酶催化的协同作用,选择具有互补性的2种或2种以上酶配合而成组合酶制剂,从而提高酶制剂的催化率。代发文等[4]在麻羽肉鸡饲粮中添加100 mg/kg细菌性木聚糖酶+100 mg/kg真菌性木聚糖酶,其生产性能优于单一木聚糖酶组。据研究,当用纤维素酶与木聚糖酶比例为7 : 3的组合酶水解菜籽粕时,其还原糖增长率显著高于单酶[5]。木聚糖酶的水解产物以低聚木糖为主,而低聚木糖是一类已被证实可以选择性地促进双歧杆菌等有益菌增殖的寡糖[6],并可减少结肠癌的发病风险,其中木二糖已发现在这些方面表现出最佳的效果[7-8]。低于4个聚合度的低聚木糖能够促进双歧杆菌的增殖[9],其主要活性成分是木二糖和木三糖,木三糖对双歧杆菌的增殖效果最好,其次是木二糖和木寡糖[10]。张军华等[11]研究表明,5 g/L高纯度木二糖和木三糖均能在体外促进青春双歧杆菌增殖。马岩[12]的试验显示,木二糖和木三糖均具有促进乳酸杆菌和枯草芽孢杆菌增殖的作用,且可以降低大肠杆菌和沙门氏菌对细胞的黏附率。有的寡糖有直接抑制病原菌黏附肠上皮细胞的作用[13],低聚木糖与李斯特杆菌混合孵育Caco-2细胞,与对照组相比,低聚木糖组黏附到细胞的细菌数量降低了2/3[14]。能否通过添加不同来源的木聚糖酶来分解木聚糖,对水解产物的组成产生影响,从而发挥更大的益生作用,目前国内外还没有见到此方面的报道。本试验通过对木聚糖水解产物进行分析,探究不同来源木聚糖酶及其组合对木聚糖水解产物组成的影响,并用所得木聚糖水解产物培养细菌,探究其对有害菌和有益菌增殖的影响,然后进一步通过细菌黏附性试验研究木聚糖水解产物对大肠杆菌黏附性的影响,为研究木聚糖酶对肠道菌群结构调控的作用机理提供科学依据。
1 材料与方法 1.1 木聚糖酶木聚糖酶A和木聚糖酶B分别来源于毕赤酵母和米曲霉,参照GB/T 23874-2009的方法测得木聚糖酶A和木聚糖酶B的活性分别为14 232、7 088 U/g。试验设5组,各组均保持酶的总活性为12 088 U/g,酶源分别为木聚糖酶A、木聚糖酶B、组合酶1(木聚糖酶A :木聚糖酶B=3 : 7)、组合酶2(木聚糖酶A :木聚糖酶B=1 : 1)、组合酶3(木聚糖酶A :木聚糖酶B=7 : 3)。分别称取1 g上述5个组的酶源溶于100 mL磷酸盐缓冲液 (PBS) 中,再加入3 g木聚糖,反应2 h即得酶解液,采用高效液相色谱 (HPLC) 仪测定酶解液中木聚糖水解产物的组成,以Ecosil氨基柱 (250 mm×4.6 mm) 为分析柱,流动相为乙腈+水 (67 : 33),检测器温度为35 ℃,流速为1 mL/min,进样量为10 μL,采用外标法测定。木聚糖、木糖均购自Sigma公司,木二糖、木三糖、木四糖均购自Floko公司。
1.2 木聚糖水解产物将所得木聚糖水解产物经0.22 μm过滤膜过滤除菌,保存于4 ℃冰箱。取一定体积 (V, mL) 的木聚糖水解产物测定总还原糖含量,加入等体积的8% H2SO4溶液,充分摇匀,121 ℃保温1 h。以15% NaOH溶液中和至pH为6.5~7.0,用蒸馏水定容 (V0, mL),使其总还原糖含量为0.2~2.0 g/L。采用3, 5-二硝基水杨酸 (DNS) 法[6]测定中和液中各还原糖含量 (C, g/L),则木聚糖水解产物中各还原糖 (TC, g/L) 含量按照以下公式计算:
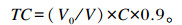
|
式中0.9为将单糖换算为聚糖的系数。
1.3 细菌培养大肠杆菌购自广东省微生物菌种保藏中心,乳酸杆菌由广东省农科院畜牧所馈赠,枯草芽孢杆菌为本实验室自行分离。
从-80 ℃冰箱中取出冻存的菌株,用灭菌环蘸取少许菌液于平板上划线,大肠杆菌和枯草芽孢杆菌接种于LB琼脂,乳酸杆菌接种于MRS琼脂,平板倒置于37 ℃细菌培养箱培养过夜。挑取生长状况较好的单个菌落进行液体培养基扩增,大肠杆菌和枯草芽孢杆菌于37 ℃、170 r/min摇床内过夜培养,乳酸杆菌在37 ℃细菌培养箱中静止过夜培养。
测定木聚糖水解产物对细菌增殖的影响时,取培养的菌液接种到新的液体培养基中,接种量为0.5%。5个试验组的液体培养基中加入对应的木聚糖水解产物,水解产物终浓度为0.5%(质量体积分数),对照组加入等量的PBS,放入37 ℃细菌培养箱培养。根据3种细菌在全波长酶标仪上的最大吸收值来确定吸收波长,在不同时间点取菌液测定吸光度 (OD) 值,同时用培养基作空白对照。
1.4 鸡胚肠道上皮细胞 (intestinal epithelial cells, IEC) 培养取18日龄鸡胚,分离小肠,0.1%Ⅱ型胶原酶消化50 min,过滤,离心收集细胞,具体操作参考文献[15]。将冻存的细胞复苏,完全培养基为10%血清+0.5%青-链霉素+低糖 (1 g/mL葡萄糖) DMEM培养基,接种于25 cm2细胞瓶中,在37 ℃、5% CO2培养箱中培养,细胞长至瓶底面积的80%即可传代。将细胞悬液以1×105个/mL的密度接种于6孔板,每孔3 mL,待细胞贴壁铺满后,弃去培养基,用DMEM培养基冲洗3遍,进行不同处理。
1.5 木聚糖水解产物对大肠杆菌黏附率影响的测定将大肠杆菌接种于LB培养基中,置于空气摇床培养,培养至所需浓度后,经6 000 r/min离心10 min,弃上清,用无菌PBS漂洗细菌,再离心,重复3次。最后用无菌DMEM培养基调节菌液浓度为1×108 CFU/mL。经漂洗过的6孔板细胞每孔加入混合好的1 mL菌液与对应的木聚糖水解产物,水解产物终浓度为0.5%(质量体积分数),对照组不添加菌液中不添加木聚糖水解产物,放入培养箱继续培养45 min,取出,用PBS冲洗细胞3次以除去未黏附的细菌,然后加入含有1% Triton X-100的PBS 0.2 mL裂解细胞,反应10 min后,再加入1.3 mL PBS吹打混匀,吸出各孔悬液,用PBS稀释100倍后进行细菌涂布,在37 ℃下培养48 h后计数。每个样品做2个平行。根据以下公式计算黏附率:
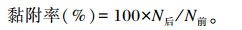
|
式中:N后为菌体黏附后的活菌数 (CFU/mL);N前为加入的活菌数 (CFU/mL)。
1.6 数据统计与分析数据采用SPSS 20.0统计软件中的ANOVA过程进行单因素方差分析,并进行Duncan氏法多重比较检验,结果用平均值±标准误 (mean±SE) 表示,P < 0.05为差异显著。
2 结果与分析 2.1 不同来源木聚糖酶及其组合对木聚糖水解产物组成的影响由表 1可知,各组的水解木聚糖产物都以木二糖和木三糖为主。木聚糖酶A、木聚糖酶B、组合酶1、组合酶2、组合酶3组的木二糖和木三糖的总含量分别为95.70%、86.79%、93.11%、94.55%和87.55%,木二糖的含量分别为50.08%、42.64%、44.60%、44.21%和40.88%,木三糖的含量分别为45.62%、44.15%、48.51%、50.34%和46.67%。其中。以木聚糖酶A组产木二糖最多,以组合酶2组产木三糖最多,且组合酶组的木三糖含量均高于单酶组。
|
|
表 1 不同来源木聚糖酶及其组合对木聚糖水解产物组成的影响 Table 1 Effects of different sources of xylanase and their combinations on xylan hydrolysate composition |
将木聚糖水解产物加入到细菌的培养基中,培养细菌后分别测定菌液的OD值,结果见表 2。
|
|
表 2 木聚糖水解产物对细菌增殖的影响 Table 2 Effects of xylan hydrolysate on bacteria proliferation |
大肠杆菌增殖试验中,培养至5 h时,除木聚糖酶A组,其余试验组菌液的OD值显著高于对照组 (P < 0.05);培养至8 h时,各试验组菌液的OD值均显著高于对照组 (P < 0.05);但是当培养至20 h时,菌液的OD值在各组之间差异不显著 (P>0.05)。
枯草芽孢杆菌增殖试验中,培养至7 h时,各试验组菌液的OD值都显著低于对照组 (P < 0.05);培养至24 h时,各试验组菌液的OD值都显著高于对照组 (P < 0.05);培养至30 h时,各试验组菌液的OD值都显著高于对照组 (P < 0.05),且组合酶2组菌液的OD值显著高于其余试验组 (P < 0.05)。
乳酸杆菌增殖试验中,培养至3 h时,对照、木聚糖酶A、木聚糖酶B和组合酶2组菌液的OD值均显著高于组合酶1和组合酶3组 (P < 0.05);培养至13、17 h时,各试验组菌液的OD值均显著高于对照组 (P < 0.05)。
2.3 木聚糖水解产物对大肠杆菌对IEC黏附性的影响由表 3可知,与对照组相比,加入木聚糖酶解产物的各试验组中大肠杆菌对IEC的黏附率均显著降低 (P < 0.05),但各试验组之间没有显著差异 (P>0.05)。
|
|
表 3 木聚糖水解产物对大肠杆菌对IEC黏附性的影响 Table 3 Effects of xylan hydrolysate on the adhesion of Escherichia coli to IEC |
不同菌源表达的木聚糖酶有不同的酶学特性,表现为最适pH、等电点、米氏常数的不同[16-18],此外还有不同的酶结合位点和酶切位点。Meagher等[19]指出黑曲霉产生的内切型木聚糖酶有8个结合位点;Vršanská等[20]发现黑曲霉来源的酸性木聚糖酶有7个亚位点;而Biely等[21]也发现来源于隐球菌的内切型木聚糖酶有4个与底物结合有关的亚位点。有些酶的酶切位点的特异性还与木聚糖的支链结构有关,似乎这些取代基有助于酶的催化基团的定位[22],如黑曲霉的2个木聚糖酶所催化的反应产物中并没有阿拉伯糖,而且对去除了阿拉伯糖残基的木寡糖作用很小或不起作用,表明其作用位点要求其近旁有阿拉伯糖残基的存在[23]。因而,不同来源的木聚糖酶其分解木聚糖后水解产物的组成也会有所不同。本试验研究了不同菌源表达的木聚糖酶及其组合对木聚糖水解产物组成的影响。试验结果发现,2种单酶的产物都以木二糖和木三糖为主,与石波等[24]的研究结果一致。组合酶组的木三糖含量均高于单酶组,其中组合酶2组的木三糖含量最高,达到50.34%,较木聚糖酶A和木聚糖酶B组分别提高了5.27%和6.09%,但3个组合酶组的木二糖含量都低于木聚糖酶A,木聚糖酶A组总低聚糖的产量最多,其次是组合酶1组。结果产生的原因可能是2种单酶间具有不同的酶切位点特异性,当二者同时分解木聚糖时,可彼此影响底物的生成,最终影响产物的组成。本试验结果可以为生产特定组分含量的低聚木糖提供参考,即要获得更多木二糖时,可用木聚糖酶A来水解木聚糖,要获得更多木三糖时,可以将木聚糖酶A与木聚糖酶B按照1 : 1的组合来水解木聚糖。
3.2 木聚糖水解产物对细菌增殖的影响在众多双歧因子中,低聚木糖因其低热值、难消化性和对双歧杆菌的高选择增殖性备受关注。低聚木糖的生产目前常用的方法有微波法、酸解法、酶解法等,而酶解法因其成本低、安全、效率高而应用最为广泛[25]。目前报道的低聚木糖的生产采用的酶解法都是应用单一酶,而不同菌源表达的木聚糖酶对木聚糖水解产物的影响还没有相关报道。
木聚糖酶水解木聚糖后的低聚木糖包含多个组分,一般认为聚合度在2~7之间的低聚木糖才有益生作用[26]。但单一组分的低聚木糖的生物活性被研究报道的很少,主要原因是低聚木糖单一组分之间除分子质量有微小差别外,其理化性质十分接近,没有十分有效的分离手段将各组分分离[6]。目前的研究发现,低聚木糖可以有效地促进青春双歧杆菌、婴儿双歧杆菌和长双歧杆菌的增殖[27],而肠道有害菌群对低聚木糖的利用率很差。本试验发现,木聚糖水解产物对大肠杆菌的增殖在培养至5和8 h时得到促进,但在20 h时各试验组与对照组没有显著差异,而马岩[12]的试验结果显示木二糖和木三糖对大肠杆菌和沙门氏菌的增殖均没有促进作用。木聚糖水解产物对乳酸杆菌和枯草芽孢杆菌均有显著的促进作用,且水解产物组分含量不同,其促进作用也不同。本试验中木聚糖酶A对乳酸杆菌的增殖效果最好,木聚糖酶A与木聚糖酶B以1 : 1组合对枯草芽孢杆菌的增殖效果最好,结合木聚糖水解产物的组成中木聚糖酶A组产木二糖最多,组合酶2组产木三糖最多进行分析,木二糖可能为本试验所用乳酸杆菌的最优糖源,而木三糖则可能为本试验所用枯草芽孢杆菌的最优糖源,与马岩[12]的试验结果一致。
3.3 木聚糖水解产物对大肠杆菌对IEC黏附性的影响细菌在肠道内发挥作用的前提是其能够在肠道体内成功定植,定植后的细菌可以免于肠道蠕动等对它的排除作用,而微生物黏附与宿主细胞是定植的第1步[28]。病原菌菌体表面与宿主细胞表面特异性寡糖配体结合的蛋白,常被称为黏附素、凝集素或血凝素。大多数黏附素可以与含有3~5个单糖的特定寡糖片段相结合[29]。已有研究证明,乳源性寡糖可以抑制病原菌在肠道体内定植[30]。目前认为乳源性寡糖发挥作用的基团有唾液酸、N-乙酰基葡萄糖、L-岩藻糖、半乳糖等[31],其中乙酰化的甘露糖和葡萄糖醛胺是合成唾液酸的主要原料[32]。例如,壳寡糖含有肠道黏蛋白的组分N-乙酰氨基葡糖,可以作为病原菌的黏附受体[33-34],能够与病原菌的黏附素结合,从而抑制病原菌在肠道内的定植,使其随着肠道的蠕动而排出体外。尽管大多数的病原菌存在多种黏附素,能够识别和结合细胞上各种寡糖片段,在体内利用单一的寡糖受体类似物加上机体自身的清除机制,足够使得该病原菌的定值受到影响[28]。Ebersbach等[14]的研究表明,低聚木糖可以减少李斯特菌对Caco-2细胞的黏附,显著降低李斯特菌黏附素inla和lap的表达,这可能是试验中饲喂低聚木糖的豚鼠感染李斯特杆菌的严重程度降低的原因[35],低聚木糖通过阻碍李斯特杆菌黏附到肠道上皮,和/或通过改变细菌的表面结构降低细菌的黏附能力。此外,由低聚木糖增殖产生的双歧杆菌,还可协同其他肠道菌群促进肠道蠕动,通过竞争肠道营养和肠上皮表面的黏附位点,减少致病菌的附着机会[36]。本试验发现木聚糖水解产物同样能降低大肠杆菌对细胞的黏附率,最高可降低27.27%。各试验组木聚糖水解产物降低大肠杆菌黏附IEC的效果没有显著差异。马岩[12]的试验中,木三糖对大肠杆菌黏附上皮细胞的抑制率显著高于木二糖,本试验也有这一趋势,3个组合酶组的木三糖含量均高于单酶组,同时大肠杆菌对IEC的黏附率均在数值上低于单酶组。
4 结论①不同来源木聚糖酶及其组合水解木聚糖的主要产物是木二糖和木三糖,其中以木聚糖A产木二糖最多,木聚糖酶A与木聚糖酶B以1 : 1组合产木三糖最多。
②不同来源木聚糖酶及其组合所得木聚糖水解产物均能促进枯草芽孢杆菌和乳酸杆菌的增殖,其中木聚糖酶A与木聚糖酶B以1 : 1组合对枯草芽孢杆菌增殖的促进作用最好,木聚糖酶A对乳酸杆菌增殖的促进作用最好;各木聚糖水解产物在培养后期对大肠杆菌的增殖没有促进作用。
③不同来源木聚糖酶及其组合所得木聚糖水解产物均能显著抑制大肠杆菌对IEC的黏附,但各木聚糖水解产物之间的抑制作用没有显著差异。
| [1] | 谭权, 张克英. 木聚糖的抗营养作用[J]. 中国家禽, 2008, 30(12) :55–57. |
| [2] | 于旭华, 冯定远.真菌性和细菌性木聚糖酶的分离纯化和酶学性质研究[C]//中国畜牧兽医学会动物营养学分会--第九届学术研讨会论文集.重庆:中国畜牧兽医学会动物营养学分会, 2004:1. |
| [3] | 冯定远. 饲料工业的技术创新与技术经济[J]. 饲料工业, 2004, 25(11) :10–11. |
| [4] | 代发文, 左建军, 黄升科, 等.组合型木聚糖酶对麻羽肉鸡生产性能的影响[C]//饲料酶制剂的研究与应用.广州:中国畜牧兽医学会动物营养学分会, 2009:9. |
| [5] | 孙赫, 张玉枝, 姜飞.纤维素酶与不同来源的木聚糖酶之间协同效果的比较[C]//饲料酶制剂的研究与应用.广州:中国畜牧兽医学会动物营养学分会, 2009:5. |
| [6] | 张军华.低聚木糖单一组分的制备分离及其用于双歧杆菌的体外培养[D].博士学位论文.南京:南京林业大学, 2005. |
| [7] | POURABEDIN M, GUAN L L, ZHAO X. Xylo-oligosaccharides and virginiamycin differentially modulate gut microbial composition in chickens[J]. Microbiome, 2015, 3: 15. DOI: 10.1186/s40168-015-0079-4 |
| [8] | XU Q, CHAO Y L, WAN Q B. Health benefit application of functional oligosaccharides[J]. Carbohydrate Polymers, 2009, 77(3): 435–441. DOI: 10.1016/j.carbpol.2009.03.016 |
| [9] | GULLÓN P, MOURA P, ESTEVES M P, et al. Assessment on the fermentability of xylooligosaccharides from rice husks by probiotic bacteria[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 7482–7487. DOI: 10.1021/jf800715b |
| [10] | ZHU Z Y, ZHAO L, GE X R, et al. Preparation, characterization and bioactivity of xylobiose and xylotriose from corncob xylan by xylanase[J]. European Food Research and Technology, 2015, 241(1): 27–35. DOI: 10.1007/s00217-015-2431-0 |
| [11] | 张军华, 徐勇, 勇强, 等. 木二糖和木三糖的分离及其用于双歧杆菌的体外培养[J]. 林产化学与工业, 2005, 25(1) :15–18. |
| [12] | 马岩.木二糖与木三糖分离纯化及其对鸡肠道细菌增殖和细胞黏附率的影响[D].硕士学位论文.广州:华南农业大学, 2015. |
| [13] | SHARON N. Carbohydrates as future anti-adhesion drugs for infectious diseases[J]. Biochimica et Biophysica Acta:General Subjects, 2006, 1760(4): 527–537. DOI: 10.1016/j.bbagen.2005.12.008 |
| [14] | EBERSBACH T, ANDERSEN J B, BERGSTRÖM A, et al. Xylo-oligosaccharides inhibit pathogen adhesion to enterocytes in vitro[J]. Research in Microbiology, 2012, 163(1): 22–27. DOI: 10.1016/j.resmic.2011.10.003 |
| [15] | 马玉龙, 许梓荣, 郭彤, 等. 鸡肠上皮细胞的分离及原代培养方法[J]. 中国兽医学报, 2007, 27(1) :74–76. |
| [16] | 赵新河, 王剑锋, 裴疆森. 嗜热真菌Thermomyces lanuginosus TP-1的培养及其产木聚糖酶性质研究[J]. 食品与发酵工业, 2009, 35(3) :58–63. |
| [17] | BASTAWDE K B. Xylan structure, microbial xylanases, and their mode of action[J]. World Journal of Microbiology and Biotechnology, 1992, 8(4): 353–368. DOI: 10.1007/BF01198746 |
| [18] | POLLET A, BELIËN T, FIERENS K, et al. Fusarium graminearum xylanases show different functional stabilities, substrate specificities and inhibition sensitivities[J]. Enzyme and Microbial Technology, 2009, 44(4): 189–195. DOI: 10.1016/j.enzmictec.2008.12.005 |
| [19] | MEAGHER M M, TAO B Y, CHOW J M, et al. Kinetics and subsite mapping of a D-xylobiose-and D-xylose-producing Aspergillus niger endo-(1→4)-β-D-xylanase[J]. Carbohydrate Research, 1988, 173(2): 273–283. DOI: 10.1016/S0008-6215(00)90823-1 |
| [20] | VRŠANSKÁ M, GORBACHEVA I V, KRÁTKý Z, et al. Reaction pathways of substrate degradation by an acidic endo-1, 4-β-xylanase of Aspergillus niger[J]. Biochimica et Biophysica Acta:Protein Structure and Molecular Enzymology, 1982, 704(1): 114–122. DOI: 10.1016/0167-4838(82)90138-8 |
| [21] | BIELY P, MISLOVIĆOVÁ D, TOMAN R. Soluble chromogenic substrates for the assay of endo-1, 4-β-xylanases and endo-1, 4-β-glucanases[J]. Analytical Biochemistry, 1985, 144(1): 142–146. DOI: 10.1016/0003-2697(85)90095-8 |
| [22] | COUGHLAN M P, HAZLEWOOD G P. β-1, 4-D-xylan-degrading enzyme systems:biochemistry, molecular biology and application[J]. Biotechnology and Applied Biochemistry, 1993, 17(3): 259–289. |
| [23] | NISHITANI K, NEVINS D J. Glucuronoxylan xylanohydrolase.A unique xylanase with the requirement for appendant glucuronosyl units[J]. The Journal of Biological Chemistry, 1991, 266(10): 6539–6543. |
| [24] | 石波, 李里特. 功能性添加剂木寡糖的制备研究[J]. 国外畜牧科技, 2000, 27(6) :14–17. |
| [25] | 胡晓瑜.酶法生产低聚木糖的研究[D].硕士学位论文.贵阳:贵州大学, 2008. |
| [26] | 郑建仙. 功能性低聚糖[M]. 北京: 化学工业出版社, 2004: 185. |
| [27] | 徐勇, 江华, 勇强, 等. 低聚木糖对青春双歧杆菌的增殖[J]. 食品科学, 2001, 22(7) :15–17. |
| [28] | HORI K, MATSUMOTO S. Bacterial adhesion:from mechanism to control[J]. Biochemical Engineering Journal, 2010, 48(3): 424–434. DOI: 10.1016/j.bej.2009.11.014 |
| [29] | 潘晓东.若干寡糖的功能特性及对肠道生理生态调控机制的研究[D].博士学位论文.杭州:浙江大学, 2009. |
| [30] | 王凤英, 王玉梅, 常青, 等. 母乳及婴儿食品对致病性大肠杆菌黏附的影响[J]. 第三军医大学学报, 2001, 23(4) :478–480. |
| [31] | KUNZ C, RUDLOFF S, BAIER W, et al. Oligosaccharides in human milk:structural, functional, and metabolic aspects[J]. Annual Review of Nutrition, 2000, 20: 699–722. DOI: 10.1146/annurev.nutr.20.1.699 |
| [32] | TAO N N, OCHONICKY K L, GERMAN J B, et al. Structural determination and daily variations of porcine milk oligosaccharides[J]. Journal of Agricultural and Food Chemistry, 2010, 58(8): 4653–4659. DOI: 10.1021/jf100398u |
| [33] | ORTIZ G G.Natural sources against veterinary pathogens:evaluation of the anti-adhesive and anti-biofilm activity of wheat bran[D].Ph.D.Thesis.Barcelona:Facultat de Veterinária de Barcelona, 2013. |
| [34] | ZOU P, YANG X, WANG J, et al. Advances in characterisation and biological activities of chitosan and chitosan oligosaccharides[J]. Food Chemistry, 2016, 190: 1174–1181. DOI: 10.1016/j.foodchem.2015.06.076 |
| [35] | EBERSBACH T, JØRGENSEN J B, HEEGAARD P M, et al. Certain dietary carbohydrates promote Listeria infection in a guinea pig model, while others prevent it[J]. International Journal of Food Microbiology, 2010, 140(2/3): 218–224. |
| [36] | 章建浩. 双岐杆菌的生物学特征、生理功能及食品中的开发应用[J]. 食品科学, 2002, 23(10) :141–142. |




