2. 莆田市优利可农牧发展有限公司, 莆田 351111
2. Putian Youlike Agriculture and Animal Husbandry Developing Co., Ltd., Putian 351111, China
小肠作为动物机体重要的消化吸收器官和免疫器官,兼具消化吸收营养物质的功能和抵御外界病原入侵的作用[1]。断奶、换料和转栏等应激因子,常导致仔猪的肠绒毛迅速萎缩,进而引起腹泻等一系列症状[2],因此控制好断奶仔猪肠道内环境稳态是饲养环节的关键。有研究发现,饲粮中添加中药多糖能够抵抗仔猪断奶应激、提高断奶仔猪免疫功能和抗氧化能力以及改善仔猪肠道微生物菌群等[3-6]。太子参作为福建省柘荣县一种重要的经济药材,具有补气生津之功效,常用于脾胃气虚引起的食欲不振、倦怠乏力[7]。本课题组前期研究发现,太子参多糖具有拮抗环磷酰胺所致的小鼠肠黏膜损伤、提高肠道免疫力等作用[8]。雷松波等[9]研究表明,太子参茎叶能够减少应激对断奶仔猪生长发育造成的不利影响,从而改善机体的抗应激能力。目前对太子参的应用研究多集中于其根块部分,而茎叶部分则丢弃不用。但有研究表明,太子参茎叶中多糖含量可达5%~10%[10],但太子参茎叶多糖在断奶仔猪中的应用却鲜见报道。本试验在断奶仔猪基础饲粮中添加太子参茎叶多糖,通过检测试验猪小肠组织中细胞因子白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、干扰素-γ(IFN-γ)、分泌型免疫球蛋白A (SIgA) 含量和肠道形态结构以及盲肠内容物菌群等的变化,探讨其对断奶仔猪肠道的保健作用及可能的作用机理,研究结果为太子参茎叶多糖在断奶仔猪中的应用提供科学依据,同时亦为太子参茎叶的进一步深入开发提供借鉴。
1 材料与方法 1.1 试验材料太子参茎叶多糖粉末购自陕西藤迈生物科技有限公司。以葡萄糖为标准品,苯酚-浓硫酸法测得其多糖含量为70%。
1.2 主要仪器全自动放免计数仪 (XH-6020西安核仪器厂)、全自动酶标仪 (STATFAX-2100Awareness Technology Inc.USA)、荧光定量PCR (C1000美国伯乐)、电泳仪 (DYY-2C北京六一仪器厂)、凝胶成像系统 (GL200柯达公司)、快速混匀器 (Sk-1金坛市科析仪器有限公司)、数显恒温水浴锅 (HH-2国华电器有限公司)。
1.3 试验设计选取胎次、体重相近的25日龄断奶仔猪120头,按体重相近、公母各1/2的原则,随机分成4组,每组3个重复,每个重复10头猪。对照组:饲喂基础饲粮;0.05%多糖组:饲喂基础饲粮+500 mg/kg太子参茎叶多糖;0.10%多糖组:饲喂基础饲粮+1 000 mg/kg太子参茎叶多糖;0.15%多糖组:饲喂基础饲粮+1 500 mg/kg太子参茎叶多糖。试验期间所有仔猪都自由采食干粉料,自由饮水,并按照猪场常规管理程序进行驱虫与免疫防疫,预试期5 d,试验期30 d。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平 (干物质基础) Table 1 Composition and nutrient levels of basal diets (DM basis) |
试验结束当天,每个重复随机挑选1头仔猪屠宰。取十二指肠、空肠和回肠,磷酸盐缓冲溶液 (PBS) 冲洗之后将每个肠断分成2份,一份用4%多聚甲醛固定,用于肠道形态结构的测定;另一份装入自封袋中,-80 ℃保存,用于肠道组织细胞因子 (IL-2、IL-4和IFN-γ) 及SIgA含量的测定。同时无菌取盲肠内容物,EP管分装,-80 ℃保存,用于盲肠菌群的测定。
1.5 肠道组织细胞因子与SIgA含量测定酶联免疫吸附测定法 (ELISA) 测定不同肠段中IL-2、IL-4和IFN-γ的含量,放射免疫法 (RIA) 测定不同肠段中SIgA含量,具体操作见试剂盒说明书。
1.6 肠黏膜形态结构与上皮内淋巴细胞数量测定将保存在4%多聚甲醛的小肠组织经过浸洗→脱水→透明→浸蜡→包埋→切片→贴片→烘干→脱蜡入水后通过苏木精-伊红 (HE) 染色。每张切片选取2个视野,每个视野连续测定10根肠绒毛,运用Imageproplus 6.0软件计算肠绒毛高度和隐窝深度,并计算绒毛高度/隐窝深度 (V/C) 值;通过光镜观察,分别在十二指肠、空肠和回肠切片上选取5个典型视野 (绒毛完整、走向平直),计算每100个肠上皮柱状细胞间上皮内淋巴细胞的数量。
1.7 盲肠内容物中大肠杆菌与乳酸杆菌数量的测定 1.7.1 样本总DNA的提取及纯度鉴定从每组断奶仔猪盲肠内容物中提取总DNA,样本总DNA的提取步骤按照粪便基因组提取试剂盒 (离心柱型) 进行。提取的DNA通过微量紫外分光光度计检测其浓度与纯度。DNA应在吸光值 (OD)260处有显著吸收峰,OD260/OD280比值应为1.7~1.9。
1.7.2 引物设计参照许丛丛等[11]设计出肠道总菌、大肠杆菌以及乳酸杆菌的特异性引物,引物序列与片段大小见表 2。引物送往上海生物工程有限公司合成。
|
|
表 2 引物序列与片段大小 Table 2 Primer sequence and fragment size |
以提取的肠道总DNA为模板,分别对总菌、大肠杆菌和乳酸杆菌的引物进行PCR反应,PCR总反应体系为25 μL:mix 12.5 μL、ddH2O 8.5 μL、模板2 μL、上游引物1 μL、下游引物1 μL。PCR反应条件如下:95 ℃预变性5 min;95 ℃变性30 s,总菌和乳酸杆菌均用65 ℃退火30 s (大肠杆菌退火温度为60 ℃),72 ℃延伸30 s,30个循环;72 ℃总延伸10 min。将得到的PCR产物进行凝胶电泳,通过凝胶成像系统分析。
1.7.4 实时荧光定量PCR采用12.5 μL反应体系:GoTaq® qPCR Master Mix 6.25 μL,CRX Reference Dye 0.25 μL,Nuclease-Free Water 4.5 μL,上下游引物各0.25 μL,DNA模板1 μL。GoTaq® qPCR Master Mix荧光试剂盒购于Promega公司。反应条件:98 ℃预变性2 min;98 ℃变性10 s,60 ℃退火10 s,68 ℃延伸30 s,39个循环。
1.7.5 荧光相对定量分析将每个DNA样品分别进行荧光定量PCR,测得样品的Ct值。采用2-△△Ct法计算并分析不同组的大肠杆菌与乳酸杆菌的变化情况,△△Ct=[Ctm (待测样品)-Ctn (待测样品)]-[Ctm (对照样品)-Ctn (对照样品)],m代表目的基因,n代表内参基因。本试验以总菌的16S rDNA作为内参基因,大肠杆菌和乳酸杆菌的16S rDNA作为目的基因。试验组大肠杆菌与乳酸杆菌的数量变化情况通过与对照组对照的比值来表示,其中对照组的PCR产物相对值默认为1,采用2-△△Ct法计算各组相对数量。
1.8 统计分析试验结果用平均值±标准差 (mean±SD) 表示,应用SPSS 17.0统计软件进行单因素方差分析,LSD进行多重比较。
2 结果 2.1 太子参茎叶多糖对断奶仔猪十二指肠细胞因子与SIgA含量的影响由表 3可知,与对照组相比,3个多糖组的十二指肠IL-4含量分别提高了17.81%(P < 0.05)、27.39%(P < 0.05) 和15.07%(P < 0.05),3个多糖组间差异不显著 (P>0.05);0.10%和0.15%多糖组的十二指肠IFN-γ含量分别提高了48.79%(P < 0.01) 和9.88%(P>0.05),且0.10%多糖组极显著高于0.05%和0.15%多糖组 (P < 0.01)。3个多糖组的十二指肠IL-2和SIgA含量与对照组相比差异不显著 (P>0.05)。
|
|
表 3 太子参茎叶多糖对断奶仔猪十二指肠细胞因子与SIgA含量的影响 Table 3 Effects of Radix pseudostellariae stem and leaf polysaccharide on duodenum cytokines and SIgA contents of weaned piglets |
由表 4可知,与对照组相比,0.10%多糖组的空肠IFN-γ含量提高了27.67%(P < 0.05),且显著高于0.05%和0.15%多糖组 (P < 0.05);0.10%多糖组的空肠SIgA含量提高了30.31%(P < 0.05),且显著高于0.05%和0.15%多糖组 (P < 0.05)。3个多糖组的空肠IL-2和IL-4含量与对照组相比差异不显著 (P>0.05)。
|
|
表 4 太子参茎叶多糖对断奶仔猪空肠细胞因子与SIgA含量的影响 Table 4 Effects of Radix pseudostellariae stem and leaf polysaccharide on jejunum cytokines and SIgA contents of weaned piglets |
由表 5可知,与对照组相比,3个多糖组的回肠IFN-γ含量分别提高了18.82%(P < 0.05)、25.14%(P < 0.05) 和18.96%(P < 0.05),各多糖组间差异不显著 (P>0.05);0.10%和0.15%多糖组的回肠SIgA含量分别提高了19.81%(P < 0.05) 和8.21%(P < 0.05),且显著高于0.05%多糖组 (P < 0.05)。3个多糖组的回肠IL-2和IL-4含量与对照组相比差异不显著 (P>0.05)。
|
|
表 5 太子参茎叶多糖对断奶仔猪回肠细胞因子与SIgA含量的影响 Table 5 Effects of Radix pseudostellariae stem and leaf polysaccharide on ileum cytokines and SIgA contents of weaning piglets |
由表 6可知,与对照组相比,0.10%多糖组和0.15%多糖组十二指肠绒毛高度分别提高了26.36%(P < 0.01) 和23.93%(P < 0.01),且极显著高于0.05%多糖组 (P < 0.01);3个多糖组的V/C值分别提高了23.02%(P < 0.05)、30.93(P < 0.05) 和30.21%(P < 0.05),各多糖组间差异不显著 (P>0.05)。3个多糖组的隐窝深度和上皮内淋巴细胞数量与对照组相比差异不显著 (P>0.05)。
|
|
表 6 太子参茎叶多糖对断奶仔猪十二指肠形态结构与上皮内淋巴细胞数量的影响 Table 6 Effects of Radix pseudostellariae stem and leaf polysaccharide on duodenum morphology and epithelial lymphocytes number of weaned piglets |
由表 7可知,与对照组相比,0.10%和0.15%多糖组空肠绒毛高度分别提高了14.08%(P < 0.05)、17.41%(P < 0.05),且0.10%和0.15%多糖组显著高于0.05%多糖组 (P < 0.05)。3个多糖组的空肠隐窝深度、V/C值和上皮内淋巴细胞数量与对照组相比差异不显著 (P>0.05)。
|
|
表 7 太子参茎叶多糖对断奶仔猪空肠形态结构与上皮内淋巴细胞数量的影响 Table 7 Effects of Radix pseudostellariae stem and leaf polysaccharide on jejunum morphology and epithelial lymphocytes number of weaning piglets |
由表 8可知,与对照组相比,0.15%多糖组的回肠绒毛高度提高了20.18%(P < 0.05),且显著高于0.05%和0.10%多糖组 (P < 0.05);3个多糖组的回肠隐窝深度、V/C值和上皮内淋巴细胞数量与对照组相比差异不显著 (P>0.05)。
|
|
表 8 太子参茎叶多糖对断奶仔猪回肠形态结构与上皮内淋巴细胞数量的影响 Table 8 Effects of Radix pseudostellariae stem and leaf polysaccharide on ileum morphology and epithelial lymphocytes number of weaned piglets |
由图 1可见,与对照组相比,3个多糖组均显著降低了盲肠内容物大肠杆菌数量 (P < 0.05),并显著提高了盲肠内容物乳酸杆菌数量 (P < 0.05),其中0.10%多糖组效果最佳。
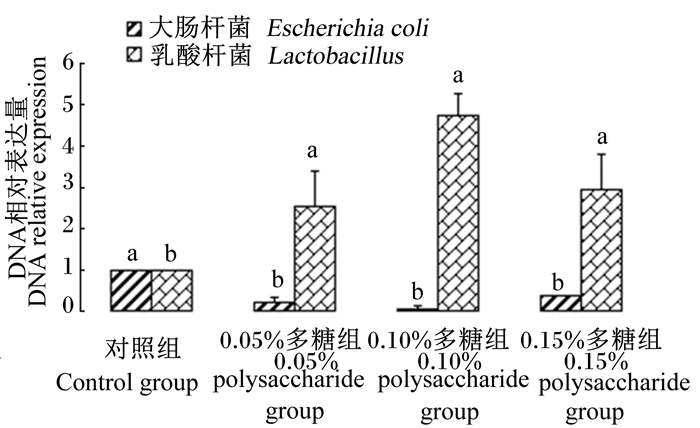
|
图 1 太子参茎叶多糖对断奶仔猪盲肠内容物菌群的影响 Figure 1 Effects of Radix pseudostellariae stem and leaf polysaccharide on cecum contents flora of weaned piglets |
SIgA是小肠黏膜固有层参与机体免疫应答的主要效应分子,当动物机体受到抗原刺激时,黏膜层能分泌大量SIgA通过与黏液混合进而阻断病原体附着在黏膜表层,发挥其黏膜免疫的功能[12]。肠黏膜白细胞介素同样是参与机体黏膜免疫的重要部分,IL-2能够促进T淋巴细胞和B淋巴细胞增殖分化,并产生特异性抗体,进而提高SIgA肠道黏膜免疫功能[13]。IFN-γ能够通过促进IL-2生成,进而发挥其黏膜免疫的功能。张大鹏等[14]研究表明,四君子汤总多糖能够促进免疫抑制小鼠肠黏膜SIgA的分泌;王庭祥等[15]试验结果表明,海带多糖能够提高肠黏膜SIgA的分泌;姬云丽等[16]研究表明,当归补血多糖可以促进小鼠肠道IL-2、IL-4和黏膜SIgA的分泌;张圣方等[17]研究表明,泰山蛹虫草多糖能够提高免疫抑制小鼠肠道黏膜SIgA的分泌。本试验结果显示,饲粮添加太子参茎叶多糖能不同程度地提高断奶仔猪肠道黏膜IL-2、IL-4、IFN-γ和SIgA含量,说明太子参茎叶多糖能够促进肠道分泌免疫细胞的增殖分化,提高机体免疫力。通过3个不同肠段的对比可以发现,在十二指肠肠段,太子参茎叶多糖对肠黏膜免疫功能的作用最为显著,这可能是因为相较于空肠和回肠,十二指肠黏膜含有较多的免疫细胞,对于多糖的刺激作用较为敏感。
3.2 太子参茎叶多糖对断奶仔猪小肠形态结构与上皮内淋巴细胞数量的影响小肠作为动物机体一个重要的消化器官和免疫器官,具有消化吸收营养物质的功能和起到抵御外界病原入侵的作用。绒毛高度与隐窝深度可以反映出黏膜上皮成熟细胞的数量,影响机体对营养物质的吸收作用[18]。V/C值可以综合反映出小肠对营养物质的吸收能力,比值升高则消化吸收功能增强,机体的生长性能好[19]。肠道黏膜上皮内淋巴细胞可以参与肠道免疫调节,单位面积内的淋巴细胞数量可以反映出机体肠道免疫功能的强弱。王留等[20]研究显示,大枣多糖能够提高保育猪肠道绒毛高度,降低隐窝深度;黄玉章等[21]试验表明,黄芪多糖能够提高罗非鱼肠道绒毛度,降低隐窝深度,同时还可提高黏膜上皮内淋巴细胞数量;石玉祥等[22]研究发现,枸杞多糖能够促进小鼠肠道黏膜屏障的完整性,提高黏膜上皮内淋巴细胞数量。本试验结果表明,在断奶仔猪饲粮中添加太子参茎叶多糖能够极显著提高十二指肠绒毛高度,显著提高十二指肠V/C值,一定程度提高肠道黏膜上皮内淋巴细胞数量。这说明太子参茎叶多糖具有调节肠道形态结构、促进仔猪对营养物质的消化吸收、提高肠道免疫功能的作用。
3.3 太子参茎叶多糖对断奶仔猪肠盲肠内容物菌群的影响大肠杆菌作为一种条件致病菌,在动物肠道内环境稳定的状态下不会对机体产生致病力,只有当机体受到外界因素刺激影响内环境稳态,使大肠杆菌大量增殖才会造成动物腹泻等症状,降低动物机体的抵抗力和生长性能[11]。乳酸杆菌作为动物肠道的有益菌,能够调节肠道菌群平衡,促进蛋白质等营养物质的消化吸收。在免疫调节方面,乳酸杆菌同样发挥着重要作用,不仅能够提高超氧化物歧化酶活力,还能兼具抑制胆固醇吸收、降血脂等作用。王留等[20]研究显示,饲粮中添加1 000、1 500 mg/kg大枣多糖能够提高仔猪肠道乳酸杆菌和双歧杆菌的增殖,抑制肠道大肠杆菌的繁殖;冯澜等[23]研究结果表明,马芷苋多糖能够提高溃疡性结肠炎小鼠肠道内乳酸杆菌和双歧杆菌数量;张圣方等[17]研究表明,泰山蛹虫草多糖能够提高免疫抑制小鼠肠道乳酸杆菌和双歧杆菌数量,并降低肠道内大肠杆菌和肠球菌的数量。本试验结果显示,在断奶仔猪基础饲粮中添加太子参茎叶多糖能够降低盲肠大肠杆菌的数量并提高乳酸杆菌数量,但是从图 1的趋势来看,太子参茎叶多糖的添加量并不是越高越好,以添加0.10%的添加量较为适宜。这可能是因为太子参茎叶多糖在该的添加量能够较好的调节盲肠内的pH,使肠道处于一个偏酸性的环境,促进乳酸杆菌等有益菌繁殖,同时又能够一定程度上抑制大肠杆菌增殖。
4 结论饲粮中添加太子参茎叶多糖能够提高断奶仔猪肠道免疫功能,增加小肠吸收面积,改善肠道菌群结构,帮助断奶仔猪平稳度过断奶应激,促进仔猪生长发育,其适宜的添加量为0.10%。
| [1] | BISCHOFF S C. 'Gut health':a new objective in medicine[J]. BMC Medicine, 2011, 9: 24. DOI: 10.1186/1741-7015-9-24 |
| [2] | LAMBERT G P. Stress-induced gastrointestinal barrier dysfunction and its inflammatory effects[J]. Journal of Animal Science, 2009, 87(S14): 101–108. |
| [3] | 李同洲, 薛凌峰, 臧素敏, 等. 香菇多糖对仔猪生产性能、部分血清激素和免疫指标的影响[J]. 动物营养学报, 2009, 21(1) :101–106. |
| [4] | 韩杰, 边连全, 刘显军, 等. 刺五加多糖对断奶仔猪血液免疫指标的影响[J]. 动物营养学报, 2012, 24(12) :2444–2449. |
| [5] | 杨兵, 夏先林, 施晓丽, 等. 熟地黄多糖对断奶仔猪抗氧化性能和免疫性能的影响[J]. 江苏农业学报, 2012, 28(4) :787–791. |
| [6] | 杨侃侃, 边连全, 刘显军, 等. 刺五加多糖对断奶仔猪生长性能、血清免疫指标及粪便微生物菌群的影响[J]. 动物营养报, 2013, 25(3) :628–634. |
| [7] | 国家药典委员会. 中华人民共和国药典:一部[M]. 2010版. 北京: 中国医药科技出版社, 2010: 62-63. |
| [8] | 严胜泽, 马玉芳, 廖吕燕, 等. 太子参多糖对环磷酰胺所致肠道黏膜损伤小鼠SIgA、IL-2、IL-6含量的影响[J]. 中国畜牧兽医, 2015, 42(5) :1187–1192. |
| [9] | 雷松波, 池春梅, 金其全, 等. 太子参茎叶对断乳仔猪抗氧化和抗应激能力的影响[J]. 福建畜牧兽医, 2014, 36(6) :28–30. |
| [10] | 曾丽娜, 袁玉虹, 黄淑燕, 等. 不同采收时间、不同入药部位太子参有效药用成分含量的比较[J]. 福建林业, 2014(2) :25–26. |
| [11] | 许丛丛, 陈小连, 朱丽慧, 等. 复合抗氧化剂对早期断奶仔猪肠道主要菌群的影响[J]. 饲料研究, 2012(4) :4–7. |
| [12] | GEBERT A, GÖKE M, ROTHKÖTTER H J, et al. The mechanisms of antigen uptake in the small and large intestines:the roll of the M cells for the initiation of immune responses[J]. Zeitschrift Für Gastroenterologie, 2000, 38(10): 855–872. DOI: 10.1055/s-2000-10001 |
| [13] | 张源淑, 邓艳, 宋晓丹, 等. 酪啡肽及其酪蛋白水解肽对早期断奶仔猪分泌型免疫球蛋白A和细胞因子水平的影响[J]. 动物营养学报, 2008, 20(2) :196–199. |
| [14] | 张大鹏, 周联, 张志敏, 等. 四君子汤总多糖对免疫抑制小鼠肠道SIgA的影响及其机制研究[J]. 中药新药与临床药理, 2010, 21(1) :11–14. |
| [15] | 王庭祥, 王庭欣, 刘峥颢, 等. 海带多糖对小鼠肠黏膜组织SIgA的影响[J]. 安徽农业科学, 2009, 37(12) :5515, 5520. |
| [16] | 姬云丽, 凌虹, 于新慧, 等. 当归补血汤多糖对隐孢子虫感染小鼠肠道局部免疫功能的影响[J]. 牡丹江医学院学报, 2007, 28(6) :6–8. |
| [17] | 张圣方, 赵龙玉, 赵凤春, 等. 泰山蛹虫草多糖对免疫抑制小鼠肠道菌群及分泌型免疫球蛋白A的影响[J]. 食品科学, 2015, 36(5) :148–152. |
| [18] | DUNSFORD B R, KNABE D A, HAENSLY W E. Effect of dietary soybean meal on the microscopic anatomy of the small intestine in the early-weaned pig[J]. Journal of Animal Science, 1989, 67(7): 1855–1863. DOI: 10.2527/jas1989.6771855x |
| [19] | 李鹏.半乳甘露寡糖对兔小肠黏膜结构及黏膜免疫相关指标的影响[D].硕士学位论文.北京:中国农业大学, 2007:119-121. |
| [20] | 王留, 王向国. 大枣多糖对保育猪肠道微生物菌群及肠道组织形态的影响[J]. 养猪, 2014(6) :7–8. |
| [21] | 黄玉章, 林旋, 王全溪, 等. 黄芪多糖对罗非鱼肠绒毛形态结构及肠道免疫细胞的影响[J]. 动物营养学报, 2010, 22(1) :108–116. |
| [22] | 石玉祥, 闫金坤, 王雪敏. 枸杞多糖对小鼠肠道上皮内淋巴细胞和杯状细胞数量、分布及对IL-2水平影响[J]. 食品科学, 2011(13) :318–320. |
| [23] | 冯澜, 李绍民, 代立娟, 等. 马齿苋多糖对溃疡性结肠炎小鼠肠黏膜细胞因子及肠道菌群的影响[J]. 中国微生态学杂志, 2015, 27(2) :139–142. |




