在我国北方地区,冬季气候寒冷,外界无蜜源,蜜蜂越冬期间无法从外界获取食物,只能消耗越冬前期贮备的饲料。因此,越冬饲料质量的好坏直接影响着蜂群的越冬性能。自然状态下蜜蜂在越冬期间取食的饲料应该为蜂蜜,但是,蜂农为了追求蜂产品产量和利润,秋天大都不给蜂群储备足够的蜂蜜作为越冬饲料,而是改喂价格相对便宜的白砂糖[1]。近年来,由于白砂糖价格不断攀升,使得越来越多的蜂农采用廉价的果葡糖浆替代白砂糖作为越冬饲料。果葡糖浆,也称高果糖浆 (high fructose syrup) 或异构糖浆,是以酶法转化淀粉所得的糖化液经葡萄糖异构酶的异构作用,将其中一部分葡萄糖异构成果糖,由葡萄糖和果糖组成的一种混合糖浆[2]。目前,对于果葡糖浆用作蜜蜂越冬饲料的安全性尚存在许多争议。李中礼[3]和沈育初[4]认为果葡糖浆可以替代白砂糖饲喂蜂群,而陈渊[5]和李家柱[6]则认为果葡糖浆用作蜜蜂越冬饲料会使蜂群受到严重损失,如:蜂群出现群势变差或者见子 (卵) 不见虫的现象。由于缺乏蜜蜂越冬期间的饲养标准,蜂农在选择越冬饲料时缺乏科学依据。
鉴于此,本研究分别以白砂糖、蜂蜜、果葡糖浆作为越冬饲料对蜜蜂进行饲喂,通过比较3种越冬饲料对蜜蜂中肠消化酶活性、组织发育状态以及抗氧化酶基因表达的影响,来评价3种饲料作为蜜蜂越冬饲料的适用性,旨在为广大蜂农更好地选择越冬饲料提供参考。
1 材料与方法 1.1 试验材料试验所用蜜蜂为本地意大利蜜蜂 (Apis mellifera L.),由山东农业大学蜂场提供;试验所用蜂蜜由山东农业大学蜂场提供,白砂糖由云南德宏英茂糖业有限公司弄璋糖厂提供,果葡糖浆由临沂沂水鲁洲生物科技有限公司提供。
1.2 试验地点及时间试验于2015年10月底至2016年3月初在山东农业大学蜂场进行。
1.3 试验设计选取群势相当的本地意大利蜜蜂越冬蜂群 (群内无储备越冬饲料脾)9群 (5框蜂/群),随机分为3个试验组 (蜂蜜组、果葡糖浆组和蔗糖组),每组设3个重复。蜂蜜组以蜂蜜作为越冬饲料,果葡糖浆组以果葡糖浆作为越冬饲料,蔗糖组以白砂糖水 (白砂糖:水=2:1) 作为越冬饲料。
1.4 蜂群管理试验开始前对所有蜂群进行逐一检查,确保每一蜂群内没有储备好的越冬饲料脾。试验开始后于每天傍晚将饲料盛到相应巢内的饲喂盒内,每次饲喂时都将饲喂盒盛满 (约1.5 kg),一直饲喂到11月下旬蜂群完全进入到越冬状态时停止进行饲喂,以保证蜂群储备足够的越冬饲料。
1.5 测定指标及方法 1.5.1 样本处理方法在整个试验期内一共取3次样品,在越冬前 (11月初)、越冬中期 (1月初) 和越冬后 (3月初)3个时间点分别进行取样。其中越冬前取样时每个试验组取45只蜜蜂,随机分为3个重复,每重复15只蜜蜂,统一作为饲喂之前蜂群的整体水平。而越冬中期和越冬后采样时每次每群取45只蜜蜂,随机分为3个重复,每个重复15只蜜蜂。用镊子分别夹住蜜蜂的腹柄和螯针或第7腹节,将蜜蜂的肠道拉出,截取其中肠,放在1.5 mL离心管中准确称重,按重量 (g):体积 (mL)=1:9加入生理盐水,在冰浴条件下机械匀浆,2 500 r/min离心10 min后取上清,配制成10%的匀浆液。然后取部分上述10%的匀浆液用生理盐水按1:9比例稀释成1%的匀浆液。10%的匀浆液用于测定中肠消化酶活性,1%的匀浆液用于测定蜜蜂中肠蛋白质浓度。
在越冬中期,按照上述方法分组和取样,将蜜蜂的肠道拉出后,截取其中肠放入多聚甲醛固定液中,用于制作中肠组织切片;按同样的分组和取样方法截取蜜蜂中肠用于提取蜜蜂总RNA。
1.5.2 蜜蜂中肠蛋白质浓度测定将1.5.1中1%的匀浆液采用蛋白质定量测试盒 (南京建成生物工程研究所生产,货号A045-2) 测定蜜蜂中肠蛋白质浓度 (考马斯亮蓝法)。
1.5.3 蜜蜂中肠淀粉酶活性测定将1.5.1中10%的匀浆液采用淀粉酶测试盒 (南京建成生物工程研究所生产,货号C016) 测定蜜蜂中肠淀粉酶活性 (碘-淀粉比色法)。
1.5.4 蜜蜂中肠蔗糖酶活性测定将1.5.1中10%的匀浆液采用二糖酶测试盒 (南京建成生物工程研究所生产,货号A082-2) 测定蜜蜂中肠蔗糖酶活性 (比色法)。
1.5.5 蜜蜂中肠蛋白酶活性测定将1.5.1中10%的匀浆液采用胃蛋白酶测试盒 (南京建成生物工程研究所生产,货号A080-1) 测定蜜蜂中肠蛋白酶活性 (比色法)。
1.5.6 蜜蜂中肠组织发育状态观察将固定好的中肠进行苏木精-伊红 (HE) 染色,制作切片 (由武汉谷歌生物科技有限公司制作),在10×显微镜下对中肠组织结构进行观察。
1.5.7 蜜蜂中肠抗氧化酶基因表达检测采用Trizol法提取总RNA,使用反转录试剂盒 (TaKaRa) 将提取的RNA样品反转录为cDNA,放在-20 ℃保存。采用荧光定量PCR法对中肠抗氧化酶基因——超氧化物歧化酶1(Sod1)、超氧化物歧化酶2(Sod2) 和过氧化氢酶 (CAT) 的相对表达量进行检测。取2 μL cDNA加入到20 μL荧光定量体系中,按照荧光定量试剂盒 (TaKaRa) 操作指南,用荧光定量PCR仪检测目的基因的相对表达量。目的基因引物设计参考序列来自于NCBI数据库,以β-肌动蛋白 (β-actin) 为内参基因,采用Primer 5.0进行引物设计,委托生工生物工程 (上海) 股份有限公司合成,引物序列如表 1所示。
|
|
表 1 引物序列 Table 1 Primer sequences |
数据采用SAS 9.2软件进行单因素方差分析 (one-way ANOVA),并采用Duncan氏法进行多重比较,以P<0.05表示差异显著。
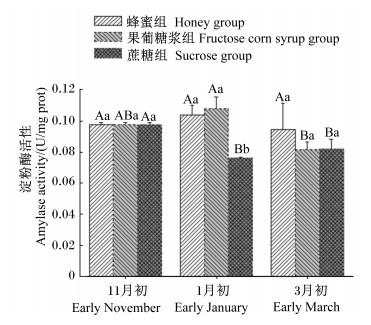
2 结果与分析 2.1 不同越冬饲料对蜜蜂中肠淀粉酶活性的影响通过对蜜蜂中肠淀粉酶活性 (图 1) 进行分析发现,在越冬中期,蜂蜜组和果葡糖浆组的蜜蜂中肠内淀粉酶活性显著高于蔗糖组 (P < 0.05);而在越冬后,饲喂3种越冬饲料的蜜蜂中肠内淀粉酶的活性无显著差异 (P > 0.05)。在整个试验期内,蜂蜜组的蜜蜂中肠内淀粉酶活性没有发生显著变化 (P > 0.05),而蔗糖组的蜜蜂中肠内淀粉酶活性在越冬中期和越冬后显著低于越冬前 (P < 0.05),果葡糖浆组的蜜蜂中肠内淀粉酶活性在越冬后显著低于越冬中期 (P < 0.05)。
|
数据柱标注相同字母表示差异不显著 (P>0.05),不同小写字母表示不同饲料组之间差异显著 (P<0.05),不同大写字母表示不同取样时间点差异显著 (P<0.05)。图 2、图 3同。 Date columns with the same letters mean no significant difference (P > 0.05), while with different small letters mean significant difference among different feed groups (P < 0.05), and with different capital letters mean significant difference among different sampling time points (P < 0.05). The same as Fig. 2 and Fig. 3. 图 1 中肠淀粉酶活性 Figure 1 Amylase activity of midgut |
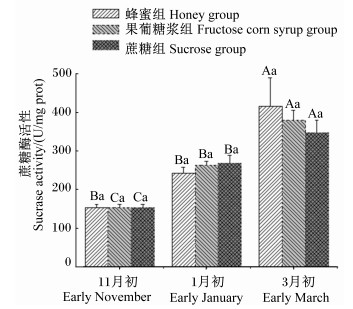
通过对蜜蜂中肠蔗糖酶活性 (图 2) 进行分析发现,在越冬中期和越冬后,蜂蜜、果葡糖浆和白砂糖3种不同越冬饲料对蜜蜂中肠内蔗糖酶活性的影响不显著 (P > 0.05)。而在整个试验期内,随着试验的进行,饲喂不同越冬饲料的3组蜜蜂中肠内蔗糖酶活性统一呈现出逐渐增强的趋势。蜂蜜组的蜜蜂中肠内蔗糖酶活性在越冬后显著高于越冬前和越冬中期 (P < 0.05),果葡糖浆组和蔗糖组蜜蜂中肠内蔗糖酶活性在越冬中期和越冬后显著高于越冬前 (P < 0.05),同时在越冬中期还显著低于越冬后 (P < 0.05)。
|
图 2 中肠蔗糖酶活性 Figure 2 Sucrase activity of midgut |
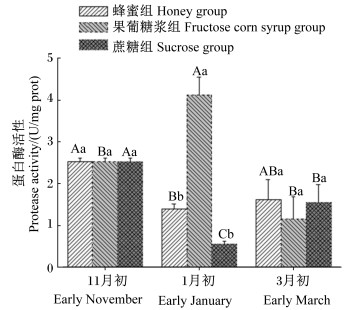
通过对蜜蜂中肠蛋白酶活性 (图 3) 进行分析发现,在越冬中期,蜜蜂中肠内蛋白酶活性在3组之间存在显著差异 (P < 0.05),以果葡糖浆组最高,蜂蜜组次之,蔗糖组最低;而在越冬后,蜜蜂中肠内蛋白酶活性各组之间差异不显著 (P > 0.05)。在整个试验期内,蜂蜜组的蜜蜂中肠内蛋白酶活性在越冬前显著高于越冬中期 (P < 0.05),果葡糖浆组的蜜蜂中肠内蛋白酶活性在越冬中期显著高于越冬前和越冬后 (P < 0.05),蔗糖组的蜜蜂中肠内蛋白酶活性在越冬中期显著低于越冬前和越冬后 (P < 0.05),同时在越冬后显著低于越冬前 (P < 0.05)。
|
图 3 中肠蛋白酶活性 Figure 3 Protease activity of midgut |
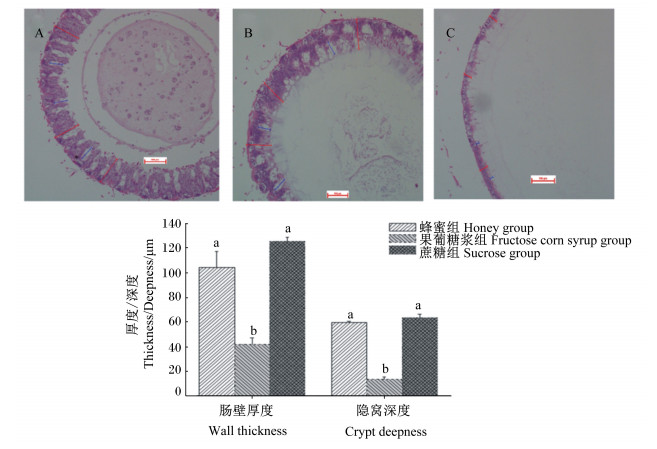
由图 4可知,蜂蜜组和蔗糖组的蜜蜂中肠肠壁厚度极显著大于果葡糖浆组 (P < 0.01),同时蜂蜜组和蔗糖组的蜜蜂中肠隐窝深度要比果葡糖浆组深,且差异极显著 (P < 0.01)。
|
A:蔗糖组中肠切片;B:蜂蜜组中肠切片;C:果葡糖浆组切片。图中红色线段表示肠壁厚度,蓝色线段表示隐窝深度 (HE染色, 10×)。数据柱标注相同字母表示差异不显著 (P>0.05),不同字母表示差异极显著 (P<0.01)。 A: midgut histological picture of sucrose group; B: midgut histological picture of honey group; C: midgut histological picture of fructose corn syrup group. In the figure, the red line indicated the intestinal wall thickness, and the blue line indicated the crypt deepness (HE staining, 10×). Date columns with the same letters mean no significant difference (P > 0.05), while with different letters mean significant difference (P < 0.01). 图 4 中肠组织发育状态 Figure 4 Tissue developmental status of midgut |
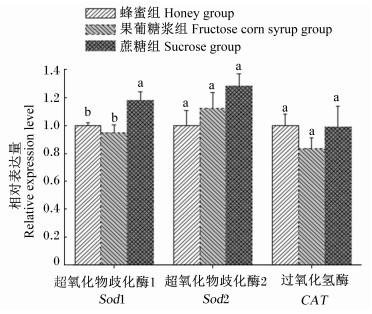
由图 5可知,蔗糖组的蜜蜂中肠Sod1基因的相对表达量显著高于蜂蜜组和果葡糖浆组 (P<0.05),而饲喂不同越冬饲料对蜜蜂中肠Sod2和CAT基因的相对表达量的影响不显著 (P>0.05),但蜂蜜组、果葡糖浆组和蔗糖组的蜜蜂中肠Sod2基因的相对表达量呈依次上升的趋势,同时蜂蜜组和蔗糖组的蜜蜂中肠CAT基因的相对表达量高于果葡糖浆组。
|
数据柱标注相同字母表示差异不显著 (P>0.05),不同字母表示差异显著 (P<0.05)。 Date columns with the same letters mean no significant difference (P > 0.05), while with different letters mean significant difference (P < 0.05). 图 5 中肠抗氧化酶基因的相对表达量 Figure 5 Relative expression levels of antioxidant enzyme genes from midgut |
蜂蜜的主要成分是糖类和水分,另外还含有蛋白质、矿物质、维生素、酶等成分[1]。Popek[7]研究表明,蜂蜜中总糖含量占蜂蜜的72.88%~84.02%,总糖中果糖和葡萄糖含量在79%以上,另有1%~6%的蔗糖。王贻节[8]发现,蜂蜜中的糖类除果糖、葡萄糖和蔗糖外,还含有少量的麦芽糖、曲二糖、异麦芽糖、糊精等糖类。白砂糖属于蔗糖,蔗糖营养成分相对单一,是由果糖和葡萄糖脱水缩合形成的双糖,缺乏蛋白质、维生素等营养成分。目前,在蜂群越冬和春繁阶段白砂糖已成为主要的糖饲料。但随着白砂糖价格不断攀升,不少蜂农选择用廉价的果葡糖浆代替白砂糖作为越冬饲料来饲喂蜂群。果葡糖浆通常是以粮食下脚料为原料,以酶法转化粮食淀粉所得的糖化液经葡萄糖异构酶的异构作用,将其中一部分葡萄糖异构成果糖而形成的一种混合糖糖浆。但在生产过程,酶解不完全会导致糖浆中不溶性颗粒物含量过高,导致蜜蜂不能正常消化,影响蜜蜂的生长发育[2]。
本研究发现果葡糖浆组的蜜蜂在越冬中期中肠内蛋白酶和淀粉酶活性均比蜂蜜组和蔗糖组高。这与工业果葡糖浆中含有未完全酶解的底物物质 (如淀粉) 和残留的杂质物质 (如不溶性蛋白颗粒) 有一定关系,机体需要提高消化道内相应酶的活性来帮助蜂体进行消化。因此,果葡糖浆提高淀粉酶和蛋白酶活性并不能作为果葡糖浆更适合作为蜜蜂越冬饲料的依据,需采用试验级的纯果葡糖浆进行深入研究。蜂蜜中含有少量的花粉,而花粉中含有淀粉等多糖[9],Lotmar[10]指出蜜蜂能少量利用花粉中的淀粉。本研究发现蜂蜜组的蜜蜂中肠内淀粉酶活性在越冬中期显著高于蔗糖组,这可能与蜂蜜中含有花粉有关,为了消化花粉中的淀粉,蜜蜂必须在一定程度上提高肠道中淀粉酶的活性。
蜜蜂消化道中的酶系统在消化食物、吸收营养和能量转化过程中起着极为重要的作用,其与蜜蜂的生命活动和群体生活息息相关[11]。蜜蜂肠道消化酶活性除了会受到饲料糖源类型的影响外,也会受到越冬时间的影响。研究表明蜜蜂在不同时期对蛋白质的需求有所不同[12-13],在越冬期内越冬蜂不担任哺育工作,而在越冬结束后,越冬蜂需要担任哺育工作其王浆腺功能恢复,对蛋白质的需求增加,因此在越冬中期蛋白酶活性低于越冬前和越冬前后。蜜蜂调节巢温所需的能量主要依靠碳水化合物的分解[14],这些碳水化合物包括果糖、葡萄糖、蔗糖和麦芽糖等[15]。在寒冷的冬季,蜜蜂需要更多的能量来维持巢内温度和自身的基础代谢。在越冬期内蜜蜂主要以碳水化合物为食物,蔗糖酶活性升高有助于蜂体消化摄入体内的碳水化合物,从而为蜜蜂提供所需的能量,以利于蜂群安全度过寒冷的冬季。
3.2 不同越冬饲料对蜜蜂中肠组织发育状态的影响蜜蜂的消化道分为前肠、中肠和后肠。中肠是蜜蜂进行消化和吸收的主要场所。中肠呈环节状,增加了肠壁内吸收面积和肠壁的伸缩性。中肠肠腔内有多层的围食膜包裹食物,可保护中肠细胞不受食物磨损,又可以让中肠消化酶穿过围食膜对食物进行消化,分解的营养物再由中肠细胞吸收[16]。本试验发现,蔗糖组和蜂蜜组的蜜蜂中肠肠壁厚度极显著大于果葡糖浆组,而且蜂蜜组和蔗糖组的蜜蜂中肠隐窝深度比果葡糖浆组要深。可见,蜂蜜和白砂糖有利于中肠肠道的发育和保护,这为春繁期蜜蜂更好地利用和消化营养物质打下了基础,对蜂群的快速繁衍具有促进作用。
3.3 不同越冬饲料对蜜蜂中肠抗氧化酶基因表达的影响生物体在代谢过程中会产生大量的过氧化氢、羟自由基和超氧阴离子自由基等活性氧,如果过多的活性氧不能及时被机体清除就会导致一系列的氧化损伤,进而引起机体的衰老和病变[17]。为了避免氧化损伤,生物体在进化的过程中形成了一个由酶促系统和非酶促系统构成的复杂且高度保守的抗氧化系统,来清除机体代谢过程中产生的活性氧[18]。超氧化物歧化酶 (SOD) 是氧自由基的天然清道夫,生物体内SOD活性高低是衰老与死亡的直观指标,CAT可以催化机体内的过氧化氢 (H2O2) 分解为H2O和O2,从而保护机体组织免受损伤。Williams等[19]研究表明,抗氧化能力降低是蜜蜂寿命缩短和行为衰老的主要原因,蜜蜂正常代谢时其体内会产生大量的氧自由基,这些氧自由基随蜜蜂的生长发育在体内不断积累,其肤色逐渐变深,生命力也逐渐下降。Wang等[20]研究表明,营养对工蜂寿命和相关基因的表达有一定的影响,其中花粉显著影响了Sod1基因的表达,同时该研究发现,饲喂花粉+王浆的蜜蜂生存状况最好,可见抗氧化酶基因的表达可在一定程度上体现蜜蜂的生存状况、健康程度等。
本试验发现,不同越冬饲料对蜜蜂中肠Sod2和CAT基因的相对表达量的影响不显著,但蔗糖组的蜜蜂中肠Sod1基因的相对表达量显著高于蜂蜜组和果葡糖浆组,这表明白砂糖有助于提高越冬蜂中肠的抗氧化能力,从而有利于蜜蜂安全的渡过越冬期。
4 结论蜂蜜能够提高越冬蜂中肠消化酶活性,蜂蜜和白砂糖有利于越冬蜂中肠组织的发育,而且蔗糖能够提高越冬蜂中肠抗氧化基因的表达。因此,蜂蜜和白砂糖比果葡糖浆更适合作为蜜蜂的越冬饲料。
| [1] | 焦震. 矿物质和维生素对意大利蜜蜂越冬性能的影响[D]. 硕士学位论文. 泰安: 山东农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10434-1012487380.htm |
| [2] | 杨海军. 果葡糖浆的特性及应用[J]. 食品科学, 2002, 23(2) :154–156. |
| [3] | 李中礼. 优质果葡糖浆可以喂蜂[J]. 蜜蜂杂志, 2012, 32(2) :18. |
| [4] | 沈育初. 白砂糖的最佳代用品——淀粉糖[J]. 蜜蜂杂志, 2006, 26(6) :41. |
| [5] | 陈渊. 用果葡糖浆作越冬饲料得不偿失[J]. 蜜蜂杂志, 2011, 30(2) :34. |
| [6] | 李家柱. 果葡糖浆不可喂蜂![J]. 蜜蜂杂志, 2011, 31(11) :17. |
| [7] | POPEK S. A procedure to identify a honey type[J]. Food Chemistry, 2002, 79(3): 401–406. DOI: 10.1016/S0308-8146(02)00391-6 |
| [8] | 王贻节. 蜜蜂产品学[M]. 北京: 农业出版社, 1994. |
| [9] | 赵凤奎, 胥保华. 蜂花粉的抗氧化作用[J]. 中国蜂业, 2013, 64(Suppl.2) :38–43. |
| [10] | LOTMAR R. Abbau und verwertung von stärke und dextrin durch die honigbiene[J]. Archiv für Bienenkunde, 1935, 16(6): 195–204. |
| [11] | 刘彩珍. 中华蜜蜂 (Apis cerana cerana Fabricius) 中肠消化酶活性的探讨[D]. 硕士学位论文. 福州: 福建农林大学, 2001. http://cdmd.cnki.com.cn/Article/CDMD-10389-2001006232.htm |
| [12] | HAYDAK M H. Honey bee nutrition[J]. Annual Review of Entomology, 1970, 15: 143–156. DOI: 10.1146/annurev.en.15.010170.001043 |
| [13] | HERB B R, WOLSCHIN F, HANSEN K D, et al. Reversible switching between epigenetic states in honeybee behavioral subcastes[J]. Nature Neuroscience, 2012, 15(10): 1371–1373. DOI: 10.1038/nn.3218 |
| [14] | BEENAKKERS A M T. Carbohydrate and fat as a fuel for insect flight.A comparative study[J]. Journal of Insect Physiology, 1969, 15(3): 3535–361. |
| [15] | STANDIFER L N. Honey bee nutrition and supplemental feeding[J]. Agriculture Handbook-United States Department of Agriculture, 1980(335): 39–45. |
| [16] | 曾志将. 养蜂学[M]. 2版. 北京: 中国农业出版社, 2009: 32-33. |
| [17] | JIN L H, BAHN J H, EUM W S, et al. Transduction of human catalase mediated by an HIV-1 TAT protein basic domain and arginine-rich peptides into mammalian cells[J]. Free Radical Biology and Medicine, 2001, 31(11): 1509–1519. DOI: 10.1016/S0891-5849(01)00734-1 |
| [18] | CORONA M, ROBINSON G E. Genes of the antioxidant system of the honey bee:annotation and phylogeny[J]. Insect Molecular Biology, 2006, 15(5): 687–701. DOI: 10.1111/imb.2006.15.issue-5 |
| [19] | WILLIAMS J B, ROBERTS S P, ELEKONICH M M. Age and natural metabolically-intensive behavior affect oxidative stress and antioxidant mechanisms[J]. Experimental Gerontology, 2008, 43(6): 538–549. DOI: 10.1016/j.exger.2008.02.001 |
| [20] | WANG H, ZHANG S W, ZENG Z J, et al. Nutrition affects longevity and gene expression in honey bee (Apis mellifera)[J]. Apidologie, 2014, 45(5): 618–625. DOI: 10.1007/s13592-014-0276-3 |




