牛奶总固形物中乳脂含量高达27%,是构成牛奶的重要物质基础,也是衡量乳品质的重要指标。氨基酸 (AA) 作为乳蛋白合成的主要前体物,不仅影响乳蛋白合成,对乳脂的合成也有影响[1],因此,深入研究AA对乳脂合成的影响及其机理对改善乳品质有重要的意义。亮氨酸 (Leu) 是动物的必需氨基酸,研究发现,小鼠饲粮缺乏Leu后其白色脂肪组织中的脂肪合成受限制,脂肪酸合成酶 (FASN) 和乙酰辅酶A羧化酶A (ACACA) 基因以及固醇调节元件结合蛋白1c (SREBP1c) 和FASN蛋白的表达显著下降,血清游离脂肪酸和甘油的含量也显著下降[2]。体外研究发现,Leu在影响乳蛋白合成的同时,也促进奶牛乳腺上皮细胞 (BMECs) 内固醇调节元件结合蛋白-1(SREBP1) 基因的表达和甘油三酯 (TG) 的合成[3]。这些结果提示Leu可能通过影响脂肪合成相关基因的表达促进脂肪合成。然而,采食高脂饲粮的小鼠摄入过量的Leu后,其体重下降,脂肪合成受抑制[4]。也有研究发现小鼠日摄入需要量2倍以上的Leu对血浆胆固醇和TG的合成无显著的影响[5]。可见,Leu对动物脂肪代谢的影响在不同的组织中不完全一样,有关Leu对奶牛乳脂合成的影响及其机理的研究报道很少。鉴于此,本试验以BMECs为模型,研究不同浓度Leu对乳脂合成相关基因及蛋白表达的影响,为进一步探讨Leu对乳脂合成的影响机理提供理论基础。
1 材料与方法 1.1 主要试剂DMEM/F12基础培养基 (12400-024)、胎牛血清 (FBS,10099-141)、Ⅱ型胶原酶 (17101-015)、胰岛素转铁蛋白硒钠 (51500-056)、细胞培养用青链霉素混合液 (15140-122) 及0.05%胰蛋白酶胰蛋白酶-乙二胺四乙酸 (EDTA) 溶液 (25300054) 均购自Gibco公司。Leu(L8912)、琼脂糖 (A9539)、氢化可的松 (H0135)、催乳素 (L6520)、表皮生长因子 (EGF,E4127)、油红O (O9755)、兔抗过氧化物酶体增殖物激活受体γ(PPARγ) 抗体 (AV32880) 购自Sigma公司。鼠抗SREBP1抗体 (ab3259) 购自Abcam公司。RIPA蛋白裂解液 (P0013C)、苯甲基磺酰氟 (PMSF,ST506)、二喹啉甲酸 (BCA) 蛋白浓度测定试剂盒 (P0012)、Western一抗稀释液 (P0023A)、Western二抗稀释液 (P0023D)、Western十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 电泳液 (P0014B)、Western转膜液 (P0012B)、ECL化学超敏显色液 (P0018) 均购自北京碧云天公司。RNAiso PLUS (D9109B)、PrimeScriptTM RT Master Mix (DRR036A) 和SYBR® Premix Ex TaqTM Ⅱ试剂盒 (DRR820A) 均购自TaKaRa公司。Tris-HCl缓冲液 (TBST)、兔抗甘油醛-3-磷酸脱氢酶 (GAPDH) 抗体 (10494-1-AP)、辣根过氧化物酶 (HRP) 标记山羊抗兔二抗 (04-15-06)、HRP标记山羊抗鼠二抗 (LK2003) 分别购自HyClone、Proteintech、KPL、三箭公司。无蛋白封闭液 (C520041) 购自上海生工有限公司。
1.2 试剂配制生长培养基的配制:在100 mL的DMEM/F12基础培养基中添加10%胎牛血清、1%胰岛转铁蛋白、1 μg/mL氢化可的松、0.5%胰岛素转铁蛋白硒钠、10 ng/mL表皮生长因子、5 μg/mL催乳素、100 μg/mL链霉素、100 IU/mL青霉素和2.5 μg/mL两性霉素B。
Leu工作液的配制:称取0.118 g的Leu粉末溶于10 mL无血清的生长培养基中,配成浓度为90 mmol/L的Leu贮备液,0.22 μm滤器过滤。用无血清的生长培养基按照梯度稀释法将90 mmol/L的Leu贮备液根据试验要求配制成不同Leu浓度的细胞培养液。
1.3 BMECs的培养采用胶原酶消化法培养BMECs,具体方法参照Sheng等[6]的方法进行。从内蒙古呼和浩特市北亚清真屠宰场选取3~5岁经产的健康泌乳中期的高产荷斯坦奶牛乳腺组织,0~4 ℃条件下运回实验室。从深层取约1 cm3组织块放入3×双抗的磷酸盐缓冲液 (PBS) 中。随后分别用3×双抗的PBS、75%酒精和1×PBS清洗。将腺泡丰富的组织剪成糊状后加入等体积0.5%的Ⅱ型胶原酶,37 ℃消化1 h。80目滤网过滤后,179×g离心5 min,弃上清;PBS冲洗细胞,179×g离心3 min,重复冲洗2次。用生长培养基悬浮接种于25 cm2透气培养瓶中,于37 ℃、5% CO2条件下培养,直至原代细胞贴壁率达约90%后用0.05%胰蛋白酶-EDTA纯化和传代细胞。
1.4 试验设计收集第3代BMECs并悬浮于生长培养基中按照试验要求的密度接种于细胞培养板上,于37 ℃、5% CO2培养24 h。试验采用单因子随机试验设计,将BMECs培养24 h后随机分为6个处理,每个处理6个重复。细胞培养液中Leu的浓度是参考庞学燕[7]和代文婷等[8]的研究结果,然后利用噻唑蓝 (MTT) 法通过细胞的增殖率确定,6个处理Leu的浓度分别为0.45、0.90、1.80、3.60、2.70和7.20 mmol/L,每个处理6个重复。在BMECs贴壁率为80%~90%时,换为无血清的生长培养基,12 h后按照试验设计要求换为不同Leu浓度的细胞培养液,37 ℃、5% CO2培养48 h。
1.5 测试指标与方法 1.5.1 BMECs内TG含量的测定BMECs内TG的含量参考Ramírez-Zacarías等[9]的方法测定,用吸光度 (OD) 值表示其含量,具体方法:将细胞悬液以5×104个/mL的密度接种于24孔培养板,按试验设计培养48 h后,弃培养液,PBS漂洗2次,每孔加入4%多聚甲醛溶液0.2 mL固定细胞1 h后,PBS漂洗2次,0.5 mL油红O工作液避光浸染2 h。然后用PBS漂洗3次,晾干培养板后,加入0.3 mL异丙醇萃取30 min,用全自动酶标仪在波长为510 nm处测定其OD值。
1.5.2 BMECs内乳脂合成相关基因表达的测定BMECs内乳脂合成相关基因的表达采用荧光定量PCR仪 (Thermo,美国) 检测,引物设计使用Primer 5.0进行 (表 1),测定的基因包括FASN、ACACA、硬脂酰辅酶A去饱和酶1(SCD1)、脂肪酸结合蛋白3(FABP3)、脂蛋白脂酶 (LPL)、PPARγ、SREBP1、乙酰甘油磷酸脂酰转移酶6(AGPAT6)、线粒体甘油-3-磷酸酰基转移酶 (GPAM)、磷脂酸磷酸酯酶1(LPIN1)、嗜乳脂蛋白亚家族1成员1(BTN1A1)、黄嘌呤脱氢酶 (XDH),并以GAPDH为管家基因。将细胞悬液以2×105个/mL的密度接种于24孔培养板,按试验设计培养48 h后提取总RNA。总RNA的提取采用Trizol法,于全自动酶标仪上检测总RNA的纯度与浓度,OD260 nm/OD280 nm在1.8~2.2范围内表示RNA纯度较好。在2%凝胶上电泳检测RNA完整性。RNA反转录成cDNA的操作步骤按照PrimeScriptTM RT Master Mix试剂盒的说明书进行,反转录体系为10 μL。基因表达量的检测依据SYBR Premix Ex TaqTM Ⅱ试剂盒的说明书进行操作,反应体系为20 μL。实时荧光定量PCR的反应程序为:95 ℃预变性30 s,95 ℃变性5 s;60 ℃退火34 s,95 ℃延伸20 s,进行40个循环;95 ℃、5 s,60 ℃、30 s,95 ℃、15 s,51个循环;绘制熔解曲线。采用2-△△Ct法进行目的基因相对表达量的计算。
|
|
表 1 乳脂合成相关基因的引物序列 Table 1 Primer sequences of genes related with milk fat synthesis |
BMECs内乳脂合成相关蛋白的表达采用蛋白质免疫印迹 (Western blotting) 的方法测定。将细胞悬液以1×106个/mL的密度接种于25 cm2细胞培养瓶,按试验设计培养48 h后,弃上清,PBS清洗贴壁生长的细胞2次,弃去上清,加入含0.1%PMSF的RIPA细胞裂解液250 μL,4 ℃裂解5 min后收集细胞悬液,4 ℃、15 455×g离心10 min,收集上清液检测PPARγ和SREBP1蛋白的表达。将60 μg待检测蛋白样品与5×上样缓冲液按照4:1的比例混合,100 ℃变性5 min后进行电泳,于浓缩胶上80 V电泳40 min,分离胶上120 V电泳100 min。目的蛋白经电泳分离后转移到聚偏二氟乙烯 (PVDF) 膜上。转膜完成后,用蒸馏水冲洗1 min,室温封闭1 h后,TBST洗涤3次,每次2 min。然后分别用兔抗PPARγ(1:250) 和鼠抗SREBP1(1:50) 于4 ℃孵育过夜,取出PVDF膜后TBST洗涤3次,每次5 min。分别用山羊抗兔二抗 (1:1 000) 和山羊抗鼠二抗 (1:500) 室温孵育1 h,TBST洗涤3次,每次8 min。用ECL化学超敏显色液进行显色,凝胶成像仪上照相分析 (Tanongis-1000,上海天能生物科技公司)。图片用Quantity one软件进行灰度值分析,PPARγ和SREBP1蛋白的相对表达量采用各处理与Leu浓度为0.45 mmol/L的处理的比值表示。
1.6 数据处理所有数据利用Excel 2007进行计算和整理,采用SAS 9.0软件的回归统计程序进行一次线性与二次曲线回归分析,P < 0.05表示回归关系显著,0.05≤P < 0.10表示回归关系趋于显著。
2 结果 2.1 Leu对BMECs内TG含量和乳脂合成相关基因表达的影响由表 2可知,不同浓度 (0.45~7.20 mmol/L) Leu处理的BMECs内TG含量差异不显著 (P>0.05),但0.90~2.70 mmol/L Leu处理的TG含量在数值上高于其他处理。随着Leu浓度的增加,BMECs内FABP3基因的相对表达量呈显著的一次线性下降 (P=0.018),LPL基因的相对表达量呈显著的二次曲线下降 (P=0.016),二者在3.60~7.20 mmol/L Leu处理的相对表达量均较低;BMECs内FASN和ACACA基因的相对表达量均呈显著的二次曲线增加 (P=0.013、P=0.002),FASN基因的相对表达量以1.80~2.70 mmol/L Leu处理较高,7.20 mmol/L Leu处理较低;BMECs内ACACA基因的相对表达量以1.80~7.20 mmol/L Leu处理较高,其他处理均较低。BMECs内SCD1和PPARγ基因的相对表达量与Leu浓度无显著的回归关系 (P>0.05),但从数值上看,PPARγ基因的相对表达量以0.90~2.70 mmol/L Leu处理较高,7.20 mmol/L Leu处理最低。BMECs内SREBP1基因的相对表达量随Leu浓度的增加呈显著的二次曲线增加 (P=0.022),以1.80 mmol/L Leu处理的相对表达量最高,7.20 mmol/L Leu处理的相对表达量最低。BMECs内AGPAT6、GPAM、LPIN1和BTN1A1基因的相对表达量随Leu浓度的增加呈显著的一次线性下降 (P=0.018、P=0.032、P=0.034、P < 0.001),以0.45~2.70 mmol/L Leu处理的AGPAT6、GPAM和BTN1A1基因的相对表达量较高,以0.45~1.80 mmol/L Leu处理的LPIN1基因的相对表达量较高。BMECs内XDH基因的相对表达量与Leu浓度无显著的回归关系 (P>0.05)。
|
|
表 2 Leu对BMECs内TG含量和乳脂合成相关基因表达的影响 Table 2 Effects of Leu on TG content and expression of genes related with milk fat synthesis in BMECs |
由表 3和图 1可知,BMECs内PPARγ蛋白的相对表达量与Leu浓度无显著的剂量依赖关系 (P>0.05),但从数值上看,以0.90~2.70 mmol/L Leu处理的相对表达量较高,3.60~7.20 mmol/L Leu处理的相对表达量较低。BMECs内SREBP1蛋白的相对表达量随着Leu浓度的增加呈显著的二次曲线增加 (P=0.032),以0.90~3.60 mmol/L Leu处理的相对表达量较高,且尤以1.80 mmol/L Leu处理的相对表达量最高,以7.2 mmol/L Leu处理的相对表达量最低。
|
|
表 3 Leu对BMECs内乳脂合成相关蛋白表达的影响 Table 3 Effects of Leu on expression of proteins related with milk fat synthesis in BMECs |
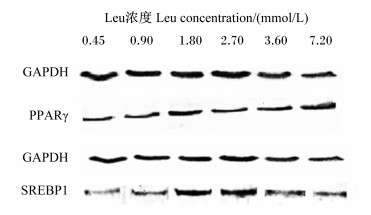
|
GAPDH:甘油醛-3-磷酸脱氢酶glycerol phosphate dehydrogenase;PPARγ:过氧化物酶体增殖物激活受体γ peroxisome proliferator-activated receptor gamma;SREBP1:固醇调节元件结合蛋白1 sterol regulatory element binding protein 1。 图 1 Leu对BMECs内乳脂合成相关蛋白表达的影响 Figure 1 Effects of Leu on expression of proteins related with milk fat synthesis in BMECs |
细胞内脂肪酸的自由扩散效率较低,而且不具有生物靶向性,所以大部分脂肪酸的靶向性运输都需要相关转运蛋白的参与[14]。LPL和FABP3基因是参与哺乳动物多种组织中长链脂肪酸 (LCFA) 摄取与细胞内转运的重要基因[15]。在玉米秸秆为粗饲料的条件下,奶牛阴外动脉灌注AA后,乳腺对LCFA的摄取及乳脂中的C18:0、c-9, c-12-C18:2和C18:3含量也下降[16]。本研究结果得出,随着Leu浓度的增加,BMECs内FABP3和LPL基因的相对表达量下降,说明Leu可能抑制BMECs内LCFA的摄入与转运。目前,关于Leu对FABP3和LPL基因表达影响的研究报道极少,有待于进一步研究探讨。
固醇调节元件结合蛋白 (SREBP) 和PPARγ是乳脂合成的重要调控因子。沉默BMECs内SREBP1基因后,ACACA和FASN基因的相对表达量显著下降[17]。用PPARγ的激活剂罗格列酮处理BMECs后,FASN和ACACA基因的相对表达量增加[18]。ACACA是脂肪酸从头合成的一种限速酶,催化乙酰-辅酶A (CoA) 羧化生成丙二酰CoA。FASN是一种多功能的酶系统,以一种代谢酶类参与脂肪的生成和沉积,是体内脂肪合成途径中的一个关键酶。在泌乳期间乳腺内FASN基因编码的蛋白FASN调控中短链脂肪酸 (SMCFA)(C4~C16) 的合成[19]。Cheng等[2]的研究发现,小鼠饲粮缺乏Leu后白脂肪组织中FASN和ACACA基因的相对表达量以及FASN和SREBP1c蛋白的相对表达量显著下降。另有研究发现,Leu上调BMECs内SREBP1基因的表达[3]。本研究结果显示,1.8~2.7 mmol/L的Leu可上调SREBP1和PPARγ基因和蛋白的表达,其靶基因ACACA和FASN的表达也上调。这说明Leu对乳脂的合成有显著的影响,且SREBP1和PPARγ可能参与Leu对乳脂合成的调控;此外,Leu对乳脂合成的影响与剂量有关,1.8~2.7 mmol/L的Leu可促进SMCFA的合成。
GPAM、AGPAT6和LPIN1是参与TG合成的主要基因,同时其编码的蛋白也是参与乳脂合成的关键酶[20]。GPAM催化脂酰CoA结合到甘油-3-磷酸的sn-1位点形成溶血磷脂酸,AGPAT催化第2个脂酰辅酶A结合到甘油-3-磷酸的sn-2位点形成磷脂酸。LPIN1能转移磷酸基团,将磷脂酸转变成二酰甘油,然后,另外一个脂酰CoA酯化到甘油的sn-3位点形成TG。乳腺细胞内的TG在一系列蛋白的作用下形成脂滴。BTN1A1和XDH是参与脂滴形成的主要蛋白[21]。BTN1A1在乳腺细胞分泌时帮助形成乳脂滴,XDH在乳脂肪球和细胞顶膜偶联过程中起重要作用。Leu、异亮氨酸 (Ile) 和缬氨酸 (Val) 等支链氨基酸 (BCAA) 对饲喂高脂饲粮的小鼠肥胖和脂肪代谢平衡具有一定影响,BCAA组小鼠肝脏和肌肉中TG的含量较对照组显著降低[22]。然而,日摄入2倍以上需要量的Leu对小鼠血浆胆固醇和TG的合成无显著的影响[5]。这些研究结果说明Leu对TG合成的影响结果不尽一致。本研究结果表明,高浓度 (3.60~7.20 mmol/L) Leu尽管抑制GPAM和AGPAT6基因的表达,但对TG的合成并没有显著的抑制效果;结果也得出Leu促进了脂肪酸的从头合成,但抑制了与LCFA的摄取与转运有关的基因的表达,这可能是导致其对TG合成影响不显著的主要原因。本研究还得出,高浓度Leu下调脂滴形成相关基因BTN1A1基因的表达。在奶山羊BMECs内,FASN基因干扰后BTN1A1基因的相对表达量和脂滴形成数量显著下降[23],说明高浓度Leu处理BMECs内BTN1A1基因表达的下调可能与FASN基因表达的下调有关。综合结果得出Leu对脂肪酸从头合成基因FASN和ACACA基因的表达均具有促进作用,且呈剂量依赖关系,FASN基因的表达以1.80~2.70 mmol/L的Leu促进效果较好,ACACA基因的表达以1.80~7.20 mmol/L的Leu促进效果较好;Leu上调SREBP1基因及蛋白的表达,1.80 mmol/L的Leu促进效果最好;Leu抑制FABP3、LPL、AGPAT6、GPAM和BTNIA1基因的表达,但只在添加高浓度 (3.60~7.20 mmol/L) 的Leu时抑制作用较大。综合乳脂合成的多项指标,Leu浓度为1.80~2.70 mmol/L效果较好。
4 结论Leu浓度为1.80~2.70 mmol/L时,对BMECs内FASN、ACACA和SREBP1基因及SREBP1蛋白表达的促进效果较好,对TG合成及脂滴形成相关基因的表达抑制作用较小。
| [1] | CANT J P, TROUT D R, QIAO F, et al. Milk composition responses to unilateral arterial infusion of complete and histidine-lacking amino acid mixtures to the mammary glands of cows[J]. Journal of Dairy Science, 2001, 84(5): 1192–1200. |
| [2] | CHENG Y, MENG Q S, WANG C X, et al. Leucine deprivation decreases fat mass by stimulation of lipolysis in white adipose tissue and upregulation of uncoupling protein 1(UCP1) in brown adipose tissue[J]. Diabetes, 2009, 59(1): 17–25. |
| [3] | 王立娜. 氨基酸与STAT5A基因互作对奶牛乳腺上皮细胞泌乳的调节作用及机理[D]. 博士学位论文. 哈尔滨: 东北农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10224-1014364717.htm |
| [4] | ZHANG Y Y, GUO K Y, LEBLANC R E, et al. Increasing dietary leucine intake reduces diet-induced obesity and improves glucose and cholesterol metabolism in mice via multimechanisms[J]. Diabetes, 2007, 56(6): 1647–1654. DOI: 10.2337/db07-0123 |
| [5] | NAIRIZI A, SHE P X, VARY T C, et al. Leucine supplementation of drinking water does not alter susceptibility to diet-induced obesity in mice[J]. Journal of Nutrition, 2009, 139(4): 715–719. DOI: 10.3945/jn.108.100081 |
| [6] | SHENG S, YAN S M, QI L Z, et al. Effect of the ratios of acetate and β-hydroxybutyrate on the expression of milk fat-and protein-related genes in bovine mammary epithelial cells[J]. Czech Journal of Animal Science, 2015, 60: 531–541. |
| [7] | 庞学燕. 亮氨酸在奶牛乳腺中的摄取效率及其对乳蛋白合成的影响[D]. 硕士学位论文. 扬州: 扬州大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-11117-1014356016.htm |
| [8] | 代文婷, 李爱军, 郑楠, 等. 亮氨酸水平对奶牛乳腺上皮细胞增殖及κ-酪蛋白合成相关基因表达的影响[J]. 动物营养学报, 2015, 27(5) :1559–1566. |
| [9] | RAMÍREZ-ZACARÍAS J, CASTRO-MUÑOZLEDO F, KURI-HARCUCH W, et al. Quantitation of adipose conversion and triglycerides by staining intracytoplasmic lipids with oil red O[J]. Histochemistry, 1992, 97(6): 493–497. DOI: 10.1007/BF00316069 |
| [10] | ZHOU Y, AKER R M, JIANG H. Growth hormone can induce expression of four major milk protein genes in transfected MAC-T cells[J]. Journal of Dairy Science, 2008, 91(1): 100–108. DOI: 10.3168/jds.2007-0509 |
| [11] | QI L Z, YAN S M, SHENG R, et al. Effects of saturated long-chain fatty acid on mRNA expression of genes associated with milk fat and protein biosynthesis in bovine mammary epithelial cells[J]. Asian Australasian Journal of Animal Sciences, 2014, 27(3): 414–421. |
| [12] | BIONAZ M, LOOR J J. Gene networks driving bovine milk fat synthesis during the lactation cycle[J]. BMC Genomics, 2008, 9: 366. DOI: 10.1186/1471-2164-9-366 |
| [13] | 张养东. 脂多糖对泌乳奶牛乳脂肪和乳蛋白影响及其机理研究[D]. 博士学位论文. 哈尔滨: 东北农业大学, 2011. |
| [14] | STREMMEL W, POHL J, RING A, et al. A new concept of cellular uptake and intracellular trafficking of long-chain fatty acids[J]. Lipids, 2001, 36(9): 981–989. |
| [15] | LEHNER R, KUKSIS A. Biosynthesis of triacylglycerols[J]. Progress in Lipid Research, 1996, 35(2): 169–201. DOI: 10.1016/0163-7827(96)00005-7 |
| [16] | 张福全. 泌乳奶牛阴外动脉灌注脂肪酸和氨基酸对乳腺脂肪酸代谢的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2015. |
| [17] | MA L, CORL B A. Transcriptional regulation of lipid synthesis in bovine mammary epithelial cells by sterol regulatory element binding protein-1[J]. Journal of Dairy Science, 2012, 95(7): 3743–3755. |
| [18] | KADEGOWDA A K G, BIONAZ M, PIPEROVA L S, et al. Peroxisome proliferator-activated receptor-γ activation and long-chain fatty acids alter lipogenic gene networks in bovine mammary epithelial cells to various extents[J]. Journal of Dairy Science, 2009, 92(9): 4276–4289. DOI: 10.3168/jds.2008-1932 |
| [19] | WAKIL S J. Fatty acid synthase, a proficient multifunctional enzyme[J]. Biochemistry, 1989, 28(11): 4523–4530. DOI: 10.1021/bi00437a001 |
| [20] | BIONAZ M, LOOR J J. ACSL1, AGPAT6, FABP3, LPIN1, and SLC27A6 are the most abundant isoforms in bovine mammary tissue and their expression is affected by stage of lactation[J]. Journal of Nutrition, 2008, 138(6): 1019–1024. |
| [21] | MCMANAMAN J L, RUSSEL T D, SCHAACK J, et al. Molecular determinants of milk lipid secretion[J]. Journal of Mammary Gland Biology and Neoplasia, 2007, 12(4): 259–268. |
| [22] | ARAKAWA M, MASAKI T, NISHIMURA J, et al. The effects of branched-chain amino acid granules on the accumulation of tissue triglycerides and uncoupling proteins in diet-induced obese mice[J]. Endocrine Journal, 2011, 58(3): 161–170. DOI: 10.1507/endocrj.K10E-221 |
| [23] | 朱江江. FASN基因对奶山羊乳腺脂肪酸代谢的调控作用研究[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10712-1015333512.htm |




