脐带间充质干细胞 (umbilical cord mesenchymal stem cells, UC-MSCs) 是间充质干细胞 (mesenchymal stem cells, MSCs) 家族的重要成员,不仅保持了MSCs多向分化潜能,还具有强大的自分泌/旁分泌功能,可分泌血管内皮生长因子 (vascular endothelial growth factor,VEFG)、类胰岛素样生长因子-Ⅰ(insulin like growth factor-Ⅰ, IGF-Ⅰ)、表皮生长因子 (epidermal growth factor,EGF) 等多种细胞因子[1],其中IGF-Ⅰ对乳腺发育和泌乳功能调控具有重要作用,在阻止乳腺上皮细胞凋亡中发挥关键作用[2]。目前,公认的IGF-Ⅰ发挥抗凋亡作用主要通过磷脂酰肌醇-3激酶 (phosphatidylinositol-3-kinase, PI3K)[3]和丝裂原激活蛋白激酶 (mitogen-activated protein kinase, MAPK) 信号通路来实现[4],且作用机制已清晰。研究发现,体外培养的奶牛乳腺上皮细胞 (bovine mammary gland epithelial cells, BMECs) 中,PI3K调节亚基可诱导转录因子——信号转导及转录活化因子 (signal transducer and activator of transcription,STAT) 调节细胞凋亡[5];此外,类胰岛素样生长因子-Ⅰ受体 (insulin like growth factor-Ⅰ receptor, IGF-ⅠR) 可以激活PI3K、MAPK、Janus激酶 (Janus kinase, JAK) 等多种胞内亚单位[6],产生级联信号转导反应,通过启动相关的信号通路来抑制细胞凋亡,这3条信号途径对细胞的存活都是必需的,当其中有信号通路被阻断后,IGF-Ⅰ就不能对抗多种因素引起的细胞凋亡反应。因此,随着对BMECs凋亡调控途径的不断探索,近些年,在乳腺方面,主要研究热点集中在JAK/STAT信号通路,其在参与调节乳腺组织增殖、代谢、凋亡、泌乳等生物学功能中发挥重要作用[7],但非外源性IGF-Ⅰ介导的JAK/STAT信号通路在BMECs抗凋亡中并未见报道。本团队前期工作已成功构建UC-MSCs和BMECs无血清最佳共培养体系,且发现共培养减弱了共培养体系细胞的凋亡[8],但具体作用机制并不清楚,因此本研究从模拟体内内源性细胞因子调节细胞凋亡的角度出发,将UC-MSCs和BMECs利用TranswellTM小室共培养,采用IGF-ⅠR抑制剂和JAK/STAT信号阻断剂,探究JAK/STAT是否参与UC-MSCs通过IGF-Ⅰ抑制BMECs凋亡及相关基因表达的调节作用,以揭示与UC-MSCs共培养对BMECs凋亡的影响及可能的作用机制。
1 材料与方法 1.1 试验设计与分组在前期试验[8]的基础上,按照UC-MSCs和BMECs最佳共培养条件,应用TranswellTM小室 (孔径0.4 μm) 建立上下双层细胞共培养体系,在上室接种BMECs 1 mL (1×105个/孔),下室接种UC-MSCs 2 mL (1×105个/孔),并以单纯培养BMECs作为对照。48 h之后给予IGF-ⅠR抑制剂AG1024(10 μmol/L) 和/或JAK抑制剂AG490(50 μmol/L) 处理细胞,均置于37 ℃、5% CO2培养箱常规培养,培养液为无血清基础培养基 (serum free medium, SFM),培养24 h后吸取上清并采用胰酶消化法收集细胞,-20 ℃保存备用。按照试验设计,试验共设8组,分别为BMECs (单纯培养BMECs)、BMECs/UC-MSCs (共同培养BMECs和UC-MSCs)、BMECs+AG1024(AG1024处理单纯培养的BMECs)、BMECs/UCMSCs+AG1024(AG1024处理与UC-MSCs共培养的BMECs)、BMECs+AG490(AG490处理单纯培养的BMECs)、BMECs/UC-MSCs+AG490(AG490处理与UC-MSCs共培养的BMECs)、BMECs+AG490+AG1024(AG1024与AG490共同处理单纯培养的BMECs)、BMECs/UCMSCs+AG490+AG1024组 (AG1024与AG490共同处理与UC-MSCs共培养的BMECs),每组均设3个平行。
1.2 试验材料 1.2.1 试验细胞来源UC-MSCs:前期试验[8]体外分离培养并鉴定的荷斯坦奶牛UC-MSCs;BMECs:购自广州吉妮欧生物科技有限公司。
1.2.2 主要仪器和试剂倒置显微镜 (Motic-AE31)、CO2培养箱 (HF151UV)、TranswellTM小室 (Corning)、AG1024(Alexis)、AG490(Sigma)、实时荧光定量PCR (real-time quantitative PCR, RT-qPCR) 试剂盒 (上海诺伦生物医药技术有限公司),膜联蛋白V (Annexin V)-异硫氰酸荧光素 (fluorescein isothiocyanate, FITC)/碘化丙啶 (propidium iodide,PI) 检测试剂盒 (上海博古生物科技有限公司)、流式细胞仪 (Becton Dickinson Facscalibour)。
1.3 指标测定与方法应用流式细胞仪联合Annexin V-FITC/PI检测试剂盒检测各组细胞凋亡情况;参考RT-qPCR试剂盒检测各组细胞半胱氨酸蛋白酶3(cysteine aspartic acid specific protease,Caspase-3)、B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)、B细胞淋巴瘤/白血病基因伴随蛋白x (Bcl-associated x protein, Bax) 基因的表达丰度,以β-肌动蛋白 (β-actin) 为内参基因,基因序列均从GenBank中获取,引物用Primer 5.0软件进行设计,由上海博古生物科技有限公司合成,见表 1;采用Annexin V-FITC/PI双染法进行细胞凋亡检测,方法参照Annexin V-FITC/PI试剂盒说明书,应用流式细胞仪测定。
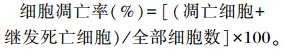
|
|
|
表 1 引物序列 Table 1 Sequences of primers |
数据采用SPSS 18.0软件进行方差分析,结果用平均值±标准差 (mean±SD) 表示,以P < 0.05作为差异显著性判断标准。
2 结果 2.1 AG1024干预下AG490对细胞凋亡率的影响各组细胞凋亡散点如图 1所示,横坐标是Annexin V-FITC,纵坐标是PI,Q1区域代表机器损伤细胞,Q2区域代表晚期凋亡细胞或继发性坏死亡细胞,Q3区域代表正常细胞,Q4区域代表早期凋亡细胞。
|
SSC:侧向角散射side scatter;FSC:前向角散射forward scatter;Blank:空白; Annexin V:膜联蛋白V;FITC:异硫氰酸荧光素fluorescein isothiocyanate;PI:碘化丙啶propidium iodide。 图 1 各组细胞凋亡散点图 Figure 1 Apoptosis scatter plot diagram of each group |
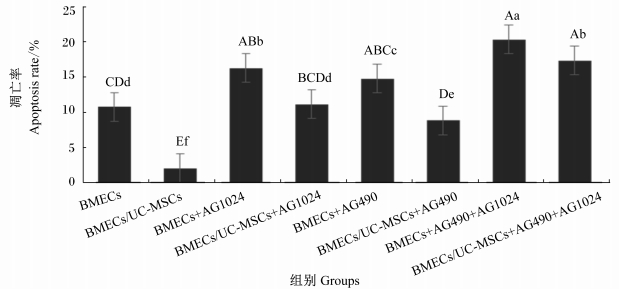
各组细胞凋亡率结果如图 2所示,BMECs/UC-MSCs组的细胞凋亡率极显著低于其他各组 (P < 0.01);AG1024处理极显著升高了单独培养的BMECs以及与UC-MSCs共培养的BMECs的凋亡率 (P < 0.01);AG490处理显著升高了单独培养的BMECs的凋亡率 (P < 0.05),极显著升高了与UC-MSCs共培养的BMECs的凋亡率 (P < 0.01);AG490与AG1024共同处理极显著升高了单独培养的BMECs以及与UC-MSCs共培养的BMECs的凋亡率 (P < 0.01)。
|
数据柱标有不同小写字母表示差异显著 (P < 0.05),不同大写字母表示差异极显著 (P < 0.01)。 Data columns with different small letters mean significant difference (P < 0.05), and with different capital letters mean significant difference (P < 0.01). 图 2 各组细胞凋亡率 Figure 2 Apoptosis rate of cells in each group |
RT-qPCR结果如表 2所示,BMECs/UC-MSCs组的Caspase-3、Bax基因的相对表达丰度显著或极显著低于其他各组 (P < 0.05或P < 0.01),Bcl-2基因的相对表达丰度则极显著高于其他各组 (P < 0.01);AG1024或AG490处理单独培养的BMECs和与UC-MSCs共培养的BMECs后Caspase-3、Bax基因的相对表达丰度均显著或极显著上调 (P < 0.05或P < 0.01),AG1024与AG490共同处理单独培养的BMECs和与UC-MSCs共培养的BMECs后Caspase-3、Bax基因的相对表达丰度均极显著上调 (P < 0.01);除AG1024处理单独培养的BMECs后Bax基因的相对表达丰度稍有下调 (P > 0.05) 外,AG1024处理与UC-MSCs共培养的BMECs或AG490处理单独培养的BMECs和与UC-MSCs共培养的BMECs后Bax基因的相对表达丰度均显著或极显著下调 (P < 0.05或P < 0.01),AG1024与AG490共同处理单独培养的BMECs和与UC-MSCs共培养的BMECs后Bax基因的相对表达丰度均显著或极显著下调 (P < 0.05或P < 0.01)。
|
|
表 2 AG1024干预下AG490对细胞凋亡相关基因表达的影响 Table 2 Effects of AG490 on the expression of apoptosis related genes under AG1024 intervention |
细胞凋亡是基因控制的细胞的自然死亡,Bcl-2家族中的Bcl-2、Bax基因是目前已知的细胞凋亡中功能相互对立的一对最重要的调控基因[9],而Caspase-3是细胞凋亡的主要执行者[10]。本试验结果显示,与单纯培养BMECs相比,共培养BMECs和UC-MSCs使细胞的凋亡率极显著降低,Caspase-3、Bax基因的相对表达丰度显著或极显著下调,Bcl-2基因的相对表达丰度极显著上调。这说明与UC-MSCs共培养可以明显下调BMECs促凋亡基因的表达,上调抗凋亡基因的表达,从而抑制BMECs的凋亡,这与图 2细胞凋亡率数据相吻合。前期试验已证实无血清培养条件下,UC-MSCs和BMECs共培养可以显著提高IGF-Ⅰ及IGF-ⅠR含量,且IGF-Ⅰ主要存在于UC-MSCs中,而IGF-Ⅰ需要与IGF-ⅠR结合来激活下游信号通路,实现其生物学功能[8]。本试验中,AG1024处理24 h之后,显著上调了BMECs中Caspase-3、Bax基因的表达,下调了Bcl-2基因的表达,极显著提高了BMECs的凋亡率,而与UC-MSCs共培养后下调了促凋亡基因的表达,凋亡率也显著降低。多项研究已证明UC-MSCs可以分泌包括IGF-Ⅰ在内的多种促细胞生长因子[11-12];研究发现IGF-Ⅰ在调控BMECs凋亡中具有重要作用[13-14];另有报道称IGF-Ⅰ在小鼠泌乳下降阶段减缓了BMECs的凋亡[15];高玉红等[16]也通过试验证明IGF-Ⅰ对BMECs凋亡有明显抑制作用。本试验结果与前人研究结果一致,但不同之处在于本试验采用的是无血清培养基,排除了外源因子的干扰,TranswellTM小室又能准确反映出UC-MSCs对BMECs的影响,由此表明UC-MSCs是通过IGF-Ⅰ实现对BMECs凋亡的抑制的。
Wareski等[17]发现凋亡相关因子如凋亡启动子Bax、凋亡抑制子Bcl-2和凋亡操纵子Caspase-3在整个泌乳期都有表达,Bax和Caspase-3表达的上调伴随着BMECs死亡的持续性增加以及干乳期凋亡细胞数目的增多。因此可以说UC-MSCs可以通过自身分泌的IGF-Ⅰ流通至上室影响BMECs,IGF-Ⅰ对BMECs发挥内源性保护机制以下调促凋亡基因Bax和Caspase-3的表达,上调抗凋亡基因Bcl-2的表达,削减促凋亡因子对BMECs的损害,联合抗凋亡因子维持或促进BMECs的生长,最终达到抑制BMECs凋亡的作用,由于BMECs自身不能持续分泌IGF-Ⅰ等生长因子,所以体外将UC-MSCs和BMECs共培养可代替外源性添加IGF-Ⅰ来抑制BMECs的凋亡,这为延长BMECs生长、增殖分化过程等提供了一个新颖的方法。
3.2 UC-MSCs通过IGF-Ⅰ抑制BMECs凋亡的可能途径凋亡的发生及发展的开关就是信号传递,诱导细胞凋亡的因素主要是通过受体介导进入细胞内,经信号传递进入中央调控阶段,激活相应凋亡相关因子,最后使细胞结构改变引起死亡[18]。那么IGF-Ⅰ对BMECs发挥抗凋亡的具体分子机制又是怎样的呢?前人已报道IGF-Ⅰ可激活PI3K/AKT、MAPK等信号通路对其他类型的细胞促增殖、抗凋亡等作用[19],而JAK/STAT信号途径参与细胞增殖、分化、功能发挥、凋亡等过程,是一条重要的介导细胞因子信号传导的通路[20],那UC-MSCs内源性分泌的IGF-Ⅰ是否可以激活JAK/STAT这条重要的信号通路对BMECs发挥抗凋亡的作用呢?迄今并未见报道。因此本试验在前期试验的基础上进行更深一步的探索。
本试验结果显示,AG490处理的BMECs的凋亡率较正常培养的BMECs显著升高,且AG490处理的与UC-MSCs共培养的BMECs的凋亡率极显著升高。研究称AG490作为JAK激酶抑制剂,可以有效阻断JAK2和JAK3的激活,从而阻断JAK/STAT信号通路传导[21]。这说明本试验中JAK/STAT信号通路参与了BMECs凋亡变化过程。但BMECs与UC-MSCs共培养时加入AG490后则极显著降低了BMECs的凋亡率,这说明UC-MSCs可以有效再次激活被阻断的JAK/STAT信号通路,降低BMECs的凋亡率。而图 2中,与无处理的BMECs相比,AG490和AG1024共同处理的BMECs的凋亡率极显著升高,AG490和AG1024单独处理的BMECs的凋亡率也均显著升高,再与UC-MSCs共培养则BMECs的凋亡率更是极显著升高,表明被抑制的IGF-Ⅰ切断了JAK/STAT信号通路,促进了BMECs凋亡,这揭示了IGF-Ⅰ介导JAK/STAT信号通路参与对BMECs凋亡的调节。表 2结果与凋亡率结果一致,当IGF-Ⅰ和JAK/STAT被阻断,Caspase-3、Bax基因的表达下调的同时,相应的Bcl-2基因的表达上调,Bcl-2与Bax比值下降,诱导了BMECs的凋亡。研究发现,IGF-Ⅰ的缺失会引发BMECs凋亡,STAT3的磷酸化伴随着乳腺的复原性退化[22];有报道称,乳腺退化时BMECs内的Bax、Caspase-3基因表达丰度的上升[23];Xiong等[24]发现,AG490可阻断JAK/STAT3信号通路,下调Bcl-2基因的表达;另有报道瘦素、催乳素等可能通过激活JAK/STAT5信号通路参与对乳腺生长发育的调控[25-26],JAK/STAT5信号通路被阻断则会诱导BMECs的凋亡,影响泌乳功能[27]。这提示UC-MSCs可能是通过独立的分泌功能分泌的IGF-Ⅰ与其受体IGF-ⅠR结合,吸引JAK聚集磷酸化,JAK又磷酸化活化STAT,激活JAK/STAT信号通路,上调抗凋亡基因、下调促凋亡基因的表达,进而发挥对BMECs凋亡的抑制作用,但对于IGF-Ⅰ是否和其他激素或生长因子共同作用亦或是有其他通路的参与以及通路的协同作用等尚不明确。
4 结论在体外无血清共培养条件下,IGF-ⅠR抑制剂和JAK/STAT信号阻断剂单独处理均可促进BMECs的凋亡,但同时处理较单独处理的BMECs的凋亡率显著升高,而UC-MSCs能够通过IGF-Ⅰ介导JAK/STAT信号通路调节BMECs凋亡相关基因的表达,降低BMECs的凋亡率。
| [1] | GUILLOT P V, GOTHERSTROM C, CHAN J, et al. Human first-trimester fetal MSC express pluripotency markers and grow faster and have longer telomeres than adult MSC[J]. Stem Cells, 2007, 25(3): 646–654. |
| [2] | 牛朝诗. IGF-ⅠR与细胞增殖、凋亡和肿瘤[J]. 国外医学:生理、病理科学与临床分册, 2000, 20(3) :212–215. |
| [3] | 黄露麒, 王万铭. IGF-Ⅰ通过PI3K/Akt通路抑制MPP+诱导PC12细胞凋亡机制的研究[J]. 中风与神经疾病杂志, 2014, 31(10) :897–899. |
| [4] | FLEMING J M, BRANDIMARTO J A, COHICK W S. The mitogen-activated protein kinase pathway tonically inhibits both basal and IGF-Ⅰ-stimulated IGF-binding protein-5 production in mammary epithelial cells[J]. Journal of Endocrinology, 2007, 194(2): 349–359. DOI: 10.1677/JOE-06-0121 |
| [5] | GUO C, YANG L, WAN C X, et al. Anti-neuroinflammatory effect of sophoraflavanone G from Sophora alopecuroides in LPS-activated BV2 microglia by MAPK, JAK/STAT and Nrf2/HO-1 signaling pathways[J]. Phytomedicine, 2016, 23(13): 1629–1637. DOI: 10.1016/j.phymed.2016.10.007 |
| [6] | 王俊宏. 胰岛素样生长因子Ⅰ受体与细胞凋亡信号转导[J]. 国外医学:生理、病理科学与临床分册, 2002, 22(5) :445–447. |
| [7] | HACHIM I Y, SHAMS A, LEBRUN J J, et al. A favorable role of prolactin in human breast cancer reveals novel pathway-based gene signatures indicative of tumor differentiation and favorable patient outcome[J]. Human Pathology, 2016, 53: 142–152. DOI: 10.1016/j.humpath.2016.02.010 |
| [8] | 王立文. 奶牛乳腺上皮细胞和奶牛脐带间充质干细胞共培养的试验研究[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2014: 35-38. |
| [9] | 董雅洁, 高维娟. Bcl-2、Bax、Caspase-3在细胞凋亡中的作用及其关系[J]. 中国老年学杂志, 2012, 32(21) :4828–4830. |
| [10] | 袁长青, 丁振华. Caspase的结构与功能[J]. 国外医学分子生物学分册, 2002, 24(3) :146–151. |
| [11] | CHEN K, WANG D, DU W T, et al. Human umbilical cord mesenchymal stem cells hUC-MSCs exert immunosuppressive activities through a PGE2-dependent mechanism[J]. Clinical Immunology, 2010, 135(3): 448–458. DOI: 10.1016/j.clim.2010.01.015 |
| [12] | DENG Y, ZHANG Y, YE L, et al. Umbilical cord-derived mesenchymal stem cells instruct monocytes towards an IL10-producing phenotype by secreting IL6 and HGF[J]. Science Reports, 2016, 5(6): 37566. |
| [13] | HA W T, JEONG H Y, LEE S Y, et al. Effects of the insulin-like growth factor pathway on the regulation of mammary gland development[J]. Development & Reproduction, 2016, 20(3): 179–185. |
| [14] | TONNER E, ALLAN G, SHKRETA L, et al. Insulin-like growth factor binding protein-5(IGFBP-5) potentially regulates programmed cell death and plasminogen activation in the mammary gland[J]. Advances in Experimental Medicine and Biology, 2000, 480: 45–53. |
| [15] | HADSELL D L, BONNETTE S G, LEE A V. Genetic manipulation of the IGF-Ⅰ axis to regulate mammary gland development and function[J]. Journal of Dairy Science, 2002, 85(2): 365–377. DOI: 10.3168/jds.S0022-0302(02)74083-6 |
| [16] | 高玉红, 李庆章. IGFs对小鼠乳腺IGFBP-5和Cyclin D1表达的影响[J]. 中国乳品工业, 2007, 35(11) :41–43. |
| [17] | WARESKI P, MOTYL T, RYNIEWICZ Z, et al. Expression of apoptosis-related proteins in mammary gland of goat[J]. Small Ruminant Research, 2001, 40(3): 279–289. DOI: 10.1016/S0921-4488(01)00178-X |
| [18] | 黄鑫华. 泌乳期牛乳腺上皮细胞凋亡的研究[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2007. |
| [19] | GAO H N, HU H, ZHENG N, et al. Leucine and histidine independently regulate milk protein synthesis in bovine mammary epithelial cells via mTOR signaling pathway[J]. Journal of Zhejiang University Science B, 2015, 16(6): 560–572. |
| [20] | ZHANG X K, DARNELL J E. Functional importance of STAT3 tetramerization in activation of the α2-macroglobulin gene[J]. Journal of Biological Chemistry, 2001, 276(36): 33576–33581. DOI: 10.1074/jbc.M104978200 |
| [21] | HEBENSTREIT D, HOREJS-HOECK J, DUSCHL A. JAK/STAT-dependent gene regulation by cytokines[J]. Drug News & Perspectives, 2005, 18(4): 243–249. |
| [22] | 黄田英, 李庆章, 侯晓明. 乳腺中JAK-STAT信号通路的研究进展[J]. 中国乳品工业, 2010, 38(2) :41–44. |
| [23] | 肖阳, 张莉, 高学军, 等. 奶牛乳腺上皮细胞凋亡周期性规律及机理研究[J]. 畜牧与兽医, 2012, 44(增刊1) :229–230. |
| [24] | XIONG H, ZHANG Z G, TIAN X Q, et al. Inhibition of JAK1, 2/STAT3 signaling induces apoptosis, cell cycle arrest, and reduces tumor cell invasion in colorectal cancer cells[J]. Neoplasia, 2008, 10(3): 287–297. DOI: 10.1593/neo.07971 |
| [25] | 田青, 季昀, 庞学燕, 等. 胰岛素对奶牛乳腺上皮细胞酪蛋白合成调节机理的研究[J]. 动物营养学报, 2013, 25(3) :550–560. |
| [26] | 邢媛媛, 李大彪, 李红磊, 等. 催乳素对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响[J]. 动物营养学报, 2016, 28(8) :2439–2447. |
| [27] | KE Y H, LESPERANCE J, ZHANG E E, et al. Conditional deletion of Shp2 in the mammary gland leads to impaired lobulo-alveolar outgrowth and attenuated Stat5 activation[J]. Journal of Biological Chemistry, 2006, 281(45): 34374–34380. DOI: 10.1074/jbc.M607325200 |




