2. 河北工程大学农学院, 邯郸 056021
2. College of Agriculture, Hebei University of Engineering, Handan 056021, China
家禽肠道菌群对宿主营养吸收和肠道发育发挥着重要的作用,进而影响家禽的生长与健康[1]。环境因素、饲粮和日龄均可影响肠道菌群[2-5]。研究报道,热应激作用下,肉鸡盲肠内菌群数量变化明显,乳酸杆菌和双歧杆菌的数量显著降低,大肠杆菌和产气荚膜梭菌的数量显著升高[6],饲粮可显著影响胃肠道菌群的组成和代谢活性[7]。长期以来,对家禽消化道菌群的研究,多利用传统纯培养法对菌群数量进行检测[8],但结果不够准确。原因是由于胃肠道菌群绝大多数是厌氧的,但当下技术还不够成熟,由此可见基础培养方法对肠道菌群的分析局限性很大。据报道,用传统培养技术,鸡肠道内50%以上的正常菌群不易被检测[9]。随着现代新型技术的发展,分子生物学为研究肠道菌群提供了科学方便的方法[10]。本实验室利用变性梯度凝胶电泳 (DGGE) 技术研究发现,26 ℃持续偏热处理减少了肉鸡盲肠菌群的多样性[11],而且发现间歇性偏热环境 (26和31 ℃) 和相对湿度 (RH) 诱导的应激显著影响肉鸡的生产性能、体温和酸碱平衡[12]。目前为止,利用DGGE技术对肉鸡肠道菌群影响因素的研究在饲粮成分[7, 13]、日龄大小[14-17]、热应激[18-19]方面有所报道,但有关RH在间歇性26 ℃环境下对肉鸡肠道菌群的研究未见报道。因此,本试验通过对肉鸡盲肠菌群16S rDNA的DGGE图谱进行分析,研究间歇性26 ℃环境下不同RH对肉鸡盲肠菌群多样性的影响。
1 材料与方法 1.1 试验动物与饲养管理选取180只29日龄健康爱拔益加 (AA) 肉鸡,体重 (1 210±13) g,随机分成3个组,每组6个重复,每个重复10只鸡 (公母各5只)。试验在动物营养学国家重点实验室环境控制舱内进行,温度、RH自动控制 (精度分别为±1 ℃和±7%),无风,24 h光照。试验肉鸡饲养在本实验室研发的单层平养笼具[20]上,自由采食与饮水。试验动物所用饲粮与文献[21-22]保持一致。
1.2 试验设计22日龄肉鸡在21 ℃、RH为60%的环境适应1周。29日龄时,将肉鸡分别转入3个环境控制舱,RH分别为30%、60%和85%,温度在10:00—16:00(6 h) 维持在26 ℃,剩余时间温度为21 ℃,RH为60%至试验结束,共14 d。
1.3 样品的收集与处理分别于试验第7天和第14天,每组随机选取6只鸡 (公母各3只,每重复选1只),禁食12 h后处死,用5%新洁尔灭浸泡3 min,全身消毒,打开腹腔,结扎盲肠两端,剪下后转移至超净工作台,用无菌剪刀剪开盲肠肠壁,将同一组的6个样品迅速混合均匀,放入无菌的2 mL离心管中,液氮速冻,-80 ℃冰箱保存备用。
1.4 盲肠样品分析 1.4.1 细菌总DNA的提取参考文献[23],采用十六烷基三甲基溴化铵 (CTAB) 手提法,提取样品基因组总DNA (由北京亿鸣复兴生物科技有限公司完成)。提取的基因组总DNA置于-20 ℃保存备用。
1.4.2 基因组总DNA 16S rDNA V3区扩增根据参考文献[24]设计出16S rDNA V3区引物 (由北京亿鸣复兴生物科技有限公司合成),见表 1。
|
|
表 1 引物序列 Table 1 Sequences of primers |
PCR扩增体系 (50 μL) 为:10×PCR缓冲液5 μL;dNTP (2.5 mmol/μL)3.2 μL;TaqDNA聚合酶 (5 U/μL)0.4 μL;GC357F (20 μmol/μL)1 μL;517R (20 μmol/μL)1 μL;模板DNA 50 ng;补ddH2O至50 μL。PCR扩增程序为94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火0.5 s,72 ℃延伸1 min,30个循环,72 ℃延伸10 min。
采用OMEGA公司DNA Gel Extraction Kit对PCR产物进行纯化回收。PCR仪为Biometra公司生产的T-gradient。
1.4.3 基因组总DNA 16S rDNA V3区扩增片段DGGE取10 μL PCR的产物,采用Bio-Rad公司的Gel-Doc2000凝胶成像系统进行凝胶电泳分析。采用浓度为7%的聚丙烯酰胺凝胶、变性梯度为30%~60%、150 V、60 ℃下在1×TAE缓冲液中电泳5~8 h。DGGE完毕后,参考文献[25]进行硝酸银染色。染色完毕后,采用Bio-Rad公司的Gel-Doc2000凝胶成像系统扫描成像。
1.4.4 割胶回收差异条带和共性条带并克隆测序用灭菌的手术刀切下条带,目的条带的回收采用OMEGA公司Poly-Gel DNA Extraction Kit。以回收产物为模板,按1.4.2方法再次扩增16S rDNA V3区,把重新扩增的DNA片段切胶回收、纯化,将产物连接在Pmd18-T载体上,并转化至大肠杆菌DH5α感受态细胞中,挑选阳性克隆,北京亿鸣复兴生物科技有限公司进行测序。测序结果分析在GenBank的Blast中进行。
1.5 数据处理DGGE图谱采用Quantity One软件对每个样品的条带数目进行量化分析,用非加权组平均法 (UPGMA) 进行聚类分析。根据DGGE图谱样品条带数及每个条带灰度值,对各样品中细菌多样性指数进行分析。样品的多样性用香农-维纳指数 (H)、均匀度 (E) 和丰富度 (S) 表示。其算法如下:
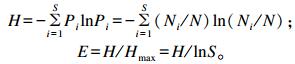
|
式中:Pi为样品中单一条带的强度在该样品所有条带总强度中所占的比率;N为DGGE图谱单一泳道上所有条带的丰富度,Ni为第i条带的丰富度;S是某样品中所有条带数目总和。
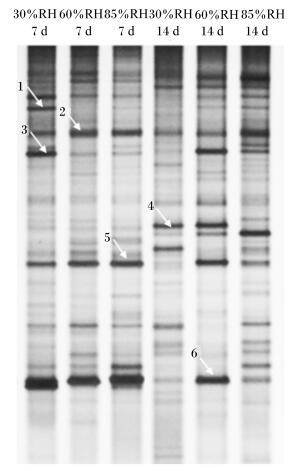
2 结果与分析 2.1 肉鸡盲肠菌群结构分析各部位样品均是6只鸡盲肠内含物的混合物。持续偏热处理影响肉鸡盲肠菌群的PCR-DGGE图谱 (图 1),相同时间、不同RH处理下的图谱均有差异。采用Quantity One软件将肉鸡盲肠菌群16S rDNA V3区PCR-DGGE图谱进行数字化分析,结果显示:试验第7天,30%RH组细菌条带比60%RH组增加了2条,85%RH组细菌条带比60%RH组减少了1条;试验第14天,30%、85%RH组细菌条带比60%RH组分别增加了8和5条。结果表明:试验第7天,30%RH增加了肉鸡盲肠菌群的多样性,85%RH减少了肉鸡盲肠菌群的多样性;试验第14天,30%、85%RH均增加了肉鸡盲肠菌群的多样性。相同RH处理,不同时间对肉鸡盲肠菌群的PCR-DGGE图谱影响也有差异。30%、85%RH组条带在试验第14天比第7天增加了5条,60%RH组则减少了1条,这说明30%、85%RH组处理时间对肉鸡盲肠菌群多样性影响较大,而60%RH组则影响较小。
|
图谱中数字为切胶编号。 The numbers in the profiles showed excised gel No. 图 1 肉鸡盲肠内容物PCR-DGGE图谱 Figure 1 PCR-DGGE profiles generated from cecum contents of broilers |
聚类分析结果 (图 2) 显示,试验第7天,30%、85%RH组和60%RH组的相似系数分别为71.2%、64.4%;试验第14天,30%、85%RH组和60%RH组的相似系数分别为52.9%、65.2%;试验第14天较第7天,30%RH组相似系数较85%RH组明显下降。以上结果表明,试验第7天,85%RH对盲肠菌群影响明显;试验第14天,30%RH对盲肠菌群影响明显,且随着处理时间推移,30%RH对肉鸡盲肠菌群影响越大。

|
图 2 肉鸡盲肠菌群PCR-DGGE聚类分析 Figure 2 Cluster analysis of PCR-DGGE for cecum flora of broilers |
根据PCR-DGGE图谱中样品条带数目及每个条带的强度,对各样品中细菌多样性指标进行分析。由表 2可知,不同RH处理下肉鸡盲肠菌群多样性指标存在差异。试验第7天,30%RH组盲肠菌群香农-维纳指数和丰富度是2.81和20,85%RH组为2.65和17;试验第14天,30%RH组盲肠菌群香农-维纳指数和丰富度是3.03和25,85%RH组为2.96和22;且在整个试验期间30%RH组香农-维纳指数和丰富度均高于60%、80%RH组。试验第7天,85%RH组香农-维纳指数和丰富度均低于60%RH组;试验第14天,30%、85%RH组香农-维纳指数和丰富度均高于60%RH组。在试验全期,各组的均匀度都在92%以上。结果表明,30%RH提高了肉鸡盲肠菌群多样性指数和丰富度;试验第7天,85%RH降低了肉鸡盲肠菌群多样性指数和丰富度;试验第14天,30%、85%RH提高了肉鸡盲肠菌群多样性指数和丰富度。
|
|
表 2 肉鸡盲肠菌群多样性 Table 2 Cecum flora diversity of broilers |
从肉鸡盲肠菌群16S rDNA V3区PCR-DGGE图谱中分别割胶回收了2个共性条带和4个特异性条带 (见图 1中箭头所指),PCR扩增后克隆到Pmd18-T载体并测序,在GenBank数据库中进行比对分析,测序结果见表 3,试验第7、14天时盲肠均检测到2和6号条带 (Faecalibacterium prausnitzii);间歇性26 ℃环境下不同RH处理后,盲肠菌群也会出现明显差异,在试验第7天,1号条带 (Stomatobaculum longum) 均出现在30%、85%RH组,而60%RH组未发现;在试验第14天,1和5号条带 (Stomatobaculum longum和Faecalibacterium prausnitzii) 在30%RH处理下均不生长,在60%、85%RH组均被测出,4号条带 (Clostridium thermosuccinogenes) 均出现在30%、60%RH组,而85%RH组未发现。以上结果说明,在试验第7天,30%、85%RH促进了Stomatobaculum longum生长;在试验第14天,30%RH抑制了Faecalibacterium prausnitzii的定植,85%RH抑制了Clostridium thermosuccinogenes的定植。
在6个测序结果中,条带序列分布于厚壁菌门 (Firmicutes)、拟杆菌门 (Bacteroidetes),与GenBank数据库中细菌的同源性绝大多数都大于95%,但条带4数据库中与之亲缘关系最近的已鉴定的菌群的同源性仅为84%。因此这个序列所代表的菌群有可能为新的不可培养菌群。
|
|
表 3 DGGE图谱中条带的基因片段序列比对 Table 3 Comparison of genomic sequences of bands from DGGE profiles |
Zhou等[26]研究表明,PCR-DGGE图谱分析家禽肠道菌群需具备合适的样本量,大量试验结果表明最佳样本量为5只鸡。Gong等[27]采用同样的分析技术研究肉鸡嗉囊到盲肠黏膜细菌的组成,采用的样本量为5只鸡。彭骞骞等[11]在2015年应用DGGE技术对持续偏热环境对肉鸡盲肠菌群多样性的研究,所采用的样本量为6只鸡。因此,本试验采用6只肉鸡盲肠内容物混合样品,应用DGGE技术分析间歇性26 ℃环境下RH对肉鸡盲肠菌群多样性的影响。
研究显示,盲肠对菌群多样性影响很大[28]。盲肠菌群的多样性以及1 g粪便含有1×1011 CFU菌群使盲肠成为人们关注的焦点[7]。许多研究报道,肉鸡肠道中盲肠菌群较丰富[29]。李永洙[19]利用PCR-DGGE技术发现肉鸡生长期对盲肠菌群的影响最大。盲肠内菌群最丰富,随着日龄的增长菌群种类会增加,28日龄达到稳定状态[27]。本试验根据前人研究,选取盲肠对肉鸡进行肠道菌群多样性的研究。
本研究结果显示,试验第7天,85%RH降低了盲肠总菌数量,减少了肉鸡盲肠菌群的多样性;试验第14天,30%、85%RH增加了盲肠总菌数量,改变了肉鸡盲肠菌群的多样性。30%、85%RH组条带在试验第14天比第7天增加5条,60%RH组则减少1条。这说明在30%、85%RH组中,处理时间对肉鸡盲肠菌群多样性影响较大,60%RH组中则影响较小。前人研究表明,间歇性偏热 (26、31℃) 环境和RH诱导显著影响肉鸡的生长性能、体温和酸碱平衡;而且85%RH显著降低肉鸡的平均日采食量和平均日增重,但对料重比都没有显著影响,显著升高肉鸡的体温,造成酸碱平衡紊乱[12]。Adams等[30]阐述,持续29 ℃时,高湿 (80% vs. 40%) 降低了4~8周龄肉鸡的生长率。本试验研究表明,85%RH先减少后增加肉鸡盲肠菌群多样性,可能由于85%RH改变了肉鸡肠道酸碱平衡,导致使肠道菌群平衡遭到破坏,从而降低了机体应对不良因素的能力。
3.2 持续偏热环境对肉鸡盲肠菌群结构的影响家禽肠道中的细菌主要是厚壁门菌[27]。本试验结果表明,间歇性26 ℃环境下,30%RH减少了Faecalibacterium prausnitzii、Stomatobaculum longum的生长,85%RH减少了Clostridium thermosuccinogenes的定植。Faecalibacterium prausnitzii能代谢肠道未吸收的糖类产品产生大量丁酸,是肠道产生丁酸的主要细菌。它也可以分泌某种尚不明确的物质与丁酸产生抗炎作用,并且可以纠正肠道菌群失调[31-32]。Stomatobaculum longum在基础厌氧培养基主要的终末代谢产物是丁酸、乳酸、异戊酸和乙酸[33]。Clostridium thermosuccinogenes主要发酵各种碳水化合物,主要产物为琥珀酸、醋酸和甲酸[33]。这3种细菌都属于不可培养的厚壁门细菌,厚壁门菌和拟杆门菌中的大部分菌可产生降解植物细胞壁的酶,参与植物细胞壁的降解,从而与肠道的消化功能有关。研究表明,丁酸对宿主的肠道健康起到重要作用[34-37]。试验第14天,30%、85%RH组条带比试验第7天增加5条,而60%RH组仅减少1条,由此可见,30%、85%RH对肉鸡盲肠菌群多样性影响较大,60%RH则影响较小。高湿和低湿应激导致的肉鸡肠道菌群数量和种类的改变,目前工作只是对部分条带进行分析,菌种对其消化吸收是正效应亦或负效应有待进一步全面研究。
4 结论① 间歇性26 ℃环境下,30%、85%RH改变了肉鸡盲肠菌群多样性。
② 间歇性26 ℃环境下,30%RH处理下的特异性菌是Stomatobaculum longum和Faecalibacterium prausnitzii,85%RH抑制了Clostridium thermosuccinogenes的定植。
| [1] | MACKIE R, WHITE B, ISAACSON R E. Gastrointestinal microbiology:gastrointestinal microbes and host interactions[M]. New York: Springer, 1997. |
| [2] | LUMPKINS B S, BATAL A B, LEE M D. Evaluation of the bacterial community and intestinal development of different genetic lines of chickens[J]. Poultry Science, 2010, 89(8): 1614–1621. DOI: 10.3382/ps.2010-00747 |
| [3] | NICHOLSON J K, HOLMES E, KINROSS J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336(6086): 1262–1267. DOI: 10.1126/science.1223813 |
| [4] | SJÖGREN Y M, TOMICIC S, LUNDBERG A, et al. Influence of early gut microbiota on the maturation of childhood mucosal and systemic immune responses[J]. Clinical & Experimental Allergy, 2009, 39(12): 1842–1851. |
| [5] | SAMUEL B S, SHAITO A, MOTOIKE T, et al. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, Gpr41[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(43): 16767–16772. DOI: 10.1073/pnas.0808567105 |
| [6] | 贺绍君, 赵书景, 李静, 等. 甜菜碱对热应激肉鸡生长性能、十二指肠消化酶活性及盲肠微生物区系的影响[J]. 动物营养学报, 2014, 26(12) :3731–3739. DOI: 10.3969/j.issn.1006-267x.2014.12.024 |
| [7] | 王丽凤, 张家超, 马晨, 等. 鸡肠道微生物研究进展[J]. 动物营养学报, 2013, 25(3) :494–502. |
| [8] | BARROW P A.Probiotics for chickens[M]//FULLER R.Probiotics:the scientific basis.Netherlands:Springer, 1992:225-257. |
| [9] | BARNES E M, MEAD G C, BARNUML D A, et al. The intestinal flora of the chicken in the period 2 to 6 weeks of age, with particular reference to the anaerobic bacteria[J]. British Poultry Science, 1972, 13(3): 311–326. DOI: 10.1080/00071667208415953 |
| [10] | HOOPER L V, WONG M H, THELIN A, et al. Molecular analysis of commensal host-microbial relationships in the intestine[J]. Science, 2001, 291(5505): 881–884. DOI: 10.1126/science.291.5505.881 |
| [11] | 彭骞骞, 王雪敏, 张敏红, 等. 持续偏热环境对肉鸡盲肠菌群多样性的影响[J]. 中国农业科学, 2016, 49(1) :186–194. |
| [12] | 周莹, 彭骞骞, 张敏红, 等. 相对湿度对间歇性偏热环境下肉鸡体温、酸碱平衡及生产性能的影响[J]. 动物营养学报, 2015, 27(12) :3726–3735. DOI: 10.3969/j.issn.1006-267x.2015.12.011 |
| [13] | TOROK V A, OPHEL-KELLER K, LOO M, et al. Application of methods for identifying broiler chicken gut bacterial species linked with increased energy metabolism[J]. Applied and Environmental Microbiology, 2008, 74(3): 783–791. DOI: 10.1128/AEM.01384-07 |
| [14] | GONG J, YU H, LIU T, et al. Effects of zinc bacitracin, bird age and access to range on bacterial microbiota in the ileum and caeca of broiler chickens[J]. Journal of Applied Microbiology, 2008, 104(5): 1372–1382. DOI: 10.1111/j.1365-2672.2007.03699.x |
| [15] | FONSECA B B, BELETTI M E, SILVA M S D, et al. Microbiota of the cecum, ileum morphometry, pH of the crop and performance of broiler chickens supplemented with probiotics[J]. Revista Brasileira De Zootecnia, 2010, 39(8): 1756–1760. DOI: 10.1590/S1516-35982010000800018 |
| [16] | LU J, IDRIS U, HARMON B, et al. Diversity and succession of the intestinal bacterial community of the maturing broiler chicken[J]. Applied and Environmental Microbiology, 2003, 69(11): 6816–6824. DOI: 10.1128/AEM.69.11.6816-6824.2003 |
| [17] | AMIT-ROMACH E, SKLAN D, UNI Z. Microflora ecology of the chicken intestine using 16S ribosomal DNA primers[J]. Poultry Science, 2004, 83(7): 1093–1098. DOI: 10.1093/ps/83.7.1093 |
| [18] | 李永洙, 李进, 张宁波, 等. 热应激环境下蛋鸡肠道微生物菌群多样性[J]. 生态学报, 2015, 35(5) :1601–1609. |
| [19] | 李永洙. 利用PCR-DGGE方法分析不同鸡群的盲肠微生物菌群结构变化[J]. 生态学报, 2011, 31(21) :6513–6521. |
| [20] | 张敏红, 苏红光, 冯京海, 等. 采集用于建立肉鸡生活环境舒适性评价模型数据的方法和专用装置: 中国, CN103404447A[P]. 2013-11-27. |
| [21] | 胡春红, 张敏红, 冯京海, 等. 偏热刺激对肉鸡休息行为、生理及生产性能的影响[J]. 动物营养学报, 2015, 27(7) :2070–2076. |
| [22] | 甄龙, 石玉祥, 张敏红, 等. 持续偏热环境对肉鸡生长性能、糖脂代谢及解偶联蛋白mRNA表达的影响[J]. 动物营养学报, 2015, 27(7) :2060–2069. |
| [23] | SHEN W H. Plant molecular biology, a laboratory manual:edited by M.S. Clark, Springer Verlag, Berlin, 1997, DM 120.00[J]. Plant Science, 1997, 124(2): 223. DOI: 10.1016/S0168-9452(97)04610-4 |
| [24] | MUYZER G, DE WAAL E C, UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3): 695–700. |
| [25] | VAN ORSOUW N J, LI D, VIJG J. Denaturing gradient gel electrophoresis (DGGE) increases resolution and informativity of Alu-directed inter-repeat PCR[J]. Molecular and Cellular Probes, 1997, 11(2): 95–101. DOI: 10.1006/mcpr.1996.0089 |
| [26] | ZHOU H, GONG J, BRISBIN J T, et al. Appropriate chicken sample size for identifying the composition of broiler intestinal microbiota affected by dietary antibiotics, using the polymerase chain reaction-denaturing gradient gel electrophoresis technique[J]. Poultry Science, 2007, 86(12): 2541–2549. DOI: 10.3382/ps.2007-00267 |
| [27] | GONG J H, SI W D, FORSTER R J, et al. 16S rRNA gene-based analysis of mucosa-associated bacterial community and phylogeny in the chicken gastrointestinal tracts:from crops to ceca[J]. FEMS Microbiology Ecology, 2007, 59(1): 147–157. DOI: 10.1111/fem.2007.59.issue-1 |
| [28] | 倪学勤, GONGJ, YUH, 等. 采用PCR-DGGE技术分析蛋鸡肠道细菌种群结构及多样性[J]. 畜牧兽医学报, 2008, 39(7) :955–961. |
| [29] | 姚琨, 张日俊. 肉仔鸡后肠道菌群多样性及其演替规律的研究[C]//中国畜牧兽医学会动物营养学分会第十次学术研讨会论文集. 杭州: 中国畜牧兽医学会, 2008: 1. |
| [30] | ADAMS R L, ROGLER J C. The effects of dietary aspirin and humidity on the performance of light and heavy breed chicks[J]. Poultry Science, 1968, 47(4): 1344–1348. DOI: 10.3382/ps.0471344 |
| [31] | SIZOVA M V, MULLER P, PANIKOV N, et al. Stomatobaculum longum gen. nov., sp. nov., an obligately anaerobic bacterium from the human oral cavity[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(4): 1450–1456. |
| [32] | SOKOL H, PIGNEUR B, WATTERLOT L, et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(43): 16731–16736. DOI: 10.1073/pnas.0804812105 |
| [33] | LOUIS P, FLINT H J. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine[J]. FEMS Microbiology Letters, 2009, 294(1): 1–8. DOI: 10.1111/fml.2009.294.issue-1 |
| [34] | SRIDHAR J, EITEMAN M A. Metabolic flux analysis of Clostridium thermosuccinogenes[J]. Applied Biochemistry and Biotechnology, 2001, 94(1): 51–69. DOI: 10.1385/ABAB:94:1 |
| [35] | DUNCAN S H, HOLD G L, HARMSEN H J M, et al. Growth requirements and fermentation products of Fusobacterium prausnitzii, and a proposal to reclassify it as Faecalibacterium prausnitzii gen. nov., comb. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(6): 2141–2146. |
| [36] | BEN-AMOR K, HEILIG H, SMIDT H, et al. Genetic diversity of viable, injured, and dead fecal bacteria assessed by fluorescence-activated cell sorting and 16S rRNA gene analysis[J]. Applied and Environmental Microbiology, 2005, 71(8): 4679–4689. DOI: 10.1128/AEM.71.8.4679-4689.2005 |
| [37] | PRYDE S E, DUNCAN S H, HOLD G L, et al. The microbiology of butyrate formation in the human colon[J]. FEMS Microbiology Letters, 2002, 217(2): 133–139. DOI: 10.1111/fml.2002.217.issue-2 |




