应激 (stress) 是机体出现的全身性的非特异性适应反应,当动物机体平衡受到威胁时所发生的一系列生理反应。应激原是指能引起全身性适应症的条件或事物的总称。导致应激的因素是多种多样的,在冬天,尤其是北方,寒冷的气候条件是导致动物产生应激反应最为常见的因素,对畜禽的生产性能以及抗病能力有着严重的影响,极大地制约了畜牧行业的发展。
蛋白质组 (proteome) 指一个基因组、细胞、组织所表达的所有蛋白质,最早由Marc Wilkins和Keith Williams在1994年的一次双向电泳会议上首次提出[1]。蛋白质组学 (proteomics) 是从蛋白质水平来分析蛋白质类型、数量、空间结构以及相互作用机制的研究[2-3]。近年来随着蛋白质组学的迅猛发展,大量的蛋白质组学技术也被广泛应用,但双向凝胶电泳 (2-DE) 和质谱 (MS) 技术仍是蛋白质组学研究中最为经典和基本的研究方法,可以将同种生物不同状态下的生物样本进行比较,监测蛋白质表达的变化,因此被广泛应用于差异表达蛋白质的检测和疾病的诊断等方面[4-9]。大量研究表明,动物长期处于寒冷环境下会导致机体内环境稳定性发生改变,从而产生一系列异常的生理反应,增加机体产热,以应对寒冷刺激的影响[10]。血清中丰富的蛋白质可以反映出动物机体的生理环境,可通过分析其表达的差异,来判断动物机体的生理状态,并将其作为疾病诊断的标志蛋白质。本试验拟利用高通量的蛋白质组学技术对雏鸡冷应激前后血清中蛋白质的表达差异进行分析和检测,得到在冷应激条件下表达发生改变的标志蛋白质,这对于其分子水平作用机理的研究、疾病的早期诊断和预防有着极其重要的意义和价值。
1 材料与方法 1.1 试验动物试验动物为30只1日龄的罗曼雏公鸡,饲养于人工智能气候室内,保证空气流通,给予充足的水和饲粮,整个试验期间均自由饮食。
1.2 动物模型及分组将1日龄的罗曼雏公鸡随机分成3组 (每组10只),第1组为常温对照组,环境温度控制在33~35 ℃(常温对照组分2批处理,分别作为冷应激组和冷适应组的对照处理);第2组为冷应激组,3日龄时将冷应激组置于25 ℃下2 h,然后将冷应激组雏鸡和对照组的5只雏鸡断头取血;第3组为冷适应组,环境温度比对照组低4~6 ℃,在第14天时将冷适应组雏鸡和对照组的5只雏鸡断头取血。每只雏鸡采血2 mL,慢慢注入到已灭菌的5 mL离心管中,室温静止1 h后,4 ℃下3 500×g离心5 min,小心收集血清。
1.3 蛋白质样品准备每组各取出50 μL血清样品。用去除血清高丰度蛋白质试剂盒 (aurum serum protein mini kits) 去除血清中的白蛋白和免疫球蛋白G (IgG)。按二辛可宁酸 (BCA) 定量试剂盒操作说明操作测出血清蛋白质的浓度。
1.4 2-DE2-DE参照Bio-Rad双向电泳手册进行操作,等电聚焦 (IEF) 采用17 cm pH 4~7的胶条,水化液同时上样,上样量为1 mg。IEF之后,将固定化pH梯度 (IPG) 胶条平衡在平衡缓冲液Ⅰ[50 mmol/L三羟甲基氨基甲烷-盐酸缓冲液 (Tris-HCl)、6 mol/L尿素 (urea)、30%丙三醇 (glycerin)、1%十二烷基硫酸钠 (SDS)、0.2% DDT、痕量溴酚蓝]中,水平摇床上平衡15 min,之后用滤纸吸掉多余的缓冲液,将胶条加入到平衡缓冲液Ⅱ[50 mmol/L Tris-HCl、6 mol/L尿素、30%丙三醇、1%SDS、3%碘乙酰胺 (IAA)、痕量溴酚蓝]中平衡15 min。平衡后的胶条用清水冲洗,滤纸吸干胶条表面水分,在12.5%的SDS-聚丙烯酰胺凝胶上进行第2向电泳。电泳结束后,立刻将凝胶浸入固定液 (40%乙醇、10%乙酸溶液) 中2 h。考马斯亮蓝染色,30 ℃摇动染色过夜,用10%乙酸反复漂洗,至凝胶背景清晰为止。染色后使用PowerLook 2 100XL扫描仪扫描并保存凝胶图像,通过PDQuest 8.0对凝胶图像进行分析。
1.5 差异蛋白质的质谱鉴定和数据分析 1.5.1 切取差异蛋白质点及脱色从凝胶中切取选定适宜大小的差异蛋白质点和非蛋白质点区域的凝胶于1 mL于EP管中,用超纯水洗涤2遍,吸干,-20 ℃保存。取50 μL脱色液 (30 mmol/L铁氰化钾溶液和100 mmol/L硫代硫酸钠按1:1混合) 于含胶块的EP管中涡旋脱色5 min,重复上述操作1次。用超纯水洗涤3次后加脱色工作液50%乙腈脱色20 min,重复1次,再加50 mol/L碳酸氢铵溶液,平衡1 h;之后用180 μL超纯水洗涤5 min,冷冻干燥机中冷冻干燥20 min。
1.5.2 酶解加10 μL二硫苏糖醇溶液到凝胶中 (足够覆盖住胶片),60 ℃下作用30 min,再加10 μL碘乙酰胺,弃掉上清,用碳酸氢铵洗涤弃上清。将凝胶切成2~4 mm3的小块,移至用水洗涤过的EP管中。用乙腈脱去凝胶的水分后再用胰酶进行酶切,酶切过程中保持胶块湿润。胰酶作用15 h后可从混合物中获得初始肽的指纹。提取肽段,在-20 ℃以下冰冻抽干。
1.5.3 基质辅助激光解吸电离飞行时间质谱 (MALDI-TOF-MS) 分析基质辅助激光解吸电离 (MALDI) 中样品制备是一个关键的步骤,被分析物必须掺入基质晶体,如有盐或缓冲液污染存在会显著影响这一过程。取1 μL冻干后的酶解肽段溶解,和基质按1:1等体积混合后吸取1 μL点样于不锈钢板,室温干燥至结晶,之后送入MALDI-飞行时间 (TOF) 质谱仪进行分析:正离子,激光源波长为337 nm的激光器,反射模式,加速电压为2 kV。
1.5.4 数据库检索将质谱分析所获得的肽质量指纹图谱 (PMF) 用Flexanalysis软件处理,通过使用Mascot搜索软件搜索NCBInr或Swissprot数据库。检索参数设置:固定修饰为carbamidomethy1(C),可变修饰为甲硫氨酸的氧化,质量允许的误差范围为最大允许误差控制在±0.5 u或1×10-4范围内,最小序列覆盖率为15%,检索物种为鸡。对匹配的覆盖率、片段数、理论等电点和分子质量、实际分子质量进行比较分析,分子质量搜索 (MOWSE) 得分≥75(P<0.05) 为成功鉴定蛋白质。
1.5.5 蛋白质印迹 (Western blot) 验证样品上样量为每个孔80 μg。配制12%的分离胶,80 V低电压恒压电泳45 min后改用120 V高电压恒压电泳大约90 min。将聚偏氟乙烯 (PVDF) 膜浸泡在甲醇溶液中激活,80 V恒压转膜2 h。转膜结束后将蛋白质膜放入封闭液[5%脱脂奶粉溶于含有1%吐温的三羟甲基氨基甲烷缓冲盐水 (TBST) 中]中封闭,之后分别孵育一抗[兔源果糖二磷酸醛缩酶C (ALDOC) 多克隆抗体和磷酸甘油醛脱氢酶 (GAPDH)]和二抗 (荧光标记),取出膜后以含有1%吐温的磷酸缓冲盐水 (PBST) 溶液漂洗3次,每次洗涤10 min。使用PowerLook 2 100XL扫描仪扫描并保存图像。
2 结果与分析 2.1 2-DE结果利用PDQuest 8.0图像分析软件对凝胶图像进行比较分析,每张血清蛋白质2-DE图谱可检测到的蛋白质点有500~600个 (图 1)。将2个试验组雏鸡血清蛋白质2-DE图谱与常温对照组进行差异对比分析,结果发现,冷应激组共找到差异蛋白质14个,其中表达上调的蛋白质为8个,表达下调的蛋白质为6个;冷适应组共找到差异蛋白质13个,其中表达上调的蛋白质为7个,表达下调的蛋白质为6个。
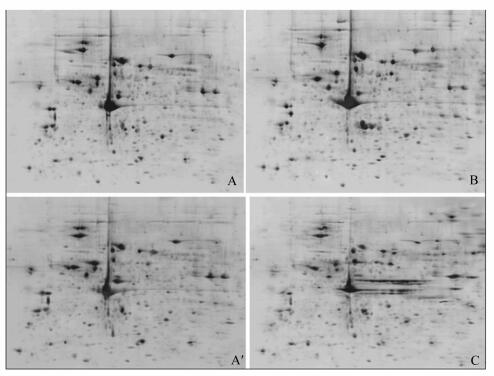
|
A:常温对照组雏鸡血清蛋白质2-DE图谱 (3日龄) 2-DE map of serum proteins of chicks in normal temperature control group (3 days of age);A′:常温对照组雏鸡血清蛋白质2-DE图谱 (14日龄) 2-DE map of serum proteins of chicks in normal temperature control group (14 days of age);B:冷应激组雏鸡血清蛋白质2-DE图谱 (3日龄) 2-DE map of serum proteins of chicks in cold stress group (3 days of age);C:冷适应组雏鸡血清蛋白质2-DE图谱 (14日龄) 2-DE map of serum proteins of chicks in cold-adapted group (14 days of age)。 图 1 雏鸡血清蛋白质2-DE图谱 Figure 1 2-DE maps of serum proteins of chicks |
分析2-DE图谱得到差异蛋白质点23个,利用MALDI-TOF-MS技术对其中8个重复性好且较为明显的差异蛋白质点进行鉴定分析,成功鉴定出4个差异蛋白质,其中2个为ALDOC,另外2个为未知蛋白质。ALDOC在冷应激组血清中含量升高,以其中1个ALDOC为例,其肽质量指纹图谱如图 2所示,利用Mascot检索NCBInr数据库,鉴定出蛋白质的相关信息见表 1。
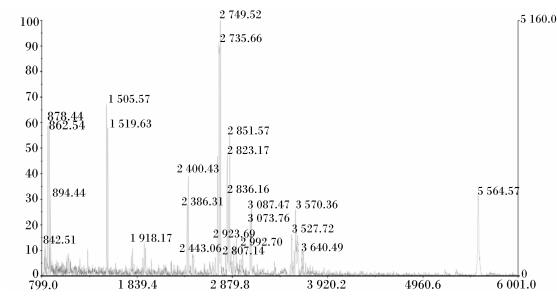
|
横坐标为肽片段质/荷比 (M/Z),纵坐标为肽片段相对丰度。 The abscissa represents the peptide mass/charge ratio (M/Z), and the ordinate represents the relative abundance of the peptide fragment. 图 2 差异表达蛋白质肽质量指纹图 Figure 2 The peptide mass fingerprints of differential expressed protein |
|
|
表 1 差异表达蛋白质的MALDI-TOF-MS分析鉴定结果 Table 1 The identification results of differential expressed proteins by MALDI-TOF-MS analysis |
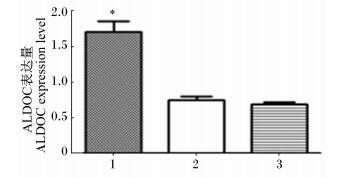
利用Western blot方法,以磷酸甘油醛脱氢酶 (GAPDH) 作为内参在蛋白质水平上验证各组雏鸡血清中ALDOC的表达情况,结果与双向电泳分析结果一致,如图 3和图 4所示。结果显示:冷应激组、冷适应组雏鸡血清中ALDOC的表达水平均高于常温对照组,且冷应激组与常温对照组的差异达到显著水平 (P < 0.05)。

|
1:冷应激组Cold stress group;2:冷适应组Cold-adapted group;3:常温对照组Normal temperature control group。GAPDH:磷酸甘油醛脱氢酶glyceraldehyde-phosphate dehydrogenase;ALDOC:果糖二磷酸醛缩酶C Aldolase C fructose-bisphosphate。 图 3 差异表达蛋白质Western blot分析验证 Figure 3 Verification of differential expressed protein by Western blot analysis |
|
1:冷应激组Cold stress group;2:冷适应组Cold-adapted group;3:常温对照组Normal temperature control group。 *表示与常温对照组相比差异显著 (P<0.05)。 * represents significant difference compared with normal temperature control group (P < 0.05). 图 4 各组雏鸡血清ALDOC的表达量 Figure 4 The expression level of ALDOC in serum of chicks in different groups |
血液中的成分会随着机体生理环境的变化而发生改变,肿瘤、心血管疾病以及代谢性疾病等多种疾病都会引起血液中蛋白质含量的变化,在现代蛋白质组学研究中,血清、血浆常被用于疾病的早期诊断,通过分析疾病与关键蛋白质之间的关系,有助于我们了解疾病早期的病理机理,对疾病的预后及治疗方面具有广阔的前景[11-21]。本研究对冷应激组、冷适应组和常温对照组的雏鸡血清蛋白质进行2-DE分析,比较了3组雏鸡血清蛋白质的表达图谱,结果发现:有3个差异蛋白质在冷应激组和冷适应组中同时存在且表达上调,1个差异蛋白质在冷应激组和冷适应组中表达下调,12个差异蛋白质只在冷应激组中表达,9个差异蛋白质只在冷适应组中表达。我们挑选在2-DE图谱上清晰、图谱重复性好、差异明显的蛋白质点,作为动物冷应激蛋白质组学研究中的一个突破点,进行后续的分析。其他所检测到的差异蛋白质还有待利用肽质量指纹图谱进行下一步鉴定分析和验证。
应用MALDI-TOF-MS技术对差异表达蛋白质进行分析,成功鉴定出4个差异蛋白质,结果显示,其中2个差异蛋白质为未知蛋白质,有待进一步研究;另外2个差异蛋白质的鉴定结果均为ALDOC,这种现象可能是由2-DE中蛋白质翻译后修饰等因素造成的。冷应激过程中血液蛋白质含量的改变很可能在其发生、发展中起到重要作用,对蛋白质的深入研究不仅能为探究冷应激相关疾病的发生机制奠定基础,而且能为探讨冷应激相关并发症的防治工作提供科学的参考依据。
醛缩酶 (aldolase, ALD) 是一种广泛存在于自然界中的糖酵解酶,能够催化醛醇反应 (产生醛醇) 或逆反应 (裂解醛醇) 的进行。在哺乳动物体内存在3种醛缩酶的同工酶,果糖二磷酸醛缩酶A (ALDOA)、果糖二磷酸醛缩酶B (ALDOB) 和ALDOC。ALDOC位于线粒体中,主要参与到糖代谢通路当中,是糖酵解过程中一种关键酶[22],后又被鉴定为脂质代谢的相关蛋白。根据其他研究学者对冷应激后雏鸡血清中糖代谢、能量代谢相关的生化指标以及其他的一些生化指标和免疫因子等的研究[23-24]发现,冷应激处理后雏鸡血清中的葡萄糖 (GLU)、胰岛素 (INS)、游离脂肪酸 (FFA) 等能量代谢指标的浓度均出现明显变化,且随着应激时间的延长呈现上升的趋势,当动物受到冷应激时,生长素和胰高血糖素分泌增加,促进糖原分解和糖异生,导致血清中葡萄糖的浓度增加,胰岛素促进糖原、脂肪酸和蛋白质的合成,游离脂肪酸作为机体热量的直接来源,在寒冷环境下,其浓度显著增加,机体这些生化指标浓度的改变,提示ALDOC很可能在冷应激后能量代谢方面发挥重要的作用。任涛等[25]研究表明,寒冷刺激会对鸡的生理环境产生一系列的影响,表现为基础代谢率升高、能量代谢增加、呼吸加深、耗氧增加、血流量升高、肝脏和肌肉中糖原贮存减少等,这些变化都可以加强机体的产热能力。动物在寒冷环境下机体的产热作用主要是由腺苷酸环化酶 (AC) 分解ATP而引起环磷酸腺苷 (cAMP) 浓度的升高,提高对蛋白激酶A的活化能力,促进葡萄糖分解,使得6-磷酸果糖和1,6-二磷酸果糖的浓度均提高,而醛缩酶是催化裂解1.6-二磷酸果糖的酶。在本试验中,冷应激组和冷适应组雏鸡血清中ALDOC含量均高于常温对照组,其表达明显上调。由此推测,当动物机体处于冷应激条件下,与糖代谢和能量代谢通路相关蛋白的表达量提高,促进糖等能量物质的分解,使机体代谢增强、产热增加,以应对寒冷的气候环境。雏鸡在寒冷条件下血清中ALDOC的表达量升高,表明了冷应激会引起机体能量代谢的增强,同时也从侧面说明ALDOC可能是冷应激反应的敏感标志物,但这种特异性表达的机制尚不明确,同时ALDOC是否可以应用到冷应激的诊断、监测以及治疗等方面还有待进一步的研究。
4 结论本试验采用2-DE结合MALDI-TOF-MS技术研究了雏鸡在冷应激后血清差异蛋白质组学变化,获得的差异蛋白质涉及葡萄糖、能量代谢等相关蛋白,重点发现了差异蛋白质ALDOC在冷应激中潜在的重要作用,其很可能与冷应激引起的生理机能改变相关。
| [1] | WILKINS M R, SANCHEZ J C, WILLIAMS K L, et al. Current challenges and future applications for protein maps and post-translational vector maps in proteome projects[J]. Electrophoresis, 1996, 17(5): 830–838. DOI: 10.1002/(ISSN)1522-2683 |
| [2] | BLACKSTOCK W P, WEIR M P. Proteomics:quantitative and physical mapping of cellular proteins[J]. Trends in Biotechnology, 1999, 17(3): 121–127. DOI: 10.1016/S0167-7799(98)01245-1 |
| [3] | ANDERSON N L, ANDERSON N G. Proteome and proteomics:new technologies, new concepts, and new words[J]. Electrophoresis, 1998, 19(11): 1853–1861. DOI: 10.1002/(ISSN)1522-2683 |
| [4] | RANSOHOFF D F, MARTIN C, WIGGINS W S, et al. Assessment of serum proteomics to detect large colon adenomas[J]. Cancer Epidemiology Biomarkers & Prevention, 2008, 17(8): 2188–2193. |
| [5] | ZINKIN N T, GRALL F, BHASKAR K, et al. Serum proteomics and biomarkers in hepatocellular carcinoma and chronic liver disease[J]. Clinical Cancer Research, 2008, 14(2): 470–477. DOI: 10.1158/1078-0432.CCR-07-0586 |
| [6] | HU S, ARELLANO M, BOONTHEUNG P, et al. Salivary proteomics for oral cancer biomarker discovery[J]. Clinical Cancer Research, 2008, 14(19): 6246–6252. DOI: 10.1158/1078-0432.CCR-07-5037 |
| [7] | MATSUMURA T, SUZUKI T, KADA N, et al. Differential serum proteomic analysis in a model of metabolic disease[J]. Biochemical and Biophysical Research Communications, 2006, 351(4): 965–971. DOI: 10.1016/j.bbrc.2006.10.137 |
| [8] | JACOT W, LHERMITTE L, DOSSAT N, et al. Serum proteomic profiling of lung cancer in high-risk groups and determination of clinical outcomes[J]. Journal of Thoracic Oncology, 2008, 3(8): 840–850. DOI: 10.1097/JTO.0b013e31817e464a |
| [9] | EDWARDS A V G, WHITE M Y, CORDWELL S J. The role of proteomics in clinical cardiovascular biomarker discovery[J]. Molecular & Cellular Proteomics, 2008, 7(10): 1824–1837. |
| [10] | 刘莉莉, 初芹, 徐青, 等. 动物冷应激的研究进展[J]. 安徽农业科学, 2012, 40(16) :8937–8940. DOI: 10.3969/j.issn.0517-6611.2012.16.057 |
| [11] | COWEN E W, LIU C W, STEINBERG S M, et al. Differentiation of tumour-stage mycosis fungoides, psoriasis vulgaris and normal controls in a pilot study using serum proteomic analysis[J]. British Journal of Dermatology, 2007, 157(5): 946–953. DOI: 10.1111/bjd.2007.157.issue-5 |
| [12] | TANG H Y, BEER L A, CHANG-WONG T, et al. A xenograft mouse model coupled with in-depth plasma proteome analysis facilitates identification of novel serum biomarkers for human ovarian cancer[J]. Journal of Proteome Research, 2012, 11(2): 678–691. DOI: 10.1021/pr200603h |
| [13] | UMEMURA H, TOGAWA A, SOGAWA K, et al. Identification of a high molecular weight kininogen fragment as a marker for early gastric cancer by serum proteome analysis[J]. Journal of Gastroenterology, 2011, 46(5): 577–585. DOI: 10.1007/s00535-010-0369-3 |
| [14] | MATT P, CARREL T, WHITE M, et al. Proteomics in cardiovascular surgery[J]. The Journal of Thoracic and Cardiovascular Surgery, 2007, 133(1): 210–214. DOI: 10.1016/j.jtcvs.2006.09.007 |
| [15] | LANGBEIN S, LEHMANN J, HARDER A, et al. Protein profiling of bladder cancer using the 2D-PAGE and SELDI-TOF-MS technique[J]. Technology in Cancer Research & Treatment, 2006, 5(1): 67–71. |
| [16] | BONS J A P, WODZIG W K W H, VAN DIEIJEN-VISSER M P. Protein profiling as a diagnostic tool in clinical chemistry:a review[J]. Clinical Chemistry and Laboratory Medicine, 2005, 43(12): 1281–1290. |
| [17] | STRECKFUS C F, BIGLER L R, ZWICK M. The use of surface-enhanced laser desorption/ionization time-of-flight mass spectrometry to detect putative breast cancer markers in saliva:a feasibility study[J]. Journal of Oral Pathology & Medicine, 2006, 35(5): 292–300. |
| [18] | HAO R J, ADOLIGBE C, JIANG B J, et al. An optimized trichloroacetic acid/acetone precipitation method for two-dimensional gel electrophoresis analysis of qinchuan cattle longissimus dorsi muscle containing high proportion of marbling[J]. PLoS One, 2015, 10(4): e0124723. DOI: 10.1371/journal.pone.0124723 |
| [19] | JUNKER K, VON EGGELING F, MVLLER J, et al. Identification of biomarkers and therapeutic targets for renal cell cancer using ProteinChip technology[J]. Der Urologe, 2006, 45(3): 305–306. DOI: 10.1007/s00120-006-1001-2 |
| [20] | PIRAS C, SOGGIU A, GRECO V, et al. Serum protein profiling of early and advanced stage Crohn's disease[J]. EuPA Open Proteomics, 2014, 3: 48–59. DOI: 10.1016/j.euprot.2014.02.010 |
| [21] | GONG Z H, SUN P, CHU H J, et al. Overexpression of sorcin in multidrug-resistant human breast cancer[J]. Oncology Letters, 2014, 8(6): 2393–2398. |
| [22] | SYGUSCH J, BEAUDRY D, ALLAIRE M. Molecular architecture of rabbit skeletal muscle aldolase at 2.7-A resolution[J]. Proceedings of the National Academy of Sciences of the United States of America, 1987, 84(22): 7846–7850. DOI: 10.1073/pnas.84.22.7846 |
| [23] | 王金涛, 张校军, 徐世文. 冷应激对雏鸡能量代谢的影响[J]. 中国应用生理学杂志, 2009(2) :172–176. |
| [24] | 姜冬梅, 李士泽, 康波, 等. 冷应激蛋鸡呼吸频率、心电与血清酶活性的变化及其相互关系[J]. 中国兽医学报, 2008, 28(9) :1077–1080. |
| [25] | 任涛, 辛朝安. 寒冷应激对鸡的影响 (上)[J]. 养禽与禽病防治, 1997(2) :32–33. |




