2. 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室, 畜禽养殖污染控制与资源化技术国家工程实验室, 湖南省畜禽健康养殖工程技术中心, 农业部中南动物营养与饲料科学观测实验站, 长沙 410125;
3. 湖南畜禽安全生产协同创新中心, 长沙 410128
2. Key Laboratory for Agro-Ecological Processes in Subtropical Region, National Engineering Laboratory for Pollution Control and Waste Utilization in Livestock and Poultry Production, Hunan Research Center of Livestock & Poultry Sciences, South-Central Experimental Station of Animal Nutrition and Feed Science of Ministry of Agriculture, Institute of Subtropical Agriculture, The Chinese Academy of Science, Changsha 410125, China;
3. Hunan Co-Innovation Center of Animal Production Safety, Changsha 410128, China
茶氨酸系统命名为5-N-乙基-γ-谷氨酰胺 (5-N-ethyl-γ-glutamine) 或γ-谷氨酰-L-乙胺 (γ-glutamyl-L-ethylamide)。茶氨酸不参与蛋白质的合成,以游离形式存在,占茶叶中游离氨基酸总量的40%~70%[1]。自然界存在的茶氨酸一般为L型,L-茶氨酸对脑组织损伤[2]、肝组织损伤[3-6]等起到保护作用。此外,茶氨酸具有多种生物活性功能和药理学效应[7]。研究表明,茶氨酸 (400 μg/mL) 可致肝癌细胞HepG、乳腺癌细胞MCF-7、结肠癌细胞HT29、前列腺癌细胞PC-3等癌细胞死亡50%[8-9]。茶氨酸还能有效抑制Hela细胞的增殖和诱导凋亡作用,且增殖抑制作用具有一定的浓度及时间依赖性,推测茶氨酸可能通过抑制Hela细胞谷氨酸的代谢以发挥其抗肿瘤活性[10]。针对茶氨酸在体内外对鼻咽癌细胞株CNE2增殖、凋亡、抗血管生成作用的研究结果表明,茶氨酸可以通过抑制肿瘤血管生成、抑制肿瘤生长、促进肿瘤细胞凋亡,进而抑制鼻咽癌细胞CNE2增殖并诱导其凋亡,且具有时间剂量效应[11]。此外,雷明盛[12]研究发现茶氨酸拮抗蛙皮素抑制树突状细胞 (DC) 表面分子的表达、白细胞介素-12(IL-12) 的分泌;结合对凋亡率及形态学的研究表明,茶氨酸能够促进受抑DC的成熟和功能,从而推测茶氨酸能够拮抗肿瘤环境对DC的抑制。
氧化应激是断奶幼畜危害问题之一,断奶家畜的精神萎靡、腹泻、采食量下降等均是与氧化应激损伤有关的疾病,而通过维持或提高机体正常生理功能来解决氧化应激对断奶家畜机体的损伤,是为断奶家畜健康成长提供保障的主要途径之一。因此,本试验以过氧化氢 (hydrogen peroxide,H2O2) 为氧化应激因子,建立山羊瘤胃上皮传代细胞凋亡模型,并研究L-茶氨酸对H2O2诱导山羊瘤胃上皮传代细胞凋亡及其凋亡通路关键基因[半胱氨酸天冬氨酸-3(cysteinyl aspartate-specific proteinase-3,Caspase-3)、半胱氨酸天冬氨酸-8(cysteinyl aspartate-specific proteinase-8,Caspase-8)、半胱氨酸天冬氨酸-9(cysteinyl aspartate-specific proteinase-9,Caspase-9)、凋亡酶激活因子-1(apoptotic protease activating facter-1,Apaf-1)、Fas相关死亡域蛋白 (Fas-associate with death domain protein,FADD)]表达量的影响,以期为山羊瘤胃上皮细胞营养代谢和氧化应激机制之间相互关系的研究提供一定的参考,进而为促进畜牧业可持续发展提供理论基础。
1 材料与方法 1.1 主要试剂细胞培养试剂:胎牛血清 (fetal calf serum,FBS)、DMEM/F12(dulbecco’s modified eagle medium: nutrient mixture F-12) 培养基、胰蛋白酶 (trypsin)-乙二胺四乙酸 (ethylene diamine tetraacetic acid,EDTA) 溶液 (0.25%胰蛋白酶+0.02%EDTA)、青链霉素、表皮细胞生长因子 (EGF)、胰岛素均购自美国Gibco公司;两性霉素B和庆大霉素溶液 (gentamicin/amphotericin solution)(R-015-10,10×1 mL) 购自美国Thermo Fisher Scientific公司;L-茶氨酸购自德国Orgentec公司。
实时荧光定量PCR (RT-qPCR) 试剂:琼脂糖购自上海麦克林生化科技有限公司;逆转录试剂盒购自北京康为世纪生物科技有限公司;焦磷酸二乙酯 (DEPC)、溴化乙锭 (EB) 溶液购自北京赛百胜基因技术有限公司;TRlzolReagent购自美国Invitogen公司;Taq酶、DL2000 DNA Marker、dNTP购自美国MBI Fermntas公司;引物购自南京金斯瑞生物科技有限公司;Sybgreen PCR Mix购自美国ABI公司;常规化学试剂购自北京化学试剂公司。
1.2 试验方法 1.2.1 山羊瘤胃上皮传代细胞的分组及处理试验动物为3只42日龄健康的湘东黑山羊,体重为 (6.4±0.8) kg。将试验羊麻醉后,颈静脉放血致死,取出瘤胃组织,去掉内容物后用生理盐水反复冲洗干净,待用于样品采集[13]。以DMEM/F12培养基培养山羊瘤胃上皮细胞,当山羊瘤胃上皮原代细胞长满培养皿的80%~90%时,弃去上清液,用磷酸缓冲盐溶液 (phosphate buffer saline,PBS) 洗涤细胞1~2次后,加入1 mL的含0.25%胰蛋白酶+0.02%EDTA的消化液,放入含5% CO2的37 ℃培养箱中消化2~3 min,放在倒置显微镜下观察细胞,开始变亮、变圆时迅速用含5% FBS的DMEM/F12培养基终止消化。将贴壁的细胞吹打为悬液,转移到15 mL离心管中,在4 ℃离心机中94×g离心5 min,弃去上清液,加入1 mL的完全DMEMF/12培养基 (含5% FBS、10 μg/mL胰岛素、10 ng/mL EGF、100 U/mL青霉素、100 mg/mL链霉素、2.5 μg/mL庆大霉素、2.5 μg/mL两性霉素B) 重悬细胞,以1 : 2的比例进行传代。在含5% CO2的37 ℃培养箱中培养30 min后,转移含细胞的完全DMEMF/12培养基至培养皿中继续培养,重复1次,进一步纯化[14]。纯化后的山羊瘤胃上皮传代细胞继续培养于含5% FBS的DMEM/F12培养基中,待细胞密度达到60%~70%时,随机分为5组,分别为培养基中无额外添加物的对照组、添加800 μmol/L H2O2的Ⅰ组、添加800 μmol/L H2O2+4 mmol/L L-茶氨酸的Ⅱ组、添加800 μmol/L H2O2+8 mmol/L L-茶氨酸的Ⅲ组和添加800 μmol/L H2O2+16 mmol/L L-茶氨酸的Ⅳ组[4-5],每组3个重复,作用12 h后进行指标测定。
1.2.2 流式细胞仪检测山羊瘤胃上皮传代细胞凋亡比率应用BD FACSCalibur流式细胞仪,采用流式细胞术 (flow cytometry,FCM) 中膜联蛋白-V (annexin V)/碘化丙啶 (propidium iodide,PI) 联合染色法检测细胞凋亡比率[15]。
1.2.3 PCR检测山羊瘤胃上皮传代细胞凋亡基因的表达量样品总RNA的抽提:采用TRIzol一步法抽提组织样品中总RNA[16-17];总RNA样品的DNaseⅠ处理参考文献[18-19];反转录反应参考文献[20-22],按M-MLV试剂说明书进行。
1.2.4 引物设计与合成 1.2.4.1 引物合成根据新基因的测序结果,利用分子生物学软件Primer premier 5、Primer 3.0、Oligo 6.71软件设计引物,并用Blast工具进行引物特异性分析。运用PCR检测其组织特异性,所用引物如表 1所示,引物由上海生工基因技术有限公司合成。
|
|
表 1 引物设计 Table 1 Primer design |
RT-PCR反应体系:在一灭菌的0.2 mL RT-qPCR管中建立如表 2所示的RT-qPCR反应体系。
|
|
表 2 RT-qPCR反应体系 Table 2 The reaction system of RT-qPCR |
RT-qPCR反应程序:94 ℃预变性5 min;94 ℃变性30 s、55℃退火45 s、72 ℃延伸2 min,循环35圈;72 ℃再延伸10 min。
RT-qPCR结束后,取18 μL PCR产物与2 μL溴酚兰混合点样,并以DL2000 DNA Marker作为参照,在1×TAE电泳缓冲液中进行2%琼脂糖凝胶 (含0.5 μg/mL EB) 电泳 (5 V/cm),电泳结束后,用凝胶成像系统拍照。
1.3 数据统计与分析细胞凋亡应用BD FACSCalibur流式细胞仪采集数据,并用专业软件Flowjo进行图像分析。试验数据采用SAS 8.2的一般线性模型 (GLM) 对细胞凋亡数据进行统计[23-24],应用contrast语句分别进行造模组 (Ⅰ组) 与对照组、各H2O2添加组 (Ⅰ、Ⅱ、Ⅲ、Ⅳ组) 之间的显著性比较。通过运用LSMEANS方法来计算平均值。运用正交多项式对比来检查其P值的相关效应 (线性或者二次)。在正交多项式分析之前,使用SAS 8.2的IML程序来校正系数[25]。P<0.05定义为差异显著,0.05≤P<0.10为具有差异显著趋势。
2 结果与分析 2.1 L-茶氨酸对H2O2诱导山羊瘤胃上皮传代细胞凋亡比率的影响由图 1和表 3可以看出,与Ⅰ组相比较,Ⅱ、Ⅲ、Ⅳ组细胞晚期凋亡比率显著降低 (P<0.05),且随着L-茶氨酸添加浓度的升高,细胞晚期凋亡比率逐渐减小,且各组间差异显著 (P<0.05)。上述结果说明,L-茶氨酸可缓解H2O2对山羊瘤胃上皮细胞造成的氧化应激损伤。
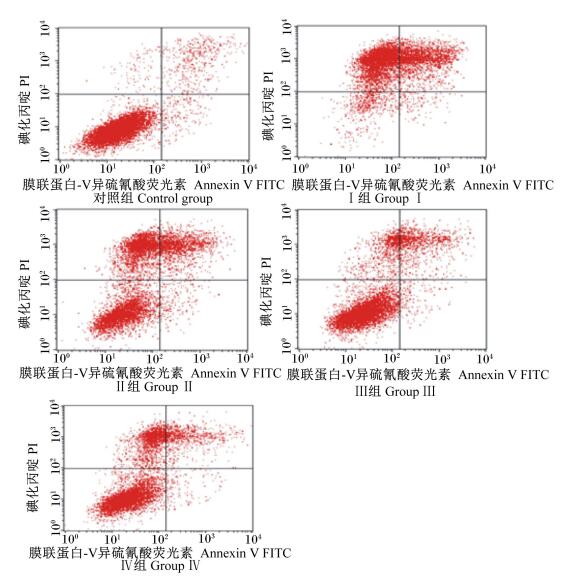
|
图 1 L-茶氨酸影响H2O2诱导山羊瘤胃上皮传代细胞凋亡的流式细胞术检测结果 Figure 1 FCM results of L-theanine affected subculture ruminal epithelium cells apoptosis induced by H2O2 of goats |
|
|
表 3 L-茶氨酸对H2O2诱导山羊瘤胃上皮传代细胞凋亡比率的影响 Table 3 Effects of L-theanine on apoptosis ratio of subculture ruminal epithelial cells induced by H2O2 of goats (n=3) |
部分总RNA电泳图如图 2所示,提取的总RNA的28S和18S条带清晰,可用于后续PCR操作。
|
M:DL2000 DNA Marker;1~5:总RNA样品。 M: DL2000 DNA Marker; 1 to 5: samples of total RNA. 图 2 部分总RNA电泳图 Figure 2 The electrophoretogram of partial total RNA |
由表 4可以看出,与Ⅰ组相比较,Ⅱ、Ⅲ、Ⅳ组的Caspase-3、Caspase-9、Apaf-1基因表达量皆显著降低 (P<0.05),Ⅱ、Ⅲ组的Caspase-8基因表达量显著降低 (P<0.05)。
|
|
表 4 L-茶氨酸对H2O2诱导山羊瘤胃上皮传代细胞凋亡通路关键基因表达量的影响 Table 4 Effects of L-theanine on expression quantities of key genes in apoptosis pathway of subculture ruminal epithelial cells induced by H2O2 of goats |
高浓度氧直接损伤瘤胃上皮细胞,促使细胞凋亡或使胃部疾病恶化。大量氧化自由基是引起细胞损伤的重要原因之一,缺血再灌注、药物代谢、金属中毒等会诱导细胞产生大量氧自由基[26],而H2O2作为氧化自由基的主要成分,得到广泛的应用[27-29]。
减少H2O2诱导细胞的凋亡比率,对减轻过氧化应激对机体的损伤,改善机体功能与状态具有非常重要的意义。本试验对于山羊瘤胃上皮传代细胞的凋亡检测结果表明,L-茶氨酸可缓解H2O2引起的山羊瘤胃上皮传代细胞的氧化应激损伤。其机制可能是:L-茶氨酸作为谷氨酰胺的衍生物,在细胞内可代谢为谷氨酸,参与到谷胱甘肽 (glutathione,GSH) 的合成过程。此外,L-茶氨酸可以通过维持细胞内抗氧化酶的活性,一方面减少GSH的损耗,另一方面增加GSH的生成,达到稳定细胞内GSH含量的效果,维持了细胞内的氧化还原平衡状态,从而保护机体避免氧化应激反应的损伤[30]。
3.2 L-茶氨酸对H2O2诱导山羊瘤胃上皮传代细胞凋亡通路关键基因表达量的影响本试验主要从细胞凋亡角度出发,在细胞传代培养试验的基础上,利用PCR针对L-茶氨酸对H2O2诱导山羊瘤胃上皮细胞凋亡基因FADD、Caspase-8、Apaf-1、Caspase-9、Caspase-3的表达情况进行检测,结果显示:与Ⅰ组相比较,Ⅱ、Ⅲ、Ⅳ组Caspase-3、Caspase-9、Apaf-1基因的表达量皆显著降低;Ⅱ、Ⅲ组Caspase-8基因的表达量显著降低。上述结果说明:1)L-茶氨酸对山羊瘤胃上皮传代细胞的凋亡起到一定的抑制作用;2)L-茶氨酸可以通过降低线粒体通路相关的基因表达量,促使山羊瘤胃上皮传代细胞的凋亡比率降低,且呈剂量依赖性;3)L-茶氨酸在一定浓度范围内通过外源性通路,降低山羊瘤胃上皮传代细胞的凋亡比率,但不是通过直接刺激外源性基因 (FADD) 实现的。这是由于L-茶氨酸可通过线粒体途径和外源性途径缓解H2O2诱导的山羊瘤胃上皮传代细胞的凋亡。a) 线粒体途径:细胞色素C (CytC) 与Apaf-1结合形成单体减少,单体 (7个) 聚合形成凋亡体的数量减少,凋亡体通过酶募集区 (CARD) 募集Caspase-9前体 (pro-Caspase-9) 数量减少,促使pro-Caspase-9活化能力减弱,成熟为有活性的Caspase-9的数量降低,进一步激活具有代表性效应的Caspase-3的能力降低,Caspase-3再裂解多聚 (ADP-核糖) 聚合酶[poly (ADP-ri-bose) polymerase,PARP]的能力减弱,DNA继续修复能力恢复;活化的核酸内切酶可特异性切割核小体间的连接序列的能力减弱,DNA断裂成n×(180~200) bp的片段数量减少,细胞骨架蛋白、核蛋白和细胞外基质蛋白等完整性增强,促使细胞形态正常,诱导细胞凋亡率降低[31]。b) 外源性凋亡途径[由细胞膜上的死亡受体介导,当其与死亡配体结合后,受体通过胞浆区的DD (DD是一段高度保守的氨基酸序列,若一个重要残基突变,相应受体便失去活性功能) 募集相应的衔接蛋白 (adaptor protein) 形成死亡诱导信号复合物 (DISC)]:Fas与肿瘤坏死因子相关的凋亡诱导配体 (TRAIL) 直接募集Fas相关死亡结构域[该结构域由1个N端的死亡效应域 (DED) 和C端的死亡域 (DD) 构成[32])]和pro-Caspase-8结合形成DISC的能力降低,之后pro-Caspase-8被同源活化成Caspase-8的数量减少;Ⅰ型细胞的活化的Caspase-8通过异源活化激活Caspase-3的能力降低,诱导细胞凋亡率降低;Ⅱ型细胞中,原来活化的Caspase-8较少,不能激活足够的Caspase-8诱导细胞凋亡。此外,Caspase-8通过裂解促凋亡基因BID形成截短的BID[truncated BID,tBID (tBID被认为是内外凋亡途径的结合点)]的数量也减少,激活线粒体细胞凋亡途径的能力降低,不能将死亡信号放大。少量的tBID移位到线粒体外膜,通过构象改变诱导促凋亡基因Bak形成寡聚体的数量随之降低[33],激活线粒体细胞凋亡途径的能力减弱[34]。
4 结论不同浓度的L-茶氨酸均可使细胞晚期凋亡比率显著降低,且随着L-茶氨酸添加浓度的增加,晚期细胞凋亡比率随之降低,表明L-茶氨酸可有效缓解H2O2引起的山羊瘤胃上皮传代细胞的氧化损伤。
| [1] | MUKAI T, HORIE H, GOTO T. Differences in free amino acids and total nitrogen contents among various prices of green tea[J]. Tea Research Journal, 1992, 1992(76): 45–50. |
| [2] | 彭彬, 刘仲华, 林勇, 等. L-茶氨酸改善慢性应激大鼠抑郁行为作用研究[J]. 茶叶科学, 2014, 34(4) :355–363. |
| [3] | 顾祖维. 现代毒理学概论[M]. 北京: 化学工业出版社, 2005: 157. |
| [4] | 李桂兰, 抗晶晶, 殷志敏. L-茶氨酸对H2O2致L02细胞损伤的保护作用及其机制研究[J]. 中国细胞生物学学报, 2014, 36(6) :785–790. DOI: 10.11844/cjcb.2014.06.0374 |
| [5] | 姜薇. L-茶氨酸抑制四氯化碳诱导的小鼠急性肝损伤的研究[D]. 硕士学位论文. 南京: 南京大学, 2012. |
| [6] | BUKOWSKI J F, PERCIVAL S S. L-theanine intervention enhances human γδ T lymphocyte function[J]. Nutrition Reviews, 2008, 66(2): 96–102. DOI: 10.1111/j.1753-4887.2007.00013.x |
| [7] | KHAN W, MUKHTAR H. Tea polyphenols for health promotion[J]. Life Sciences, 2007, 81(7): 519–533. DOI: 10.1016/j.lfs.2007.06.011 |
| [8] | FRIEDMAN M, MACKRY B E, KIM H J, et al. Structure-activity relationships of tea compounds against human cancer cells[J]. Journal of Agricultural & Food Chemistry, 2007, 55(2): 243–253. |
| [9] | BALEEIRO R B, ANSELMO L B, SOARES F A, et al. High frequency of immature dendritic cells and altered in situ production of interleukin-4 and tumor necrosis factor-α in lung cancer[J]. Cancer Immunology, Immunotherapy, 2008, 57(9): 1335–1345. DOI: 10.1007/s00262-008-0468-7 |
| [10] | 孙凌燕, 尹翠, 张玲, 等. 茶氨酸对人宫颈癌Hela细胞增殖作用的影响[J]. 时珍国医国药, 2012, 23(3) :643–645. |
| [11] | 李艳东, 郑建云, 刘冰, 等. 茶氨酸对鼻咽癌细胞CNE2增殖及凋亡影响的研究[J]. 山西医科大学学报, 2011, 42(8) :633–635. |
| [12] | 雷明盛. 茶氨酸刺激树突状细胞调节T淋巴细胞抑制肺腺癌细胞生长的研究[D]. 博士学位论文. 长沙: 中南大学, 2009. |
| [13] | 韩奇鹏, 罗玲, 揭红东, 等. 浏阳黑山羊瘤胃上皮细胞周期分布、增殖和凋亡特点[J]. 动物营养学报, 2016, 28(7) :2269–2277. |
| [14] | 刘思乐, 康劲翮, 谭支良, 等. 不同培养方法对山羊瘤胃上皮细胞生长及角蛋白18表达量的影响[J]. 动物营养学报, 2016, 28(4) :1225–1232. |
| [15] | 韩奇鹏, 掲红东, 罗玲, 等. 谷氨酰胺及其二肽对过氧化氢诱导山羊瘤胃上皮细胞凋亡及凋亡相关基因表达的影响[J]. 动物营养学报, 2016, 28(10) :3301–3310. DOI: 10.3969/j.issn.1006-267x.2016.10.034 |
| [16] | 樊善继. 丹参酮ⅡA对SW480细胞增殖与凋亡的影响[D]. 硕士学位论文. 衡阳: 南华大学, 2014. |
| [17] | 唐丽丽. 调节性T细胞在小鼠肥胖早期阶段的数量变化及其对内脏脂肪巨噬细胞亚型的调节作用[D]. 硕士学位论文. 长沙: 中南大学, 2014. |
| [18] | 雷震. 药物热原检测平台-TLR4、MD2及CD14基因稳定表达细胞系的构建[D]. 硕士学位论文. 银川: 宁夏医科大学, 2014. |
| [19] | 谢涛. 隔药饼灸对动脉粥样硬化兔易损斑块TLR2/4-IRF3信号通路调控胆固醇逆转运的影响[D]. 硕士学位论文. 长沙: 湖南中医药大学, 2015. |
| [20] | 王尧尧, 李冉, 李运生, 等. Nesfatin-1对初情期雌性大鼠促性腺激素及其mRNA表达的影响[J]. 中国农业大学学报, 2015, 20(3) :139–145. |
| [21] | 贾宇. HL-60白血病细胞内Nucleostemin下调对PI3K/AKT/mTOR通路相关基因的影响[D]. 硕士学位论文. 郑州: 郑州大学, 2014. |
| [22] | 黄国任. 1, 3-二氯-2-丙醇对小鼠脂质代谢的影响及机制研究[D]. 硕士学位论文. 长春: 吉林大学, 2014. |
| [23] | 牟国学. 一般线性模型中线性估计的可容许性特征及优良性[D]. 硕士学位论文. 北京: 北京交通大学, 2008. |
| [24] | 高树新, 许尚忠, 李金泉, 等. 利用一般线性模型分析奶牛乳房炎的影响因素[J]. 华北农学报, 2006, 21(4) :114–117. |
| [25] | 王钦秀. 一般线性回归模型——参数估计、假设检验、回归预测[J]. 数量经济技术经济研究, 1988(2) :39–44. |
| [26] | 叶煦亭, 沙继宏, 汤莹, 等. 生物细胞氧化应激模型探讨[J]. 电子显微学报, 2000, 19(3) :207–208. |
| [27] | 蔡善荣, 郑树, 张苏展, 等. 过氧化氢诱导肠上皮干细胞DNA氧化损伤模型的建立[J]. 浙江大学学报:医学版, 2006, 35(4) :366–369. |
| [28] | 廖德荣, 刘启功, 程燕子, 等. 血管内皮生长因子对过氧化氢诱导的内皮细胞凋亡的影响及其机制[J]. 中国动脉硬化杂志, 2006, 14(6) :483–485. |
| [29] | 郑延松, 李源, 张珊红, 等. 用低浓度过氧化氢建立心肌细胞氧化损伤模型[J]. 第四军医大学学报, 2001, 22(20) :1849–1851. DOI: 10.3321/j.issn:1000-2790.2001.20.008 |
| [30] | 叶寅. L-茶氨酸通过增强肝脏细胞中抗氧化物质活性抑制酒精性肝损伤的研究[D]. 硕士学位论文. 南京: 南京大学, 2011. |
| [31] | LONG S, WILSON M, BENGTÉN E, et al. Identification and characterization of a FasL-like protein and cDNAs encoding the channel catfish death-inducing signaling complex[J]. Immunogenetics, 2004, 56(7): 518–530. DOI: 10.1007/s00251-004-0701-2 |
| [32] | 陈益华, 张华杰, 南发俊. Caspase抑制剂的研究进展[J]. 生命科学, 2006, 18(3) :247–254. |
| [33] | 袁海波, 沈忠明. 细胞凋亡的分子机理[J]. 上海大学学报:自然科学版, 2001, 7(1) :77–80. |
| [34] | TAIT S W G, GREEN D R. Mitochondrial regulation of cell death[J]. Cold Spring Harbor Perspectives Biology, 2013, 5(9): a008706. DOI: 10.1101/cshperspect.a008706 |




