2. 四川农业大学动物营养研究所, 雅安 625014
2. Institute of Animal Nutrition, Sichuan Agricultural University, Ya'an 625014, China
一磷酸腺苷激活蛋白激酶 (AMPK) 是一种能被一磷酸腺苷 (AMP) 激活的蛋白激酶,参与体内营养代谢调节,在糖代谢中起着非常重要的作用[1]。在小鼠上的研究表明,激活AMPK可通过磷酸化作用抑制糖原合成酶活性,降低糖原的合成速率,并可导致葡萄糖转运子4(GLUT-4) 从细胞内移位到细胞浆膜上,促进肌肉对葡萄糖的吸收,从而提高骨骼肌中糖原含量[2],进而可能影响肉质。AMPK由催化亚基α、调节亚基β和γ构成,α和β亚基分别有2种同工型,γ亚基有γ1、γ2、和γ3 3种同工型。PRKAG3(protein kinase adenosine monophosphate-activated γ3-subunit) 基因是编码AMPK γ3亚基的基因,只特异性在骨骼肌中表达[3]。Milan等[4]报道,汉普夏猪PRKAG3基因的第200个密码子发生突变 (Arg200→Gln200),可降低AMPK活性,使骨骼肌中糖原含量升高70%,导致猪肉终pH降低,是引起汉普夏猪酸肉效应的根本原因。Ciobanu等[5]证实,PRKAG3基因中紧邻Arg200的Val199→Ile199突变具有与RN基因 (Rendement Napole gene,又叫酸肉基因) 相反的效应,它使骨骼肌中糖原含量降低,因而有利于改善肉质。由此可以推测,PRKAG3基因可能是一个影响肉质性状的主效基因。但目前关于PRKAG3基因表达量与肉质关系的研究还未见报道。本试验拟研究汉普夏猪和长撒[长白 (L)×撒坝 (S)]猪在不同生长阶段骨骼肌中PRKAG3基因的表达差异及其表达量与肉质的关系,这对从分子水平研究肉质具有非常重要的意义。
1 材料与方法 1.1 试验设计采用单因子试验设计,挑选15 kg左右的汉普夏阉公猪17头和长撒阉公猪16头,共计33头猪。2个品种猪在相同环境条件下采用相同的饲粮配方饲喂,在体重分别达到20和50 kg时,每个品种猪尽量挑选体重相近的猪各5头屠宰,测定各发育阶段骨骼肌pH、肌糖原含量和PRKAG3基因的表达量;在体重100 kg时,将剩下的7头汉普夏猪和6头长撒猪全部屠宰,除了测定骨骼肌pH、肌糖原含量和PRKAG3基因的表达量外,还测定肉质性状。
1.2 试验饲粮试验饲粮按NRC (2012) 标准,分20~50 kg、51~80 kg和81~100 kg 3个阶段进行配制。2个品种猪的饲粮配方相同,具体见表 1。
|
|
表 1 试验饲粮组成及营养水平 (饲喂基础) Table 1 Composition and nutrient levels of experimental diets (as-fed basis) |
试验猪以圈为单位进行圈养,每头猪占1个圈,进行单圈饲养,试验猪从15 kg开始,到100 kg结束。每天饲喂颗粒料3次 (08:00、13:00和18:00),每次以吃足略有剩余为度,自由饮水,2个品种猪饲养管理条件一致。
1.4 样品采集在体重达20或50 kg屠宰时,在背最长肌第10根肋骨处取2块10 g左右的样品,分别测pH和肌糖原含量。在体重达100 kg屠宰时,在背最长肌第10根肋骨处取3块50 g左右的样品,一块用于测定滴水损失;另一块用于测定pH、肌糖原含量、色度和失水率;最后一块用于测定熟肉率。另取一块100 g左右的腰大肌,用于剪切力的测定,具体测定方法参见文献[6]。
每批猪屠宰后快速分离出第10根肋骨处背最长肌样品,剪碎后用含0.1%焦碳酸二乙酯 (DEPC) 处理过的磷酸盐缓冲液 (PBS) 冲洗2次,装入消过毒的一次性1.5 mL EP管中,迅速在液氮中冷冻,然后在-70 ℃保存,用于PRKAG3基因表达量的测定。
1.5 指标测定 1.5.1 pH的测定pH用专用肉质酸度计测定pH,具体测定方法参见文献[6]。pH1指屠宰后45 min的pH,pH2指屠宰后24 h的pH。
1.5.2 肌糖原含量的测定采用南京建成生物工程研究所生产的肌糖原测定试剂盒按说明书测定肌糖原含量,因猪屠宰后肌糖原易酵解,因此肌糖原含量在屠宰后第2天进行测定。
1.5.3 肉质性状的测定滴水损失、色度、失水率、剪切力、熟肉率的具体测定方法参见文献[6]。
1.5.4 PRKAG3基因表达量的测定 1.5.4.1 总RNA提取及反转录 (RT) 反应取背最长肌样品30 mg,加入液氮并研磨成粉,收集入1.5 mL EP管中,提取总RNA,提取过程按QIAGEN公司试剂盒 (Rneasy Mini Kit) 操作说明进行。提取的总RNA通过凝胶电泳检测其完整性,并测定总RNA在260和280 nm处的OD值,以检测RNA样品的纯度。将提取的总RNA作为模板进行RT反应。反应体系:RNA酶抑制剂0.25 μL、MgCl2 2 μL、Oligo dT引物1 μL、dNTP Mixture 1 μL、总RNA 4.25 μL、10×RT缓冲液1 μL、反转录酶0.5 μL,总体积为10 μL。反应程序:30 ℃ 10 min、42 ℃ 2 h、99 ℃ 5 min、5 ℃ 5 min。
1.5.4.2 引物和TaqMan探针的设计与合成PRKAG3基因与内参基因β-肌动蛋白 (β-actin) 引物和探针分别根据基因序列AF214520和U07786设计,由上海基康生物公司合成。PRKAG3和β-actin基因的引物及探针序列见表 2。
|
|
表 2 PKKAG3和β-actin基因的引物及探针序列 Table 2 Primer and probe sequences of PKKAG3 and β-actin genes |
以cDNA为模板进行实时荧光定量PCR,反应体系总体积为25 μL。反应体系:cDNA 2 μL、Premix Ex Taq (2×) 12.5 μL、上游引物0.5 μL、下游引物0.5 μL、探针 (10 μmol/L) 1 μL、ROX DyeⅡ(50×) 0.5 μL、0.1%DEPC处理水8 μL。反应程序:95 ℃ 3 min;然后94 ℃ 25 s,60 ℃ 30 s,共40个循环;最后70 ℃延伸5 min。
1.5.4.4 定量分析定量扩增目的基因和内参基因前先绘制标准曲线,根据标准曲线,定量PCR仪自动计算出每毫升样本中PRKAG3和β-actin基因的拷贝数,则PRKAG3基因的表达量为每毫升样本中PRKAG3基因的拷贝数与每毫升样本中β-actin基因的拷贝数的比值。
1.6 统计分析采用SPSS 17.0统计软件对不同品种猪不同发育阶段的数据进行方差分析和Duncan氏法多重比较,对相同阶段的不同品种猪的数据进行t检验,并将PRKAG3基因的表达量与肉质性状进行相关性分析。试验结果用平均值±标准误 (mean±SE) 表示。
2 结果与分析 2.1 不同品种猪不同生长阶段骨骼肌中PRKAG3基因的表达量汉普夏猪和长撒猪在不同发育阶段骨骼肌中PRKAG3基因的表达量如表 3所示。长撒猪在不同发育阶段骨骼肌中PRKAG3基因的表达量均高于汉普夏猪,特别是在100 kg阶段,骨骼肌中PRKAG3基因的表达量显著高于汉普夏猪 (P < 0.05),是汉普夏猪的6.81倍。长撒猪与汉普夏猪骨骼肌中PRKAG3基因的表达量均随体重的增加而增加,但汉普夏猪不同发育阶段骨骼肌中PRKAG3基因的表达量差异不显著 (P>0.05),而长撒猪100 kg阶段时骨骼肌中PRKAG3基因的表达量显著高于20和50 kg阶段时 (P < 0.05)。
|
|
表 3 汉普夏猪和长撒猪在不同发育阶段骨骼肌中PKKAG3基因的表达量 Table 3 PKKAG3 gene expression level in skeletal muscle of Hampshire pigs and LS pigs in different growth phases |
汉普夏猪和长撒猪在不同生长阶段骨骼肌中肌糖原含量和pH如表 4所示。在20 kg阶段,汉普夏猪和长撒猪骨骼肌中肌糖原含量和pH1均无显著差异 (P>0.05),但汉普夏猪骨骼肌中pH2显著低于长撒猪 (P < 0.05);在50 kg阶段,汉普夏猪骨骼肌中肌糖原含量和pH1均显著高于长撒猪 (P < 0.05),pH2则极显著低于长撒猪 (P < 0.01);在100 kg阶段,汉普夏猪骨骼肌中肌糖原含量和pH2显著低于长撒猪 (P < 0.05),而pH1则差异不显著 (P>0.05)。
|
|
表 4 汉普夏猪和长撒猪在不同发育阶段骨骼肌中肌糖原含量和pH Table 4 Muscle glycogen content and pH in skeletal muscle of Hampshire pigs and LS pigs in different growth phases |
表 5为汉普夏猪和长撒猪肉质性状的测定结果。数据显示汉普夏猪骨骼肌的剪切力显著低于长撒猪 (P < 0.05),滴水损失和失水率显著高于长撒猪 (P < 0.05),熟肉率和黄度 (b) 值极显著低于长撒猪 (P < 0.01),而亮度 (L) 值和红度 (a) 值在2个品种猪间差异不显著 (P>0.05)。
|
|
表 5 汉普夏猪和长撒猪肉质性状差异比较 Table 5 Difference comparison between Hampshire and LS pigs for meat quality traits |
表 6是不同品种猪骨骼肌中PRKAG3基因表达量与肉质性状的相关性分析,从表中数据可以看出,汉普夏猪骨骼肌中PRKAG3基因的表达量与pH2呈显著负相关 (P < 0.05),与熟肉率、a值呈负相关,与滴水损失和b值呈正相关,但相关性均不显著 (P>0.05),虽与pH1、L值、失水率和剪切力也存在一定的相关性,但相关系数均较小;长撒猪骨骼肌中PRKAG3基因的表达量与pH2和a值呈负相关,与滴水损失、失水率和L值呈正相关,但相关性均不显著 (P>0.05),虽与pH1、剪切力、熟肉率和b值也存在一定的相关性,但相关系数均较小。当不考虑品种效应时,骨骼肌中PRKAG3基因的表达量与pH2呈显著负相关 (P < 0.05),与滴水损失和失水率呈负相关,与熟肉率、pH1、L值、a值和b值呈正相关,但相关性均不显著 (P>0.05)。
|
|
表 6 骨骼肌中PKKAG3基因的表达量与肉质性状间的相关系数 Table 6 Correlation coefficients among PKKAG3 gene expression level in skeletal muscle and meat quality traits |
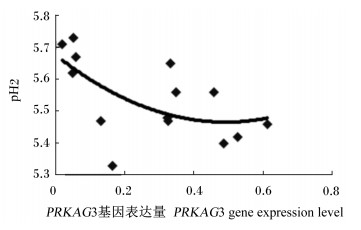
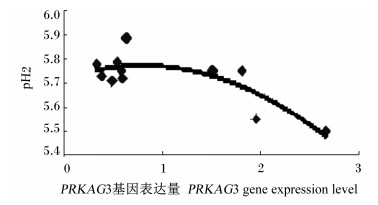
为了更一步阐明骨骼肌中PRKAG3基因表达量与pH2之间的关系,将2个品种猪骨骼肌中PRKAG3基因的表达量与pH2分别作图,如图 1和图 2所示。从图中可以看出,尽管汉普夏猪和长撒猪pH2随骨骼肌中PRKAG3基因表达量的变化趋势稍有差异,但2个品种猪骨骼肌中PRKAG3基因的表达量均与pH2呈负相关。
|
图 1 汉普夏猪骨骼肌中PKKAG3基因的表达量与pH2的关系 Figure 1 Relationship between pH2 and PKKAG3 gene expression level in skeletal muscle of Hampshire pigs |
|
图 2 长撒猪骨骼肌中PKKAG3基因的表达量与pH2与的关系 Figure 2 Relationship between pH2 and PKKAG3 gene expression level in skeletal muscle of LS pigs |
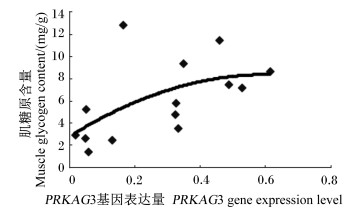
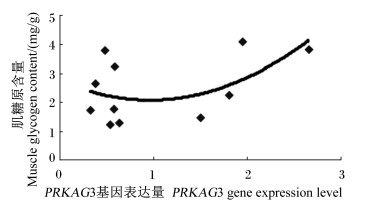
将汉普夏猪和长撒猪各生长阶段骨骼肌中PRKAG3基因的表达量与肌糖原含量分别作图,如图 3和图 4所示。从图中可以看出,尽管汉普夏猪和长撒猪肌糖原含量的变化规律不尽一致,但总体上都是随着骨骼肌中PRKAG3基因表达量的增加而非线性增加。
|
图 3 汉普夏猪骨骼肌中PKKAG3基因的表达量与肌糖原含量的关系 Figure 3 Relationship between muscle glycogen content and PKKAG3 gene expression level in skeletal muscle of Hampshire pigs |
|
图 4 长撒猪骨骼肌中PKKAG3基因的表达量与肌糖原含量的关系 Figure 4 Relationship between muscle glycogen content and PKKAG3 gene expression level in skeletal muscle of LS pigs |
目前关于PRKAG3基因在猪不同生长阶段骨骼肌中表达差异的研究还未见报道。Milan等[4]的研究表明,PRKAG3基因中的Arg200→Gln200突变可使汉普夏猪AMPK的活性降低3倍;Galve等[7]在杜长大猪上的研究表明,PRKAG3基因中Val199→Ile199突变可以使腿肌和腰肌中pH2分别提高0.14和0.16,但上述研究均没有测定PRKAG3基因的表达量。本研究结果表明,在不同生长阶段长撒猪骨骼肌中PRKAG3基因的表达量均高于汉普夏猪,特别是在100 kg阶段,长撒猪骨骼肌中PRKAG3基因的表达量是汉普夏猪的6.81倍。Barnes等[8]通过转基因小鼠模型证实Val199→Ile199可使PRKAG3基因的表达量大幅降低。而且骨骼肌中高糖原含量可反馈抑制AMPK活性[9]。本试验结果也证实,50和100 kg阶段汉普夏猪肌糖原含量均显著高于长撒猪,这可能是汉普夏猪骨骼肌中PRKAG3基因表达量低于长撒猪的原因。
Mahiapuu等[10]研究表明,γ3是糖酵解纤维 (ⅡB型纤维) 中的主要的AMPKγ异构体形式,在白色糖酵解纤维的糖代谢中起着非常重要的作用。Scheffler等[11]研究表明,和正常猪相比,不管是否激活AMPK,PRKAG3基因中R225Q变异均可导致猪骨骼肌中较高的糖原含量。体外试验也表明,AMPKγ3异构体对5-氨基-4-咪唑羧基酰胺核苷 (AICAR) 诱导的葡萄糖转运是必需的,其他γ异构体不能补偿该功能[8]。以上结果表明,PRKAG3基因可调节骨骼肌特别是糖酵解纤维中的糖代谢,因而影响骨骼肌中糖原含量,由此可以推断,PRKAG3基因表达量可影响肌糖原含量,进而影响肉质。汉普夏猪和长撒猪在20和50 kg阶段肌糖原含量差异不显著,而在100 kg阶段差异显著,这为这2个品种猪骨骼肌中PRKAG3基因表达量在20和50 kg阶段差异不显著,而在100 kg阶段差异显著提供了依据。至于这2个品种猪骨骼肌中PRKAG3基因的表达量都是随着体重的增加而增加的原因,目前还不清楚,还有待于进一步的研究。
3.2 PRKAG3基因表达量与肉质的关系已有的研究表明,PRKAG3基因是引起猪肉质性状改变的关键基因,可使猪肉pH、色度及滴水损失等肉质性状发生改变[4, 12]。Uimari等[13]在约克夏和长白猪上的研究表明,PRKAG3基因外显子中24E和199I处的变异可提高猪肉品质。Milan等[4]发现,PRKAG3基因中R200Q突变可使RN-/RN-(显性纯合子) 和RN-/rn+(杂合子) 动物的肌糖原含量提高70%,高糖原含量导致猪肌肉pH2降低,使蛋白质对水的结合力下降,从而使肌肉的系水力降低,并影响肉色、剪切力等指标,且pH与其他肉质性状间存在较强的相关性[14],因而推测PRKAG3基因表达量与肉质也存在相关性。但关于PRKAG3基因表达量与肉质的相关性目前还未见报道。本试验结果表明,汉普夏猪PRKAG3基因表达量与滴水损失和b值呈正相关,与熟肉率和a值呈负相关,与pH2呈显著负相关。长撒猪PRKAG3基因表达量与失水率和L值呈正相关,与pH2、滴水损失、a值和屠宰率呈负相关。这说明PRKAG3基因表达量与肉质间的相关性存在品种效应。Şkrlep等[15]的研究也表明,猪PRKAG3基因R200Q和I199V的变异可导致pH2降低,而L值、a值、b值及滴水损失增加。
Enfalt等[16]从长白和汉普夏杂交猪中分离出PRKAG3基因中的3种基因型,即RN-(Val199→Gln200)、rn+(Val199→Arg200) 和rn*(Ile199→Arg200) 型,并比较它们对肉质和胴体组成的影响,结果表明PRKAG3基因的2个基因型RN-和rn*型对肉质胴体组成具有相反的效应,即RN-型个体具有较高的肌糖原含量、高瘦肉率和低的终pH,而rn*型个体则具有较低的肌糖原含量、低瘦肉率和高的终pH。Granlund等[17]在汉普夏猪上的研究表明,Ile199→Arg200变异可以促进背最长肌中葡萄糖的磷酸化,提高氧化能力并降低糖酵解能力和磷酸酶活性。但随后Riedl等[18]又发现AMPK的γ3异构体对猪肌肉的生长并不是必需的。目前可以肯定的是AMPKγ3异构体变异可控制肌肉对葡萄糖的吸收,并调节糖原的合成,因而影响骨骼肌中糖原的含量,进而影响肉质[8]。但关于PRKAG3基因表达量对肉质的影响及其作用机理还有待于进一步的研究。
4 结论PKKAG3基因在猪骨骼肌中的表达具有品种和生长阶段的差异性,长撒猪骨骼肌中PKKAG3基因表达量高于汉普夏猪,且其表达量随着猪体重的增加而增加。PKKAG3基因的表达量与肉质相关,特别是与pH2,二者呈显著负相关。
| [1] | BARNES B R, GLUND S, LONG Y C, et al. 5'-AMP-activated protein kinase regulates skeletal muscle glycogen content and ergogenics[J]. The FASEB Journal, 2005, 19(7): 773–779. DOI: 10.1096/fj.04-3221com |
| [2] | HOLMES B F, KURTH-KRACZEK E J, WINDER W W. Chronic activation of 5'-AMP-activated protein kinase increases GLUT-4, hexokinase, and glycogen in muscle[J]. Journal of Applied Physiology, 1999, 87(5): 1990–1995. |
| [3] | PINTER K, GRIGNANI R T, WATKINS H, et al. Localisation of AMPK γ subunits in cardiac and skeletal muscles[J]. Journal of Muscle Research and Cell Motility, 2013, 34(5/6): 369–378. |
| [4] | MILAN D, JEON J T, LOOFT C, et al. A mutation in PRKAG3 associated with excess glycogen content in pig skeletal muscle[J]. Science, 2000, 288(5469): 1248–1251. DOI: 10.1126/science.288.5469.1248 |
| [5] | CIOBANU D, BASTIAANSEN J, MALEK M, et al. Evidence for new alleles in the protein kinase adenosine monophosphate-activated γ3-subunit gene associated with low glycogen content in pig skeletal muscle and improved meat quality[J]. Genetics, 2001, 159(3): 1151–1162. |
| [6] | 杨公社. 猪生产学[M]. 北京: 中国农业出版社, 2002: 148-156. |
| [7] | GALVE A, BURGOS C, VARONA L, et al. Allelic frequencies of PRKAG3 in several pig breeds and its technological consequences on a Duroc×Landrace-Large White cross[J]. Journal of Animal Breeding and Genetics, 2013, 130(5): 382–393. |
| [8] | BARNES B R, MARKLUND S, STEILER T L, et al. The 5'-AMP-activated protein kinase γ3 isoform Has a key role in carbohydrate and lipid metabolism in glycolytic skeletal muscle[J]. The Journal of Biological Chemistry, 2004, 279(37): 38441–38447. DOI: 10.1074/jbc.M405533200 |
| [9] | RICHTER E A, MCDONALD C, KIENS B, et al. Dissociation of 5'AMP-activated protein kinase activity and glucose uptake in human skeletal muscle during exercise[J]. Diabetes, 2001, 50(Suppl.2): A62. |
| [10] | MAHIAPUU M, CARINA J, KERSTIN L, et al. Expression profiling of the γ-subunit isoforms of AMP-activated protein kinase suggests a major role for γ3 in white skeletal muscle[J]. American Journal of Physiology:Endocrinology and Metabolism, 2003, 286(2): E194–E200. DOI: 10.1152/ajpendo.00147.2003 |
| [11] | SCHEFFLER T L, PARK S, ROACH P J, et al. Gain of function AMP-activated protein kinase γ3 mutation (AMPKγ3R200Q) in pig muscle increases glycogen storage regardless of AMPK activation[J]. Physiological Reports, 2016, 4(11): e12802. DOI: 10.14814/phy2.12802 |
| [12] | LINDAHL G, ENFALT A C, VON SETH G, et al. A second mutant allele (V199I) at the PRKAG3(RN) locus-Ⅰ.Effect on technological meat quality of pork loin[J]. Meat Science, 2004, 66(3): 609–619. DOI: 10.1016/S0309-1740(03)00179-7 |
| [13] | UIMARI P, SIRONEN A. A combination of two variants in PRKAG3 is needed for a positive effect on meat quality in pigs[J]. BMC Genetics, 2014, 15(1): 29. DOI: 10.1186/1471-2156-15-29 |
| [14] | 朱砺, 李学伟, 李芳琼, 等. 肉质性状与胴体性状间的相关分析[J]. 四川农业大学学报, 2002, 20(1) :20–22. |
| [15] | ŞKRLEPM, KAVART, ČANDEK-POTOKARM. Comparison of PRKAG3 and RYR1 gene effect on carcass traits and meat quality in Slovenian commercial pigs[J]. Czech Journal of Animal Science, 2010, 55(4) :149–159. |
| [16] | ENFALT A C, VONSETH G, LUNDSTROM K, et al. In 48th International Congress of Meat Science and Technology[C].Rome:Food Engineering, 2002:618-619. |
| [17] | GRANLUND A, JENSEN-WAERN M, ESSÉN-GUSTAVSSON B. The influence of the PRKAG3 mutation on glycogen, enzyme activities and fibre types in different skeletal muscles of exercise trained pigs[J]. Acta Veterinaria Scandinavica, 2011, 53(1): 20. DOI: 10.1186/1751-0147-53-20 |
| [18] | RIEDL I, OSLER M E, BJÖRNHOLM M, et al. AMPKγ3 is dispensable for skeletal muscle hypertrophy induced by functional overload[J]. American Journal of Physiology:Endocrinology and Metabolism, 2016, 310(6): E461–E472. DOI: 10.1152/ajpendo.00387.2015 |




