2. 中国科学院大学, 北京 100049;
3. 湖南农业大学动物科学技术学院, 长沙 410128;
4. 湘潭大学, 湘潭 411105
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China;
4. Xiangtan University, Xiangtan 411105, China
哺乳仔猪因自身合成的谷氨酰胺 (Gln) 不能满足机体需求,且消化道发育不完善,外加早期断奶应激的影响,导致了仔猪获取外源性Gln的能力较弱[1],因此,断奶仔猪饲粮中及时补充外源性Gln显得尤为重要。据相关研究报道表明,Gln作为条件性必需氨基酸,参与多条代谢途径,是合成鸟氨酸、瓜氨酸、脯氨酸和精氨酸的前体物质,其不仅可以刺激细胞生长和抗体产生,而且是肠道细胞能量的主要来源[2]。刘巧婷等[3]研究发现,饲粮中添加不同水平的Gln提高了保育猪的生长性能,并以1.0%添加水平为最优。陈静等[4]研究发现,饲粮中添加Gln能够缓解免疫应激对仔猪断奶7 d后生长性能的影响。尽管国内外学者对Gln缓解仔猪断奶应激的研究已经取得了很多成果,但关于Gln缓解仔猪断奶后期 (21 d后) 应激的研究报道较少,特别是Gln对早期断奶仔猪在外界直接刺激产生免疫应激的研究并不多[5]。因此,本研究拟通过饲喂添加1%Gln的饲粮并在断奶后期多次腹腔注射肠道杆菌系脂多糖 (LPS) 建立仔猪应激模型,研究Gln对断奶仔猪不同时期生长性能的影响,以及其对LPS诱导应激后断奶仔猪后期生长性能和血清生化指标的影响,以期为生产实践提供一定的理论指导依据。
1 材料与方法 1.1 试验设计选取24头28日龄健康的“杜×长×大”三元杂交断奶仔猪[体重 (6.24±0.25) kg],随机分为3组,每组设8个重复 (公母各占1/2),每个重复1头猪。整个试验期内,对照组和LPS组饲喂基础饲粮,Gln+LPS组饲喂添加了1%的外源性Gln的基础饲粮;在试验第22、25、28、30天,LPS组和Gln+LPS组腹腔注射100 μg/kg BW LPS,对照组则注射相同剂量的生理盐水。试验第30天进行前腔静脉采血并屠宰。试验在中科院亚热带农业生态研究所动物房进行,试验采用单笼饲养,粉料饲喂,自由采食和饮水,消毒、免疫按照猪场常规程序进行,试验期间记录采食量、体重。仔猪在28日龄断奶,转入动物房实验室,适应期为3 d,之后进入正试期,试验期30 d。
1.2 试验材料与基础饲粮试验用Gln有效成分含量为99.5%,购自武汉远成共创科技有限公司。LPS购自美国Sigma公司,型号为E. coli serotype O55: B5。基础饲粮按照NRC (2012) 饲养标准配制,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平 (风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验期间记录采食量,在试验第1、7、14、21、30天空腹称量仔猪重量,计算平均日采食量 (ADFI)、平均日增重 (ADG) 和料重比 (F/G)。
试验仔猪在第30天屠宰,屠宰前进行前腔静脉采血10 mL,经4 ℃冰箱静置30 min后3 000 r/min离心15 min分离制备血清,利用全自动生化分析仪测定血清中的碱性磷酸酶 (ALP)、谷丙转氨酶 (ALT)、谷草转氨酶 (AST)、磷酸肌酶激酶 (CK)、α-淀粉酶 (α-AMY) 活性及尿素 (UREA)、高密度脂蛋白胆固醇 (HDLC)、低密度脂蛋白胆固醇 (LDLC)、免疫球蛋白M (IgM)、葡萄糖 (GLU) 含量。
屠宰后摘取心脏、肝脏、脾脏、肾脏进行称重记录,摘取小肠测量其长度并记录。

|
所有数据采用SPSS 17.0统计软件中ANOVA过程进行单因素方差分析,P < 0.05为差异显著。
2 结果 2.1 饲粮中添加Gln对断奶仔猪注射LPS前后生长性能的影响由表 2可知,试验第1~7天,Gln+LPS组的ADFI和ADG均显著高于对照组 (P < 0.05),且分别提高了20%和34%,F/G较对照组降低了16%(P>0.05)。试验第8~14天,Gln+LPS组的ADFI显著高于对照组 (P < 0.05),但ADG却降低了10%(P>0.05),且F/G增加20%(P>0.05)。试验第15~21天,3组间ADFI、ADG、F/G均无显著差异 (P>0.05)。总的来看,试验第1~21天,即LPS未处理前,与对照组相比,Gln+LPS组的ADFI显著提高了11%(P < 0.05),但是第21天体重、ADG和F/G均无显著差异 (P>0.05),F/G反而增加了9%(P>0.05)。LPS处理后的试验第22~30天,LPS组的ADFI、ADG和第30天体重均显著低于对照组 (P < 0.05),但是Gln+LPS组的ADFI、ADG、第30天体重较LPS组分别提高了12%、17%、7%(P>0.05),F/G降低了9%(P>0.05)。整个试验期 (第1~30天),LPS的组仔猪的第30天体重显著低于对照组 (P < 0.05),ADFI、ADG均低于对照组 (P>0.05);与LPS组比较,Gln+LPS组的ADFI、ADG及第30天体重分别提高了7%、12%和9%(P>0.05),F/G降低了5%(P>0.05)。
|
|
表 2 谷氨酰胺对断奶仔猪生长性能的影响 Table 2 Effects of glutamine on growth performance of weaned piglets |
由表 3可知,与对照组相比,LPS组的心脏指数、肝脏指数、脾脏指数、肾脏指数分别提高了9%、33%、37%、8%,均无显著差异 (P>0.05)。Gln+LPS组的心脏指数、肝脏指数、脾脏指数、肾脏指数比LPS组分别降低了10%、19%、12%、4%,均无显著差异 (P>0.05)。
|
|
表 3 谷氨酰胺对断奶仔猪脏器指数的影响 Table 3 Effects of glutamine on organ index of weaned piglets |
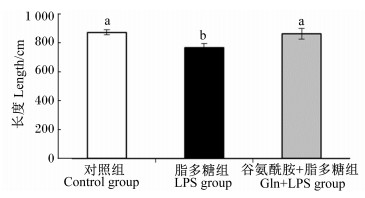
由图 1可以看出,LPS组小肠长度显著低于对照组,但Gln+LPS组与对照组之间无显著差异 (P>0.05),并且对照组和Gln+LPS组的小肠长度均显著高于LPS组 (P < 0.05)。
|
数据柱标注不同小写字母表示差异显著 (P < 0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 1 谷氨酰胺对断奶仔猪小肠长度的影响 Figure 1 Effects of glutamine on small intestinal length of weaned piglets |
由表 4可知,与对照组相比,LPS组血清ALP活性降低了16%(P>0.05),Gln+LPS组血清ALP活性显著降低了32%(P < 0.05)。Gln+LPS组血清HDLC含量较对照组显著降低了29%(P < 0.05),但LPS组血清HDLC含量与对照组无显著差异 (P>0.05)。与对照组相比,Gln+LPS组和LPS组血清IgM含量均显著提高 (P < 0.05),并且Gln+LPS组较LPS组血清IgM含量提高了16%(P>0.05)。3组血清UREA、LDLC、GLU含量及ALT、AST、CK、α-AMY活性均无显著差异 (P>0.05)。
|
|
表 4 谷氨酰胺对断奶仔猪血清生化指标的影响 Table 4 Effects of glutamine on serum biochemical parameters of weaned piglets |
据研究报道,Gln作为条件性必需氨基酸,也是母猪乳汁中含量最丰富的氨基酸,其对仔猪的生长发育起着非常重要的作用[6]。因早期断奶仔猪胃肠道发育不完善,故消化分解饲粮获取外源性Gln的能力不足,从而导致Gln缺乏,影响其生长性能。本研究发现,饲粮中添加1% Gln仅能显著提高断奶仔猪前期 (断奶后1周左右) 的生长性能,之后效果不明显。出现这一现象的原因可能是断奶后1周左右,饲喂添加了1% Gln饲粮的断奶仔猪能够从饲粮中获取足够的外源性Gln从而缓解了因断奶造成的内源性Gln的不足,从而显著提高了其生长性能。另外,未添加Gln组的仔猪1周后逐渐适应了断奶后环境,并在断奶1周后出现了生长补偿[7],使得对照组仔猪试验后期的ADG和F/G得以提高,所以造成试验1周后对照组与添加Gln组的仔猪生长性能并无显著差异。这一结果与代兵等[8]和刘涛等[9]研究结果基本一致,代兵等[8]还发现饲粮中添加Gln能够提高仔猪断奶后7 d小肠绒毛的长度,降低隐窝深度,而断奶后14 d与饲喂基础饲粮相比,其生长性能和小肠发育差异均不显著,这进一步说明了添加Gln仅能显著提高断奶后1周左右的生长性能。但张建刚等[10]总结之前的研究报道,发现关于饲粮中添加1% Gln的促进生长效果在仔猪断奶后哪个阶段表现更明显的报道并不一致。Wu等[11]研究发现,饲粮中添加1%的Gln对28日龄断奶仔猪前期 (21~35日龄) 作用效果不明显,但在断奶后期 (21~49日龄) 作用效果显著,这与张建刚等[10]和钱利纯等[12]报道基本一致。另外,杨彩梅等[13]发现添加1%的Gln可显著提高断奶前期和整个试验期的ADG。这些差异可能与仔猪断奶时的生理状况、断奶之前是否饲喂教槽料及仔猪的断奶日龄有关。众所周知,仔猪生长发育不完善容易受到断奶、营养、免疫、饲养管理等因素的影响产生应激,从而影响仔猪的生长性能。目前,腹腔注射LPS是构建仔猪应激的经典模型[14]。本研究中,在试验第22、25、28、30天,Gln组和LPS组分别腹腔注射LPS (100 μg/kg BW),导致这2组生长性能显著降低,而添加了Gln组的生长性能较未添加组有所改善。这与陈静等[5]报道基本一致,陈静等[5]研究发现,免疫应激使断奶仔猪生长性能下降,而添加Gln能够缓解免疫应激对仔猪生长性能的影响。这一结果说明添加1% Gln能够缓解仔猪因LPS诱导的免疫应激对生长性能造成的影响。
由本研究结果可知,饲粮添加1%的Gln仅能显著提高28日龄断奶仔猪断奶后1周左右的生长性能,但是在仔猪整个生理期添加1% Gln能够缓解应激对仔猪生长性能的影响。因此,在实际生产中,我们可以考虑提高仔猪断奶后前期 (1周左右) 饲粮中Gln的添加水平,但是在断奶后期Gln的添加水平可在一定程度上有所降低。
3.2 饲粮中添加Gln对LPS诱导应激后断奶仔猪脏器指数和小肠长度的影响动物机体的器官指数是一种生物学特性指标,在一定程度上决定了器官功能的强弱。陈静等[15]研究发现,免疫应激显著降低了仔猪的脾脏指数和胸腺指数,而添加Gln显著提高了应激仔猪的脾脏指数和胸腺指数,显著缓解了LPS诱导应激对仔猪免疫器官的影响。本研究发现饲粮中添加Gln对LPS诱导应激后心脏、肝脏、脾脏、肾脏的脏器指数均无显著影响,但LPS组心脏、肝脏、脾脏、肾脏的脏器指数均高于对照组,而Gln+LPS组的心脏、肝脏、脾脏、肾脏的脏器指数低于LPS组。这可能是因为注射LPS造成的脏器水肿或充血导致内脏器官重量增加,而添加Gln能够在一定程度上缓解了注射LPS对心脏、肝脏、脾脏、肾脏造成的损伤。据相关报道小肠长度和重量是衡量小肠发育和吸收能力的关键指标,小肠长度越长及小肠吸收表面积越大,小肠消化吸收功能越强,这也预示着小肠免疫功能越完善,发育的越好[16]。代兵等[8]研究发现,饲粮添加1% Gln能够显著提高仔猪断奶后1周小肠的重量和绒毛的长度,显著降低隐窝深度。目前研究也表明,饲粮添加Gln可提高绒毛高度,减少隐窝深度,进而改进肠道形态,促进肠道发育。本研究中,对照组和Gln+LPS组的仔猪小肠长度显著高于LPS组,而Gln+LPS组和对照组之间无显著差异,这一结果说明添加Gln能够有效缓解因LPS诱导应激对仔猪肠道发育造成的影响,从而维护了断奶仔猪肠道健康。
3.3 饲粮中添加Gln对LPS诱导应激后断奶仔猪血清生化指标的影响血清生化指标是反映机体代谢状况的重要指标,因此通过测定血清中的生化指标可以在一定程度上可以反映动物的健康和生长性能,在动物生产研究中有重要的意义[17]。据相关研究报道,血清中的IgM具有免疫和营养的作用,当仔猪收到外界各种抗原的刺激,会激发免疫反应,此时会在短时间内产生较高水平的抗体 (球蛋白) 用于抵制抗原[18]。叶亚玲等[19]研究表明,饲粮中添加丙氨酸联合Gln可提高断奶仔猪小肠黏膜固有层免疫球蛋白A (IgA) 浆细胞数量和分泌型免疫球蛋白A (SIgA) 的分泌量。本研究中,LPS组和Gln+LPS组仔猪血清中IgM含量均显著高于对照组,并且Gln+LPS组血清中的IgM含量较LPS组提高了16%,从这一结果可知饲粮中添加Gln可提高血清中抗体蛋白合成水平,从而增强了仔猪抵抗应激的能力。相关报道表明,通常情况下畜禽血清中的ALP活性只有在肠道吸收障碍时才表现下降,它是肠道吸收发生障碍时的重要指标[20]。钱利纯等[12]研究发现,断奶应激显著降低了仔猪血清中ALP的活性,而添加Gln对血清中ALP的活性无显著影响。本研究结果显示,LPS诱导应激后仔猪血清中ALP活性显著降低,且添加Gln并不会提高其活性。这一结果说明LPS应激可能会导致仔猪肠道吸收功能障碍,添加Gln未对仔猪血清中ALP的活性产生影响。有研究表明,HDLC能与LPS结合,从而具有对抗LPS毒性作用,HDLC与LPS结合能够有效的封闭LPS的活性中心,竞争性的抑制LPS与其受体结合,降低LPS对靶细胞的激活作用,减少炎性介质的释放,从而缓解LPS引起的免疫炎症反应[21-22]。本研究中,由于注射LPS导致LPS组和Gln+LPS组血清中HDLC的含量显著低于对照组,并且Gln+LPS血清中HDLC的含量较LPS组降低了22%。出现这一结果一方面可能是因为血清中HDLC与LPS结合导致血清中HDLC含量降低,另一方面可能说明饲粮中添加1% Gln增强了HDLC与LPS的结合能力,从而降低了血清中HDLC的含量,提高了仔猪对抗LPS刺激的能力。因此,添加1% Gln能够调节应激仔猪血清相关生化指标,进一步地缓解仔猪应激反应。
4 结论① 饲粮中添加1%的Gln仅能够显著提高仔猪断奶后1周的生长性能,之后效果不明显。
② 饲粮中添加1%的Gln能够提高应激仔猪的血清中IgM的含量并降低HDLC的含量,改善其生长性能和小肠长度,从而缓解仔猪应激。
| [1] | 王继强, 赵中生, 龙强, 等. 断奶仔猪的生理特点及降低腹泻的营养调控措施[J]. 广东饲料, 2007, 16(1) :42–44. |
| [2] | 唐倩, 李吕木, 丁维民. 谷氨酰胺对肠道营养与健康的影响[J]. 饲料博览, 2015(2) :11–16. |
| [3] | 刘巧婷, 何若钢, 刘谨, 等. 谷氨酰胺对保育猪生长性能、免疫器官及其小肠形态学发育程度影响的研究[J]. 饲料工业, 2014, 35(15) :35–40. |
| [4] | 陈静, 刘显军, 张飞, 等. 谷氨酰胺对免疫应激仔猪生产性能的影响[J]. 黑龙江畜牧兽医:科技版, 2010(2) :61–62. |
| [5] | 杨淑芬, 方热军. 谷氨酰胺在动物生产中的应用研究[J]. 广东饲料, 2015, 24(12) :27–28. DOI: 10.3969/j.issn.1005-8613.2015.12.008 |
| [6] | WU G, KNABE D A. Free and protein-bound amino acids in sow's colostrum and milk[J]. The Journal of Nutrition, 1994, 124(3): 415–424. |
| [7] | 刘永功, 杜伦, 杨胜, 等. 3周龄与6周龄断奶仔猪生产性能的比较[J]. 中国畜牧杂志, 1990, 26(1) :19–21. |
| [8] | 代兵, 邹思湘, 陈够芬, 等. 谷氨酰胺对早期断奶仔猪生长性能及肠道形态发育的影响[J]. 畜牧与兽医, 2011, 43(11) :7–11. |
| [9] | 刘涛, 彭健. 在日粮中添加谷氨酰胺和谷氨酸对断奶仔猪生产性能的影响[J]. 华中农业大学学报, 1999, 18(5) :457–460. |
| [10] | 张建刚, 李文婷, 侯玉洁, 等. 谷氨酰胺对断奶仔猪生长性能和健康状况的影响[J]. 养猪, 2012(2) :25–27. |
| [11] | WU G, MEIER S A, KNABE D A. Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs[J]. The Journal of Nutrition, 1996, 126(10): 2578–2584. |
| [12] | 钱利纯, 尹兆正, 郑根华, 等. 谷氨酰胺对断奶仔猪生长性能的影响[J]. 浙江大学学报:农业与生命科学版, 2005, 31(5) :649–653. |
| [13] | 杨彩梅, 陈安国. 谷氨酰胺对早期断奶仔猪生产性能和小肠消化酶活性的影响[J]. 中国畜牧杂志, 2005, 41(6) :21–22. |
| [14] | LIU Y L, LI D F, GONG L M, et al. Effects of fish oil supplementation on the performance and the immunological, adrenal, and somatotropic responses of weaned pigs after an Escherichia coli lipopolysaccharide challenge[J]. Journal of animal science, 2003, 81(11): 2758–2765. DOI: 10.2527/2003.81112758x |
| [15] | 陈静, 刘显军, 张飞, 等. 谷氨酰胺对免疫应激仔猪免疫器官指数的影响[J]. 中国兽医杂志, 2010, 46(9) :3–5. |
| [16] | 董泾青, 董琦, 刘茂玲. 新型早产猪短肠综合征模型的建立[J]. 中国普外基础与临床杂志, 2015, 22(9) :1052–1056. |
| [17] | 周玉香, 吕玉玲, 王洁, 等. 血液生化指标在动物生产与营养调控研究中的应用概况[J]. 畜牧与饲料科学, 2012, 33(5) :72–74. |
| [18] | MORRILL J L, MORRILL J M, FEYERHERM A M, et al. Plasma proteins and a probiotic as ingredients in milk replacer[J]. Journal of Dairy Science, 1995, 78(4): 902–907. DOI: 10.3168/jds.S0022-0302(95)76704-2 |
| [19] | 叶亚玲, 王自蕊, 游金明, 等. 丙氨酰-谷氨酰胺对断奶仔猪小肠黏膜固有层免疫球蛋白A浆细胞数量、分泌型免疫球蛋白A及黏膜中白细胞介素含量的影响[J]. 动物营养学报, 2015, 27(1) :59–66. |
| [20] | 王秋颖. 碱性磷酸酶特性及其应用的研究进展[J]. 中国畜牧兽医, 2011, 38(1) :157–161. |
| [21] | LEVELS J H M, ABRAHAM P R, VAN DEN ENDE A, et al. Distribution and kinetics of lipoprotein-bound endotoxin[J]. Infection and Immunity, 2001, 69(5): 2821–2828. DOI: 10.1128/IAI.69.5.2821-2828.2001 |
| [22] | KITCHENS R L, WOLFBAUER G, ALBERS J J, et al. Plasma lipoproteins promote the release of bacterial lipopolysaccharide from the monocyte cell surface[J]. The Journal of Biological Chemistry, 1999, 274(48): 34116–34122. DOI: 10.1074/jbc.274.48.34116 |




