随着畜牧业的发展,畜禽养殖的集约化程度越来越高,且抗生素在动物饲粮中的应用已被许多国家明令禁止,在这个过程中,畜禽将受到养殖环境与疾病的双重压力。因此,寻找安全有效的饲料添加剂引起人们的广泛关注。益生菌是生产中使用较广泛的添加剂之一,它可以改善肠道菌群[1],增强机体免疫力[2],提高动物生产性能[3-4]。益生元也被证明在改善宿主健康方面具有重要作用。目前,可选择性刺激乳酸菌和双歧杆菌生长的低聚糖已被人们所熟知;关于多糖也被大量研究证实在改善生长性能[5]、抗氧化[6-7]、促进有益菌生长[8]及免疫调节[9]等方面具有重要作用。虽然关于益生菌与低聚糖联合使用在动物生产中的应用已有较多报道,但关于益生菌与多糖之间的协同作用在蛋鸡上的研究较为少见。本试验旨在探讨枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡生产性能、蛋品质、血液指标及粪和肠道微生物区系的影响,并观察枯草芽孢杆菌与苜蓿多糖是否具有协同作用,两者联合使用相较于枯草芽孢杆菌单独使用是否可以产生更优的效果,以期为其在蛋鸡生产中的应用提供试验依据。
1 材料与方法 1.1 试验动物与试验设计选用288只27周龄产蛋率 (92.2%、91.2%、91.7%和92.3%) 和体重 (1.658~1.679 kg) 相近的健康海兰褐壳蛋鸡,随机分为4组,每组6个重复,每个重复12只鸡。1组为对照组,饲喂基础饲粮,其参照NRC (1994) 营养需要配制,基础饲粮组成及营养水平见表 1。2~4组分别在基础饲粮中添加1.0×107 CFU/g枯草芽孢杆菌、1.0×107 CFU/g枯草芽孢杆菌+250 mg/kg苜蓿多糖、1.0×107 CFU/g枯草芽孢杆菌+4 000 mg/kg苜蓿多糖。试验期为24周。
|
|
表 1 基础饲粮组成及营养水平 (风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
菌种选用枯草芽孢杆菌CGMCC 1.921,购自中国普通微生物菌种保藏中心,由沧州华雨药业有限公司生产制备,活菌数≥1.0×1010 CFU/g;苜蓿多糖成分:多糖含量为24.28%,黄酮含量为2.90%,皂苷含量为3.47%,粗蛋白质含量为15.55%,粗灰分含量为24.35%。
1.3 饲养管理采用2层笼养,每个重复由相邻2笼组成 (长×宽×高为80 cm×60 cm×50 cm),每笼6只鸡。每日饲喂3次,自由采食;乳头式饮水器,自由饮水。采用16 h (06:00—22:00) 光照,自动控温、供暖、通风。
1.4 测定指标及方法 1.4.1 生产性能试验期间以重复为单位记录每天产蛋数、蛋重、死淘鸡只数,每周结料,称取并记录剩余料重,计算产蛋率、采食量、蛋重、料蛋比、只产蛋量和死淘率。
1.4.2 蛋品质试验开始前 (0周,下同) 及试验第1、2、3、4、8、12、16、20和24周,采集当天所有鸡蛋进行测定。采用蛋壳颜色测定仪测定蛋壳颜色 (QCR,TSS公司,英国);蛋壳强度测试仪测定蛋壳强度 (Model-Ⅲ,Robotmation公司,日本);采用蛋壳厚度测定仪测定蛋壳厚度 (Model P-1,Ozaki MFG公司,日本);采用卵形系数测定器测定蛋形指数 (NFN384,FHK公司,日本);采用蛋品质测定仪测定蛋白高度、哈氏单位及蛋黄颜色 (EMT-2500,Robotmation公司,日本)。
1.4.3 血液指标试验开始前及试验第1、2、3、4、8、12、16、20和24周,以重复为单位随机选取4只鸡,采血前禁食12 h,自由饮水。通过翅下静脉采集血液于普通真空采血管中,静置待有少量血清析出后,2 000 r/min离心10 min,取上清液于EP管中待测。用日本东芝TBA-120FR全自动生化分析仪进行血清中谷丙转氨酶 (ALT)、谷草转氨酶 (AST) 活性及总蛋白 (TP)、白蛋白 (ALB)、总胆红素 (TBIL)、葡萄糖 (GLU)、尿素 (UREA)、尿酸 (UA)、肌酐 (CREA)、甘油三酯 (TG) 和胆固醇 (CHOL) 含量的测定。
通过翅下静脉采集血液分别于5 mL的乙二胺四乙酸 (EDTA) 抗凝真空采血管和2 mL柠檬酸钠抗凝真空采血管,轻轻混匀。采用电阻抗法,由江西特康全自动三分群血细胞分析仪 (TEK-Ⅱ mini) 进行白细胞 (WBC)、淋巴细胞 (LYM)、中间细胞 (MID)、中性粒细胞 (GRA)、红细胞 (RBC) 数目及红细胞压积 (HCT)、血红蛋白 (HGB) 含量和血小板 (PLT) 数目的测定;采用魏氏法,由北京普利生XC-40B全自动红细胞沉降率测定仪进行红细胞沉降率 (ESR) 的测定。
血清中免疫球蛋白A (IgA)、免疫球蛋白G (IgG)、免疫球蛋白M (IgM) 含量采用双抗体夹心酶联免疫吸附法 (ELISA),按照上海朗顿生物科技有限公司提供的试剂盒进行测定。
1.4.4 微生物区系检测试验开始前及试验第1、2、3、4、8、12、16、20和24周,每个重复选取6只鸡,收集新鲜粪便,采用平板计数法对粪便中大肠杆菌进行计数。大肠杆菌采用伊红美蓝琼脂培养基计数。
第24周末,每重复选取1只鸡 (每组6只),颈静脉放血法处死,打开腹腔,结扎空肠、回肠和盲肠并剪下,放置于50 mL灭菌离心管中,立即回实验室于超净台分别采集空肠、回肠、盲肠内容物于灭菌EP管,采用平板计数法对其乳酸菌、双歧杆菌、大肠杆菌、肠球菌、产气荚膜梭菌、弯曲杆菌进行计数,并计算大肠杆菌/乳酸菌值。乳酸菌采用MRS培养基计数,双歧杆菌采用TPY琼脂培养基计数,大肠杆菌采用伊红美蓝琼脂培养基计数,肠球菌采用Pfizer肠球菌选择性琼脂培养基计数,产气荚膜梭菌采用胰月示-亚硫酸盐-环丝氨酸 (TSC) 琼脂培养基计数,弯曲杆菌采用改良Camp-BAP氏琼脂基础计数。
1.5 数据统计与分析试验数据采用SPSS 19.0进行统计分析。采用one-way ANOVA方差分析和最小显著差数 (LSD) 法进行多重比较,显著水平设为P < 0.05,试验数据表示为平均值±标准差。
2 结果与分析 2.1 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡生产性能的影响由图 1可知,饲粮中添加枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋重、采食量、只产蛋量及死淘率无显著影响 (P>0.05);对于产蛋率,3、4组第9~16周显著高于对照组 (P < 0.05),但与2组差异不显著 (P>0.05);对于料蛋比,2、3、4组第9~16、17~24及1~24周显著低于对照组 (P < 0.05),而3个试验组之间无显著差异 (P>0.05)。上述结果说明,在生产性能方面,饲粮中添加枯草芽孢杆菌联合苜蓿多糖没有产生优于单独使用枯草芽孢杆菌的效果。
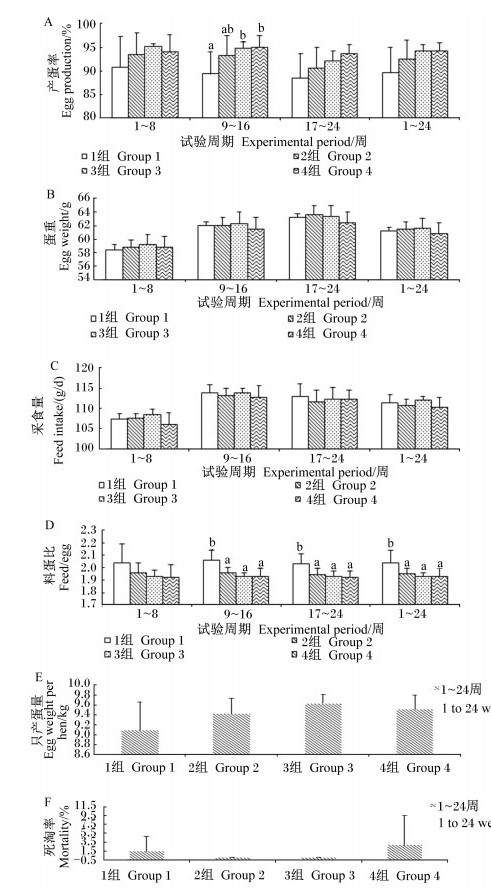
|
数据柱标注不同小写字母表示差异显著 (P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡生产性能的影响 Figure 1 Effects of Bacillus subtilis and its combination with alfalfa polysaccharides on performance of laying hens |
由图 2可知,饲粮中添加枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋壳颜色无显著影响 (P>0.05)。对于蛋壳厚度,2、3、4组第1周显著高于对照组 (P < 0.05);2组第3周显著高于对照组和4组 (P < 0.05),与3组差异不显著 (P>0.05)。对于蛋壳强度,2组第8周显著高于对照组和4组 (P < 0.05),3组与对照组和2组差异不显著 (P>0.05)。对于蛋形指数,2组第20周显著低于3组 (P < 0.05),且2、3组与4组和对照组均无显著差异 (P>0.05)。2、3组第4周的哈夫单位和蛋白高度显著低于对照组 (P < 0.05),且2组显著高于3组 (P < 0.05),并都显著低于4组 (P < 0.05);2、3组第8周哈夫单位显著低于对照组 (P < 0.05),与4组差异不显著 (P>0.05);3组第24周哈夫单位显著高于2、4组 (P < 0.05),与对照组无显著差异 (P>0.05)。对于蛋黄颜色,试验开始前2、3、4组显著低于对照组 (P < 0.05),且4组显著高于3组 (P < 0.05),显著低于2组 (P < 0.05);2、3、4组第1周显著高于对照组 (P < 0.05),且3组显著高于4组 (P < 0.05),与2组无显著差异 (P>0.05);2、4组第2周显著高于对照组 (P < 0.05),与3组无显著差异 (P>0.05);2、3、4组第4周显著高于对照组 (P < 0.05),且3个试验组间无显著差异 (P>0.05);2、3、4组第12周显著高于对照组 (P < 0.05),且2组显著高于3、4组 (P < 0.05);3组第20周显著低于其他各组 (P < 0.05)。由此可知,枯草芽孢杆菌及其与苜蓿多糖联合使用对改善蛋黄颜色有一定作用,但两者联合使用较枯草芽孢杆菌单独使用优势不明显。
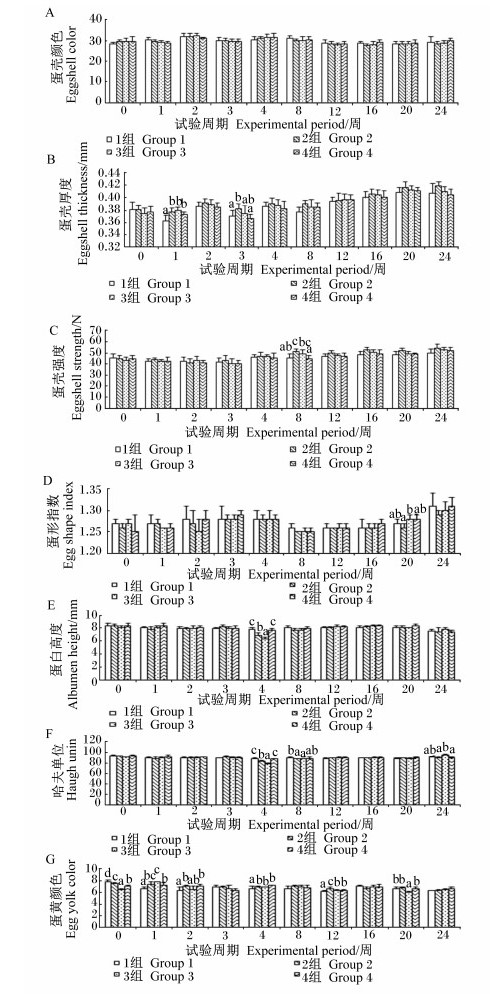
|
图 2 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡蛋品质的影响 Figure 2 Effects of Bacillus subtilis and its combination with alfalfa polysaccharides on egg quality of laying hens |
由图 3可知,对于RBC数目,2(第2、12周)、3(第1、3周)、4(第1、2、3、12周) 组显著低于对照组 (P < 0.05),且4组第3周显著低于2、3组 (P < 0.05),其他时间3、4组与2组无显著差异 (P>0.05);2组第16、20周显著高于其他各组 (P < 0.05)。对于HCT,2(第1、2、3、12周)、3(第1周)、4(第1、2、3、12周) 组显著低于对照组 (P < 0.05),且4组第3周显著低于2、3组 (P < 0.05);2、3组第20周显著高于对照组 (P < 0.05),而4组显著低于2组 (P < 0.05)。对于HGB含量,2(第1、3、12周)、3(第8、20周)、4(第1、2、3、8、12、16、20周) 组显著低于对照组 (P < 0.05),2(第16周)、3(第4周) 组显著高于对照组 (P < 0.05);3(第16周)、4(第2、8、16、20周) 组显著低于2组 (P < 0.05);3组第4周显著高于2组 (P < 0.05)。对于PLT数目,2(第3、16、24周)、3(第3、24周)、4(第3、24周) 组显著高于对照组 (P < 0.05)。对于WBC数目,2(第1、3、4、8、16、20、24周)、3(第8、12、20、24周)、4(第0、2、16、20、24周) 组显著高于对照组 (P < 0.05);3(第1、3、4、16、20周)、4(第1、3、4、20周) 组显著低于2组 (P < 0.05);3(第12周)、4(第0、2、12周) 组显著高于2组 (P < 0.05)。对于LYM数目,2(第3、4、8、20、24周)、3(第20、24周)、4(第20、24周) 组显著高于对照组 (P < 0.05),3(第3、4、20周)、4(第3、4、8、20周) 组显著低于2组 (P < 0.05)。对于MID数目,2(第0、12、16、20、24周)、3(第1、3、4、8、12、16、24周)、4(第0、1、3、12、16周) 组显著高于对照组 (P < 0.05),3(第1、3、4、8、12周)、4(第0、3周) 组显著高于2组 (P < 0.05);3、4组第16周显著低于2组 (P < 0.05)。对于NEU数目,2(第0、12、16、24周)、3(第1、4、8、12、16、20、24周)、4(第8、12、16、24周) 组显著高于对照组 (P < 0.05),3(第1、3、4、8周)、4(第1、3、8周) 组显著高于2组 (P < 0.05)。对于ESR,2(第3、20周)、3(第8、20周)、4(第3、8、20、24周) 组显著高于对照组 (P < 0.05);2组第3周显著高于其他各组 (P < 0.05)。由上可知,与单独添加枯草芽孢杆菌相比,枯草芽孢杆菌与苜蓿多糖联合使用显著提高了血液MID、NEU数目,而对其他血液指标没有产生显著影响。
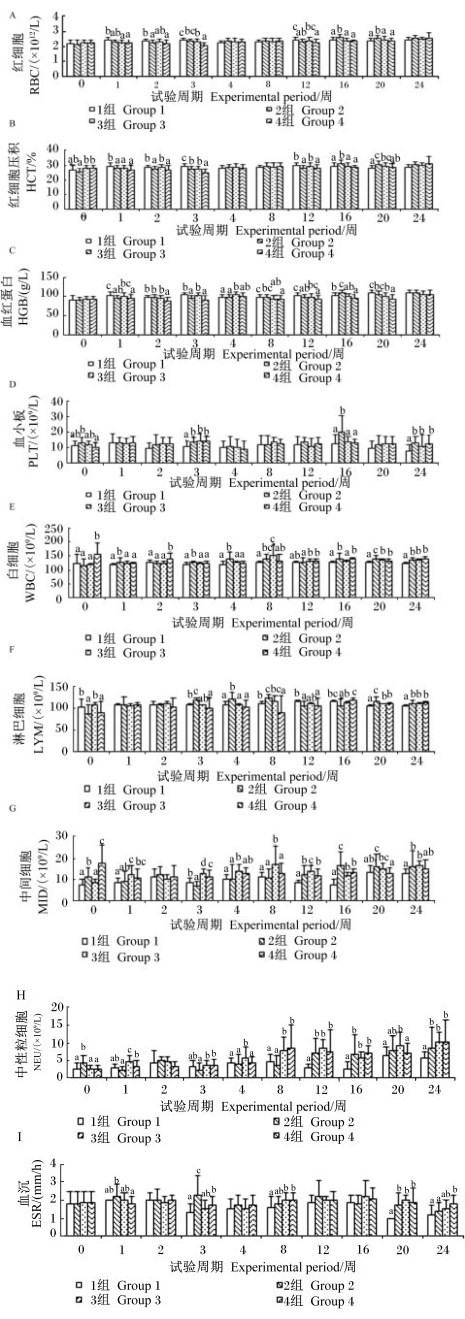
|
图 3 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡血常规指标的影响 Figure 3 Effects of Bacillus subtilis and its combination with alfalfa polysaccharides on routine blood indices of laying hens |
由图 4可知,饲粮中添加枯草芽孢杆菌及其与苜蓿多糖联合使用对血清ALT活性和TG含量无显著影响 (P>0.05)。对于AST活性,2、4组第8周显著高于对照组 (P < 0.05),与3组无显著差异 (P>0.05)。对于TP和GLB含量,3、4组第3周显著高于其他各组 (P < 0.05)。对于ALB含量,3组第4周显著低于对照组 (P < 0.05),且4组显著低于3组 (P < 0.05)。对于ALB/GLB值,2、3、4组第2周与对照组差异不显著 (P>0.05);3、4组第3周显著低于其他各组 (P < 0.05);4组第4周显著低于对照组 (P < 0.05)。对于TBIL含量,3组第1周显著高于其他各组 (P < 0.05);2、3、4组第3周显著低于对照组 (P < 0.05);3、4组第4周显著低于对照组 (P < 0.05),且4组显著低于2、3组 (P < 0.05)。对于GLU含量,2(第8周)、3(第1、8、24周)、4(第24周) 组显著低于对照组 (P < 0.05);2(第2、3、12、16周)、3(第2、3、4、12周)、4(第2、3、4、8、12、16、20周) 组显著高于对照组 (P < 0.05),且3(第2、3、4、12周)、4(第3、4、8、12、20周) 组高于2组 (P < 0.05)。对于UREA含量,3(第4周)、4(第4、16周) 组显著高于对照组 (P < 0.05),2(第3、12周)、3(第2、3、12周)、4(第3、8、12、20周) 组显著低于对照组 (P < 0.05);且3(第2周)、4(第8、20周) 组低于2组 (P < 0.05)。对于UA含量,2、4组第3周显著低于对照组 (P < 0.05)。对于CHOL含量,3组第1周显著高于对照组和4组 (P < 0.05)。对于CREA含量,2组第1、2周显著低于对照组 (P < 0.05);3(第2、3、4周)、4(第4周) 组显著高于对照组 (P < 0.05)。综上,饲粮中添加枯草芽孢杆菌及其与苜蓿多糖联合使用对血清ALT、AST活性及TP、ALB、GLB、TBIL、UA、CREA、CHOL、TG含量及ALB/GLB值无显著影响,但对血清GLU、UREA含量有一定改善作用,且枯草芽孢杆菌和苜蓿多糖联合使用对改善血清GLU含量具有一定优势。
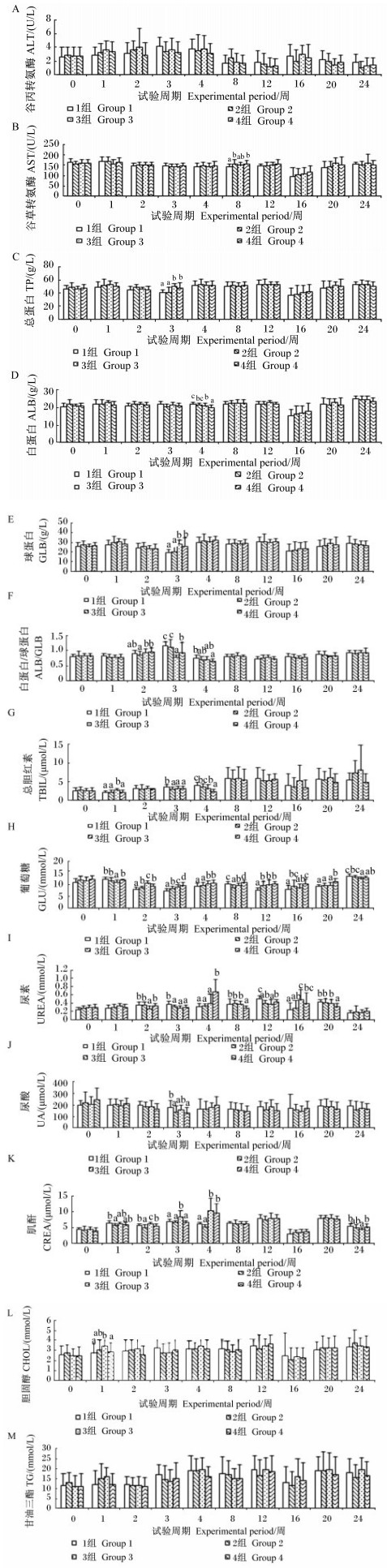
|
图 4 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡血清生化指标的影响 Figure 4 Effects of Bacillus subtilis and its combination with alfalfa polysaccharides on serum biochemical indices of laying hens |
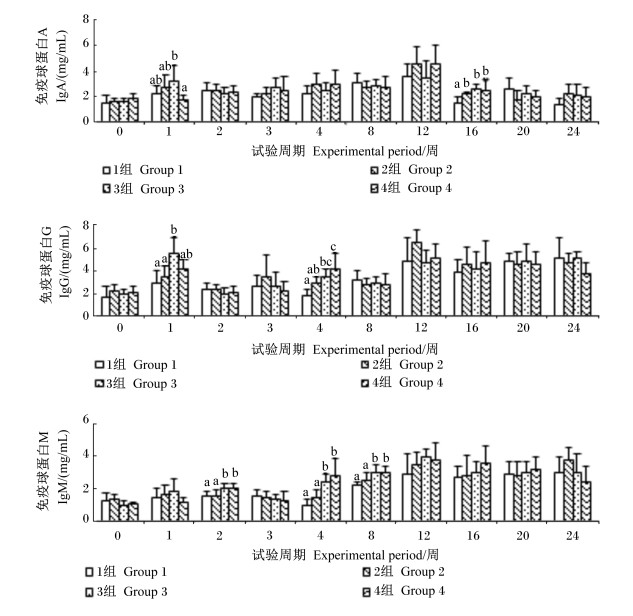
由图 5可知,对于IgA含量,4组第1周显著低于3组 (P < 0.05),与其他2组差异不显著 (P>0.05);2、3、4组第16周显著高于对照组 (P < 0.05)。对于IgG含量,3(第1、4周)、4(第4周) 组显著高于对照组 (P < 0.05),且3(第1周)、4组 (第4周) 显著高于2组 (P < 0.05)。对于IgM含量,3、4组第2、4、8周显著高于对照组和2组 (P < 0.05)。由上可知,与单独添加枯草芽孢杆菌相比,枯草芽孢杆菌与苜蓿多糖联合使用显著提高了血清免疫球蛋白含量。
|
图 5 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡血清免疫球蛋白含量的影响 Figure 5 Effects of Bacillus subtilis and its combination with alfalfa polysaccharides on serum immunoglobulin content of laying hens |
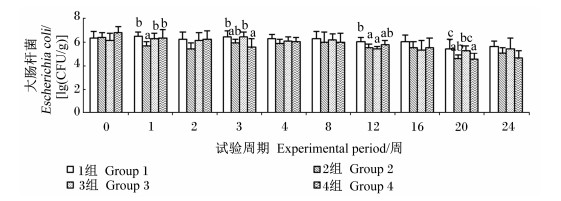
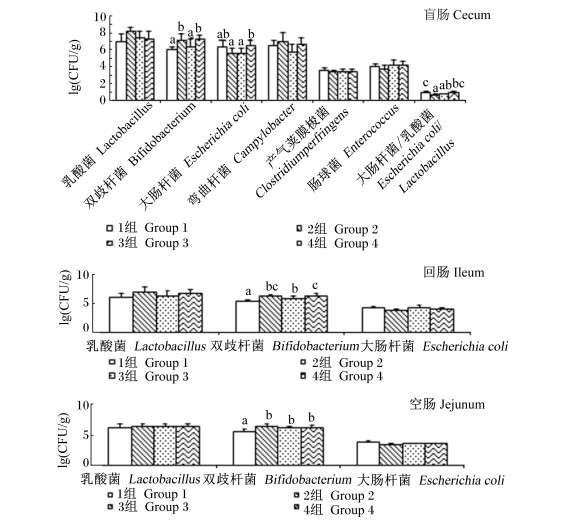
由图 6可知,与对照组相比,2(第1、12、20周)、3(第12周)、4组 (第3、20周) 大肠杆菌数量显著降低 (P < 0.05),3、4组第1周显著高于2组 (P < 0.05)。由图 7可知,饲粮中添加枯草芽孢杆菌和苜蓿多糖对盲肠乳酸菌、弯曲杆菌、产气夹膜梭菌和肠球菌及空肠、回肠的乳酸菌和大肠杆菌数量无显著影响 (P>0.05);2、4组盲肠双歧杆菌数量显著高于对照组 (P < 0.05);2、3组盲肠大肠杆菌数量显著低于4组 (P < 0.05),且大肠杆菌/乳酸菌值显著低于对照组 (P < 0.05),而4组大肠杆菌/乳酸菌值与对照组相比差异不显著 (P>0.05);2、3、4组空肠、回肠双歧杆菌数量显著高于对照组 (P < 0.05),而3个试验组间无显著差异 (P>0.05)。由上可知,在粪和肠道微生物区系方面,枯草芽孢杆菌联合苜蓿多糖没有产生优于单独使用枯草芽孢杆菌的效果。
|
图 6 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡粪中大肠杆菌数量的影响 Figure 6 Effects of Bacillus subtilis and its combination with alfalfa polysaccharides on fecal Escherichia coli count of laying hens |
|
图 7 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡肠道微生物区系的影响 Figure 7 Effects of Bacillus subtilis and its combination with alfalfa polysaccharides on intestinal microbial flora of laying hens |
饲粮中添加益生菌可以提高动物机体消化酶的活性[10],增强对营养物质的消化吸收能力[11-12],从而提高动物的生产性能[13]。本实验室研究表明,苜蓿多糖可以提高蛋鸡的产蛋率和只产蛋量[14]。Geng等[15]饲喂军曹鱼壳聚糖+枯草芽孢杆菌以及Fan等[16]饲喂海参黄芪多糖+茯苓多糖+枯草芽孢杆菌均显著提高了比生长速率。合生元对促进动物生长有明显作用[17],可能是因为益生元促进了益生菌的生长[18-20],为其改善肠道结构或肠道菌群提供了条件[21]。本试验发现,添加枯草芽孢杆菌及枯草芽孢杆菌+苜蓿多糖可显著降低料蛋比,但两者间无显著差异,即枯草芽孢杆菌与苜蓿多糖联合使用没有产生优于枯草芽孢杆菌单独添加的效果。李树鹏[22]研究表明,益生菌及其与黄芪多糖 (含量为36.12%) 联合使用均能显著提高蛋雏鸡周增重,降低料重比,但未发现合生元组生产性能与益生菌组有显著差异,与本试验结果相似。多糖与益生菌联合使用对动物生产性能的影响可能与饲养环境、生理状态以及多糖本身的性质等有关。目前关于这方面的报道较为少见,其两者联合使用对动物生产性能的影响机制尚不清楚。
3.2 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡蛋品质的影响益生菌对蛋品质的影响报道不尽一致。雷凯[23]研究表明,蛋鸡饲粮中添加地衣芽孢杆菌可以改善蛋壳厚度、蛋壳强度、哈夫单位、蛋白高度和蛋黄颜色,而Tang等[24]研究发现,添加益生菌制剂 (嗜酸乳杆菌、干酪乳杆菌、两岐双歧杆菌、粪链球菌、米曲霉) 对蛋壳厚度、哈夫单位、蛋黄颜色无显著影响。王翠菊等[25]和辛小青等[14]研究发现,黄芪多糖和苜蓿多糖对改善蛋黄颜色、蛋白高度、哈夫单位及蛋壳厚度有一定作用。但关于多糖与益生菌联合使用对蛋品质的影响尚未见报道。本试验研究表明,饲粮中添加枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋壳颜色、蛋壳厚度、蛋壳强度、蛋形指数、蛋白高度及哈夫单位没有显著改善作用,但在一定程度上提高了蛋黄颜色。蛋黄颜色决定于饲粮中的类胡萝卜素含量,任何阻碍类胡萝卜素吸收及沉积的因素都将导致蛋黄颜色变浅[26]。因此,本试验蛋黄颜色的改善可能是因为添加枯草芽孢杆菌及其与苜蓿多糖联合使用促进了类胡萝卜素的吸收和沉积。也有结果表明,枯草芽孢杆菌[27-28]和苜蓿多糖[29]有抗氧化的作用,所以也可能是其抗氧化作用保护了更多类胡萝卜素不被氧化,增加了色素的沉积,从而改善蛋黄颜色,但具体作用机制尚需进一步研究。
3.3 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡血清生化指标的影响ALT和AST主要存在于肝细胞中,ALT主要存在于细胞浆,AST主要存在于细胞浆的线粒体,当细胞损伤时,ALT首先进入血液,若细胞损伤严重危及线粒体时,则AST进入血液,引起血液ALT和AST活性升高。本试验结果表明,添加枯草芽孢杆菌及其与苜蓿多糖联合使用对ALT和AST活性影响不大。血清TP、ALB、GLB、TBIL含量及ALB/GLB值也是衡量肝脏功能是否正常的关键指标。对于血清TP、ALB、GLB含量及ALB/GLB值,各试验组与对照组之间总体上没有大的差异;2(第3周)、3(第3、4周)、4(第3、4周) 组显著降低血清TBIL含量,提示添加枯草芽孢杆菌及其与苜蓿多糖联合使用未对肝脏造成不良影响。研究表明,饲粮中添加益生菌 (乳酸菌和芽孢杆菌) 和合生元 (益生菌+黄芪多糖) 对血清AST活性和TP含量无显著影响[30],这与本试验结果相一致。饲粮中添加枯草芽孢杆菌和枯草芽孢杆菌+苜蓿多糖可升高血清中GLU含量,且枯草芽孢杆菌+250 mg/kg苜蓿多糖组 (第2、3、4、8周) 和枯草芽孢杆菌+4 000 mg/kg苜蓿多糖组 (第3、4、8、20周) 显著高于枯草芽孢杆菌组。说明枯草芽孢杆菌和苜蓿多糖加强了糖原的分解或者促进了糖异生的发生,也可能与增强了肠道中淀粉酶等的活性有关。而李亚杰等[31]研究表明,肉鸡饲粮中添加益生菌 (芽孢杆菌、乳酸菌) 和合生元 (益生菌+黄芪多糖) 降低了血清GLU含量。本试验结果表明,添加枯草芽孢杆菌和苜蓿多糖对TG和CHOL的含量无显著影响,这与李亚杰等[31]的研究结果一致。另外,添加枯草芽孢杆菌及其与苜蓿多糖联合使用对UA、CREA含量影响不大,但显著降低了UREA含量,且枯草芽孢杆菌+250 mg/kg苜蓿多糖组 (2周) 和枯草芽孢杆菌+4 000 mg/kg苜蓿多糖组 (第8、20周) 显著低于枯草芽孢杆菌组。上述结果提示枯草芽孢杆菌和苜蓿多糖的添加一方面提高了饲料氮的利用,另一方面也说明了在一定程度上具有保护肾脏的作用,且两者具有协同作用。多糖与益生菌联合使用对血清UREA和UA含量等的影响鲜有报道,但Fallah等[32]饲喂雏鸵鸟屎肠球菌+低聚果糖+海藻糖可升高血清GLU含量,降低UA含量,提示苜蓿多糖可能也是一种潜在的益生元。
3.4 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡免疫功能的影响白细胞作为机体防御系统的一个重要组成部分,具有吞噬病原体、防御疾病等作用。廉新慧等[33]研究表明,益生菌 (芽孢杆菌、乳酸杆菌、双歧杆菌)+酵母多糖组显著提高10日龄海兰褐蛋鸡血液WBC数目,益生菌+黄芪多糖组显著提高40和50日龄海兰褐蛋鸡血液WBC数目,但益生菌组与对照组无显著差异。本试验研究表明,添加枯草芽孢杆菌及其与苜蓿多糖联合使用对提高血液WBC、LYB、MID、NEU数目有一定作用,且枯草芽孢杆菌+苜蓿多糖组MID (第1、3、4、8、12周) 和NEU (第1、3、4、8周) 数目显著高于枯草芽孢杆菌组。Hassaan等[34]报道添加地衣芽孢杆菌和酵母提取物可以显著提高WBC数目,且地衣芽孢杆菌+酵母提取物组WBC数目显著高于地衣芽孢杆菌组;对RBC和HGB数目有一定提高;对于HCT,2.4×105 CFU/g地衣芽孢杆菌+酵母提取物组显著低于对照组和地衣芽孢杆菌组,4.8×105 CFU/g地衣芽孢杆菌+酵母提取物组显著高于对照组和地衣芽孢杆菌组。而廉新慧等[33]研究表明,添加益生菌 (芽孢杆菌、乳酸杆菌、双歧杆菌) 和酵母多糖/黄芪多糖组对RBC数目无显著影响。本研究表明,添加枯草芽孢杆菌及其与苜蓿多糖联合使用对血液RBC、HGB数目和HCT影响效果不显著,但对PLT数目有一定提高。而Elzey等[35]报道血小板在免疫系统中也具有重要作用。此外,饲粮中添加枯草芽孢杆菌和苜蓿多糖提高了血清IgA (第1、16周)、IgG (第1、4周) 和IgM (第2、4、8周) 含量。免疫球蛋白是B细胞经抗原刺激后分化增殖产生的,参与补体激活及毒素的中和等途径,其含量高低反映机体免疫力的强弱。王晓慧[36]研究结果显示人参多糖联合植物乳杆菌C88可显著提高免疫抑制小鼠血清IgG的含量。邵丽玮[37]在蛋雏鸡饲粮中添加枯草芽孢杆菌+刺五加多糖显著提高了血清IgA、IgM和IgG的含量。本研究表明,枯草芽孢杆菌+苜蓿多糖组较枯草芽孢杆菌组有明显优势,表明苜蓿多糖联合枯草芽孢杆菌可增强体液免疫。
3.5 枯草芽孢杆菌及其与苜蓿多糖联合使用对蛋鸡粪和肠道微生物区系的影响本试验结果表明,饲粮中添加枯草芽孢杆菌及其与苜蓿多糖联合使用对降低粪和盲肠大肠杆菌数量、提高肠道乳酸菌和双歧杆菌数量有显著作用。胡美娟[38]研究表明,香菇多糖和植物乳杆菌C88的联合使用可显著提高乳杆菌和双歧杆菌数量,降低肠球菌、肠杆菌数量,有效改善小鼠肠道菌群,且优于单独使用植物乳杆菌C88。Li等[39]研究表明,添加益生菌 (乳酸菌和蜡样芽孢杆菌) 与合生元 (益生菌+黄芪多糖) 显著增加了21、42日龄回肠和盲肠乳酸菌和双歧杆菌数量,降低了大肠杆菌数量;且盲肠合生元组显著优于益生菌组;而回肠合生元组双歧杆菌数量显著高于益生菌组,大肠杆菌数量两组间无显著差异,21日龄回肠合生元组乳酸菌数量与益生菌组无显著差异,42日龄显著高于益生菌组。Calik等[40]研究表明,孵化过程中注射屎肠球菌+菊糖与出壳后饲喂均可增加21日龄盲肠乳酸菌数量,降低42日龄盲肠肠杆菌数量,且在21日龄时孵化中和出壳后均给予或仅在孵化中给予屎肠球菌+菊糖盲肠乳酸菌数量显著高于仅出壳后给予,提示动物本身的生理状态可能是影响合生元发挥调节微生物区系作用的原因之一。
4 结论① 饲粮中添加枯草芽孢杆菌及其与苜蓿多糖联合使用可以降低料蛋比,对提高产蛋率和蛋黄颜色有一定作用,但枯草芽孢杆菌与苜蓿多糖联合使用相较于枯草芽孢杆菌单独使用并未有更优的效果。
② 饲粮中添加枯草芽孢杆菌及其与苜蓿多糖联合使用可以改善血清生化及血常规指标;在一定程度上可以提高蛋鸡的免疫力,且联合使用效果有明显优势。
③ 饲粮中添加枯草芽孢杆菌及其与苜蓿多糖联合使用对粪和盲肠大肠杆菌数量有显著降低,可增加肠道双歧杆菌数量,降低盲肠大肠杆菌/乳酸菌值,改善肠道微生态环境,但联合使用与单独使用没有显著差异。
| [1] | LI Y, XU Q, HUANG Z, et al. Effect of Bacillus subtilis CGMCC 1.1086 on the growth performance and intestinal microbiota of broilers[J]. Journal of Applied Microbiology, 2016, 120(1): 195–204. DOI: 10.1111/jam.12972 |
| [2] | HATAB M H, ELSAYED M A, IBRAHIM N S. Effect of some biological supplementation on productive performance, physiological and immunological response of layer chicks[J]. Journal of Radiation Research and Applied Sciences, 2016, 9(2): 185–192. DOI: 10.1016/j.jrras.2015.12.008 |
| [3] | FAN G G, CHANG J, YIN Q Q, et al. Effects of probiotics, oligosaccharides, and berberine combinationson growth performance of pigs[J]. Turkish Journal of Veterinary and Animal Sciences, 2015, 39(6): 637–642. |
| [4] | PENG Q, ZENG X F, ZHU J L, et al. Effects of dietary Lactobacillus plantarum B1 on growth performance, intestinal microbiota, and short chain fatty acid profiles in broiler chickens[J]. Poultry Science, 2016, 95(4): 893–900. DOI: 10.3382/ps/pev435 |
| [5] | WANG X F, LI Y L, SHEN J, et al. Effect of Astragalus polysaccharide and its sulfated derivative on growth performance and immune condition of lipopolysaccharide-treated broilers[J]. International Journal of Biological Macromolecules, 2015, 76: 188–194. DOI: 10.1016/j.ijbiomac.2015.02.040 |
| [6] | DENG B, WANG Z P, TAO W J, et al. Effects of polysaccharides from mycelia of Cordyceps sinensis on growth performance, immunity and antioxidant indicators of the white shrimp Litopenaeus vannamei[J]. Aquaculture Nutrition, 2015, 21(2): 173–179. DOI: 10.1111/anu.2015.21.issue-2 |
| [7] | LI C, HUANG Q, FU X, et al. Characterization, antioxidant and immunomodulatory activities of polysaccharides from Prunella vulgaris Linn[J]. International Journal of Biological Macromolecules, 2015, 75: 298–305. DOI: 10.1016/j.ijbiomac.2015.01.010 |
| [8] | HE Z M, WANG X H, LI G F, et al. Antioxidant activity of prebiotic ginseng polysaccharides combined with potential probiotic Lactobacillus plantarum C88[J]. International Journal of Food Science & Technology, 2015, 50(7): 1673–1682. |
| [9] | SUN H, NI X Q, SONG X, et al. Fermented Yupingfeng polysaccharides enhance immunity by improving the foregut microflora and intestinal barrier in weaning Rex rabbits[J]. Applied Microbiology and Biotechnology, 2016, 100(18): 8105–8120. DOI: 10.1007/s00253-016-7619-0 |
| [10] | MURUGESAN G R, ROMERO L F, PERSIA M E. Effects of protease, phytase and a Bacillus sp. direct-fed microbial on nutrient and energy digestibility, ileal brush border digestive enzyme activity and cecal short-chain fatty acid concentration in broiler chickens[J]. PLoS One, 2014, 9(7): e101888. DOI: 10.1371/journal.pone.0101888 |
| [11] | RAWSKI M, KIEROŃCZYK B, DŁUGOSE J, et al. Dietary probiotics affect gastrointestinal microbiota, histological structure and shell mineralization in turtles[J]. PLoS One, 2016, 11(2): e0147859. DOI: 10.1371/journal.pone.0147859 |
| [12] | LEI X J, PIAO X S, RU Y J, et al. Effect of Bacillus amyloliquefaciens-based direct-fed microbial on performance, nutrient utilization, intestinal morphology and cecal microflora in broiler chickens[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(2): 239–246. |
| [13] | GALARZA-SEEBER R, LATORRE J D, WOLFENDEN A D, et al. Evaluation of Bacillus spp. as direct fed microbial (DFM) candidates for aflatoxin B1 biodegradation in broiler chickens[J]. International Journal of Probiotics & Prebiotics, 2016, 11(1): 29–36. |
| [14] | 辛小青, 董晓芳, 佟建明. 饲粮添加不同水平苜蓿粗多糖对蛋鸡生产性能和蛋品质的影响[J]. 动物营养学报, 2016, 28(8) :2465–2475. |
| [15] | GENG X, DONG X H, TAN B P, et al. Effects of dietary chitosan and Bacillus subtilis on the growth performance, non-specific immunity and disease resistance of cobia, Rachycentron canadum[J]. Fish & Shellfish Immunology, 2011, 31(3): 400–406. |
| [16] | FAN Y, YU X Q, XU L, et al. Synergy of microcapsule polysaccharides and Bacillus subtilis on the growth, immunity and resistance of sea cucumber Apostichopus japonicus against Vibrio splendidus infection[J]. Fisheries Science, 2013, 79(5): 807–814. DOI: 10.1007/s12562-013-0644-3 |
| [17] | GHASEMI H A, SHIVAZAD M, MIRZAPOUR REZAEI S S, et al. Effect of synbiotic supplementation and dietary fat sources on broiler performance, serum lipids, muscle fatty acid profile and meat quality[J]. British Poultry Science, 2016, 57(1): 71–83. DOI: 10.1080/00071668.2015.1098766 |
| [18] | KRUMBECK J A, MALDONADO-GOMEZ M X, MARTÍNEZ I, et al. In vivo selection to identify bacterial strains with enhanced ecological performance in synbiotic applications[J]. Applied and Environmental Microbiology, 2015, 81(7): 2455–2465. DOI: 10.1128/AEM.03903-14 |
| [19] | WANG X, HUANG M Y, YANG F, et al. Rapeseed polysaccharides as prebiotics on growth and acidifying activity of probiotics in vitro[J]. Carbohydrate Polymers, 2015, 125: 232–240. DOI: 10.1016/j.carbpol.2015.02.040 |
| [20] | 黄梅英. 菜籽多糖的提取、分离纯化及其对益生菌的增殖作用研究[D]. 硕士学位论文. 合肥: 合肥工业大学, 2013: 47-50. http://cdmd.cnki.com.cn/Article/CDMD-10359-1014113872.htm |
| [21] | AL-SULTAN S I, ABDEL-RAHEEM S M, EL-GHAREEB W R, et al. Comparative effects of using prebiotic, probiotic, synbiotic and acidifier on growth performance, intestinal microbiology and histomorphology of broiler chicks[J]. Japanese Journal of Veterinary Research, 2016, 64(Suppl.2): S187–S195. |
| [22] | 李树鹏. 黄芪多糖益生菌合生元对雏鸡生长和免疫作用的研究[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2005: 34-36. http://d.wanfangdata.com.cn/Thesis/Y753034 |
| [23] | 雷凯. 地衣芽孢杆菌对蛋鸡生产性能的影响及机理研究[D]. 博士学位论文. 杭州: 浙江大学, 2015: 32-34. http://d.wanfangdata.com.cn/Conference/7183213 |
| [24] | TANG S G H, SIEO C C, KALAVATHY R, et al. Chemical compositions of egg yolks and egg quality of laying hens fed prebiotic, probiotic, and synbiotic diets[J]. Journal of Food Science, 2015, 80(8): C1686–C1695. DOI: 10.1111/1750-3841.12947 |
| [25] | 王翠菊, 王洪芳, 陈辉, 等. 黄芪多糖对蛋鸡抗氧化性能和蛋品质的影响[J]. 动物营养学报, 2011, 23(2) :280–284. |
| [26] | AHMADI F, RAHIMI F. Factors affecting quality and quantity of egg production in laying hens:a review[J]. World Applied Sciences Journal, 2011, 12(3): 372–384. |
| [27] | FAN Y, ZHAO L H, JI C, et al. Protective effects of Bacillus subtilis ANSB060 on serum biochemistry, histopathological changes and antioxidant enzyme activities of broilers fed moldy peanut meal naturally contaminated with aflatoxins[J]. Toxins, 2015, 7(8): 3330–3343. DOI: 10.3390/toxins7083330 |
| [28] | BAI K W, HUANG Q, ZHANG J F, et al. Supplemental effects of probiotic Bacillus subtilis fmbJ on growth performance, antioxidant capacity, and meat quality of broiler chickens[J]. Poultry Science, 2017, 96(1): 74–82. DOI: 10.3382/ps/pew246 |
| [29] | LIU H W, DONG X F, TONG J M, et al. Alfalfa polysaccharides improve the growth performance and antioxidant status of heat-stressed rabbits[J]. Livestock Science, 2010, 131(1): 88–93. DOI: 10.1016/j.livsci.2010.03.004 |
| [30] | 李树鹏, 赵献军. 黄芪多糖、益生菌合生元对雏鸡生长和免疫的作用[J]. 中国农学通报, 2005, 21(6) :51–54, 57. |
| [31] | 李亚杰, 赵献军. 益生菌·黄芪多糖微胶囊制剂对肉仔鸡生长性能、免疫器官指数及血液生化指标的影响[J]. 安徽农业科学, 2007, 35(1) :100–103. |
| [32] | FALLAH R, FOSOUL S S A S, REZAEI H. Effect of synbiotic on performance and serum biochemical parameters of ostrich chicks[J]. Journal of Farm Animal Nutrition and Physiology, 2014, 9/1(1): 51–56. |
| [33] | 廉新慧, 李金敏, 谷巍. 益生菌和两种多糖合用对海兰褐蛋鸡疫功能影响的研究[J]. 家畜生态学报, 2012, 33(4) :73–77. |
| [34] | HASSAAN M S, SOLTAN M A, GHONEMY M M R. Effect of synbiotics between Bacillus licheniformis and yeast extract on growth, hematological and biochemical indices of the Nile tilapia (Oreochromis niloticus)[J]. The Egyptian Journal of Aquatic Research, 2014, 40(2): 199–208. DOI: 10.1016/j.ejar.2014.04.001 |
| [35] | ELZEY B D, TIAN J, JENSEN R J, et al. Platelet-mediated modulation of adaptive immunity:a communication link between innate and adaptive immune compartments[J]. Immunity, 2003, 19(1): 9–19. DOI: 10.1016/S1074-7613(03)00177-8 |
| [36] | 王晓慧. 人参多糖联合植物乳杆菌抗氧化及免疫调节活性研究[D]. 硕士学位论文. 长春: 吉林农业大学, 2015: 34-35. http://cdmd.cnki.com.cn/Article/CDMD-10193-1015963182.htm |
| [37] | 邵丽玮. 枯草芽孢杆菌-刺五加多糖合生元在蛋雏鸡日粮中的应用[D]. 硕士学位论文. 保定: 河北农业大学, 2015: 17-18. http://cdmd.cnki.com.cn/Article/CDMD-10086-1015392674.htm |
| [38] | 胡美娟. 香菇多糖联合益生菌改善小鼠肠道微生态的探究及产品研发[D]. 硕士学位论文. 吉林: 北华大学, 2015: 32-35. |
| [39] | LI S P, ZHAO X J, WANG J Y. Synergy of Astragalus polysaccharides and probiotics (Lactobacillus and Bacillus cereus) on immunity and intestinal microbiota in chicks[J]. Poultry Science, 2009, 88(3): 519–525. DOI: 10.3382/ps.2008-00365 |
| [40] | CALIK A, CEYLAN A, EKIM B, et al. The effect of intra-amniotic and posthatch dietary synbiotic administration on the performance, intestinal histomorphology, cecal microbial population, and short-chain fatty acid composition of broiler chickens[J]. Poultry Science, 2017, 96(1): 169–183. DOI: 10.3382/ps/pew218 |




