生长激素(GH)是腺垂体细胞分泌的肽类激素,是影响动物生长和发育的主要内源因素。类胰岛素生长因子(IGFs)分为类胰岛素生长因子-Ⅰ(IGF-Ⅰ)和类胰岛素生长因子-Ⅱ(IGF-Ⅱ)2种类型,是存在于血浆内的一类既有促生长作用又有胰岛素样作用的多肽。目前已阐明机体的生长是由GH/IGFs轴所控制,GH从垂体分泌后,通过GH受体的介导进而刺激肝脏和其他组织合成并分泌IGFs,后者通过IGFs受体的介导发挥生物学功能[1]。
棘腹蛙(Paa boulengeri)又名石坑、石蛙等,隶属于无尾目,蛙科,棘蛙属,是我国西部中高海拔区域特有的珍稀两栖动物[2-3]。由于环境污染、生态破坏等原因,野生棘腹蛙的规模日趋萎缩,现已被《中国濒危物种红皮书》[4]、《中国物种红色目录》[5]等收录。棘腹蛙目前市场需求旺盛,人工饲养的子二代出栏价达到45~70元/kg,其人工养殖已经成为山区农民脱贫致富的重要途径。为更好地保护野生资源,同时满足经济需求,棘腹蛙的人工养殖热度逐年上升。
本课题组前期对棘腹蛙的人工饲养条件进行探索时发现,温度过高或过低都会影响其生长发育,而温度对GH/IGFs轴的影响尤为明显。对棘腹蛙的遗传特性研究发现棘腹蛙种群属于一个单系分支[6-7],在进化过程中相对独立[8-9],并无其他模式物种的相关数据可以参考。本研究拟从转录组测序获得的信息入手,克隆GH/IGFs轴的关键基因(IGF-Ⅰ、IGF-Ⅱ和GH)并对其进行生物信息学分析,深入了解其基因特性,发掘物种特异性的潜在功能作用位点,为探索以棘腹蛙为代表的两栖动物的生理反应和生长发育调节机制奠定理论基础。
1 材料与方法 1.1 试剂与耗材2岁龄健康棘腹蛙,饲养于重庆珍稀濒危水产资源保护与开发研究中心两栖动物流水养殖系统。Trizol、焦碳酸二乙酯(DEPC)购自上海生工生物工程有限公司,cDNA合成试剂盒、Taq酶、PCR纯化试剂盒购自Promega公司,凝胶回收试剂盒购自Omega公司,DL2000 DNA Marker购自宝生物工程(大连)有限公司。
1.2 引物设计与合成基因序列主要基于前期本实验室建立的棘腹蛙蝌蚪的Illumina solexa第二高通量转录组数据库,利用实时荧光定量PCR(RT-qPCR)分别获取了棘腹蛙GH、IGF-Ⅰ、IGF-Ⅱ的全长基因序列,并经过比对验证其序列与转录组数据结果一致。最后,利用Primer 5.0软件设计基因的特异性引物,所用引物如表 1所示,由苏州金唯智生物科技有限公司合成。
|
|
表 1 引物设计 Table 1 Primer design |
取双毁髓法处死的棘腹蛙肝脏,立即放入液氮中。随后总RNA按照试剂盒说明书进行提取,并利用Promega公司的cDNA合成试剂盒说明书完成单链cDNA(ss cDNA)的制备。
1.4 序列克隆与测定利用高保真DNA Taq酶进行PCR扩增,RT-qPCR反应体系为:cDNA模板1 μL、10×Ex Taq PCR buffer 2.5 μL、Ex Taq 0.65 U、dNTP(100 μmol/L)1 μL、MgCl2 1 μL、上游引物1 μL、下游引物1 μL,加ddH2O至总体积25 μL。PCR反应程序:1)94 ℃预变性4 min;2)94 ℃变性90 s;3)58 ℃退火90 s;4)72 ℃延伸90 s;5) 将步骤2~4重复循环30次;6)72 ℃终延伸10 min;7)12 ℃保存。最后,PCR产物经1%琼脂糖凝胶电泳进行检测后切取与基因长度一致的片段,经TaKaRa凝胶回收试剂盒纯化后连接pMD 19-T载体,并转化至大肠杆菌(E. coli)JM109感受态细胞中,利用蓝白斑筛选阳性质粒,经双酶切验证后送苏州金唯智生物科技有限公司测序。
1.5 生物信息学分析 1.5.1 遗传多态性分析方法在NCBI数据库中检索GH、IGF-Ⅰ、IGF-Ⅱ的同源序列,利用ClustalX 1.83软件进行多重序列比对和Boxshade Server序列对齐,最后结果由Photoshop CS6进行处理。
1.5.2 遗传进化分析在GenBank数据库中检索近缘物种序列,利用ClustalW对齐后,利用MEGA 5.0软件对GH、IGF-Ⅰ、IGF-Ⅱ同源基因以邻近(neighbor-joining)法构建系统进化树,取1 000次重复检验以估算各分支的置信值。
1.5.3 蛋白质结构分析首先利用Phyre2软件(http://www.sbg.bio.ic.ac.uk/)检索蛋白质模型,然后使用Swiss-model server软件(https://swissmodel.expasy.org/)预测目的蛋白质的三维结构,最后采用Swiss-Pdb-viewer软件进行图像处理和蛋白质结构还原。
2 结果与分析 2.1 IGF-Ⅰ的序列特征分析以2岁龄棘腹蛙肝脏组织cDNA为模板进行IGF-Ⅰ的基因扩增(图 1-A)及测序(图 1-B),并将棘腹蛙IGF-Ⅰ与已发布的2种蟾蜍的近缘基因进行比较,发现前者保守的功能结构域存在较多的氨基酸位点突变(图 1-C)。

|
A:棘腹蛙IGF-Ⅰ的基因扩增;B:棘腹蛙IGF-Ⅰ的序列分析;C:已知两栖动物的IGF-Ⅰ遗传多态性分析。NP_001156865.1注释为非洲爪蟾IGF-Ⅰ;XP_002936875.1注释为热带爪蟾IGF-Ⅰ;IGF__1-like-Pb注释为棘腹蛙IGF-Ⅰ。黄色表示棘腹蛙IGF-Ⅰ潜在功能分化位点。 A: the gene amplification of IGF-Ⅰ from Paa boulengeri; B: the sequence analysis of IGF-Ⅰ from Paa boulengeri; C: the genetic polymorphism analysis of IGF-Ⅰ from known amphibians. NP_001156865.1 represents for IGF-Ⅰ from Xenopus laevis; XP_002936875.1 represents for IGF-Ⅰ from Xenopus tropicalis; IGF__1-like-Pb represents IGF-Ⅰfrom Paa boulengeri. The potential differentiation amino acid sites of IGF-Ⅰ from Paa boulengeri are shadowed in yellow. 图 1 棘腹蛙IGF-Ⅰ序列特征分析 Figure 1 The sequence characteristic analysis of IGF-Ⅰ form Paa boulengeri |
取不同代表物种IGF-Ⅰ进行聚类分析并构建系统进化树(图 2),发现IGF-Ⅰ主要分为两大支,一支为高等哺乳动物,一支为爬行动物、鸟类和两栖动物;其中,棘腹蛙IGF-Ⅰ与无尾目两栖动物、部分水栖性爬行动物聚为一支,与其他陆生脊椎动物近缘,说明棘腹蛙IGF-Ⅰ与两栖类模式动物爪蟾IGF-Ⅰ存在较大程度的遗传分化。值得注意的是,扬子鳄IGF-Ⅰ有3个拷贝,其中2个拷贝与鸟纲近缘,另1个拷贝与中华鳖单独聚为一支,与缅甸蟒蛇和龟壳花蛇近缘,推测脊椎动物的IGF-Ⅰ可能是由原始的爬行两栖动物起源而来。
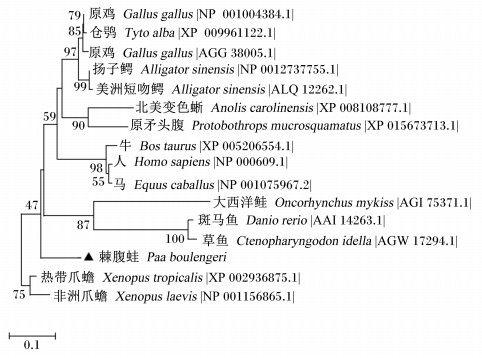
|
图 2 棘腹蛙IGF-Ⅰ的聚类分析 Figure 2 The clustering analysis of IGF-Ⅰ form Paa boulengeri |
为深入分析棘腹蛙IGF-Ⅰ的蛋白质结构,我们利用Swiss-model server软件进行结构预测,如图 3所示。相较于人类IGFs蛋白质结构3lri.1A[10]而言,两者序列相似度达84.6%。其氨基酸序列中,氨基酸31~48处存在1个跨膜域,氨基酸51~109处为IGF-Ⅰ-like superfamily功能结构域。IGF-Ⅰ的蛋白质结构成分主要由2个β折叠和4个α螺旋构成,且两端存在未知功能区域,其中THR52、LEU53、PHE72、PHE73、SER74为物种特异的氨基酸突变位点,暗示该蛋白质存在一定功能分化。
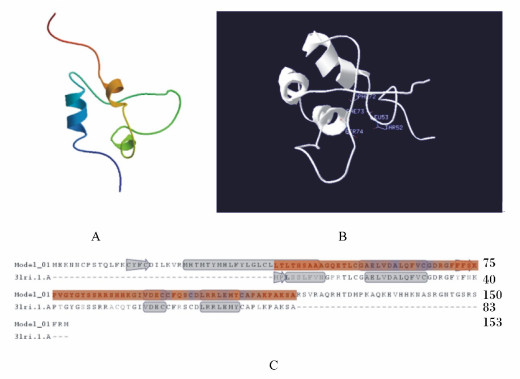
|
A:棘腹蛙IGF-Ⅰ的蛋白质三维结构分析;B:棘腹蛙IGF-Ⅰ的特异功能结合位点预测;C:棘腹蛙IGF-Ⅰ与人类IGFs模板3lri.1.A[10]的蛋白质构象差异分析。 A: the 3D protein structure analysis of IGF-Ⅰ from Paa boulengeri; B: the specific functional target prediction of IGF-Ⅰ from Paa boulenger; C: the protein conformation difference analysis between IGF-Ⅰ from Paa boulengeri and the IGFs template 3lri.1.A from human beings[10]. 图 3 棘腹蛙IGF-Ⅰ的蛋白质结构分析 Figure 3 The protein structure analysis of IGF-Ⅰ from Paa boulengeri |
扩增棘腹蛙的IGF-Ⅱ基因并测序,利用ClustalX 1.83软件对其遗传多态性进行分析,结果如图 4所示。其氨基酸序列中,氨基酸54~114处为IGF-Ⅱ的功能结构域,氨基酸147~204处为IGF-Ⅱ的C端功能结构域,暗示该基因可能主要参与棘腹蛙的免疫防御。与非洲爪蟾和热带爪蟾2种已知的两栖模式动物相比,棘腹蛙IGF-Ⅱ的拷贝数明显减少,并且该基因的N端呈简缩进化趋势,且其功能结构域呈现插入突变,说明棘腹蛙IGF-Ⅱ的功能分化较为明显。

|
A:棘腹蛙IGF-Ⅱ的基因扩增;B:棘腹蛙IGF-Ⅱ的序列分析;C:已知两栖动物的IGF-Ⅱ遗传多态性分析。XP_012816009、XP_012816008、NP_001107144、OCA36474.1注释为热带爪蟾IGF-Ⅱ;NP_001085129、AAH72153.1、NP_001082128、AAH70545.1注释为非洲爪蟾IGF-Ⅱ;IGF-2-Pb.aa注释为棘腹蛙IGF-Ⅱ。黄色表示棘腹蛙IGF-Ⅱ潜在功能分化位点,红色下划线表示N端功能分化区域。 A: the gene amplification of IGF-Ⅱ from Paa boulengeri; B: the sequence analysis of IGF-Ⅱ from Paa boulengeri; C: the genetic polymorphism analysis of IGF-Ⅱ from known amphibians. NP_001085129, AAH72153.1, NP_001082128 and AAH70545.1 are stand for IGF-Ⅱ from Xenopus laevis; XP_012816009, XP_012816008, NP_001107144 and OCA36474.1 are stand for IGF-Ⅱ from Xenopus tropicalis; GF-2-Pb.aa represents IGF-Ⅱfrom Paa boulengeri. The potential differentiation amino acid sites of IGF-Ⅱ from Paa boulengeri are shadowed in yellow, and the N terminal differentiation region is underline in red. 图 4 棘腹蛙IGF-Ⅱ序列特征分析 Figure 4 The sequence characteristic analysis of IGF-Ⅱ form Paa boulengeri |
棘腹蛙IGF-Ⅱ同源序列的系统进化分析结果(图 5)显示,整个进化树分为三大支,一支为高等哺乳动物类,一支为两栖动物类,另一支则包括硬骨鱼、陆生动物及部分鸟类,说明IGF-Ⅱ基因的进化相对保守。
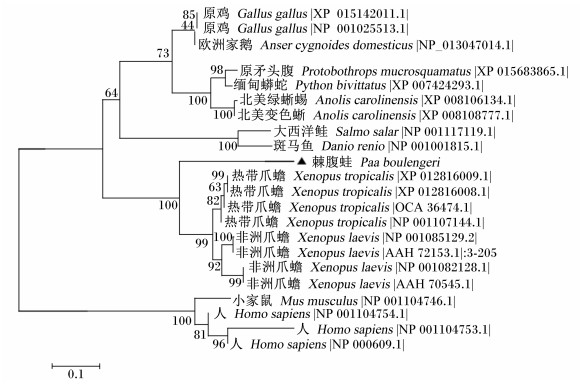
|
图 5 棘腹蛙IGF-Ⅱ的聚类分析 Figure 5 The clustering analysis of IGF-Ⅱ from Paa boulengeri |
利用Swiss-model server软件模拟IGF-Ⅱ蛋白质的三维结构,结果显示,其与棘腹蛙IGF-Ⅰ蛋白质的结构类似,主要由6个α螺旋构成,其中TYR81、LYS82、LYS83存在特异的氨基酸位点突变,暗示该蛋白质在物种进化过程中存在一定的功能分化。
对比IGF-Ⅰ和IGF-Ⅱ作用位点和结合方式差异的预测,我们利用PDB-Viewer还原了这2种蛋白质的蛋白质骨架,如图 3-A和图 6-A所示,黄色部分为IGF-Ⅰ和IGF-Ⅱ作用位点相同的区域,结果二者仅有3处区域有明显差异,其蛋白质修饰方式的对比显示所有差异位点均位于功能结合区域(图 3-B和图 6-B),随后对二者功能差异位点的比对结果显示二者差异部分有2处为IGFs保守的功能结构域,其中一处为棘腹蛙IGF-Ⅰ特异的功能区域。由此可知,深入挖掘IGFs的功能对于研究棘腹蛙生理代谢的物种特异性具有重大意义。
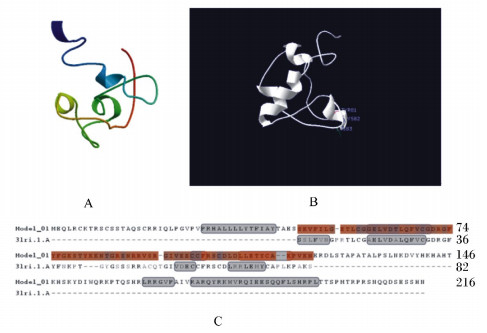
|
A:棘腹蛙IGF-Ⅱ的蛋白质三维结构分析;B:棘腹蛙IGF-Ⅱ的特异功能结合位点预测;C:棘腹蛙IGF-Ⅱ与人类IGFs模板3lri.1.A[10]的蛋白质构象差异分析。 A: the 3D protein structure analysis of IGF-Ⅰ from Paa boulengeri; B: the specific functional target prediction of IGF-Ⅰ from Paa boulenger; C: the protein conformation difference analysis between IGF-Ⅰ from Paa boulengeri and the IGFs template 3lri.1.A from human beings[10]. 图 6 棘腹蛙IGF-Ⅱ的蛋白质结构分析 Figure 6 The protein structure analysis of IGF-Ⅱ from Paa boulengeri |
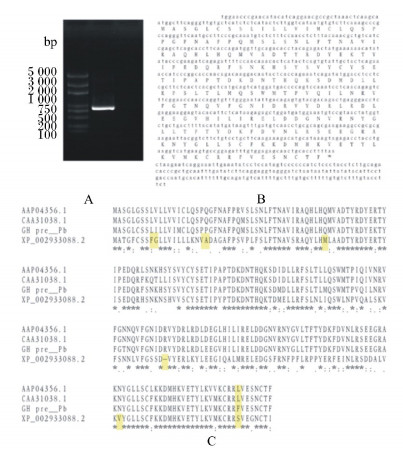
通过克隆测序(图 7-A),获得了棘腹蛙GH基因序列(图 7-B)。遗传多态性分析结果发现棘腹蛙GH与已知的两栖动物同源基因存在较少的氨基酸位点突变,并且其中大多数为同义氨基酸突变,对其功能结构影响不大(图 7-C)。
|
A:棘腹蛙GH的扩增;B:棘腹蛙GH的序列分析;C:已知两栖动物的GH遗传多态性分析。XP_002933088.2注释为热带爪蟾GH;AAP4356.1和CAA31038.1注释为牛蛙GH;GH pre__Pb注释为棘腹蛙GH。黄色表示棘腹蛙GH潜在功能分化区域。 A: the gene amplification of GH from Paa boulengeri; B: the sequence analysis of GH from P. boulengeri; C: the genetic polymorphism analysis of GH from known amphibians. AAP4356.1 and CAA31038.1 both stand for GH from Rana catesbeiana; XP_012816009 and XP_002933088.2 both stand for GH from Xenopus tropicalis; GH pre__Pb stand for GH from Paa boulengeri. The potential differentiation amino acid sites of GH from Paa boulengeri are shadowed in yellow. 图 7 棘腹蛙GH的序列特征分析 Figure 7 The sequence characteristic analysis of GH form Paa boulengeri |
与GH同源基因进行系统进化树聚类分析,结果如图 8所示。棘腹蛙的GH与牛蛙近缘,并与草鱼、斑马鱼和淡水鳇等水生动物单独聚为一支,暗示水生动物GH具有共同的祖先,鸟类与陆生动物聚为一支,高等哺乳动物单独聚为一支,证实了棘腹蛙GH基因的进化相对保守。

|
图 8 棘腹蛙GH的聚类分析 Figure 8 The clustering analysis of GH from Paa boulengeri |
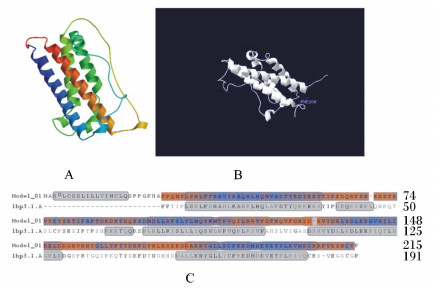
对棘腹蛙GH蛋白质结构进行分析,结果如图 9所示。棘腹蛙GH具有典型的Hormone_1结构域(图 9-C),属于典型的4-螺旋细胞因子(4-helix cytokines)(图 9-A)。其中,PHE208与模式脊椎动物相比为突变位点(图 9-B和图 9-C),而与两栖模式动物相比则相对保守,说明棘腹蛙GH功能结构域相对保守。
|
A:棘腹蛙GH的蛋白质三维结构分析;B:棘腹蛙GH的特异功能结合位点预测;C:棘腹蛙GH与人类GH模板1bp3.1.A[11]的蛋白质构象差异分析。 A: the 3D protein structure analysis of GH from Paa boulengeri; B: the specific functional target prediction of IGF-Ⅰ from Paa boulenger; C: the protein conformation difference analysis between GH from Paa boulengeri and the GH template 1bp3.1.A from human beings[11]. 图 9 棘腹蛙GH的蛋白质结构分析 Figure 9 The protein structure of GH from Paa boulengeri |
在GH-IGFs轴中,GH处于上游位置,而IGFs则处于下游位置[12]。GH-IGFs轴的作用并不单一,是由多种因子和多种调控模式组成了GH合成与分泌的调控网络[13]。GH/IGF-Ⅰ轴作为调控机体生长发育的主线[14],其信号转递通路主要是通过启动2条信号传递链,即磷酯酰肌醇-3激酶(PI3-K)激活途径和丝裂原活化蛋白激酶(MAPK)激酶激活途径,把有丝分裂和代谢信号传递到细胞核内,从而启动IGFs分泌,促进细胞增殖、分化以及抑制细胞的凋亡。IGF-Ⅰ与其受体结合后,首先导致胰岛素底物-1(IRS-1) 磷酸化,IRS-1被磷酸化后,PI3-K和生长因子结合蛋白2(Grb2) 才能够与其结合,由此启动2条信号传递链。一条途径是PI3-K被激活并形成磷酸化磷酸肌醇(PIP3),PIP3就是细胞生长的信号,且PIP3途径是抑制细胞凋亡的最经典途径。另一条途径是激活细胞外信号调节激酶(ERK),ERK把信号传递到细胞核内启动有丝分裂[15]。也就是说,IGF-Ⅰ一方面通过增加细胞的有丝分裂来促进机体的生长,另一方面则通过抑制细胞的凋亡来促进机体的生长。
目前针对两栖动物GH功能的报道较少,在仅有的部分早期研究中发现,两栖动物变态前外源GH可刺激其幼体——蝌蚪的生长且在幼体的生长发育(尤其是肢的生长)中发挥特殊的作用[16]。外源性GH能促进蟾蜍幼体的生长,也能促进牛蛙幼体下肢的生长[17]。在蝌蚪发育的后期,血液中内源性GH水平会不断升高[16]。但内源性GH在两栖动物幼体生长、发育和变态中的确切作用仍然没有相应的报道。本研究针对棘腹蛙内源GH、IGF-Ⅰ和IGF-Ⅱ进行分析,结果发现三者与已知两栖模式生物相比均存在较多氨基酸突变位点,说明其存在一定程度的功能分化。遗传进化树聚类分析显示,与已知两栖模式动物相比,棘腹蛙IGF-Ⅰ和IGF-Ⅱ均存在特异的物种分化趋势,而GH的进化则相对保守。蛋白质结构分析显示,与人类IGFs相比,棘腹蛙IGF-Ⅰ存在5处功能作用位点的分化区域,IGF-Ⅱ存在3处功能作用位点的分化区域;而棘腹蛙GH与模式脊椎动物GH相比,则仅有PHE208处存在氨基酸突变,说明该氨基酸位点对于棘腹蛙的功能分化具有重要研究价值。值得注意的是,该位点在两栖动物中则相对保守,暗示PHE208是两栖动物与高等哺乳动物功能分化的氨基酸位点。
综上所述,尽管功能结构域和遗传进化特征相对保守,但棘腹蛙IGF-Ⅰ的THR52、LEU53、PHE72、PHE73、SER74,IGF-Ⅱ的TYR81、LYS82、LYS83以及GH的PHE208为潜在的功能作用位点和结合位点。鉴于本课题组前期研究发现GH/IGFs轴易受到温度影响,导致棘腹蛙蝌蚪无法变态甚至死亡,成蛙生长异常。因此,本研究为揭示温度如何介导GH/IGFs轴代谢机制进而调控棘腹蛙生长发育筛选了分子靶标,并为今后棘腹蛙优质品种选育提供理论依据。
4 结论棘腹蛙GH/IGFs轴的主要基因相对保守,但与已知模式物种相比,存在潜在的功能分化位点,可作为后期棘腹蛙GH/IGFs轴功能研究和遗传进化特征分析的分子靶标。
| [1] | POLLAK M. The insulin and insulin-like growth factor receptor family in neoplasia:an update[J]. Nature Reviews Cancer, 2012, 12(3): 159–169. |
| [2] | 费梁, 叶昌媛, 黄永昭, 等. 中国两栖动物检索及图解[M]. 成都: 四川科学技术出版社, 2005: 137-139. |
| [3] | YAN F, ZHOU W W, ZHAO H T, et al. Geological events play a larger role than Pleistocene climatic fluctuations in driving the genetic structure of Quasipaa boulengeri (Anura: Dicroglossidae)[J]. Molecular Ecology, 2013, 22(4): 1120–1133. DOI: 10.1111/mec.12153 |
| [4] | 汪松, 赵尔宓. 中国濒危动物红皮书(两栖类和爬行类)[M]. 北京: 科学出版社, 1998: 80-83. |
| [5] | 汪松, 解焱. 中国物种红色名录:第1卷:红色目录[M]. 北京: 高等教育出版社, 2004: 1-224. |
| [6] | SHAN X, XIA Y, ZHENG Y C, et al. The complete mitochondrial genome of Quasipaa boulengeri (Anura:Dicroglossidae)[J]. Mitochondrial DNA, 2014, 25(2): 83–84. DOI: 10.3109/19401736.2013.782023 |
| [7] | XIA Y, HU L J, SHAN X, et al. Isolation and characterization of eleven polymorphic tetranucleotide microsatellite loci for Quasipaa boulengeri (Anura:Dicroglossidae)[J]. Conservation Genetics Resources, 2013, 5(1): 5–7. DOI: 10.1007/s12686-012-9716-4 |
| [8] | YUAN S Q, XIA Y, ZHENG Y C, et al. Development of microsatellite markers for the spiny-bellied frog Quasipaa boulengeri (Anura:Dicroglossidae) through transcriptome sequencing[J]. Conservation Genetics Resources, 2014, 7(1): 229–231. |
| [9] | QING L Y, XIA Y, ZHENG Y C, et al. A de novo case of floating chromosomal polymorphisms by translocation in Quasipaa boulengeri (Anura, Dicroglossidae)[J]. PLoS One, 2012, 7(10): e46163. DOI: 10.1371/journal.pone.0046163 |
| [10] | LAAJOKI L G, FRANCIS G L, WALLACE J C, et al. Solution structure and backbone dynamics of long-[J]. The Journal of Biological Chemistry, 2000, 275(14): 10009–10015. DOI: 10.1074/jbc.275.14.10009 |
| [11] | SOMERS W, ULTSCH M, DE VOS A M, et al. The X-ray structure of a growth hormone-prolactin receptor complex[J]. Nature, 1994, 372(6505): 478–481. DOI: 10.1038/372478a0 |
| [12] | PERRINI S, LAVIOLA L, CARREIRAM M C, et al. The GH/IGF1 axis and signaling pathways in the muscle and bone:mechanisms underlying age-related skeletal muscle wasting and osteoporosis[J]. Journal of Endocrinology, 2010, 205(3): 201–210. DOI: 10.1677/JOE-09-0431 |
| [13] | CANOSA L F, CHANG J P, PETER R E. Neuroendocrine control of growth hormone in fish[J]. General and Comparative Endocrinology, 2007, 151(1): 1–26. DOI: 10.1016/j.ygcen.2006.12.010 |
| [14] | BARTKE A. Impact of reduced insulin-like growth factor-1/insulin signaling on aging in mammals:novel findings[J]. Aging Cell, 2008, 7(3): 285–290. DOI: 10.1111/j.1474-9726.2008.00387.x |
| [15] | JONES J I, CLEMMONS D R. Insulin-like growth factors and their binding proteins:biological actions[J]. Endocrine Reviews, 2002, 16(1): 3–34. |
| [16] | MCLEAN E, DONALDSON E M.The role of growth hormone in the growth of poikilotherms[M]//SCHREIBMAN M.The endocrinology of growth, development, and metabolism in vertebrates.Amsterdam:Elsevier, 1993:43-71. |
| [17] | KIKUYAMA S, KAWAMURA K, TANAKA S, et al. Aspects of amphibian metamorphosis: hormonal control[J]. International Review of Cytology, 1993, 145: 105–148. DOI: 10.1016/S0074-7696(08)60426-X |




