黄颡鱼属淡水杂食性鱼类,味道鲜美、无肌间刺,且因其雄鱼生长快于雌鱼,全雄黄颡鱼成了养殖户重点养殖对象。有关黄颡鱼蛋白质、氨基酸营养需求方面的研究已经取得了一定进展,对瓦氏黄颡鱼的蛋白质及精氨酸(Arg)、赖氨酸(Lys)的研究结果显示,饲料蛋白质水平在42.9%~43.5%[1],其幼鱼Arg需要量在2.38%~2.74%[2],Lys最适需要量为2.61%[3]。由于Arg、Lys二者同为碱性氨基酸,共用转运载体,人们对二者间吸收利用的关系一直关注。目前,在对虹鳟[4-5]、大西洋鲑[6-7]的研究中发现二者存在明显的拮抗作用,在对鳖[8]及大菱鲆[9]的研究中发现高水平的Lys对Arg存在拮抗作用。但有关饲料中不同精氨酸与赖氨酸配比(Arg/Lys)对全雄黄颡鱼生长性能等的影响尚未见报道。本试验通过在饲料中设定不同Arg/Lys,探讨其对全雄黄颡鱼生长性能、体组成、血清生化指标及氨基酸沉积率的影响,为完善全雄黄颡鱼的营养需求参数、科学配制黄颡鱼饲料提供依据。
1 材料与方法 1.1 试验设计参照前期试验及相关文献[2-3],将对照组(Ⅰ组)饲料Arg/Lys设定为2.19/2.61(%/%,下同);Ⅱ组饲料Arg、Lys水平均低于对照组20%,饲料Arg/Lys设定为1.74/2.08;Ⅲ组饲料Arg水平低于对照组20%、Lys水平高于对照组20%,饲料Arg/Lys设定为1.75/3.02;Ⅳ组饲料Arg水平高于对照组20%、Lys水平低于对照组20%,饲料Arg/Lys设定为2.63/2.08;Ⅴ组饲料Arg、Lys水平均高于对照组20%,饲料Arg/Lys设定为2.64/3.12;Ⅵ组饲料Arg水平高于对照组40%、Lys水平不变,饲料Arg/Lys设定为3.07/2.61;Ⅶ组饲料Arg水平不变、Lys水平高于对照组40%,饲料Arg/Lys设定为2.19/3.65;Ⅷ组水平Arg、Lys水平均高于对照组40%,饲料Arg/Lys设定为3.08/3.65。
1.2 试验饲料以鱼粉、膨化大豆、豆粕、菜籽粕和晶体氨基酸作为主要蛋白质源,以豆油、大豆卵磷脂为主要脂肪源,并补充矿物质、维生素配制出基础饲料。按照试验设计,在基础饲料中添加不同水平的晶体Arg和晶体Lys,以晶体甘氨酸(Gly)作为等氮替代物配制试验饲料。试验饲料组成及营养水平见表 1。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of trial diets (air-dry basis) |
试验原料经粉碎、过筛后,按照饲料配方配料混匀,加入豆油和大豆卵磷脂,最后加水,手工搓匀,用F-26型颗粒饲料挤条机加工成粒径为2 mm硬颗粒饲料,自然晾干后,破碎,过筛,-20 ℃冰箱中备用。
1.3 试验分组与饲养管理全雄黄颡鱼购自扬州市董氏特种水产有限公司,增氧运输至养殖温室,暂养1周。挑选体质健壮、反应敏捷、平均体重为(2.34±0.05) g的个体960尾,随机分成8组,每组4个重复,每个重复30尾,以重复为单位放养于200 L圆形水族箱中。每天06:00和16:00投喂至表观饱食,记录投料量。试验全程遮光,采用微循环换水,水温24~28 ℃,间隙式增氧,溶氧浓度维持在5 mg/L以上,试验期为70 d。
1.4 样品采集与分析试验结束后,禁食24 h,分别对每个桶的试验鱼进行计数、称重。每桶随机抽取5尾鱼,保存于-20 ℃冰箱中,用于全鱼常规营养成分分析;每桶另随机取10尾鱼,从胸鳍至尾鳍剥离肌肉,保存于-20 ℃冰箱中,用于肌肉常规营养成分分析;每桶再随机取2尾鱼,用1 mL注射器从尾静脉取血,转移至1.5 mL离心管中,4 ℃静置过夜后4 000 r/min离心10 min,取上清,用于血清生化指标的测定。
每个养殖桶的饲料和鱼样(包括全鱼和肌肉)分析2次确定其常规营养成分含量。饲料、全鱼及肌肉中水分含量采用常压干燥法测定,粗蛋白质含量采用全自动凯氏定氮仪(FOSS Kjeltec 8400,丹麦)测定;粗脂肪含量采用鲁氏抽提法测定,粗灰分含量采用高温灼烧法测定,具体测定步骤参照张丽英等[10]所述并加以改进。饲料及全鱼氨基酸组成采用博纳艾杰尔公司推出的Venusil氨基酸分析方法进行测定,分析仪器为日本岛津公司的Prominence LC-10AD高效液相色谱仪。
1.5 指标计算初重(IBW,g)=试验前鱼体总重/尾数;
末重(FBW,g)=试验后鱼体总重/尾数;
增重率(WGR,%)=100×(末重-初重)/初重;
特定生长率(SGR,%)=100×(ln末重-ln初重)/饲喂天数;
饲料系数(FCR)=采食饲料重(g)/鱼体增重(g);
蛋白质效率(PER)=鱼体增重(g)/采食蛋白质量(g);
存活率(SR,%)=100×存活尾数/初始尾数;
某氨基酸沉积率(%,鲜样基础)=100×(鱼体增重×全鱼中该氨基酸百分含量)/(饲料消耗量×饲料中该氨基酸百分含量)。
1.6 统计分析用Excel 2013对数据进行整理,采用SPSS 18.0进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行组间的多重比较,显著性水平为P < 0.05。数据表示为平均值±标准差(mean±SD)。
2 结果与分析 2.1 饲料Arg/Lys对全雄黄颡鱼生长性能的影响由表 2可知,各组试验鱼存活率、蛋白质效率无显著差异(P>0.05);增重率在Ⅵ组达到最大,除与Ⅴ组差异不显著(P>0.05) 外,显著高于其他各组(P < 0.05);末重、增重、特定生长率也在Ⅵ组达到最大,除与Ⅳ、Ⅴ组差异不显著(P>0.05) 外,显著高于其他各组(P < 0.05);Ⅱ组的饲料系数显著高于其他各组(P < 0.05),其他各组无显著差异(P>0.05)。
|
|
表 2 饲料Arg/Lys对全雄黄颡鱼生长性能的影响 Table 2 Effects of dietary Arg/Lys on growth performance of all-male yellow catfish |
由表 3可知,血清谷丙转氨酶(ALT)、谷草转氨酶(AST)活性及总蛋白(TP)、白蛋白(ALB)、球蛋白(GLOB)、葡萄糖(GLU)、尿素氮(UN)、总胆固醇(TC)、甘油三酯(TG)含量与白球比(A/G)各组之间均无显著差异(P>0.05)。
|
|
表 3 饲料Arg/Lys对全雄黄颡鱼血清生化指标的影响 Table 3 Effects of dietary Arg/Lys on serum biochemical indices of all-male yellow catfish |
由表 4可知,各组全鱼水分、粗脂肪、粗灰分含量及肌肉粗蛋白质、粗脂肪含量差异均不显著(P>0.05)。全鱼粗蛋白质含量在Ⅵ组达到最高,且显著高于Ⅱ、Ⅲ组(P < 0.05),但与Ⅰ组差异不显著(P>0.05)。肌肉水分含量以Ⅶ组最高,显著高于其他各组(P < 0.05),以Ⅰ组最低,显著低于Ⅳ、Ⅵ、Ⅶ组(P < 0.05),其他各组间差异不显著(P>0.05)。
|
|
表 4 饲料Arg/Lys对全雄黄颡鱼全鱼和肌肉常规营养成分的影响(鲜样基础) Table 4 Effects of dietary Arg/Lys on proximate nutrients in whole body and muscle of all-male yellow catfish (fresh sample basis) |
肌肉干物质中粗蛋白质与粗脂肪含量的关系如图 1所示,由回归方程(y=-0.658 5x+65.206,R2=0.750 5) 可知,肌肉干物质中粗脂肪与粗蛋白质含量呈显著负相关(P < 0.05)。
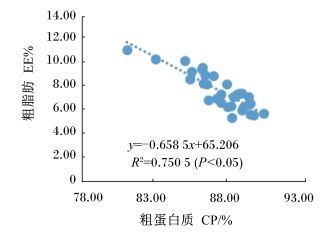
|
图 1 肌肉干物质中粗脂肪与粗蛋白质含量的关系 Figure 1 Relationship between EE and CP contents in DM of muscle |
由表 5可知,Ⅱ组的Arg沉积率最高,显著高于其他各组(P < 0.05),其次是Ⅳ组,除与Ⅵ组差异不显著(P>0.05) 外,显著高于剩余的各组(P < 0.05),Ⅷ组最低,显著低于其他各组(P < 0.05);Ⅳ组的Lys沉积率最高,显著高于其他各组(P < 0.05),其次是Ⅱ、Ⅵ、Ⅶ组,显著高于剩余的各组(P < 0.05),Ⅰ、Ⅲ组则较低,显著低于其他各组(P < 0.05)。Ⅳ组的必需氨基酸(EAA)沉积率最高,除与Ⅵ组差异不显著(P>0.05) 外,显著高于其他各组(P < 0.05),Ⅱ组最低,其与Ⅲ组均显著低于其他各组(P < 0.05);Ⅵ组的非必需氨基酸(NEAA)沉积率最高,除与Ⅳ组差异不显著(P>0.05) 外,显著高于其他各组(P < 0.05),而Ⅲ、Ⅶ组则较低,显著低于其他各组(P < 0.05)。
|
|
表 5 饲料Arg/Lys对全雄黄颡鱼氨基酸沉积率的影响(鲜样基础) Table 5 Effects of dietary Arg/Lys on amino acid deposition rates of all-male yellow catfish (fresh sample basis) |
饲料Arg/Lys比值与全雄黄颡鱼EAA及总氨基酸(TAA)沉积率的关系见图 2。由图 2可知,全雄黄颡鱼Lys(图 2-a)、Val沉积率(图 2-f)与饲料Arg/Lys比值呈线性关系,并随着Arg/Lys比值的增大而增加;而全雄黄颡鱼Arg(图 2-b)、苏氨酸(Thr)(图 2-c)、蛋氨酸(Met)(图 2-d)、苯丙氨酸(Phe)(图 2-e)、亮氨酸(Leu)(图 2-g)、组氨酸(His)(图 2-h)、异亮氨酸(Ile)(图 2-i)、EAA(图 2-j)、TAA沉积率(图 2-k)与饲料Arg/Lys比值呈二次回归关系,当Arg/Lys比值分别为0.98、1.16、1.17、1.02、1.28、1.11、1.24时,Arg、Thr、Met、Phe、Leu、His、Ile沉积率达到最大值。
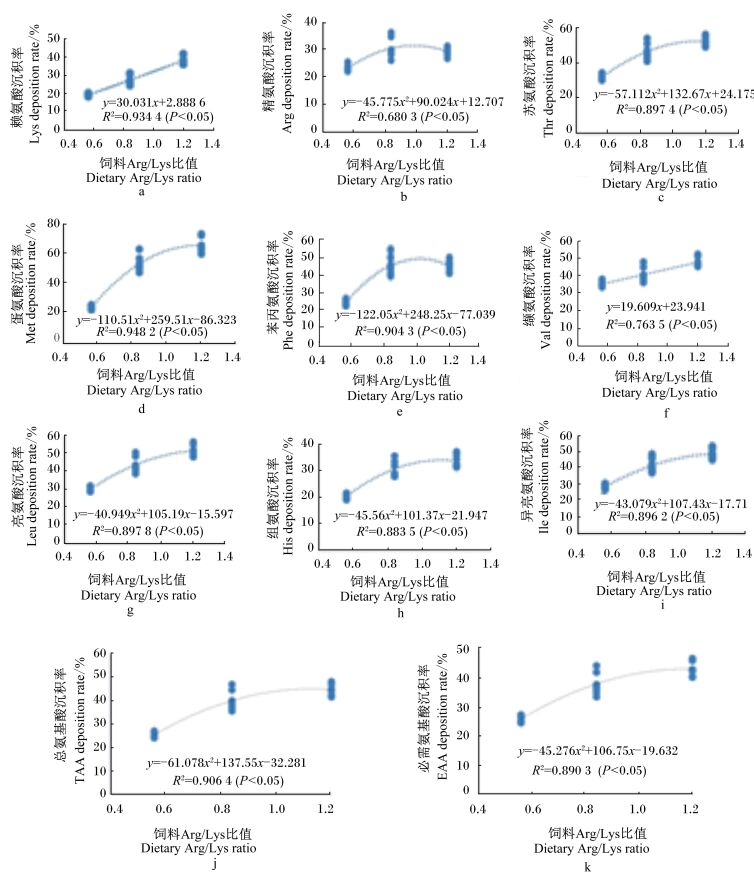
|
图 2 饲料Arg/Lys比值与全雄黄颡鱼及总氨基酸沉积率的关系 Figure 2 Relationship between dietary Arg/Lys value and EAA and TAA deposition rates |
鱼类生长性能与饲料Arg、Lys水平息息相关。因为Arg、Lys是鱼类限制性氨基酸,当饲料中二者水平未达到鱼类最低需求量时,直接导致饲料中氨基酸不平衡,体内的营养物质则会通过代谢提供能量,进而影响其生长[11]。本试验中也有类似现象,饲料Arg、Lys水平较低时,严重影响全雄黄颡鱼的生长。但随着饲料中Arg、Lys水平的增加,全雄黄颡鱼的生长出现了明显的改善,说明饲料Arg、Lys的水平增加至适宜水平时,对全雄黄颡鱼的生长具有促进作用;但Lys添加过量时,对全雄黄颡鱼的生长反而有抑制作用,在亚洲鲈鱼[12]、日本鲈鱼[13]、草鱼[14]、印度鲤鱼[15]和虹鳟[16]上也有相似报道。这主要是因为过量的Lys引起饲料中氨基酸的不平衡,加重多余氨基酸的脱氨基作用,含氮部分以氨、尿素和三甲胺等形式排出体外,不含氮部分分解成水和二氧化碳,以能量形式释放,从而影响其生长[7]。
Lys和Arg同为碱性氨基酸,在消化、吸收和吸收后的代谢过程中存在竞争抑制[17],过多的Lys会减少机体对Arg的吸收利用。代伟伟等[9]在大菱鲆的研究中发现饲料中Lys和Arg对其生长及饲料利用存在拮抗作用。而本试验中,饲料Arg、Lys水平较低时,二者不同配比对全雄黄颡鱼的生长及饲料利用并未呈现出显著差异;在此基础上将Arg、Lys的水平均上调20%时,随着Lys水平的升高,全雄黄颡鱼的生长呈下降趋势,说明二者间的相互作用与饲料中二者的水平相关,且随着Lys水平的增加,其对Arg的拮抗作用越明显。
Zhou等[18]在黑鲷鱼的研究中发现,与对照组相比,饲料中添加不平衡的Arg、Lys组的生长性能会显著降低。本试验中,从生长和饲料利用方面来看,当饲料Arg/Lys为3.07/2.61时为最适宜配比,改变Arg或者Lys水平,全雄黄颡鱼的生长性能均出现下降。其原因可能是全雄黄颡鱼的生长性能是受Arg、Lys共同影响的,当Arg/Lys为3.07/2.61时,饲料中氨基酸配比达到平衡状态,进而促进鱼体对饲料中营养物质的吸收,而改变Arg或Lys的添加量时,饲料中氨基酸平衡被打破,从而减缓其生长。
3.2 饲料Arg/Lys对全雄黄颡鱼血清生化指标的影响鱼类血液指标与机体代谢、营养水平、健康状况及免疫功能密切相关[19]。在血清生化指标中,血清中的UN含量与氮沉积形成蛋白质的量呈负相关,UN含量越高,表明净蛋白质合成率越低、氨基酸分解代谢率越高[20]。Fico等[21]在虹鳟鱼的研究中发现,在氨基酸不平衡的饲料中,其营养物质特别是氨基酸不会被有效利用,会导致其额外产生能量进行脱氮和排泄。Berge等[6]和Tantikitti等[22]发现氨基酸不平衡的饲料会使血液中的UN含量升高。在本试验中,Lys添加过量或Arg/Lys比值较低时(Ⅲ组、Ⅶ组)血清中UN含量较高,说明饲料中添加过量的Lys或当Arg/Lys比值过低会导致饲料中营养物质不平衡,从而不能被有效的利用。
正常情况,因为细胞膜的屏障作用,血液中AST和ALT的活性较低,但是当细胞病变或者受损时,其活性会升高[23]。而在本试验中,在饲料中同时添加高水平Arg和Lys的组(Ⅶ组)血清ALT活性最高,说明过高水平的Arg、Lys对全雄黄颡鱼肝细胞有损伤,这与在团头鲂[24]上得出的研究结果一致。
血清中TP含量反映机体营养状况和代谢水平,GLOB则是由B细胞转化为浆细胞后分泌而成,其含量反映机体的抵抗力[25]。Zhou等[26]在对南美白对虾的研究中发现,Arg可以提高血清中TP和GLOB的含量,利于蛋白质的合成。在本试验中,饲料中Arg、Lys水平较低时,血清TP和GLOB含量随着Arg/Lys比值的增大而升高,而当Arg、Lys水平较高时,血清TP和GLOB含量则随着Arg/Lys比值的增大先升高后降低。其原因是精氨酸酶活性受鸟氨酸的负反馈调节,Lys是精氨酸酶的抑制剂[27],而鱼体内精氨酸酶活性随着饲料中Arg水平的增加而升高,因此当Arg水平提高时,精氨酸酶活性增加[28],负反馈调节和抑制剂的作用均受到限制,从而提高机体免疫力。
在本试验中,饲料中Arg/Lys对全雄黄颡鱼的血清各生化指标的影响均不显著,这可能与采样时间有关,因鱼类自身调节能力很强,在饥饿24 h后各项生化指标均已处于饥饿时的平衡状态。因此,在今后试验中需找准采取血样的时间,改进试验方案。
3.3 饲料Arg/Lys对全雄黄颡鱼体组成的影响饲料Arg、Lys水平均能影响鱼体组成。代伟伟等[9]在大菱鲆的研究中发现,鱼体粗蛋白质含量主要受Lys水平的影响,且随着Lys水平的升高而显著升高。而Alam等[29]在牙鲆上的研究发现,鱼体粗蛋白质、粗脂肪、水分和粗灰分含量受饲料中Arg水平的显著影响。本试验中,饲料Arg/Lys对全鱼粗脂肪、粗灰分和水分含量均无显著影响,但对全鱼粗蛋白质含量的影响显著,且主要受Arg水平的影响。这可能与Arg是鱼类的必需氨基酸,饲料中Arg水平过低会导致饲料营养物质失衡,从而直接影响鱼体蛋白质的合成有关[27]。
Lys作为鱼类第一限制性氨基酸,是左旋肉碱的前身,为β-长链脂肪酰基氧化线粒体的运输起着重要的作用[30],能减少鱼体内脂肪的沉积。本试验中鱼体肌肉水分含量及肌肉干物质中粗蛋白质、粗脂肪含量主要受饲料Lys水平的影响,且随着饲料Lys水平的升高,肌肉粗脂肪含量逐渐降低而其粗蛋白质含量则逐渐升高。产生该结果的主要原因是,随着饲料Lys水平的升高,鱼体用于供能的蛋白质会减少,从而利于机体蛋白质的合成,在其他鱼类[31]上也有类似发现。
3.4 饲料Arg/Lys对全雄黄颡鱼氨基酸沉积率的影响鱼体氨基酸的沉积率与饲料氨基酸水平及氨基酸平衡状态有关。周小秋等[8]在对鳖的研究中发现,高水平的Lys与Arg之间存在拮抗效应。这种拮抗效应在黄颡鱼相关研究中同样有所体现。本试验中,饲料Arg/Lys不仅影响着Arg、Lys在鱼体内的沉积,还影响其他EAA、NEAA的沉积。饲料Arg、Lys水平较低或较高时对全雄黄颡鱼体氨基酸的沉积率均呈现同种趋势,随着饲料Arg/Lys比值的增大,大部分氨基酸的沉积率呈现先上升后降低的趋势,说明饲料中添加高水平的Lys时,在一定Arg/Lys比值范围内,Arg水平也需要相应增加。经二次回归曲线分析,当饲料中Arg/Lys比值分别为0.98、1.16、1.17、1.02、1.28、1.11、1.24时,Arg、Thr、Met、Phe、Leu、His、Ile沉积率达到最大值。除此之外,当Arg/lys比值为0.98时,Arg沉积率达到最大,Lys和Val沉积率随着Arg/Lys比值的增大而增加,并呈线性关系,说明饲料中Arg水平适宜时可以改善饲料中由于Lys水平过高导致的氨基酸不平衡所带来的负面影响。这主要是因为在高Lys水平的饲料中添加Arg可以重新提升肝脏精氨酸酶mRNA的表达量,促使Arg分解生成鸟氨酸,并在鸟氨酸脱羧酶(ODC)、精眯合成酶、精胺合成酶的作用下生成多胺,其在细胞生长、增殖分化中起重要作用[32],因而能改善鱼体的生长性能,影响鱼体中氨基酸的沉积。这也是Arg沉积率相对其他EAA提前达到最大值的原因。Lys沉积率随着Arg/Lys比值的增大呈线性关系,主要是因为饲料中Lys水平不同造成的。而当饲料Arg与Lys水平不同但Arg/Lys比值相同时似乎对氨基酸的沉积率没有影响,可能原因是当二者比值相同时,Arg和Lys之间的相互作用会达到一个相对平衡状态。当Arg/Lys比值约为1.20时,其EAA和TAA的沉积率最高,这与全雄黄颡鱼生长性能及鱼体营养成分相一致,说明在此配比下,饲料营养平衡且二者拮抗作用最小。在陆生动物的研究中发现,Lys能够刺激或抑制Arg吸收取决于它们的相对浓度[28],说明饲料中Arg/Lys比值超过一定范围后Lys与Arg的拮抗作用较大。这是因为Lys是精氨酸酶的抑制剂,能从转录水平进行调控影响Arg的代谢与利用,从而影响着Arg及其他氨基酸在体内的沉积[32]。
4 结论① 饲料Arg/Lys影响全雄黄颡鱼的生长性能,且当Arg/Lys为3.07/2.61时,生长性能最好。
② 饲料Arg/Lys影响全雄黄颡鱼的体组成,且当Arg/Lys为3.07/2.61时,全鱼粗蛋白质含量最高。
③ 饲料Arg/Lys对全雄黄颡鱼血清生化指标无显著影响。
④ 饲料Arg/Lys影响全雄黄颡鱼的氨基酸沉积率,饲料中适宜的Arg/Lys比值为1.02~1.28。
⑤ 建议全雄黄颡鱼饲料中Arg/Lys为3.07/2.61。
| [1] | 孙翰昌, 徐敬明. 日粮蛋白质水平对瓦氏黄颡鱼生长性能的影响[J]. 中国饲料, 2009(16) :30–32. DOI: 10.3969/j.issn.1004-3314.2009.16.012 |
| [2] | ZHOUQ, JINM, ELMADAZ C, 等. 饲料中不同精氨酸水平对黄鲶幼鱼(黄颡鱼)生长、免疫力以及抗嗜水气单胞菌能力的影响[J]. 饲料博览, 2015(2) :46. |
| [3] | 邱红, 黄文文, 候迎梅, 等. 黄颡鱼幼鱼的赖氨酸需要量[J]. 动物营养学报, 2015, 27(10) :3057–3066. DOI: 10.3969/j.issn.1006-267x.2015.10.010 |
| [4] | KAUSHIK S J, FAUCONNEAU B. Effects of lysine administration on plasma arginine and on some nitrogenous catabolites in rainbow trout[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1984, 79(3): 459–462. DOI: 10.1016/0300-9629(84)90546-2 |
| [5] | KAUSHIK S J, FAUCONNEAU B, TERRIER L, et al. Arginine requirement and status assessed by different biochemical indices in rainbow trout (Salmo gairdneri R[J]. Aquaculture, 1988, 70(1/2): 75–95. |
| [6] | BERGE G E, LIED E, SVEIER H. Nutrition of Atlantic salmon (Salmo salar):the requirement and metabolism of arginine[J]. Comparative Biochemistry and PhysiologyPart A:Physiology, 1997, 117(4): 501–509. DOI: 10.1016/S0300-9629(96)00410-0 |
| [7] | BERGE G E, SVEIER H, LIED E. Nutrition of Atlantic salmon (Salmo salar); the requirement and metabolic effect of lysine[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1998, 120(3): 477–485. DOI: 10.1016/S1095-6433(98)10049-1 |
| [8] | 周小秋, 杨凤, 周安国, 等. 鳖赖氨酸和精氨酸拮抗研究[J]. 四川农业大学学报, 2003, 21(2) :157–160. |
| [9] | 代伟伟, 麦康森, 徐玮, 等. 饲料中赖氨酸和精氨酸含量对大菱鲆幼鱼生长、体成分和肌肉氨基酸含量的影响[J]. 水产学报, 2015, 39(6) :876–887. |
| [10] | 张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007. |
| [11] | LANGAR H, GUILLAUME J, METAILER R, et al. Augmentation of protein synthesis and degradation by poor dietary amino acid balance in European sea bass (Dicentrarchus labrax)[J]. The Journal of Nutrition, 1993, 123(10): 1754–1761. |
| [12] | MURILLO-GURREA D P, COLOSO R M, BORLONGAN I G, et al. Lysine and arginine requirements of juvenile Asian sea bass (Lates calcarifer)[J]. Journal of Applied Ichthyology, 2001, 17(2): 49–53. DOI: 10.1046/j.1439-0426.2001.00242.x |
| [13] | MAI K S, ZHANG L, AI Q H, et al. Dietary lysine requirement of juvenile Japanese seabass, Lateolabrax japonicus[J]. Aquaculture, 2006, 258(1/2/3/4): 535–542. |
| [14] | WANG S, LIU Y J, TIAN L X, et al. Quantitative dietary lysine requirement of juvenile grass carp Ctenopharyngodon idella[J]. Aquaculture, 2005, 249(1/2/3/4): 419–429. |
| [15] | AHMED I, KHAN M A. Dietary lysine requirement of fingerling Indian major carp, Cirrhinus mrigala (Hamilton)[J]. Aquaculture, 2004, 235(1/2/3/4): 499–511. |
| [16] | CHENG Z J, HARDY R W, USRY J L. Effects of lysine supplementation in plant protein-based diets on the performance of rainbow trout (Oncorhynchus mykiss) and apparent digestibility coefficients of nutrients[J]. Aquaculture, 2003, 215(1/2/3/4): 255–265. |
| [17] | 王镜岩, 朱圣庚, 徐长法. 生物化学(下册)[M]. 3版. 北京: 高等教育出版社, 2007: 303-314. |
| [18] | ZHOU F, SHAO Q J, XIAO J X, et al. Effects of dietary arginine and lysine levels on growth performance, nutrient utilization and tissue biochemical profile of black sea bream, Acanthopagrus schlegelii, fingerlings[J]. Aquaculture, 2011, 319(1/2): 72–80. |
| [19] | 周玉, 郭文场, 杨振国, 等. 鱼类血液学指标研究的进展[J]. 上海水产大学学报, 2001, 10(2) :163–165. |
| [20] | URSCHEL K L, SHOVELLER A K, UWIERA R R E, et al. Citrulline is an effective arginine precursor in enterally fed neonatal piglets[J]. The Journal of Nutrition, 2006, 136(7): 1806–1813. |
| [21] | FICO M E, HASSAN A S, MILNER J A. The in uence of excess lysine on urea cycle operation and pyrimidine biosynthesis[J]. The Journal of Nutrition, 1982, 112(10): 1854–1861. |
| [22] | TANTIKITTI C, CHIMSUNG N. Dietary lysine requirement of freshwater catfish (Mystus nemurus Cuv. & Val.)[J]. Aquaculture Research, 2001, 32: 135–141. DOI: 10.1046/j.1355-557x.2001.00011.x |
| [23] | 杜强, 林黑着, 牛津, 等. 卵形鲳鲹幼鱼的赖氨酸需求量[J]. 动物营养学报, 2011, 23(10) :1725–1732. DOI: 10.3969/j.issn.1006-267x.2011.10.012 |
| [24] | 廖英杰, 刘波, 任鸣春, 等. 赖氨酸对团头鲂幼鱼生长、血清生化及游离必需氨基酸的影响[J]. 水产学报, 2013, 37(11) :1716–1724. |
| [25] | AFFONSO E G, DA COSTA SILVA E, TAVARES-DIAS M, et al. Effect of high levels of dietary vitamin C on the blood responses of matrinxã (Brycon amazonicus)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2007, 147(2): 383–388. |
| [26] | ZHOU Q C, ZENG W P, WANG H L, et al. Dietary arginine requirement of juvenile Pacific white shrimp, Litopenaeus vannamei[J]. Aquaculture, 2012, 364-365: 252–258. DOI: 10.1016/j.aquaculture.2012.08.020 |
| [27] | 周凡, 邵庆均. 水产动物精氨酸需求的研究进展[J]. 广东饲料, 2007, 16(2) :26–27. |
| [28] | BERGE G E, BAKKE-MCKELLEP A M, LIED E. In vitro uptake and interaction between arginine and lysine in the intestine of Atlantic salmon (Salmo salar)[J]. Aquaculture, 1999, 179(1/2/3/4): 181–193. |
| [29] | ALAM D S, TESHIMA S I, ISHIKAWA M, et al. Effects of dietary arginine and lysine levels on growth performance and biochemical parameters of juvenile Japanese flounder Paralichthys olivaceus[J]. Fisheries Science, 2002, 68(3): 509–516. DOI: 10.1046/j.1444-2906.2002.00455.x |
| [30] | TANPHAICHITR V, BROQUIST H P. Lysine defificiency in the rat:concomitant impairment in carnitine biosynthesis[J]. The Journal of Nutrition, 1973, 103(1): 80–87. |
| [31] | 褚武英, 石常友, 刘臻, 等. 鱼类碱性氨基酸需求研究进展[J]. 内陆水产, 2008, 33(1) :42–43. |
| [32] | 周凡. 饲料赖氨酸和精氨酸对黑鲷幼鱼生长影响及其拮抗作用机理研究[D]. 博士学位论文. 杭州: 浙江大学, 2011. |




