近年来排放到大气中的氨气不断增加,其中畜牧养殖排放的氨气是主要来源[1]。据欧洲环境安全局2010年统计,在全球氨气的排放中,牲畜的氨气排放量占39%,其中猪的氨气排放占25%。氨具有强烈的刺激气味,对动物的黏膜产生刺激可引发多种炎症,并通过引起黏膜细胞快速生长和代谢,造成氧和能量的需要增高,而氨的解毒过程是一个高度耗能的过程,这样动物用于生长和生产的能量就相应减少,从而降低了猪的生长性能[2]。氨自呼吸道吸入,经肺泡进入血液,与血红蛋白结合,使血红素变为正铁血红素,降低血红蛋白的携氧能力、血液碱储和血红素的氧化能力,进而出现贫血和组织缺氧,机体对疾病的抵抗力下降;另外氨也会影响免疫细胞的应答,降低动物的免疫力[3]。减少动物体内氨的产生是最有效的减少氨排放及污染的方法。因此全面了解猪内源氨的机制和研究内源氨营养调控机制具有重要意义。
1 猪肠道内氨的产生猪内源性氨是指猪体内产生的氨。肠道是氨的主要来源,肝脏为氨的主要转化场所,而肾脏为氨及其代谢产物尿素的排泄器官[4]。内源氨在体内的产生及循环过程见图 1[5]。肠道是氨的主要来源,肠道的功能状态直接影响氨的产生和吸收,氨在肠道中主要以铵离子(NH4+)形式和氨气的形式存在[6]。饲粮蛋白质在肠道被消化酶降解成氨基酸,部分氨基酸被吸收进入肠道上皮细胞中经联合脱氨基作用下产氨[7](图 1)。部分未被吸收的氨基酸经肠腔微生物脱氨与脱羧作用和尿素酶分解尿素产生氨。
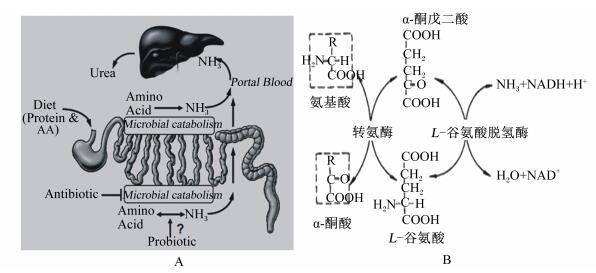
|
Diet:饲粮;Protein & AA:蛋白质和氨基酸;Mucosal catabolism:黏膜分解代谢;Microbial catabolism:微生物分解代谢;Antibiotic:抗生素;Amino Acid:氨基酸;Probiotic:益生菌;NH3:氨;Portal Blood:门静脉血;Urea:尿素;NADH:还原型烟酰胺腺嘌呤二核苷酸nicotinamide adenine dinucleotide-reduced; H+:氢离子。 图 1 内源氨在体内的产生及循环过程(A)与氨基酸的联合脱氨基作用(B) Figure 1 Production and circulation processes of endogenous ammonia in body (A) and trans-deamination procession of amino acids (B)[5, 7] |
饲粮中的蛋白质进入肠道后,在胰腺分泌的胰蛋白酶、胰糜蛋白酶以及小肠分泌的氨基肽酶及二肽酶的作用下,水解为氨基酸。氨基酸经过联合脱氨基作用产生氨气。猪摄入的蛋白质中仅有14%作为养分被保留在体内[8]。肠道内主要降解蛋白质的细菌种属有拟杆菌属、丙酸菌属、梭菌属、链球菌属、乳杆菌属等[9]。未被消化吸收的饲粮蛋白质或其水解产物氨基酸在肠道细菌腐败作用下产生大量的腐败产物(胺、氨、酚、吲哚、H2S等)。
1.2 肠道微生物产氨肠道微生物在体内产生氨的过程除了降解蛋白质产生氨,也能直接通过还原脱氨、水解脱氨以及减饱和脱氨、脱羧等作用生产氨。另外微生物还可以直接产生脲酶,分解体内的尿素进而产生氨。体内的一些微生物也可以通过脱羧作用产生氨。研究发现摩根氏菌属、肠杆菌、克雷伯氏菌、发光细菌等的组氨酸脱羧酶的作用很大;肠杆菌科、弧菌科和假单胞菌具有很强的鸟氨酸脱羧酶或赖氨酸脱羧酶的作用[10-11]。
1.3 体内谷氨酰胺的脱酰氨基作用产氨体内谷氨酰胺的来源比较广泛,在大脑、肌肉、肾脏以及肠道均不同程度的存在(图 2[12]),其中最容易导致动物出现氨中毒的是大脑和肠道中的氨。谷氨酰胺产生氨的途径主要是谷氨酰胺通过磷酸化谷氨酰胺酶的脱酰氨基作用产生谷氨酸、核苷酸、氨气和能量。此过程主要受磷酸化谷氨酰胺酶的影响。磷酸化谷氨酰胺酶主要有2种类型,肝脏型的磷酸化谷氨酰胺酶及肾脏型磷酸化谷氨酰胺酶。James等[13]研究发现,超过80%磷酸化谷氨酰胺酶存在于小肠中,15%的磷酸化谷氨酰胺酶存在于大肠中。磷酸化谷氨酰胺酶的活性受胰岛素以及血管紧张素Ⅱ的调控。研究发现,胰岛素及血管紧张素Ⅱ能够增强磷酸化谷氨酰胺酶的活性,进而导致氨增加,损害脑组织及肝脏的功能[14]。当肝脏受损害或者脑部组织受损时,磷酸化谷氨酰胺酶的活性会增加,Romero-Gómez等[15]在小肠中的十二指肠测得的磷酸化谷氨酰胺酶活性时发现,与正常人相比,肝硬化病人的磷酸化谷氨酰胺酶活性比正常人高4倍。因此猪肝脏与肾脏的健康状况直接影响体内氨的产生。
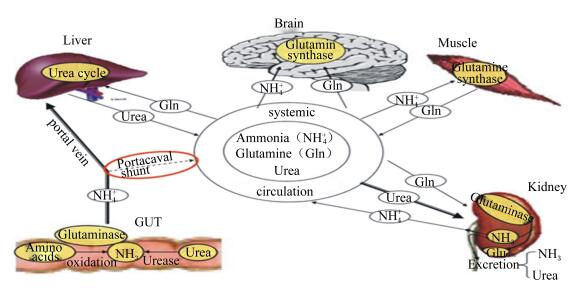
|
Ammonia (NH4+):氨(铵离子);Glutamine (Gln):谷氨酰胺;Urea:尿素;sysitemic circulation:系统循环;Brain:大脑;Glutamine synthase:谷氨酰胺合成酶;Liver:肝脏;Urea cycle:尿素循环;Muscle:肌肉;Kidney:肾脏;NH3:氨;Excretion:排放;Gut:肠道;protal vein:门静脉;Amino acids:氨基酸;oxidation:氧化;Urease:尿素酶。 图 2 谷氨酰胺在体内产氨的过程 Figure 2 Production process of ammonia from glutamine in body[12] |
正常情况下肝脏合成的尿素有15%经肠黏膜分泌入肠腔。肠道细菌有尿素酶,可将尿素水解成为二氧化碳(CO2)和氨,这一部分氨约占肠道产氨总量的90%。肠道中的氨可被吸收入血液,其中3/4的吸收部位在结肠,其余部分在空肠和回肠。氨入血后可经门脉入肝,重新合成尿素。这个过程称为尿素的肠肝循环(图 3)。
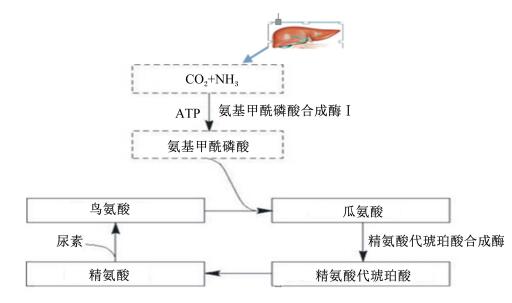
|
图 3 尿素的肠肝循环 Figure 3 Enterohepatic circulation of urea[7] |
肠道中氨重吸收入血液的程度决定于肠道内容物的pH,肠道内pH低于6时,肠道内氨生成NH4+,随粪便排出体外;肠道内pH高于6时,肠道内氨吸收入血液。正常机体内只有少量游离的氨。正常血液中氨的来源包括组织代谢产生的氨和肠道微生物产生的氨。机体组织中的氨基酸经过联合脱氨作用脱氨产生部分血液氨;肾小管上皮细胞中谷氨酰胺水解也会产生部分血液氨。肠道未被消化蛋白质腐败和细菌分解尿素产生的氨吸收进入血液。血液中氨大部分进入肝脏合成尿素,而血液中保持较低水平[16]。当血液中氨的产生与清除保持动态平衡时,机体就能正常运行。一旦平衡被破坏就会发生异常。高血液氨的根本原因是氨产生增多或氨清除减少[17]。肝脏疾病时由于肝脏通过合成尿素来清除氨的能力减退,以致来自肠道的氨不经肝脏解毒直接进入体内循环,最终导致血液中氨浓度升高。血液中氨浓度增高时,过多的氨将会干扰脑细胞能量代谢,引起脑组织能量不足,影响神经递质的产生和神经递质间的平衡,从面使兴奋性递质减少或抑制性递质增加。盛大平等[18]研究发现患各型病毒性肝炎、肝门胆管癌、肝癌与健康的人血液中氨浓度相比正常人显著增高。
3 猪内源氨营养调控措施 3.1 降低饲粮蛋白质水平猪对蛋白质的利用率受多种因素的影响,主要包括饲粮蛋白质的消化率、氨基酸组成以及饲粮氨基酸的平衡和动物的需要量[19]。50多年前,科学家就提出了理想蛋白质的概念。目前国内主要参考美国NRC标准和我国猪饲养标准,而这2种标准采用的饲粮的蛋白质水平都高于猪实际需要量。在实际生产中,为了追求最快生长速度,最大利益化,过高饲粮蛋白质水平也造成了蛋白质过量,过量的蛋白质会随粪尿排出,最终被脲酶降解产生氨[20]。Galassi等[21]通过研究低蛋白质和高纤维饲粮对猪的生长性能、养分消化率、氮沉积以及氨排放的影响,得出在满足饲粮氨基酸平衡和适宜能量载体物质平衡的条件下,适当降低饲粮的饲粮蛋白质水平可以减少氮排放。该试验分为对照组(中性洗涤纤维水平为114 g/kg,粗蛋白质水平为120 g/kg)、高纤维组(中性洗涤纤维水平为193 g/kg,粗蛋白质水平为122 g/kg)、高纤维低蛋白质组(中性洗涤纤维水平为176 g/kg,粗蛋白质水平为98 g/kg,满足必需氨基酸需要量和能量载体物质平衡)以及高纤维低蛋白质组(中性洗涤纤维水平175 g/kg,粗蛋白质水平为99 g/kg,满足必需氨基酸和适宜能量载体物质平衡,额外添加10 g/kg的膨润土)。结果表明,与比高纤维组和高蛋白质组相比,2个低蛋白质饲粮组未影响猪的平均日增重、料重比及屠宰性能,每天尿氮的排放量分别降低了8和6 g,粪氮排放量也显著降低。Hansena等[22]研究发现与标准组(粗蛋白质水平为169 g/kg)相比,氨基酸平衡的低蛋白质组(粗蛋白质水平为136 g/kg)猪的生长情况、饲料利用率以及瘦肉率未受影响,但平均每天每头猪氨排放量减少了1.8 g,粪氮排放量降低了14%,猪粪的pH显著降低(6.85 vs. 7.42)。Shi等[23]通过不同蛋白质水平对生长猪氨基酸消化率与氮排放量研究发现,与NRC标准蛋白质水平相比,氨基酸平衡的低蛋白质饲粮显著降低了氨氮的排放量的10%。Ball等[24]研究也得出过类似的结论。Hansen等[25]和Philippe等[26]均发现每千克饲粮中减少10 g粗蛋白质,在满足必需氨基酸需要量和适宜能量载体物质平衡的情况下,可以降低7%~15%氨的排放量。黄健等[27]发现,满足必需氨基酸需要量和适宜能量载体物质平衡的情况下,在NRC基础上降低粗蛋白质3~4个百分点可以显著减少氨排放量的26.55%~57.85%。总之,满足必需氨基酸需要量和适宜能量载体平衡的情况下适当降低蛋白质水平,不影响猪生长的情况,同时可以降低氨的排放。
降低饲粮蛋白质水平可降低氨排放量主要的机制在于:参照NRC标准及我国的饲养标准,蛋白质饲料的添加是过量的。过多的蛋白质不能被猪利用,被肠道微生物脲酶分解产生氨。低蛋白质饲粮模式下,部分尿氮可转换成了粪氮,最终导致氨的排放量减少;氨基酸平衡的低蛋白质饲粮有助于降低尿和粪中的pH和微生物氮分解代谢相关酶的活性[27]。微生物脲酶是分解尿氮产生氨的关键酶。脲酶活性受pH的影响,当pH>7.4,脲酶活性升高,分解产生氨氮量增加。实际生产中设计配方时,满足必需氨基酸需要量和能量载体适宜的情况下可以降低饲粮中的蛋白质水平。在NRC(2012) 推荐量的基础上降低蛋白质水平的2~4个百分点,对猪的生长性能没有影响,同时可以显著降低氨排放量。但降低超过4个百分点,会影响动物的生长性能[28]。英国动物科学学会(BSAS)考虑猪的不同生理阶段给出了蛋白质需要量(表 1[29])。
|
|
表 1 不同生理阶段猪的蛋白质需要量 Table 1 Requirements of protein for pigs at different physiologic stages[29] |
植物提取物中目前应用较多的主要是丝兰提取物、樟科提取物以及中草药等。丝兰属提取物属于龙舌兰科,其活性成分主要是皂角苷,他可以抑制体内脲酶的活性,减少尿素的分解。同时它能与体内产生的氨结合,降低畜禽舍内的有害气体的浓度,因此常作为饲料添加剂在畜牧业上得到广泛的应用。Santacruz-Reyes等[30]报道,哈夫丝兰提取物可通过抑制脲酶活性,使粪污氨挥发量减少55.5%。周学光等[31]研究丝兰提取物对降低猪舍内氨浓度的试验,结果发现添加200 g/t的丝兰宝后,在饲喂第2周时猪舍内氨浓度已经开始下降,之后氨的浓度是逐周下降的。这与Colina等[32]的结果是一致的。梁国旗等[33]比较了樟科植物提取物和丝兰植物提取物对仔猪生长性能、粪尿中氨和硫化氢散发的影响,结果发现添加樟科提取物(350 mg/kg)和丝兰提取物(125 mg/kg)后均显著降低了氨的浓度。综合已有文献报道发现在畜禽的饲粮中添加60~350 mg/kg的植物提取物均有促进动物的生长性能,同时降低粪便和畜禽舍内氨排放的作用,且在此范围内随着添加量的增加,效果更好。
丝兰提取物和樟科提取物减少氨排放的机制在于:1) 提取物的有效成分作用于脲酶的活性部位,抑制了粪便和肠道中脲酶的活性,降低了尿素分解。2) 提取物的有效成分通过干扰产生脲酶相关的微生物的代谢,阻碍脲酶的合成途径,降低脲酶的分泌,使尿素的分解速度降低。3) 提取物改变微生态环境的氧化还原条件,降低微生物的代谢活性,使其厌氧分解的能力降低。4) 提取物的活性分子结合肠道中的臭气分子,并将其转化成其他无毒的氮化物[34]。5) 提取物的主要成分可以促进肠道内的微生物利用氨合成微生物蛋白,减少氨的排放。6) 提取物通过阻止粪尿中氮发生硝化作用,从而使氮以无机质的形式存在,降低了散发到大气中的氨气的量。
3.3 添加益生菌益生菌定植于肠道中,可以调节肠道微生态平衡从而对动物的健康发挥着良好的作用。在畜牧业上常用的益生菌包括双歧杆菌、酵母菌、乳酸菌、枯草芽孢杆菌等。目前研究较多的就是将几种益生菌混合制成复合菌制剂,作为饲料添加剂添加在饲料中。国内也有将益生菌制剂与中草药或寡聚糖等以一定的比例混合制成制剂作为饲料添加剂使用的。益生菌不但能改善动物的生长性能、提高饲料利用率,也可以减少氨、硫化氢等臭气的产生。
氨对动物有毒副作用,破坏肠细胞,因此降低肠道内氨浓度,有利于动物健康生长。肠道微生物在脱羧酶作用下通过脱羧作用产生氨[10-11]。给猪饲喂适量的酵母菌和枯草芽孢杆菌制剂,可以减少氨的排放,这主要和酵母菌同化尿酸,抑制氨态氮的产生以及枯草芽孢杆菌可以抑制脱羧产氨有关[35]。Solga[36]认为有益菌能够分泌有益成分如氨基氧化酶和一些能分解硫化物的酶,从而降低氨、吲哚等有害气体的浓度。王华等[37]在基础饲粮的基础上添加0.50%、0.10%、0.15% 3个不同浓度益生菌剂,测定了盲肠和结肠的氨浓度及肠道pH。添加了益生菌剂组的氨浓度和pH均显著低于对照组。肠道内较低的pH可以促进有益菌分泌有益成分降低氨的浓度。郑卫国等[38]通过饲喂或在猪舍内喷洒益生菌发酵液的形式对不同阶段的猪进行了试验,结果发现在不同阶段猪舍得到的结果基本一致,在添加益生菌菌剂的浓度为0.1%同时喷洒菌液的情况下,持续6个月可降低氨排放30%~40%,同样的处理方式连续进行1年,可降低氨排放40%~50%。Wang等[39]在饲粮中添加0.5%~20.0%的枯草芽孢杆菌和地衣芽孢杆菌,可以减少氨排放50%。肠道中大肠杆菌通过脱氨作用产生氨。王涛等[40]发现乳酸菌菌剂添加量为0.1%和0.2%可显著降低盲肠中大肠杆菌的数量。
益生菌可以降低氨的浓度的机制主要包括:通过降低肠道内的pH,较低的pH致使通过发生脱氨、脱羧作用产生氨的厌氧微生物死亡,进而降低微生物产生氨;益生菌降低pH,可以抑制脲酶的活性,抑制尿氮分解产生氨;益生菌可以通过同化尿酸,降低氨态氮的产生;益生菌通过分解有益成分,将氨分解。目前市场上应用最广的益生菌包括酵母菌、乳杆菌、枯草芽孢杆菌等。益生菌主要通过3种形式使用:直接口服活菌、制成菌剂添加和饲粮中添加同时在舍内喷洒。目前的研究发现添加量在0.05%~2.00%具有较好的效果,且降低氨浓度最高可达到50%。
4 小结随着健康养殖观念的不断提高,人们对畜产品的健康及安全问题更加重视,在畜产品安全的前提下,氨气污染问题越来越受到国家环境部门的重视。目前研究氨气的来源多是从畜禽舍内及粪尿中产生的氨进行研究,控制氨排放的方法主要是通过调整饲粮配方、改善饲养管理。但是对于氨的来源及如何减少排放还存在以下问题:添加的益生菌要考虑成本和制备工艺;丝兰提取物在我国的产量并不多。同时肠道内氨产生的机理及氨的产生是否与一些特定的基因有关还有待于进一步的研究。总之,从根源上控制氨的产生,减少排放,从而减少疾病的发生,对于养殖业健康发展有很大的实践意义和应用前景。
| [1] |
SUTTON M A, HOWARD C M, ERISMAN J W, et al. The European nitrogen assessment:sources, effects and policy perspectives[M]. Cambridge: Cambridge University Press, 2011, 345-376.
|
| [2] |
赵红军, 王力臣. 猪舍内氨气的危害[J]. 养殖技术顾问, 2011(8): 33. |
| [3] |
张静, 刘双红, 孙斌. 猪场舍内氨气对猪的危害[J]. 养殖技术顾问, 2014(4): 26. |
| [4] |
贺勇, 高宝秀, 杨正兵, 等. 肝硬化患者消化道状态与血氨的关系研究[J]. 检验医学, 2012, 27(1): 45-47. |
| [5] |
PUIMAN P1, STOLL B, MØLBAK L, et al. Modulation of the gut microbiota with antibiotic treatment suppresses whole body urea production in neonatal pigs[J]. American Journal of Physiology Gastrointestinal Liver Physiology, 2013, 304(3): G300-G310. DOI:10.1152/ajpgi.00229.2011 |
| [6] |
GARIBOTTO G, VERZOLA D, SOFIA A, et al. Mechanisms of renal ammonia production and protein turnover[J]. Metabolic Brain Disease, 2009, 24(1): 159-167. DOI:10.1007/s11011-008-9121-6 |
| [7] |
邹思湘. 动物生物化学[M]. 北京: 中国农业出版社, 2005, 213-223.
|
| [8] |
高建萱. 猪舍内氨气排放控制研究进展[J]. 现代农业科技, 2011(6): 340, 345. |
| [9] |
朱伟云, 余凯凡, 慕春龙, 等. 猪的肠道微生物与宿主营养代谢[J]. 动物营养学报, 2014, 26(10): 3046-3051. DOI:10.3969/j.issn.1006-267x.2014.10.016 |
| [10] |
RUIZ-MOYANO S, MARTÍN A, BENITO M J, et al. Application of Lactobacillus fermentum HL57 and Pediococcus acidilactici SP979 as potential probiotics in the manufacture of traditional Iberian dry-fermented sausages[J]. Food Microbiology, 2011, 28(5): 839-847. DOI:10.1016/j.fm.2011.01.006 |
| [11] |
LINARES D M, MARTÍN M C, LADERO V, et al. Biogenic amines in dairy products[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(7): 691-703. DOI:10.1080/10408398.2011.582813 |
| [12] |
ROMEROGóMEZ M, JOVER M, GALáN J J, et al. Gut ammonia production and its modulation[J]. Metabolic Brain Disease, 2009, 24(1): 147-157. DOI:10.1007/s11011-008-9124-3 |
| [13] |
JAMES L A, LUNN P G, MIDDLETON S, et al. Distribution of glutaminase and glutamine synthease activities in the human gastrointestinal tract[J]. Clinical Science, 1998, 94(3): 313-319. DOI:10.1042/cs0940313 |
| [14] |
CORVERA S, GARCIA-SÁINZ J A. Hormonal stimulation of mitochondrial glutaminase.Effects of vasopressin, angiotensin Ⅱ, adrenaline and glucagons[J]. Biochemical Journal, 1983, 210(3): 957-960. DOI:10.1042/bj2100957 |
| [15] |
ROMERO-GÓMEZ M, RAMOS-GUERRERO R, GRANDE L, et al. Intestinal glutaminase activity is increased in liver cirrhosis and correlates with minimal hepatic encephalopathy[J]. Journal of Hepatology, 2004, 41(1): 49-54. DOI:10.1016/j.jhep.2004.03.021 |
| [16] |
SHERLOCK S, DOOLEY J S. Diseases of the liver and biliary system[M]. Oxford: Wiley-Blackwell, 2002, 26-35.
|
| [17] |
刘北航. 血氨检验方法以及临床意义[J]. 中外健康文摘, 2010, 7(22): 142-143. DOI:10.3969/j.issn.1672-5085.2010.22.117 |
| [18] |
盛大平, 徐元宏, 李涛, 等. 血氨检测的临床适应证及其价值探讨[J]. 国际检验医学杂志, 2010, 31(6): 565, 567. |
| [19] |
VAN MILGENJ, DOURMADJ Y. 猪理想蛋白质理念及应用[J]. 中国饲料, 2015(12): 39-42. |
| [20] |
贺建华, 符晨星, 黄瑞林, 等. 猪氮代谢及其调控的研究进展[J]. 饲料工业, 2012(S1): 22-25. |
| [21] |
GALASSI G, COLOMBINI S, MALAGUTTI L, et al. Effects of high fibre and low protein diets on performance, digestibility, nitrogen excretion and ammonia emission in the heavy pig[J]. Animal Feed Science and Technology, 2010, 161(3/4): 140-148. |
| [22] |
HANSENA M J, NØRGAARDBN J V, PETER S A, et al. Effect of reduced crude protein on ammonia, methane, and chemical odorants emitted from pig houses[J]. Livestock Science, 2014, 169: 118-124. DOI:10.1016/j.livsci.2014.08.017 |
| [23] |
SHI B S, LIU J Y, SUN Z H, et al. The effects of different dietary crude protein level on faecal crude protein and amino acid flow and digestibility in growing pigs[J]. Journal of Applied Animal Research, 2016. DOI:10.1080/09712119.2016.1260570 |
| [24] |
BALL M E E, MAGOWAN E, MCCRACKEN K J, et al. The effect of level of crude protein and available lysine on finishing pig performance, nitrogen balance and nutrient digestibility[J]. Asian-Australasian Journal Animal Science, 2013, 26(4): 564-572. DOI:10.5713/ajas.2012.12177 |
| [25] |
HANSEN C F, SORENSEN G, LYNGBYE M. Reduced diet crude protein level, benzoic acid and inulin reduced ammonia, but failed to influence odour emission from finishing pigs[J]. Livestock Science, 2007, 109(1/2/3): 228-231. |
| [26] |
PHILIPPE F X, LAITAT M, CANART B, et al. Effects of a reduction of diet crude protein content on gaseous emissions from deep-litter pens for fattening pigs[J]. Animal Research, 2006, 55(5): 397-407. DOI:10.1051/animres:2006029 |
| [27] |
黄健, 邓红, 谢跃伟, 等. 低蛋白和杂粕日粮对生长猪生产性能、养分消化、血液指标和猪舍氨气的影响[J]. 饲料工业, 2015, 35(21): 45-47. |
| [28] |
鲁宁, 张桂杰, 谯仕彦. 猪低蛋白质低氮排放日粮研究进展[J]. 猪业科学, 2010, 27(5): 42-47. |
| [29] |
BS AS. Nutrient requirement standards for pigs[M]. Penicuik: British Society of Animal Science, 2003, 29.
|
| [30] |
SANTACRUZ-REYES R A, CHIEN Y H. Yucca schidigera extract-a bioresource for the reduction of ammonia from mariculture[J]. Bioresource Technology, 2010, 101(14): 5652-5657. DOI:10.1016/j.biortech.2010.01.127 |
| [31] |
周学光, 张胜斌, 梁秀珍, 等. 丝兰属提取物对降低封闭式妊娠母猪舍氨气浓度的试验[J]. 猪业科学, 2015, 32(7): 91-92. |
| [32] |
COLINA J J, CHANG E J, MILLER P S, et al. Dietary manipulation to reduce aerial ammonia concentrations in nursery pig facilities[J]. Journal of Animal Science, 2001, 79(12): 3096-3103. DOI:10.2527/2001.79123096x |
| [33] |
梁国旗, 王旭平, 王现盟, 等. 樟科、丝兰属植物提取物对仔猪排泄物中氨和硫化氢散发的影响[J]. 中国畜牧杂志, 2009, 45(13): 21-25. |
| [34] |
肖英平, 代兵, 苏琴, 等. 猪场臭气的产生机理及植物提取物在除臭生产中的应用[J]. 中国畜牧杂志, 2013, 49(22): 60-64. DOI:10.3969/j.issn.0258-7033.2013.22.017 |
| [35] |
廖新俤, 吴楚弘, 雷东峰. 活菌制剂改进猪氮转化和减少猪舍氨气的研究[J]. 家畜生态, 2002, 23(2): 21-23. |
| [36] |
SOLGA S F. Probiotics can treat hepatic encephalopathy medical[J]. Medical Hypothese, 2003, 61(2): 307-313. DOI:10.1016/S0306-9877(03)00192-0 |
| [37] |
王华, 张淑梅, 钟颖婷, 等. "乳菌宝"益生菌剂对断奶仔猪肠道生理生化指标的影响[J]. 东北农业大学学报, 2013, 44(12): 27-31. DOI:10.3969/j.issn.1005-9369.2013.12.006 |
| [38] |
郑卫国, 李义, 瞿文学, 等. 益生菌对猪舍内氨气浓度的影响[J]. 上海畜牧兽医通讯, 2017(2): 50-51. |
| [39] |
WANG Y, CHO J H, CHEN Y J, et al. The effect of probiotic BioPlus 2B® on growth performance, dry matter and nitrogen digestibility and slurry noxious gas emission in growing pigs[J]. Livestock Science, 2009, 120(1/2): 35-42. |
| [40] |
王涛, 任景乐, 祝贵华, 等. 复合乳酸杆菌制剂对蛋种鸡产蛋性能、免疫机能和盲肠微生物的影响[J]. 动物营养学报, 2013, 25(7): 1551-1558. |




