在家禽生产和研究中,越来越多从业者关注其肉和蛋等产品的数量和质量改善,而对于家禽羽毛生长发育的研究鲜见报道。近年来,随着我国家禽业的迅速发展,其羽毛性状越来越被人们所关注。被覆于禽类躯体的羽毛,是禽类外貌的重要特征。但在规模化养殖过程中,家禽极易出现不同程度的啄羽或脱羽现象,影响其活体外观,特别是对多以活体形式销售的黄羽肉鸡、肉鸽等特色家禽影响更大;此外,脱羽也极大影响着家禽的屠体外观,导致其冰鲜产品皮肤颜色和松紧度不一,影响了其商品性状。因此,对家禽羽毛的生长发育规律及其营养调控机制的研究亟待加强,进而更好的服务于畜牧业生产。
1 家禽羽毛的生长发育过程 1.1 羽毛的类型羽毛是着生在皮肤表面,起源于外胚层表皮细胞的皮肤附属物,是鸟类特有的表皮结构。覆盖在鸟类皮肤的羽毛质轻而韧,略有弹性,不仅是鸟类的飞行工具,还具有保暖、防护、游泳、调控温度和发出声音等功能。根据羽毛的形状和所处部位不同,羽毛的类型主要包括:正羽、绒羽和纤羽(图 1)[1]。
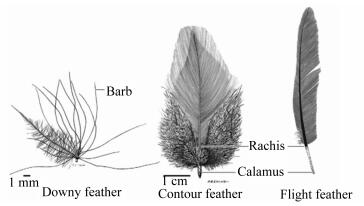
|
Downy feather:绒羽;Contour feather:正羽;Flight feather:飞羽;Barb:羽枝;Rachis:羽轴;Calamus:羽根。 图 1 鸡体羽毛的不同形态 Figure 1 Different types of chicken feathers[1] |
两侧对称的正羽覆盖禽体绝大部分,一般由羽轴和羽片构成,羽轴埋入皮肤部分称为羽根,羽片是羽小枝之间通过羽纤枝相互作用勾连而成。绒羽是径向对称的,有羽轴,但羽枝发出的小羽枝间没有羽纤枝相互勾连,故不形成羽片,其保温作用较好[2];纤羽又称毛羽,散在正羽与绒羽之间,除去正羽与绒羽后即可观察到,羽干细长,顶端有少许羽枝及羽小枝。
1.2 毛囊的基本结构毛囊为羽毛生长和再生的控制中心,是由真皮和表皮相互作用下形成,具有较为复杂的结构(图 2)[3]。毛囊是包围在毛发根部的囊状组织,位于羽毛基底部;插入皮肤真皮的部分称为毛根;毛球位于毛根下部,为羽毛的最下端部分,毛球围绕着毛乳头并与之紧密相接,外形膨大呈球状,从毛乳头中获得营养物质,使毛球内的细胞不断增殖,从而促使羽毛生长。真皮乳头是由长芽基部的间充质细胞压缩而成的紧密结构,通过调节毛囊中各种细胞的活性影响毛发形态发生和再生[4-6]。
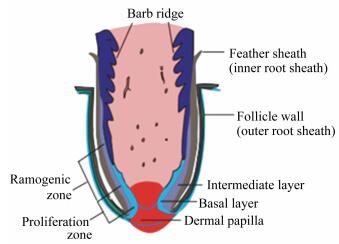
|
Barb ridge:羽枝脊;Feather sheath (inner root sheath):羽脊(内根鞘);Follicle wall (outer root sheath):毛囊壁(外根鞘);Intermediate layer:中间层;Basal layer:基底部;Dermal papilla:真皮乳头;Ramogenic zone:分枝发生区;Proliferation zone:增殖区。 图 2 羽毛毛囊结构模式图 Figure 2 Diagram of feather follicle structure[3] |
家禽羽毛发育起始于毛囊[7]。在胚胎发育的第8天,间充质细胞增殖,在羽区下方形成致密真皮;而真皮层表面积聚间充质,形成突起即真皮乳头。乳头表皮相应增厚,二者共同形成羽乳突,羽乳突向斜后方生长,基部向皮肤内下陷,形成羽囊;在胚胎期第9~10天,羽区表皮不断隆起,形成羽芽;随着胚胎期的进行,羽区表皮内陷形成毛囊壁,分枝发生区上皮细胞分化形成羽轴和羽枝脊;胚胎后期毛囊远端羽枝脊上皮细胞迅速增殖和分化形成缘板、羽小枝板和羽轴板,并进一步发育成羽枝、羽小枝和羽轴[8]。
毛囊是一种周期性再生的结构,包括发生期、生长期和静止期3个阶段(图 3)[1]。羽毛在发生期阶段毛囊孔径较小;在生长期显著扩张,毛囊长度增加,真皮层向下生长,毛基板细胞不断分化发育成羽毛。静止期毛基板分化停止,毛囊退化,随之羽毛伸长停止。毛囊基底层可通过再生循环,进入下一个生长周期。
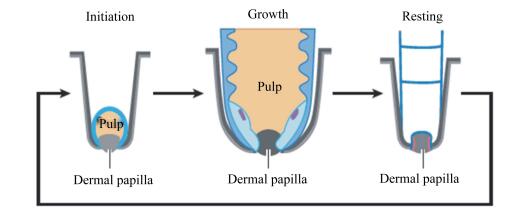
|
Initiation:发生期;Growth:生长期;Resting:静止期;Dermal papilla:真皮乳头;Pulp:髓。 图 3 羽毛毛囊周期示意图 Figure 3 Schematic diagram of feather follicle cycle[1] |
蛋白质为家禽羽毛的主要构成成分,其含量高达89%~97%(主要为角蛋白)。因此,饲粮中粗蛋白质的含量可影响羽毛的生长发育,提供给禽类充足的粗蛋白质饲粮可提高羽毛的产量和质量。但当饲粮粗蛋白质含量过低时,雏鸡羽毛质量变差[9]。Bajpai等[10]在白腹锦鸡上的研究表明,给其饲喂含13.4%的粗蛋白质饲粮会降低羽毛生长速率;饲喂含16.5%粗蛋白质饲粮可提高羽毛生长速率;然而,当饲粮粗蛋白质含量增加至19.1%时,对其羽毛生长速率并无进一步改善作用。
2.1.2 含硫氨基酸饲粮含硫氨基酸与羽毛中角蛋白的含量直接相关。因此,饲粮缺乏这些氨基酸时,首先表现为羽毛生长发育异常[11]。胱氨酸是角蛋白的主要组成成分,而蛋氨酸可转化为胱氨酸[12]。Qian等[13]在皖西白鹅上的研究表明,饲粮添加0.5%蛋氨酸可提高其羽绒产量。有研究表明,不同日龄北京鸭需要的蛋氨酸水平不同,28日龄北京鸭适宜的蛋氨酸水平为0.40%,而35日龄时为0.48%,合适的蛋氨酸水平才可使羽毛生长得更健壮;但添加水平过高(1.45%)同样会导致羽毛变得纤细、易断;氨基酸比例不合理也会造成其脱羽现象[14]。
2.1.3 矿物质元素饲粮矿物质元素锌、锡、钒、铬和镍等的缺乏,均会不同程度的引起羽毛生长受阻、羽毛磨损和易断等,其中以锌的缺乏较为明显。饲粮缺锌会导致毛发或羽毛磨损和易断等[15]。此外,家禽饲粮中缺锌时会在羽轴上出现特征性的水泡,主翼羽和次翼羽生长速度变慢;而在饲粮中添加不同形式的锌(硫酸锌和蛋氨酸锌等)均可防止其羽毛生长发育不良[16]。鸡缺钠时会表现为羽毛生长缓慢,并伴随有啄羽发生[17]。
2.1.4 维生素维生素作为诸多与毛囊发育和羽毛生长相关酶的辅酶,与家禽的羽毛生长发育密切相关。当饲粮缺乏某些维生素时,其羽毛生长发育异常。缺乏维生素A会引起上皮组织干燥和皮肤过度角质化;缺乏维生素D导致羽毛蓬松无光泽;缺乏核黄素会使羽毛卷曲脱落、足趾向内弯曲。与氨基酸或微量元素的缺乏症相类似,给雏鸡饲喂缺乏泛酸、叶酸、生物素或烟酸饲粮,均会导致其羽毛粗糙、稀疏和易脱落等症状;而饲粮中添加叶酸和核黄素等可有效防治雏鸡羽毛生长不良,且在一定剂量范围内随着添加量的增加,羽毛色泽更鲜亮[18-19]。
2.2 环境及饲养管理因素 2.2.1 养殖模式在规模化养殖过程中,笼养家禽多因饲养密度过高,导致羽毛生长发育不良、啄羽问题突出。与此同时,部分地面平养的家禽,因地面或垫料潮湿容易引起家禽腹部羽毛脱落。而保持禽舍内环境合适的温湿度范围,可降低家禽的脱毛和换羽问题。
2.2.2 饲料的选择和更换科学合理地选择和更换饲料,可减少家禽因营养不良而引起的啄羽现象。不同家禽品种适合不同的饲料类型,这与其生长习性有关。如蛋鸡多采用粉料,肉鸡多采用颗粒料,肉鸽多采用原粮饲喂,采用不合适的饲料类型会引起羽毛发育受阻。饲料更换也应在恰当的时期,防止换料对其应激过大,引起采食量下降进而导致营养摄入不平衡,从而出现脱毛和啄羽问题。
2.2.3 环境因素畜舍内的湿度、温度太高或光照太强,会导致家禽出现互啄而使羽毛脱落。而舍内的通风不好,会使家禽出现焦躁不安,尤其是在炎热的夏季,引起热应激、采食量下降,进而影响其羽毛生长。
3 调控羽毛生长发育的机制毛囊形成于胚胎期,控制着羽毛的生长、更替及其形态结构[20]。胚胎期毛囊的发生涉及一系列复杂的表皮与真皮间的相互作用,诸多因子参与该过程。其中,对毛囊形成起促进作用的是成纤维细胞生长因子(fibroblast growth factor, FGF)家族、Wnt/β-连环蛋白(β-catenin)和SHH(sonic hedge hog)信号通路等;而另一些信号分子则会抑制羽毛的生长和更替,如骨形态发生蛋白(bone morphogenetic protein, BMP)家族[21]等。不同的信号通过促进和抑制毛囊发育因子的平衡来调控毛囊活动的启动或休止,进而实现羽毛的生长或更替[22-23]。在这些调控毛囊生长发育的基因或信号通路中,Wnt/β-catenin信号通路扮演着极其重要的角色[24]。
3.1 Wnt/β-catenin信号通路Wnt信号通路是一个多环节、多作用位点的生长发育调控信号通路,包含经典的Wnt/β-catenin信号通路、Wnt/Ca2+信号通路和非经典的细胞极性通路等3个路径,其发挥作用的方式依赖Wnt配体与膜受体结合将信号转入胞内来实现(图 4)[25]。
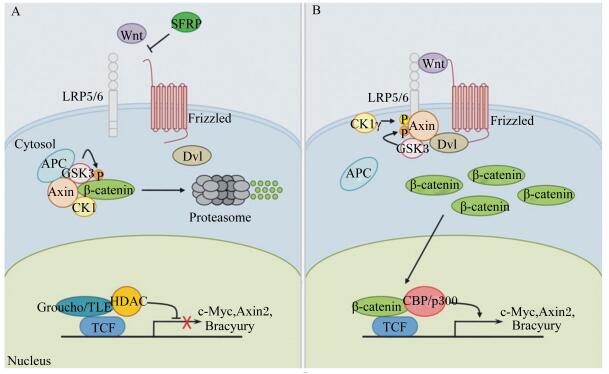
|
SFRP:分泌型卷曲相关蛋白secreted frizzled-related protein;LRP5/6:低密度脂蛋白受体相关蛋白low-density lipoprotein receptor-related protein 5/6;Frizzled:卷曲的;Cytosol:细胞质基质;Dvl:蓬乱蛋白dishevledr;APC:肿瘤抑制蛋白adenomatous polyposis coli;GSK-3β:糖原合成激酶-3β glycogen Synthase Kinase 3 Beta;Axin:轴抑制axis inhibition;CK1:蛋白激酶I casein kinase 1;β-catenin:Beta-连环蛋白;Proteasome:蛋白酶体;HDAC:组蛋白去乙酰化酶histone deacetylase;Groucho/TLE:Groucho/转导蛋白增强因子Groucho/transducin-like enhancer;TCF:转录因子transcription factor;Bracyury:短尾;CBP/p300:CREB结合蛋白CREB-binding protein p300;Nucleus:核。 图 4 Wnt/β-catenin信号通路 Figure 4 Wnt/β-catenin signaling pathway[25] |
Shin等[26]研究表明,β-catenin活性与毛发生长有关。Wnt/β-catenin信号通路在毛囊的起始、发育和生长中均可发挥作用,如可促进毛囊增殖及调控毛囊生长周期[27],在其调控毛囊形成过程中分为上游调控Wnt配体和下游调控β-catenin信号通路。
3.1.1 Wnt配体Wnt信号的作用是在游离真皮乳头细胞中保持毛囊诱导的特性,在毛囊间质和上皮之间建立信号传播,调节毛囊生长和毛干结构[28]。Wnt基因在羽毛形成中起重要作用,其中,Wnt3a在正常发育和突变的毛囊中均有表达,其在转基因小鼠上过度表达可导致短发表型[29],此外,Wnt3a可促使辐射对称羽毛的形成。在外根鞘细胞外源性表达Wnt可改变毛干的长度及其中蛋白质的含量[30]。Wnt5a在毛囊发育中主要起到抑制作用,其作为真皮乳头细胞的旁分泌因子,调控毛囊的分化[31]。Wnt6是一种富含半胱氨酸的分泌型蛋白质,可作为细胞间信号分子在毛囊发育中起关键作用[32]。Wnt7a在毛囊基质形成开始时显著上调[33]。Wnt10b可通过经典Wnt信号通路促进毛干生长[34]。
3.1.2 β-catenin信号通路当细胞接收到Wnt信号后,会抑制糖原合成激酶-3β(glycogen synthase kinase 3β, GSK-3β)的活性和对β-catenin的降解,使β-catenin在细胞内大量积累;随后去磷酸化的β-catenin进入细胞核,与淋巴增生因子/ T细胞因子(lymphoid enhancer factor/T cell factor,Lef/TCF), 复合物结合,从而影响毛囊干细胞分化[35]。β-catenin还可以启动Jagged1的转录活性,进而激活Notch信号通路,调节毛囊细胞增殖和分化[36]。此外,β-catenin还是毛囊干细胞重要的调控蛋白,其可通过靶基因c-Myc调控毛囊干细胞的分化[37]。同时,β-catenin还能促进毛囊干细胞从静止期进入增殖期,从而加速进入毛发周期[38]。研究表明[39],β-catenin还可通过调节毛囊发育中最重要的过渡细胞——毛母质细胞和外根鞘的增殖和分化,改变毛囊干细胞的形状,促进毛囊的生长发育。β-catenin的瞬时活化可导致小鼠的毛发再生长,而β-catenin的消融导致小鼠毛囊的真皮乳头中毛发的急剧缩短和毛发的异常再生[40]。真皮乳头中β-catenin的表达在毛发生长期显著上调,而在退化期和静止期显著下调[41]。
因此,Wnt/β-catenin信号通路在人和其他哺乳动物的毛囊形态发生、增殖和分化各个时期均发挥着不可忽视的作用。此外,在人或其他哺乳动物的毛囊发生及毛发生长过程中,Wnt/β-catenin信号通路可抑制外胚层细胞对FGF的响应,而促使外胚层细胞表达抑制外胚层细胞向角蛋白细胞分化的BMP信号。
3.2 BMP家族BMP家族在毛囊与羽毛发生和发育过程中均有表达,但主要发挥负调控作用[42]。在小鼠上的研究发现[43],BMP1和BMP7影响羽毛胚芽大小及空间分布;当BMP2过度表达时将抑制羽毛原基的生长,BMP2和BMP4共同促进羽枝板细胞增殖分化出羽小枝和羽小钩[44]。BMP4对羽枝分化起到平衡作用,BMP4促进羽轴形成与羽枝融合,过表达会导致羽轴过长。
3.3 FGF家族FGF家族许多成员在胚胎毛囊发育的不同时期均参与调控,如FGF2可诱导野生型鸡皮肤在缺少毛囊的皮肤中形成致密真皮,调控羽毛正常生长;在毛囊发育初期添加FGF2,可诱导羽芽大量发生[45];但未在毛囊启动时检测到FGF的表达,提示其可能不参与毛囊启动过程[46];FGF5可缩短毛囊生长期,促进向退行期转化[47]。FGF10虽能诱导表皮增厚,但其会抑制羽芽的生长。
3.4 SHH信号通路SHH信号通路可通过Gli转录因子来控制毛囊的生长和形态发生;SHH突变的小鼠能形成正常的基板,但不能进入正常的毛囊形态发生过程[48]。通过抑制SHH的表达发现毛囊停留在多个时期,表明SHH信号通路对毛发生长发挥持续作用[49]。胚胎发育早期,SHH过表达导致外胚层增殖紊乱;真皮凝聚物形成后,SHH促进细胞增殖和真皮凝集,并调控随后皮肤分化时羽芽的生长。
3.5 其他因子研究表明,cDermo-1在过表达时导致致密真皮形成,并诱导异位羽毛生成[50];头蛋白(Noggin)过表达导致羽轴断裂,常量表达促进羽轴增大、羽枝分化;在羽芽发育早期,前后轴形成时期,Notch1和Notch2分别在间充质和芽间区域表达;表皮生长因子(epidermal growth factor,EGF)存在于外毛根鞘,其作用是可延缓毛囊的发育,延长羽毛生长周期的开始和进程,减缓羽毛的生长速度;转化生长因子-β(transforming growth factor-beta,TGF-β)信号传导还可以调节BMP信号传导并有助于毛发再生[51]。
4 小结与展望随着现代家禽养殖业不断发展,对羽毛产量及其品质的要求也在逐步提高。特别是对于我国特色家禽品种如黄羽肉鸡和肉鸽,市场仍主要以活禽形式销售,其羽毛质量严重影响其销售价格。此外,对于这类特色家禽,我国也在逐步开展冰鲜产品的推广,羽毛生长发育的好坏也会影响其屠体外观,导致其整齐度变差,商品性状下降。近年来,在人和其他哺乳动物上开展了诸多关于毛囊的形成和毛发生长发育的研究,但对家禽羽毛生长发育的研究严重匮乏,调控其生长发育的机制尚不清楚。在人和其他哺乳动物上的研究表明,Wnt/β-catenin信号通路是调控毛囊形态发生和生长的核心通路,其在调控毛发的生长发育过程中发挥重要影响。但不同物种间,参与毛囊形态发生及生长周期调节的因子或分泌蛋白家族可能存在较大差异。在家禽上这些信号通路发挥何种影响,营养和环境如何对家禽羽毛生长发育产生影响,值得重点关注。总之,深入研究家禽羽毛的发生、生长和再生过程,可为揭示家禽羽毛生长发育规律和开发相应营养调控技术提供理论依据,从而解决家禽生产面临的问题,加快其产业升级。
| [1] |
CHEN C F, FOLEY J, TANG P C, et al. Development, regeneration, and evolution of feathers[J]. Annual Review of Animal Biosciences, 2015, 3(1): 169-195. DOI:10.1146/annurev-animal-022513-114127 |
| [2] |
杨宁. 家禽生产学[M]. 2版. 北京: 中国农业出版社, 2012, 22-23.
|
| [3] |
YUE Z C, JIANG T X, WU P, et al. Sprouty/FGF signaling regulates the proximal-distal feather morphology and the size of dermal papillae[J]. Developmental Biology, 2012, 372(1): 45-54. DOI:10.1016/j.ydbio.2012.09.004 |
| [4] |
DRISKELL R R, CLAVEL C, RENDL M, et al. Hair follicle dermal papilla cells at a glance[J]. Journal of Cell Science, 2011, 124(8): 1179-1182. DOI:10.1242/jcs.082446 |
| [5] |
SENNETT R, RENDL M. Mesenchymal-epithelial interactions during hair follicle morphogenesis and cycling[J]. Seminars in Cell & Developmental Biology, 2012, 23(8): 917-927. |
| [6] |
SRIWIRIYANONT P, LYNCH K A, MAIER E A, et al. Morphogenesis of chimeric hair follicles in engineered skin substitutes with human keratinocytes and murine dermal papilla cells[J]. Experimental Dermatology, 2012, 21(10): 783-785. DOI:10.1111/exd.12003 |
| [7] |
LIN C M, JIANG T X, WIDELITZ R B, et al. Molecular signaling in feather morphogenesis[J]. Current Opinion in Cell Biology, 2006, 18(6): 730-741. DOI:10.1016/j.ceb.2006.10.009 |
| [8] |
崔志锋, 赵晶, 王慧, 等. 不同培养基对山羊毛囊体外培养的影响研究[J]. 山东大学学报:理学报, 2008, 43(5): 1-5. |
| [9] |
VAN EMOUS R A, KWAKKEL R, VAN KRIMPEN M, et al. Effects of growth pattern and dietary protein level during rearing on feed intake, eating time, eating rate, behavior, plasma corticosterone concentration, and feather cover in broiler breeder females during the rearing and laying period[J]. Applied Animal Behavior Science, 2014, 150: 44-54. DOI:10.1016/j.applanim.2013.10.005 |
| [10] |
BAJPAI S K, DAS A, KULLU S S, et al. Effect of feeding graded levels of crude protein on nutrient utilization and feather growth in Lady Amherst's pheasants[J]. Zoo Biology, 2015, 35(1): 51-60. |
| [11] |
ANSARI-RENANI H R, EBADI Z, MORADI S, et al. Determination of hair follicle characteristics, density and activity of Iranian cashmere goat breeds[J]. Small Ruminant Research, 2011, 95(2/3): 128-132. |
| [12] |
XU X, ZHENG X T, YOU H L. Exceptional dinosaur fossils show ontogenetic development of early feathers[J]. Nature, 2010, 464(7293): 1338-1341. DOI:10.1038/nature08965 |
| [13] |
钱东方, 耿照玉, 袁绍友, 等. 日粮蛋氨酸对活拔羽毛后皖西白鹅体质和产羽性能的影响[J]. 安徽农业科学, 2006, 34(10): 2143-2143. DOI:10.3969/j.issn.0517-6611.2006.10.055 |
| [14] |
ZENG Q F, ZHANG Q, CHEN X, et al. Effect of dietary methionine content on growth performance, carcass traits, and feather growth of Pekin duck from 15 to 35 days of age[J]. Poultry Science, 2015, 94(7): 1592-1599. DOI:10.3382/ps/pev117 |
| [15] |
DREW C F, LIN C M, JIANG T X, et al. The Edar subfamily in feather placode formation[J]. Developmental Biology, 2007, 305(1): 232-245. DOI:10.1016/j.ydbio.2007.02.011 |
| [16] |
郭锋, 侯水生, 谢明, 等. 营养因素对水禽羽毛发育的影响[J]. 中国家禽, 2010, 32(19): 46-48. |
| [17] |
YANG C C, COTSARELIS G. Review of hair follicle dermal cells[J]. Journal of Dermatological Science, 2010, 57(1): 2-11. DOI:10.1016/j.jdermsci.2009.11.005 |
| [18] |
陈瑶. 浅析北京鸭羽毛异常的营养因素及防治[C]//第四届中国水禽发展大会论文集. 北京: 中国畜牧业协会禽业分会, 2011: 154-155. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZXMY201109003036.htm
|
| [19] |
刘伟. 影响家禽羽毛生长的因素分析[J]. 中国动物保健, 2016, 18(3): 11-12. DOI:10.3969/j.issn.1008-4754.2016.3.002 |
| [20] |
YU M K, WU P, WIDELITZ R B, et al. The morphogenesis of feathers[J]. Nature, 2002, 420(6913): 308-312. DOI:10.1038/nature01196 |
| [21] |
LIN S J, WIDELIZ R B, YUE Z C, et al. Feather regeneration as a model for organogenesis[J]. Development Growth & Regeneration, 2013, 55(1): 139-148. |
| [22] |
JIN M, WANG L, LI S, et al. Characterization and expression analysis of KAP7.1, KAP8.2 gene in Liaoning new-breeding cashmere goat hair follicle[J]. Molecular Biology Reports, 2011, 38(5): 3023-3028. DOI:10.1007/s11033-010-9968-6 |
| [23] |
BAKKER E R, RAGHOEBIR L, FRANKEN P F, et al. Induced Wnt5a expression perturbs embryonic outgrowth and intestinal elongation, but is well-tolerated in adult mice[J]. Developmental Biology, 2012, 369(1): 91-100. DOI:10.1016/j.ydbio.2012.06.007 |
| [24] |
ÖZHAN G, SEZGIN E, WEHNER D, et al. Lypd6 enhances Wnt/β-catenin signaling by promoting Lrp6 phosphorylation in raft plasma membrane domains[J]. Developmental Cell, 2013, 26(4): 331-345. DOI:10.1016/j.devcel.2013.07.020 |
| [25] |
KIM W, KIM M, JHO E H. Wnt/β-catenin signalling:from plasma membrane to nucleus[J]. Biochemical Journal, 2013, 450(1): 9-21. DOI:10.1042/BJ20121284 |
| [26] |
SHIN S H, KIM D, HWANG J, et al. OVO homolog-like 1, a target gene of the Wnt/β-catenin pathway, controls hair follicle neogenesis[J]. Journal of Investigative Dermatology, 2014, 134(3): 838-840. DOI:10.1038/jid.2013.421 |
| [27] |
HARDMAN J A, HASLAM I S, FARJO N, et al. Thyroxine differentially modulates the peripheral clock:lessons from the human hair follicle[J]. PLoS One, 2015, 10(3): e0121878. DOI:10.1371/journal.pone.0121878 |
| [28] |
YUE Z C, JIANG T X, WIDELITZ R B, et al. Wnt3a gradient converts radial to bilateral feather symmetry via topological arrangement of epithelia[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(4): 951-955. DOI:10.1073/pnas.0506894103 |
| [29] |
ITO M, YANG Z X, ANDL T, et al. Wnt-dependent de novo hair follicle regeneration in adult mouse skin after wounding[J]. Nature, 2007, 447(7142): 316-320. DOI:10.1038/nature05766 |
| [30] |
BREITKOPF T, LO B K, LEUNG G, et al. Somatostatin expression in human hair follicles and its potential role in immune privilege[J]. Journal of Investigative Dermatology, 2013, 133(7): 1722-1730. DOI:10.1038/jid.2013.53 |
| [31] |
HU B, LEFORT K, QIU W Y, et al. Control of hair follicle cell fate by underlying mesenchyme through a CSL-Wnt5a-FoxN1 regulatory axis[J]. Genes & Development, 2010, 24(14): 1519-1532. |
| [32] |
CHEN X Y, BAI H C, LI L, et al. Follicle characteristics and follicle developmental related Wnt6 polymorphism in Chinese indigenous Wanxi-white goose[J]. Molecular Biology Reports, 2012, 39(11): 9843-9848. DOI:10.1007/s11033-012-1850-2 |
| [33] |
CHANG T H, HUANG H D, ONG W K, et al. The effects of actin cytoskeleton perturbation on keratin intermediate filament formation in mesenchymal stem/stromal cells[J]. Biomaterials, 2014, 35(13): 3934-3944. DOI:10.1016/j.biomaterials.2014.01.028 |
| [34] |
LI Y H, ZHANG K, YE J X, et al. Wnt10b promotes growth of hair follicles via a canonical Wnt signalling pathway[J]. Clinical and Experimental Dermatology, 2011, 36(5): 534-540. DOI:10.1111/ced.2011.36.issue-5 |
| [35] |
SLOMINSKI A, ZBYTEK B, NIKOLAKIS G, et al. Steroidogenesis in the skin:implications for local immune functions[J]. Journal of Steroid Biochemistry and Molecular Biology, 2013, 137: 107-123. DOI:10.1016/j.jsbmb.2013.02.006 |
| [36] |
MAN X Y, YANG X H, CAI S Q, et al. Expression and localization of vascular endothelial growth factor and vascular endothelial growth factor receptor-2 in human epidermal append ages:a comparison study by immunofluorescence[J]. Clinical and Experiment Dermatology, 2009, 34(3): 396-401. DOI:10.1111/ced.2009.34.issue-3 |
| [37] |
WU X J, ZHU J W, JING J, et al. VEGF165 modulates proliferation, adhesion, migration and differentiation of cultured human outer root sheath cells from central hair follicle epithelium through VEGFR-2 activation in vitro[J]. Journal of Dermatological Science, 2013, 73(2): 152-160. |
| [38] |
BATLLE E, WILKINSON D G. Molecular mechanisms of cell segregation and boundary formation in development and tumorigenesis[J]. Cold Spring Harbor Perspectives in Biology, 2012, 4(1): a008227. |
| [39] |
ZHU B, XU T, YUAN J L, et al. Transcriptome sequencing reveals differences between primary and secondary hair follicle-derived dermal papilla cells of the cashmere goat (Capra hircus)[J]. PLoS One, 2013, 8(9): e76282. DOI:10.1371/journal.pone.0076282 |
| [40] |
ENSHELL-SEIJFFERS D, LINDON C, KASHIWAGI M, et al. β-catenin activity in the dermal papilla regulates morphogenesis and regeneration of hair[J]. Developmental Cell, 2010, 18(4): 633-642. DOI:10.1016/j.devcel.2010.01.016 |
| [41] |
OUJI Y, YOSHIKAWA M, SHIROI A, et al. Wnt-10b promotes differentiation of skin epithelial cells in vitro[J]. Biochemical and Biophysical Research Communications, 2006, 342(1): 28-35. DOI:10.1016/j.bbrc.2006.01.104 |
| [42] |
FUCHS E. Scratching the surface of skin development[J]. Nature, 2007, 445(7130): 834-842. DOI:10.1038/nature05659 |
| [43] |
CHUONG C M, YEH C Y, JIANG T X, et al. Module-based complexity formation:periodic patterning in feathers and hairs[J]. Wiley Interdisciplinary Reviews:Developmental Biology, 2013, 2(1): 97-112. DOI:10.1002/wdev.v2.1 |
| [44] |
MECKFESSEL M H, BRANDT S. The structure, function, and importance of ceramides in skin and their use as therapeutic agents in skin-care products[J]. Journal of the American Academy of Dermatology, 2014, 71(1): 177-184. DOI:10.1016/j.jaad.2014.01.891 |
| [45] |
DRISKELL R R, CLAVEL C, RENDL M, et al. Hair follicle dermal papilla cells at a glance[J]. Journal of Cell Science, 2011, 124(8): 1179-1182. DOI:10.1242/jcs.082446 |
| [46] |
RAMOS-E-SILVA M, PIRMEZ R. Disorders of hair growth and the pilosebaceous unit:facts and controversies[J]. Clinics in Dermatology, 2013, 31(6): 759-763. DOI:10.1016/j.clindermatol.2013.06.003 |
| [47] |
WANG X, TREDGET E E, WU Y. Dynamic signals for hair follicle development and regeneration[J]. Stem Cells & Development, 2011, 21(1): 7-18. |
| [48] |
MITEVA M, TOSTI A. Hair and scalp dermatoscopy[J]. Journal of the American Academy of Dermatology, 2012, 67(5): 1040-1048. DOI:10.1016/j.jaad.2012.02.013 |
| [49] |
BOTCHKAREV V A, PAUS R. Molecular biology of hair morphogenesis:development and cycling[J]. Journal of Experimental Zoology Part B Molecular and Developmental Evolution, 2003, 298B1(1): 164-180. |
| [50] |
HORNIK C, KRISHAN K, YUSUF F, et al. cDermo-1 misexpression induces dense dermis, feathers, and scales[J]. Developmental Biology, 2005, 277(1): 42-50. DOI:10.1016/j.ydbio.2004.08.050 |
| [51] |
FUCHS E, CHEN T. A matter of life and death:self-renewal in stem cells[J]. EMBO Reports, 2013, 14(1): 39-48. DOI:10.1038/embor.2012.197 |




