2. 北京福乐维生物科技股份有限公司, 北京 100071
2. Beijing Fuwish Biotech Co., Ltd., Beijing 100071, China
围产期的奶牛由于分娩的巨大生理应激而对围产期疾病极其敏感,分娩前后低血液钙含量容易导致产褥热和低血钙症的发生,进而造成泌乳期的产奶量降低和经济效益不佳[1]。目前已确诊临床产褥热的奶牛极易患难产、胎衣不下、酮病或大肠杆菌乳房炎等疾病[2-3]。许多研究证明,给围产前期奶牛饲喂补充钙的阴离子型饲粮能减少临床和亚临床低血钙症的发生率[4-6],并建议产后给泌乳牛饲喂阳离子型饲粮以预防瘤胃酸中毒,进而改善奶牛产后的生产性能[7-9]。有研究指出,奶牛产前21 d饲喂阴阳离子差(DCAD)分别为+35、+30、-7 mmol/kg饲粮后,其中DCAD为-7 mmol/kg的试验组产后的健康状况最好[10]。给围产前期奶牛饲喂DCAD为-15 mmol/kg的饲粮,提高了奶牛产后健康程度和泌乳期的乳蛋白产量[11]。综上所述,在围产前期奶牛饲粮中添加阴离子盐可以改善产后奶牛的健康和生产性能,但最佳的添加量并没有定论,且关于产前饲粮的DCAD对产后犊牛抗氧化指标方面的研究鲜有报道。因此,本试验旨在研究围产前期饲粮添加阴离子盐产品改变DCAD对产后奶牛血清生理生化指标及犊牛血清抗氧化指标的影响,确定适宜添加量,为围产前期奶牛阴离子盐的应用提供科学依据。
1 材料与方法 1.1 试验设计本试验所用的阴离子盐由北京福乐维生物科技股份有限公司和内蒙古农业大学动物科学学院动物营养与饲料科学系共同研制。其主要成分为:MgCl2、NH4Cl、CoCl2、(NH4)2SO4、FeSO4、ZnSO4,产品成分见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of trial diets (DM basis) |
试验选取20头产前28 d、体重[(600±50) kg]相近、年龄3~5岁的经产中国荷斯坦奶牛,按照完全随机区组试验设计分为4组,每组5头牛。对照组饲喂基础饲粮,试验组(Ⅰ、Ⅱ、Ⅲ组)在每头试验奶牛基础饲粮中分别人工均匀混合0、15.0、21.9、29.1 g/kg(干物质基础)的阴离子添加剂以调节饲粮的DCAD。经实际测定各组试验奶牛的饲粮DCAD分别为+262.31、+130.26、+78.51、+6.67 mmol/kg。试验期为49 d,其中预试期7 d,正试期42 d。试验饲粮组成及营养水平见表 1。
1.2 饲养管理围产期荷斯坦奶牛的饲喂方法参照标准化牛场饲养制度,从预试期(产前28 d)开始每天08:00和20:00隔栏饲喂,每次投料量为18 kg,饲喂前将饲粮与阴离子添加剂混合均匀后再投放,每次饲喂时间为2 h,采食结束后收集完全剩料并称重记录。全部试验奶牛自由饮水,采食结束后自由活动。阴离子盐添加剂对奶牛适口性较差,为了把奶牛采食量骤降的不良应激降低到最少,从产前28 d开始随饲喂次数逐次增加阴离子盐添加剂的添加量,于第5天达到预先设计的添加量。试验组奶牛饲粮中的阴离子盐添加剂在产完犊牛当天结束投放,开始统一饲喂产后奶牛饲粮。
1.3 样品采集与检测 1.3.1 DCAD分别于产前21、14、7 d及分娩当天饲喂前采集试验奶牛饲粮,混合均匀后经四分法缩样,烘干粉碎以检测其常规营养成分含量。中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量的测定方法参考Van Soest等[12](ANKOM纤维分析仪),粗蛋白质(CP)含量通过凯氏定氮法[AOAC(2000)]测定;产奶净能(NEL)使用FOSS NIRS DS 2500多功能近红外分析仪测定(华夏畜牧有限公司);钠(Na)、氯(Cl)、钾(K)含量采用原子吸收法测定(上海讯达医疗仪器有限公司GB-7,北京华英生物科技公司);钙(Ca)、磷(P)含量采用比色法测定(试剂盒:中生北控股份有限公司;检测仪器:A6半自动生化仪,北京松上技术有限公司);硫(S)含量采用比色法测定(试剂盒:北京华英生物技术研究所)。
饲粮的DCAD计算公式[6]如下:
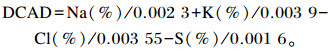
|
从产前21 d(即进入正试期)开始至分娩当天,每天记录每头试验奶牛饲粮的投料量和剩料量,以计算干物质采食量。
1.3.3 血清生化指标试验开始,从产前21、14、7、3 d及分娩当天和产后3、7、14、21 d晨饲结束后2 h内,分别采用普通采血管从颈静脉采集血液10 mL,放入离心机内并将离心机调至4 000×g,立即在室温下离心20 min,用塑料吸管吸取上层血清于1.5 mL离心管内,于-20 ℃保存。血清钙、β-羟丁酸(β-HB)含量,采用比色法(试剂盒:中生北控股份有限公司;检测仪器:A-6半自动生化仪,北京松上技术有限公司);血清维生素D、降钙素(CT)、甲状旁腺素(PTH)、肿瘤坏死因子α(TNF-α)含量检测采用酶联免疫吸附测定法(试剂盒:北京华英生物技术研究所,检测仪器:STAT FAX-2100全自动酶标仪,美国Awareness公司)。
犊牛出生12 h内,使用普通采血管采集血液5 mL,放入离心机内并将离心机调至4 000×g,立即在室温下离心20 min,用塑料吸管吸取上层血清于1.5 mL离心管内,于-20 ℃保存,用于分析血清抗氧化指标,包括:丙二醛(MAD)含量,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性和总抗氧化能力(T-AOC),抗氧化指标测定采用试剂盒,试剂盒购自北京华英生物技术研究所,检测仪器为A-6半自动生化仪(北京松上技术有限公司)。
1.3.4 尿液pH试验进入正试期后,于产前21、14、7 d的06:00采集试验奶牛尿液,立即用pH计(意大利HANNA公司)测试pH并记录。
1.4 数据统计与分析本试验数据采用SAS 9.0软件的GLM模型进行分析,组间差异性采用Duncan氏法进行多重比较,各组间数据差异显著水平为P<0.05。
2 结果与分析 2.1 奶牛干物质采食量由表 2可知,从产前21 d到分娩当天,对照组、试验Ⅰ、Ⅱ、Ⅲ组的干物质采食量依次降低,试验Ⅱ、Ⅲ组显著低于对照组(P<0.05)。
|
|
表 2 饲粮DCAD对围产期奶牛干物质采食量的影响 Table 2 Effects of dietary DCAD on DMI of peripartum dairy cows |
由表 3可知,产前21、14、7、3 d和分娩当天,各组间奶牛血清钙含量差异不显著(P>0.05);在产后3、7、14、21 d试验Ⅰ、Ⅱ、Ⅲ组的均显著高于对照组(P<0.05)。
|
|
表 3 饲粮DCAD对围产期奶牛血清钙含量的影响 Table 3 Effects of dietary DCAD on serum Ca content of peripartum dairy cows |
由表 4可知,产前3 d、分娩当天及产后3、7 d,各组间奶牛的血清β-HB含量差异不显著(P>0.05)。产后14 d,对照组奶牛的血清β-HB含量显著高于试验Ⅱ组(P<0.05),且试验Ⅰ、Ⅱ、Ⅲ组间奶牛血清β-HB含量差异不显著(P>0.05)。
|
|
表 4 饲粮DCAD对围产期奶牛血清β-羟丁酸含量的影响 Table 4 Effects of dietary DCAD on serum β-HB content of peripartum dairy cows |
由表 5可知,产前3 d,试验Ⅰ、Ⅲ组血清甲状旁腺素含量显著低于对照组(P<0.05),且试验Ⅲ组的甲状旁腺素含量显著低于试验Ⅰ组(P<0.05);分娩当天,试验Ⅲ组血清甲状旁腺素含量显著高于其他各组(P<0.05);产后3、7、14 d的奶牛血清甲状旁腺素含量各组间差异均不显著(P>0.05)。
|
|
表 5 饲粮DCAD对围产期奶牛血清甲状旁腺素含量的影响 Table 5 Effects of dietary DCAD on serum PTH content of peripartum dairy cows |
由表 6可知,产前7 d、产后3和7 d,各试验组血清降钙素含量差异不显著(P>0.05)。产前3 d时,试验Ⅱ组血清中的降钙素含量显著高于试验Ⅲ组(P<0.05)。分娩当天,试验Ⅲ组血清中的降钙素含量显著高于试验Ⅰ、Ⅱ组(P<0.05)。产后14 d,试验Ⅰ组血清中的降钙素含量显著低于其他各试验组(P<0.05),试验Ⅲ组血清中的降钙素含量显著高于试验Ⅰ、Ⅱ组(P<0.05)。
|
|
表 6 饲粮DCAD对围产期奶牛血清降钙素含量的影响 Table 6 Effects of dietary DCAD on serum CT content of peripartum dairy cows |
由表 7可知,产前3 d,试验Ⅲ组血清维生素D含量显著高于对照组和试验Ⅱ组(P<0.05)。分娩当天、产后3 d、7 d,对照组血清维生素D含量均低于其余各试验组,其中产后3 d试验Ⅱ组血清维生素D含量显著高于其他各试验组(P<0.05),产后7 d,试验Ⅰ、Ⅱ组血清维生素D含量显著高于其他各试验组(P<0.05)。
|
|
表 7 饲粮DCAD对围产期奶牛血清维生素D含量的影响 Table 7 Effects of dietary DCAD on serum vitamin D content of peripartum dairy cows |
由表 8可知,产前7 d,试验Ⅱ组血清TNF-α含量显著高于对照组和试验Ⅰ组(P<0.05),而试验Ⅰ组是最低的。产前3 d,各组间血清TNF-α含量差异不显著(P>0.05),且对照组低于其余各组。分娩当天和产后3 d各组间的TNF-α含量差异不显著(P>0.05),其中对照组最高。产后7 d,试验Ⅱ组血清TNF-α含量高于其他组,但各组间差异不显著(P>0.05)。产后14 d,试验Ⅲ组血清TNF-α含量显著高于试验Ⅱ组(P<0.05)。
|
|
表 8 饲粮DCAD对围产期奶牛血清肿瘤坏死因子α含量的影响 Table 8 Effects of dietary DCAD on serum TNF-α content of peripartum dairy cows |
由表 9可知,对照组和试验Ⅰ组犊牛的血清MDA含量显著高于试验Ⅲ组(P<0.05),且对照组最高。对照组血清SOD活性最高,显著高于试验Ⅰ组(P<0.05)。对照组血清CAT活性、T-AOC均为各试验组最低,但各组间差异不显著(P>0.05)。
|
|
表 9 奶牛围产期饲粮DCAD对其犊牛血清抗氧化指标的影响 Table 9 Effects of dietary DCAD of peripartum dairy cows on serum anti-oxidative indices of calves |
由表 10可知,产前21 d和产前7 d,试验Ⅰ、Ⅱ、Ⅲ组的奶牛尿液pH均比对照组低,试验Ⅱ、Ⅲ组显著低于对照组(P<0.05);产前14 d,试验Ⅰ、Ⅱ、Ⅲ组的奶牛尿液pH均显著低于对照组(P<0.05)。
|
|
表 10 饲粮DCAD对围产期奶牛尿液pH的影响 Table 10 Effects of dietary DCAD on urine pH of peripartum dairy cows |
一般来说,阴离子盐具有苦涩味、适口性差的特性,未经处理不宜直接添加到饲粮中。将阴离子盐用糖蜜喷雾、干酒糟及其可溶物(DDGS)混匀并制粒或酸化生物发酵处理是目前较为常见的工艺处理方式,很好地改良了阴离子盐的适口性,但是成本偏高仍然是阻碍产品推广和应用的一个因素[13]。本试验主要是为了研究阴离子盐不同添加量对奶牛的影响,因为产后奶牛均统一饲喂泌乳早期饲粮,所以本试验只检测了围产前期奶牛干物质采食量,并没有继续对产后奶牛干物质采食量进行研究。虽然本试验添加的阴离子盐已经经过特殊的适口性处理,但是预试期结束后,作者发现按照原试验设计的较高阴离子盐添加量进入正试期后,试验Ⅰ、Ⅱ、Ⅲ组奶牛干物质采食量过低(不足5 kg),为了提高干物质采食量使试验奶牛所受的应激尽量少,本试验的阴离子盐添加量调整为上述剂量并重新开始了预试期。这最终也使得试验Ⅰ、Ⅱ、Ⅲ组的DCAD均为正值,与前人试验设计[5, 10]有所出入。数据显示所有试验组的干物质采食量均低于对照组, 且随着阴离子盐添加量的增加,干物质采食量降低。Bertics等[14]认为,奶牛围产前期最后7 d的干物质采食量下降将近30%,较低的干物质采食量难以满足奶牛机体的能量需要,这提示我们需要采取更有效的办法改善其适口性以防奶牛能量供给不足和犊牛发育的迟滞。
3.2 奶牛血清生理生化指标奶牛在正常情况下,机体通过钙稳态的调节保证血液钙含量维持在9~10 mg/dL,产后奶牛因为大量泌乳,钙稳态被不可逆地打破,导致血液钙含量下降到5 mg/dL以下。当血液钙含量低于用以神经和肌肉的正常生理功能的阈值时,就会损伤奶牛肌肉和神经生理功能,导致奶牛的产后瘫痪,这就是所谓的低血钙症或产褥热,伴随着产褥热发生的奶牛常常会出现代谢紊乱(包括乳房炎、胎衣不下、酮病、皱胃移位)[3]。据报道,几乎所有奶牛产后最初几天都会经历不同程度的血液钙含量降低的过程,即亚临床低血钙症;这会容易导致奶牛产后食欲低迷,进而诱发酮病、皱胃移位和乳房炎等代谢性疾病[15]。本试验结果表明产前饲喂阴离子盐可以提高奶牛产后21 d内的血清钙含量,降低奶牛产后低血钙症的发生。甲状旁腺素动员骨钙进入血液,使血液钙含量升高来维持神经肌肉的兴奋性、凝血和酶的正常功能,最终促进骨对钙的吸收。降钙素作用是减少破骨,使骨组织释放的钙盐减少,沉积的钙盐增加,最终降低血液钙含量,促进骨形成。有研究指出,围产前期饲喂阴离子盐后奶牛血液钙含量得到显著提高,而血甲状旁腺素含量则显著降低[16],这与本试验的结果不一致。而Goff等[6]发现,围产前期奶牛饲喂饲粮DCAD为负值时,虽然对血中甲状旁腺素含量影响不显著,但对血液中维生素D含量影响显著,这与本试验结果一致;可能是因为在本试验各组饲粮中维生素D含量一致的前提下,围产前期的饲粮DCAD为负值时会促进奶牛体内维生素D合成和分泌,增强钙的吸收从而提高血液钙含量,降低产褥热的发病率。
奶牛围产期定义为从产前21 d开始到产后21 d结束[17]。Herdt[18]提出,通常在奶牛干物质采食量减少的时候,由胎儿生长和泌乳引发的能量需求却在不断增加,这样高产奶牛在分娩结束后会立即出现一定程度的能量负平衡(NEB)。Bauman等[19]提出,泌乳的启动会不断向乳腺中供给牛奶合成必要的营养物质,如果分娩后的奶牛不能迅速为牛奶合成改变自身的能量和物质代谢模式,那么这样的奶牛不仅产奶量会低于其遗传潜力,而且会更容易出现代谢紊乱疾病。奶牛在泌乳早期往往优先动员干奶期储备的体脂以游离脂肪酸(NEFA)的形式释放入血液来平衡机体的能量需求,当血液胰岛素含量降低时,脂肪分解增加从而释放更多的游离脂肪酸进入血液,而肝脏通过代谢血液中的游离脂肪酸成为酮体(主要是β-HB,再酯化为甘油三酯)来去除很大一部分游离脂肪酸[18]。所以,本试验中奶牛产前3 d各试验组血清的β-HB含量差异不显著,可能是因为奶牛尚未随泌乳而流失大量的能量物质,体脂动员还不明显。产前试验Ⅲ组奶牛较低的采食量并没有显著提高围产期血清中的β-HB含量,说明在围产前期饲粮中添加阴离子盐后,虽然采食量降低了,但并不会诱发围产期奶牛酮病的发生。王建国[20]发现,与健康奶牛相比,酮病奶牛的血清β-HB含量显著升高,这也是判断奶牛是否患有酮病的依据。本试验中,产后3、7 d对照组和试验Ⅲ组的血清β-HB含量均比试验Ⅰ、Ⅱ组高,这可能是因为产前对照组饲粮高DCAD导致的低血钙症应激,影响了产后体内的能量代谢而诱发轻微酸中毒,而试验Ⅲ组血清的β-HB含量的提高可能是因为产前高DCAD饲粮适口性较差,采食量较低,能量摄取不足导致产后的NEB,使血清β-HB含量大幅上升而致。
机体对自身组织损伤和感染而产生的生理应答就是急性期反应,机体在受到刺激后的数小时内就会产生此反应,引发机体系统和代谢的改变,如体温升高、免疫抑制。淋巴细胞和单核细胞会在这个过程中活化,TNF-α就属于促炎因子,是炎症过程中的关键调节因子[20]。王建国[20]研究表明,血清TNF-α与β-HB含量呈显著负相关,表明患酮病奶牛过度动员体脂产生酮体和肝部脂肪沉积增加对TNF-α的生成有抑制作用,使机体处于免疫抑制状态。但本试验中TNF-α与β-HB并无显著相关性,与上述说法不一致。
3.3 犊牛血清抗氧化指标过高的自由基水平是机体产生氧化应激的直接原因。自由基可通过生物膜内不饱和脂肪酸过氧化反应产生脂质过氧化物以破坏膜蛋白功能,进而降低机体的免疫应答能力和生产性能。T-AOC是综合衡量抗氧化系统功能状态的指标,体现了机体应对外来刺激的代偿能力以及自由基代谢的状态。MDA是脂质过氧化物的终产物,间接反映体内氧自由基代谢状况及脂质过氧化程度。SOD是体内清除超氧阴离子自由基的重要因子并参与转换氧自由基的过氧化物酶,平衡氧化与抗氧化机制,保护细胞免受伤害。CAT是生物体内主要参与活性氧的代谢过程的物质[13]。本试验中,对照组犊牛CAT、SOD活性均比试验组高,而MDA含量、T-AOC均比试验组低。这说明产后犊牛抗氧化能力可能受母牛产前饲粮DCAD影响,其中高DCAD可能使犊牛脂质过氧化产物和相应SOD活性增强,用以参与体内活性氧代谢的物质和总抗氧化能力降低。所以产前奶牛饲喂低DCAD的饲粮,对产后犊牛抗氧化能力有提高作用。
3.4 奶牛尿液pH很多国外文献证明,评估围产前期饲粮中添加阴离子盐的重要指标之一就是产前7 d左右测试奶牛尿液的pH。Oetzel等[21]、Jardon[22]指出,在围产前期荷斯坦奶牛饲粮中添加阴离子盐之后,奶牛的尿液pH下降到6.2~6.8。Spanghero[23]认为,衡量产前低DCAD奶牛饲粮可诱发轻度代偿性代谢酸中毒的指标是:产前其尿液pH降低到5.5~6.5。围产前期奶牛摄入较多阴离子盐(主要是氯离子、硫离子)后,提高了自身血液中的氯离子、硫离子含量,为了排泄出体内多余的氯离子、硫离子,尿液的氢离子增多,其宏观表现就是尿液pH降低。本试验的结果也证明了上述结论,尤其是产前7 d时,饲粮DCAD降低导致奶牛的尿液pH显著下降。
综合以上分析和讨论,当阴离子盐添加量为15.0 g/kg时,虽然饲粮DCAD非负值,但从本试验的结果看来,该添加量已经能够达到提高奶牛产后血清钙含量、降低尿液pH到5.5~6.5和提高犊牛抗氧化能力的效果,考虑到随着阴离子盐添加量的增加,奶牛饲喂成本也会增加,所以15.0 g/kg为最佳添加量。
4 结论本试验结果表明,产前21 d添加阴离子盐以降低奶牛饲粮中DCAD是可行的,可提高产后21 d奶牛血清钙含量和犊牛血清的抗氧化能力,有利于改善奶牛产后健康和犊牛健康状况。本试验条件下,15.0 g/kg(干物质基础)为阴离子盐最佳添加量,但是该阴离子盐的适口性还有待进一步探索。
| [1] |
WU Z, BERNARD J K, TAYLOR S J. Effect of feeding calcareous marine algae to Holstein cows prepartum or postpartum on serum metabolites and performance[J]. Journal of Dairy Science, 2015, 98(7): 4629-4639. DOI:10.3168/jds.2014-8711 |
| [2] |
CURTIS C R, ERB H N, SNIFFEN C J, et al. Path analysis of dry period nutrition, postpartum metabolic and reproductive disorders, and mastitis in Holstein cows[J]. Journal of Dairy Science, 1985, 68(6): 2347-2360. |
| [3] |
CURTIS C R, ERB H N, SNIFFEN C J, et al. Association of parturient hypocalcemia with eight periparturient disorders in Holstein cows[J]. Journal of the American Veterinary Medical Association, 1983, 183(5): 559-561. |
| [4] |
BlOCK E. Manipulating dietary anions and cations for prepartum dairy cows to reduce incidence of milk fever[J]. Journal of Dairy Science, 1984, 67(12): 2939-2948. DOI:10.3168/jds.S0022-0302(84)81657-4 |
| [5] |
OETZEL G R, OLSON J D, CURTIS C R, et al. Ammonium chloride and ammonium sulfate for prevention of parturient paresis in dairy cows[J]. Journal of Dairy Science, 1988, 71(12): 3302-3309. DOI:10.3168/jds.S0022-0302(88)79935-X |
| [6] |
GOFF J P, HORST R L, MUELLER F J, et al. Addition of chloride to a prepartal diet high in cations increases 1, 25-dihydroxyvitamin D response to hypocalcemia preventing milk fever[J]. Journal of Dairy Science, 1991, 74(11): 3863-3871. DOI:10.3168/jds.S0022-0302(91)78579-2 |
| [7] |
WEST J W, HAYDON K D, MULLINIX B G, et al. Dietary cation-anion balance and cation source effects on production and acid-base status of heat-stressed cows[J]. Journal of Dairy Science, 1992, 75(10): 2776-2786. DOI:10.3168/jds.S0022-0302(92)78041-2 |
| [8] |
WEST J W, MULLINIX B G, SANDIFER T G. Changing dietary electrolyte balance for dairy cows in cool and hot environments[J]. Journal of Dairy Science, 1991, 74(5): 1662-1674. DOI:10.3168/jds.S0022-0302(91)78329-X |
| [9] |
HU W, MURPHY M R. Dietary cation-anion difference effects on performance and acid-base status of lactating dairy cows:a meta-analysis[J]. Journal of Dairy Science, 2004, 87(7): 2222-2229. DOI:10.3168/jds.S0022-0302(04)70042-9 |
| [10] |
JOYCE P W, SANCHEZ W K, GOFF J P. Effect of anionic salts in prepartum diets based on alfalfa[J]. Journal of Dairy Science, 1997, 80(11): 2866-2875. DOI:10.3168/jds.S0022-0302(97)76251-9 |
| [11] |
DEGARIS P J, LEAN I J, RABIEE A R, et al. Effects of increasing days of exposure to prepartum transition diets on milk production and milk composition in dairy cows[J]. Australian Veterinary Journal, 2008, 86(9): 341-351. DOI:10.1111/avj.2008.86.issue-9 |
| [12] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [13] |
吴文旋, 段永邦, 李胜利. 饲粮阴阳离子差对围产期奶牛酸碱平衡、血浆钙浓度及抗氧化应激的影响[J]. 动物营养学报, 2013, 25(4): 856-863. |
| [14] |
BERTICS S J, GRUMMER R R, CADORINGA-VALINO C, et al. Effect of prepartum dry matter intake on liver triglyceride concentration and early lactation[J]. Journal of Dairy Science, 1992, 75(7): 1914-1922. DOI:10.3168/jds.S0022-0302(92)77951-X |
| [15] |
HORST R L, GOFF J P, REINHARDT T A, et al. Strategies for preventing milk fever in dairy cattle[J]. Journal of Dairy Science, 1997, 80(7): 1269-1280. DOI:10.3168/jds.S0022-0302(97)76056-9 |
| [16] |
桑松柏, 夏成, 张洪友, 等. 阴离子盐对围产期奶牛低钙血症的预防作用[J]. 中国兽医杂志, 2009, 45(12): 50-51. DOI:10.3969/j.issn.0529-6005.2009.12.019 |
| [17] |
GRUMMER R R. Impact of changes in organic nutrient metabolism on feeding the transition dairy cow[J]. Journal of Animal Science, 1995, 73(9): 2820-2833. DOI:10.2527/1995.7392820x |
| [18] |
HERDT T H. Ruminant adaptation to negative energy balance:influences on the etiology of ketosis and fatty liver[J]. Veterinary Clinics of North America:Food Animal Practice, 2000, 16(2): 215-230. DOI:10.1016/S0749-0720(15)30102-X |
| [19] |
BAUMAN D E, CURRIE W B. Partitioning of nutrients during pregnancy and lactation:a review of mechanisms involving homeostasis and homeorhesis[J]. Journal of Dairy Science, 1980, 63(9): 1514-1529. DOI:10.3168/jds.S0022-0302(80)83111-0 |
| [20] |
王建国. 围产期健康奶牛与酮病、亚临床低钙血症病牛血液代谢谱的比较与分析[D]. 博士学位论文. 长春: 吉林大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10183-1013193828.htm
|
| [21] |
OETZEL G R, GOFF J P.Milk fever(parturient paresis)in cows, ewes, and doe goats[M]//ANDERSON D E, RINGS D M, eds.Food Animal Practice.5th ed.Amsterdam:Elsevier Inc, 1998:215-218.
|
| [22] |
JARDON P W. Using urine pH to monitor anionic salt programs[J]. Compendium on Continuing Education for Practicing Veterinarian, 1995, 17: 860-862. |
| [23] |
SPANGHERO M. Prediction of urinary and blood pH in non-lactating dairy cows fed anionic diets[J]. Animal Feed Science and Technolgy, 2004, 116(1/2): 83-92. |




