2. 河南农业大学牧医工程学院, 农业部动物生化与 营养重点实验室, 郑州 450002;
3. 洛阳市龙须坡农牧有限公司, 汝阳 471200;
4. 河南省汝阳县农牧局, 汝阳 471200;
5. 河南省平顶山市畜牧局, 平顶山 467000;
6. 河南省济源市动物卫生监督所, 济源 459000
2. Key Laboratory of Animal Biochemistry and Nutrition, Ministry of Agriculture, College of Animal Science and Veterinary Medicine, Henan Agricultural University, Zhengzhou 450002, China;
3. Luoyang Longxupo Agriculture and Livestock Co., Ltd., Ruyang 471200, China;
4. Ruyang Agriculture and Animal Husbandry Bureau, Ruyang 471200, China;
5. Pingdingshan Animal Husbandry Bureau of Henan Province, Pingdingshan 467000, China;
6. Institute of Jiyuan Animal Health Supervision of Henan Province, Jiyuan 459000, China
杜仲(Eucommia ulmoides Oliver)是名贵的中药,皮入药,具有补肝肾,强筋骨、补气、安胎等功效。现代研究发现,杜仲有降血脂、降压、抗氧化、增强免疫力等作用[1]。杜仲叶量大易得,其化学成分和药理作用与杜仲皮相似[2-3]。杜仲叶含有大量的活性成分,根据其化学结构可分为木脂素类及苷类(包括丁香脂素二糖甙、松脂素二糖苷、中脂素等28种)、环烯醚萜类(包括京尼平苷酸、京尼平苷、桃叶珊瑚苷等15种)、苯丙素类(包括绿原酸、香草酸、咖啡酸等11种)、黄酮类(包括黄酮醇、芦丁、槲皮素等10种)、杜仲胶、氨基酸(16种)、维生素(4种)、微量元素(13种)及其他成分。其主要的活性成分含量(干物质基础)为丁香脂素二糖甙0.003%,京尼平苷酸0.07%,京尼平苷0.08%,桃叶珊瑚苷2.44%,绿原酸2.84%~5.28%,黄酮2.21%[1, 4]。干叶中粗脂肪的含量为7.25%,其脂肪酸的组成为豆蔻酸0.30%、棕榈酸10.70%、硬脂酸1.72%、十六三烯酸0.75%、亚油酸1.59%、亚麻酸45.85%、花生酸5.01%、山嵛酸16.36%、二十三烷酸9.95%、二十四烷酸7.10%和少量其他挥发性脂肪酸,其中十六三烯酸、亚油酸、亚麻酸3种不饱和脂肪酸(UFA)的含量为48.19%[5]。我国有丰富的杜仲叶资源,其用途除作为茶饮外,还可当作特殊的饲料在畜牧生产中应用。作为饲料,杜仲叶不仅提高动物的生产性能,而且提高了畜产品质量[6]。因此,研究杜仲叶饲料对畜产品质量的提高具有重要的意义。大量研究发现,在饲粮中添加杜仲叶或其提取物可以增强动物免疫功能,提高其生长性能,改善肉品质等[7]。杜仲叶中的活性功能成分(绿原酸、京尼平苷酸、桃叶珊瑚苷、黄酮等)具有抗菌、抗炎、抗病毒、抗氧化、减少肝脏脂肪沉积及减轻肝细胞损伤等功能[8-9]。杜仲叶及其提取物作为饲料添加剂逐渐在畜牧生产中应用,具有很大的开发价值和市场前景。杜仲叶作为饲料或添加剂在畜牧生产中的应用虽已有一些报道,但都偏重在猪和禽等单胃动物,且大多研究内容仅局限在生产效果,产品质量改善和血液生化等方面,缺乏深层次的机理研究,在反刍动物方面的研究很少。少数涉及机理方面的报道也是以大鼠、小鼠或细胞为基础进行的研究[10-11],缺乏整体性和系统性。本课题组此前曾在杜仲叶对绵羊饲料利用、生长性能和屠宰性能影响方面进行了研究报道[12],但未在脂肪代谢方面做机理性的探讨。本研究拟在绵羊血液、组织和分子水平深入研究杜仲叶调节脂肪代谢、影响肉品质的机理,为杜仲叶饲料资源的开发利用提供理论依据。
1 材料与方法 1.1 杜仲叶的来源、营养组成及饲粮配制本研究所用的杜仲叶来自河南省汝阳县种植的杜仲树,秋末采集晒干后,打包存放。经分析,杜仲叶的常规营养成分含量(风干基础)为:干物质(DM)89.46%,总能(GE)19.47 MJ/kg,粗蛋白质(CP)12.38%,钙(Ca)2.06%,磷(P)0.05%。根据NRC(2007) [13]羊营养需要设计饲粮,由全混合日粮(TMR)混合机(9JSG-5) 混合搅拌成TMR。
1.2 试验设计及动物饲养于2015年4月20日至2015年8月22日在河南省洛阳市龙须破农牧有限公司的养殖基地(河南省汝阳县小店镇)进行试验。选择70~80日龄、体重25~30 kg的30只绵羊(湖羊),试验采用单因素完全随机区组设计,饲粮为试验因素,按照体重相近的原则,随机分为3组,对照组(CTL组)(饲粮中不含杜仲叶),低水平杜仲叶组(EUL1组,饲粮含10%杜仲叶),高水平杜仲叶组(EUL2组,饲粮含20%杜仲叶),每组10只。试验饲粮组成及营养水平见表 1。开始试验前,羊只统一驱虫。预试期15 d,正试期90 d。每日早、晚饲喂2次。各组试验羊分圈群饲,每个圈内槽位比羊数多4~5个,饲料均匀撒在料槽内,保证每只羊均能吃到饲料,剩料量控制在5%左右。试验羊可自由饮水和运动。每天清理水槽,打扫羊舍。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
饲粮CP含量用凯氏定氮法[15]测定(全自动凯氏定氮仪SKD-2000,上海沛欧分析仪器有限公司);EE含量用索氏抽提法[16]测定(索氏提取仪BSXT-06,上海比朗仪器有限公司);钙含量用原子吸收分光光度法测定(原子吸收光谱仪Z-2000,日本日立公司);总磷含量用钼黄分光光度法测定(紫外可见分光光度计T6,北京普析通用分析仪器有限责任公司)[17];NDF、ADF含量参照国家标准测定[18-19]。
1.4 采食量测定正试期期间每天记录供料量和剩料量,计算采食量,根据饲粮营养成分含量计算主要营养物质采食量。
1.5 血样采集及处理正试期结束前1周,于早饲前(07:00) 分别从每只试验羊的静颈脉采集血液样品,用真空采血管(抗凝管)采血5 mL,缓慢翻转2次,使抗凝剂和血液充分混合,置于4 ℃左右的保温箱中,采血结束后,以1 500×g离心15 min(离心机型号:TDZS-WS,湘仪离心机厂),然后分离血浆,置于EP管中,-20 ℃保存,待测。
1.6 血浆脂质代谢指标测定血浆甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)含量用全自动生化分析仪(AU640,日本Olympus公司)测定;极低密度脂蛋白(VLDL)、游离脂肪酸(NEFA)含量用酶联免疫吸附试验(ELISA)法测定(试剂盒购自上海蓝基生物科技有限公司),具体操作按照说明书进行。
1.7 肉样采集饲养试验结束后,称重,每组随机选取试验羊5只,禁食24 h,禁水12 h后,称重,参照文献[20]中的方法屠宰。胴体常温放置排酸24 h,然后取胸腰段背最长肌样品200 g左右,用锡纸包好,装入塑料自封袋中,存放于有冰块的保温箱(2 ℃)中,带回实验室后放入-20 ℃冰箱中保存,待测。
1.8 肌肉营养成分含量的测定取适量肉样,剔除可见的肌膜、筋键等后切碎后,用于测量水分含量[21](电热恒温鼓风干燥箱DHG-9123A,上海煜南仪器有限公司)。另取一部分肉样经冷冻干燥后,研磨过60目筛后测定下列各项指标:粗蛋白质含量,凯氏定氮法[15](全自动凯氏定氮仪SKD-2000,上海沛欧分析仪器有限公司);粗脂肪含量,索氏抽提法[16](索氏提取仪BSXT-06,上海比朗仪器有限公司);粗灰分含量,灼烧重量法[22](马弗炉SX2-8-10,江苏泰州贝斯特电热电器有限公司)。脂肪酸含量,气相色谱法[23](Thermo Trace 1300,美国Thermo Fisher公司)。胆固醇含量,高效液相色谱法[24](Waters 2695 HPLC,美国Waters公司)。
1.9 脂肪代谢相关酶和核转录因子的mRNA表达水平测定实时荧光定量PCR测定肝脏组织中脂肪代谢相关酶和核转录因子的mRNA表达水平,脂肪代谢相关酶包括如硬脂酰辅酶A去饱和酶1(SCD1)、乙酰辅酶A羧化酶-α(ACC-α)、脂肪酸合成酶(FASN)、肉毒碱棕榈酰基转移酶1A(CPT1A)、脂蛋白酯酶(LPL)、甘油三酯脂酶(ATGL),核转录因子包括固醇调节元件结合蛋白1c(SREBP-1c)、过氧化物酶体增生激活受体γ(PPARγ)、过氧化物酶体增生激活受体α(PPARα)、CCAAT/增强子结合蛋白α(C/EBPα)。根据GenBank上搜索羊的相应基因序列设计上述基因的引物,利用在线引物设计软件(http://primer5.ut.ee/)选择引物序列,然后委托生工生物工程(上海)股份有限公司合成引物,并进行特异性验证试验,直至设计得到理想引物,具体引物信息见表 2。
|
|
表 2 基因引物信息 Table 2 Primer information of genes |
测定方法为:迅速从液氮中取出肝脏组织,剪下0.5 g左右,用RNAisoPlus提取总RNA,用反转录试剂盒(大连TaKaRa公司,PrimeScriptTM RT reagent Kit with gDNA Eraser)反转录为cDNA,使用实时荧光定量PCR仪(Mastercycler nexus, 德国Eppendorf公司)进行实时荧光定量PCR,采用SYBRGreen法进行,反应参数设置为95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火20 s,40个循环。
1.10 脂肪代谢相关酶和核转录因子的蛋白水平测定对于上述mRNA测定中表达水平差异显著(P < 0.05) 的基因,用蛋白质免疫印迹(Western blot)方法测定其蛋白水平。方法是:取冻存羊肝脏组织样品约0.1 g,用加入含1%蛋白酶抑制剂苯甲基磺酰氟(PMSF)的RIPA裂解液1 mL,裂解肝脏组织细胞,同时液氮研磨,再用组织匀浆机匀浆30 s,冰上静置30 min,12 000×g离心20 min,取中间液相,除去液面的脂肪和底部沉淀。再次12 000×g离心20 min,取中间液相。双金鸡宁酸(BCA)法测定蛋白质浓度,99 ℃煮沸10 min使蛋白质变性。制备十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)胶,样品蛋白质上样(50 μg),先在100 V条件下凝胶电泳,待蛋白条带由浓缩胶进入分离胶后,将电压调高至120~140 V,继续电泳至溴酚蓝移动到距胶底部0.5~1.0 cm,停止电泳。将凝胶湿转到事先用甲醇浸泡15 min激活后的醋酸纤维素膜(PVDF)上,倒入转膜液,接通电源,电压调至105 V转膜70 min。转膜后,用5%脱脂奶封闭液封闭1 h。然后加入一抗(事先用5%脱脂奶按1:1 000稀释),4 ℃孵育过夜,用TBST洗膜3次,每次5 min。洗膜后加入二抗[辣根过氧化物酶(HRP)标记山羊抗兔免疫球蛋白G(IgG)用5%脱脂奶按1:3 000进行稀释],在室温孵育2 h,之后再用TBST洗膜3次,每次5 min。ECL法显影,用Image J对显影照片中的目的条带进行灰度光密度分析,定量结果。同一样本采用β-肌动蛋白(β-actin)作为内参。
1.11 数据统计分析测定数据用Excel 2007初步处理后,用Graphpad prism 5.0统计软件的单因素方差分析(one-way ANOVA)进行组间差异分析。当方差分析差异显著时,再用Turkey氏法进行多重比较分析,以P < 0.05为差异显著,P < 0.01为差异极显著,0.05≤P < 0.10为差异有显著趋势,数据用平均值±标准误表示。
2 结果 2.1 杜仲叶对绵羊采食量的影响杜仲叶对绵羊干物质采食量及主要营养物质采食量的影响见表 3。EUL1和EUL2组绵羊的干物质采食量显著增加(P<0.05),EUL1组显著高于EUL2组(P<0.05);EUL1、EUL2组代谢能采食量、氮采食量显著高于CTL组(P<0.05),EUL1与EUL2组间差异不显著(P>0.05);各组钙采食量、磷采食量差异不显著(P>0.05)。
|
|
表 3 杜仲叶对绵羊干物质采食量及主要营养物质采食量的影响(干物质基础) Table 3 Effects of Eucommia ulmoides leaves on DMI and main nutrient intakes of sheep (DM basis) |
杜仲叶对绵羊血浆脂质代谢指标的影响见表 4。与CTL组相比,EUL2绵羊血浆HDL、VLDL和NEFA含量显著升高(P < 0.05),EUL1组与CTL组差异不显著(P>0.05);EUL1和EUL2组血浆TC含量较CTL组显著降低(P < 0.05),EUL1组与EUL2组差异不显著(P>0.05);EUL1和EUL2组血浆LDL含量较CTL组有下降趋势(0.05≤P < 0.10)。
|
|
表 4 杜仲叶对绵羊血浆脂质代谢指标的影响 Table 4 Effects of Eucommia ulmoides leaves on plasma lipid metabolism indices of sheep |
杜仲叶对绵羊肌肉营养成分含量的影响见表 5。各组之间肌肉水分、胆固醇和粗灰分含量差异不显著(P>0.05);与CTL组相比,EUL1和EUL2组肌肉粗蛋白含量升高,其中EUL1组显著升高(P < 0.05),EUL2组与其他2组差异不显著(P>0.05);肌肉粗脂肪的含量表现为EUL2组>EUL1组>CTL组,EUL2组显著高于CTL组(P < 0.05),EUL1组与其他2组差异不显著(P>0.05);与CTL组相比,EUL1和EUL2组肌肉剪切力下降,EUL1组显著下降(P < 0.05),EUL2组与其他2组差异不显著(P>0.05)。
|
|
表 5 杜仲叶对绵羊肌肉营养成分含量的影响 Table 5 Effects of Eucommia ulmoides leaves on muscle nutrient contents of sheep |
杜仲叶对绵羊肌肉脂肪酸组成的影响见表 6。在肌肉中共测定出14种脂肪酸,分为饱和脂肪酸(SFA)和UFA,其中UFA又分为单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)。分析发现,随着杜仲叶添加水平的升高,肌肉SFA含量逐渐降低,但各组间差异不显著(P>0.05);肌肉UFA含量随着杜仲叶添加水平的升高逐渐升高,组间差异显著(P < 0.05),其中,与CTL组相比,EUL2组肌肉MUFA、PUFA含量显著升高(P < 0.05),EUL1组变化不显著(P>0.05);总脂肪酸的含量也随着杜仲叶添加水平的升高逐渐增加。随着杜仲叶添加水平的升高,肌肉中UFA/SFA升高,由CTL组的1.49上升到EUL1组的1.85和EUL2组的2.22,EUL2组显著高于CTL组(P < 0.05)。进一步分析发现,各组肌肉各种SFA的含量无显著差异(P>0.05),各种肌肉UFA的含量均有不同程度增加,EUL1和EUL2组肌肉十五碳一烯酸、棕榈油酸、亚油酸、花生四烯酸含量均显著高于CTL组(P < 0.05),α-亚麻酸含量有高于CTL组的趋势(0.05≤P < 0.10),EUL2组肌肉油酸含量显著高于CTL组(P < 0.05)。
|
|
表 6 杜仲叶对绵羊肌肉脂肪酸组成的影响 Table 6 Effects of Eucommia ulmoides leaves on muscle fatty acid composition of sheep |
杜仲叶对绵羊肝脏脂肪代谢相关酶和核转录因子mRNA表达水平的影响见表 7。与脂肪合成相关的代谢酶,与CTL组相比,EUL1和EUL2组肝脏SCD1的mRNA表达水平降低,其中EUL2组显著下降(P < 0.05),ACC-α、FASN mRNA表达水平变化不显著(P < 0.05)。与脂肪分解相关的代谢酶,与CTL组相比,EUL1和EUL2组肝脏CPT1A的mRNA表达水平升高,其中EUL1组显著升高(P < 0.05);EUL1组肝脏LPL的mRNA表达水平在显著升高(P < 0.05),EUL2组变化不显著(P>0.05);肝脏ATGL mRNA表达水平各组之间差异不显著(P < 0.05)。与脂肪合成相关的核转录因子,与CTL组相比,EUL1和EUL2组肝脏SREBP-1c的mRNA表达水平均显著降低(P < 0.05),EUL1组与EUL2组之间差异不显著(P>0.05);EUL2组肝脏PPARγ的mRNA表达水平显著降低(P < 0.05),EUL1组变化不显著(P>0.05)。与脂肪分解相关的核转录因子,肝脏PPARα的mRNA表达水平在各组之间差异不显著(P>0.05)。肝脏C/EBPα的mRNA表达水平在各组之间均差异不显著(P>0.05)。
|
|
表 7 杜仲叶对绵羊肝脏脂肪代谢相关酶和核转录因子mRNA表达水平的影响 Table 7 Effects of Eucommia ulmoides leaves on mRNA expression levels of lipid metabolism related enzymes and nuclear factors in liver of sheep |
为进一步研究核转录因子和脂肪代谢酶的关系,选择mRNA表达水平差异显著的脂肪代谢酶SCD1、LPL及核转录因子SREBP-1c、PPARγ继续在蛋白水平上进行研究,其Western blot测定结果见图 1。上述脂肪代谢酶和核转录因子的蛋白水平变化与其mRNA表达水平变化基本一致,与CTL组相比,肝脏PPARγ和SCD1蛋白水平在EUL1和EUL2组依然表现为下降,EUL2组的下降幅度更大,EUL2组SCD1蛋白水平显著下降(P < 0.05),也证明了PPARγ和SCD1是调节脂肪代谢重要的因子,但肝脏SREBP-1c和LPL的蛋白水平在各组之间差异不显著(P>0.05)。
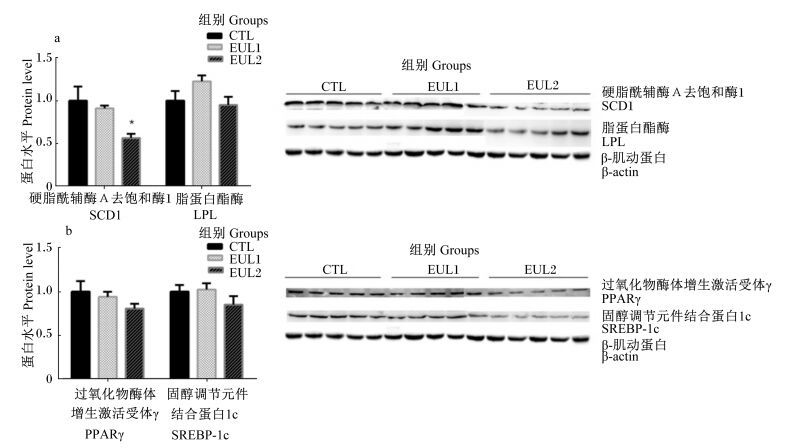
|
图 1 杜仲叶对绵羊肝脏脂肪代谢相关酶(a)和转录因子蛋白水平(b)的影响 Figure 1 Effects of Eucommia ulmoides leaves on protein expression levels of lipid metabolism related enzymes (a) and nuclear factors (b) in liver of sheep |
大量研究表明,杜仲叶对血液生理指标有显著影响。马驰聘等[25]研究发现,猪饲粮中添加杜仲叶可降低血液中TG和TC的含量。另有研究表明,鸡饲粮中添加一定水平的杜仲叶后血清中的TG、TC、LDL含量降低,而HDL含量升高,过氧化氢酶(CAT)、过氧化物酶(POD)活性增强,血清中丙二醛(MDA)含量、肝脏脂肪含量及肝脏指数显著降低[26-27]。TG、TC、VLDL、LDL、HDL含量是反映机体脂肪代谢水平的重要指标。血液VLDL是肝脏向外运输TG的形式,与TG是此消彼长的关系。本研究中,EUL1和EUL2组血浆VLDL升高表明肝脏内向外运输TG的量增加,同时血浆TG含量降低,符合变化规律。LDL来自VLDL的降解,可将肝内合成的胆固醇转运至肝外组织参加代谢。本研究中,EUL1和EUL2组LDL和TC含量均显著降低,表明肝脏内胆固醇的合成减少。HDL主要由肠合成,也可由VLDL转化而成,其作用是将外周组织胆固醇运至肝内代谢生成胆汁酸排出体外,本研究中EUL1和EUL2组血浆HDL含量显著升高与TC含量的降低有关,同时也与VLDL含量升高,分解产生的HDL含量增加有关,VLDL分解产生的TG又被分解生成NEFA,导致NEFA含量显著升高。这种变化与杜仲叶中的丁香脂醇二糖甙、京尼平苷酸、桃叶珊瑚甙等成分抑制脂肪的吸收与合成,促进脂肪的分解等作用有关[1, 28]。
3.2 杜仲叶对绵羊肌肉脂肪酸组成和肉品质的影响脂肪是影响肉品质的重要指标,肌内脂肪含量直接影响肉的风味和品质。肌内脂肪含量升高可降低肌肉的剪切力,增加肌肉的嫩度。曹国文等[29]研究表明,在育肥猪的饲粮中添加杜仲叶提取物为主要成分的中草药饲料添加剂,可使育肥猪日增重增加9.43%,料重比下降10.23%,背膘厚下降20.35%,瘦肉率增加15.10%,眼肌面积增加6.70%,鲜肉失水率下降12.02%。王建辉等[7]研究得出,饲粮中添加杜仲提取物能显著提高猪肌肉肌内脂肪、总氨基酸和鲜味氨基酸含量,并可降低滴水损失,对肉色评分、眼肌面积和肌肉大理石纹评分有一定改善作用。上述研究说明杜仲叶可改变体内脂肪的代谢和分配,减少皮下脂肪的沉积,增加肌内脂肪的含量,改善肉品质。
进一步分析发现,EUL1、EUL2组肌肉中SFA的含量差异不大,而UFA含量的显著升高,这是杜仲叶影响肉品质改善的重要原因。普遍认为,饲粮中脂肪酸的组成对肌肉中脂肪的含量和脂肪酸的组成有较大影响。EUL1、EUL2组肌肉中UFA含量的升高与以下几个方面的因素有关:1) 杜仲叶中含有丰富的UFA,如十六碳三烯酸、亚油酸、α-亚麻酸、花生酸等,增加了肌肉中UFA的前体物含量[5];2) 杜仲叶中的木质素、环烯醚萜类、黄酮类等化合物均可影响体内脂肪的代谢,抑制SFA的合成[30-32];3) 杜仲叶中的有效成分可影响体内脂肪的分配,可降低血液中脂肪的水平,增加肌内脂肪的含量[7, 29](其调控机制尚不十分清楚)。本课题组此前的研究表明,杜仲叶在一定程度上可增加动物的采食量,提高日增重,但对宰前活重影响不显著,对屠宰性能有不同的影响,骨肉比升高,屠宰率和胴体净肉率降低[12]。在本研究中,肌肉中粗蛋白质和粗脂肪的含量增加,提示杜仲叶的有效成分改变了动物体内的营养分配,其对体内整体脂肪的分配有何影响,有待进一步研究。
不同的脂肪酸对肉品质的影响不同。反刍动物肌肉中的脂肪以长链饱和性脂肪酸酸和单不饱和性脂肪酸为主,脂肪酸降解形成的不同短链脂肪酸,如己酸、辛酸是形成肉品特殊风味的重要物质[33]。棕榈油酸、油酸和亚油酸对肉的风味作用较大,而硬脂酸、α-亚麻酸、癸酸和丁酸与肉的异味有关[34-35]。因此,肌内脂肪酸的含量和组成是影响肉风味的主要原因。研究表明,大部分SFA如月桂酸、豆蔻酸、棕榈酸被认为具有诱发心血管疾病的危险。Keys等[36]和Schroeder等[37]研究发现,SFA(除硬脂酸外)有升高体内胆固醇的作用,而UFA有降低血液糖、脂肪、胆固醇含量的作用。油酸是MUFA,占肌肉脂肪酸含量的34%~43%,有降低胆固醇的作用,被认为是良性脂肪酸;PUFA(n-3和n-6系列)在生物体内发挥降血脂、降血压、预防动脉粥样硬化等多方面的生物学效应[38-39]。一般用PUFA/SFA作为衡量肉品质的指标,PUFA/SFA在一定范围内升高对降低血液TG、VLDL和TC含量有利。本研究中,EUL1与EUL2组SFA的含量不同程度地下降,而UFA的含量及PUFA/SFA不同程度地升高,对羊肉品质有改善作用。尽管如此,由于反刍动物的瘤胃消化特点,杜仲叶的有效成分对羊肉中脂肪酸组成有多大的影响,还有待进一步研究。
3.3 杜仲叶对肝脏脂肪代谢基因表达的影响肝脏是脂肪代谢的中心,在一定程度上可反映机体脂肪的代谢状况。据报道,杜仲叶中的有效成分,如丁香脂醇二糖甙、桃叶珊瑚甙、京尼平苷酸、绿原酸、黄酮等可通过细胞内信号通路影响脂肪的合成与分解。潘永芳等[40]报道,杜仲叶可抑制小鼠肝脏FASN合成,减少脂肪合成,增加激素敏感酯酶(HSL)蛋白水平和基因表达水平,促进脂肪分解,提高ACC氧化酶(ACO)和肉碱脂酰转移酶(CACT)mRNA表达水平,进而促进脂肪氧化,减少体内脂肪沉积。李文娜等[41-42]研究表明,杜仲叶物绿原酸提取物可减少大鼠食物中脂肪、胆固醇和胆汁酸的吸收,降低胰脂肪酶、羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶的活性,抑制胆固醇微胶粒的形成。除特殊的药物成分外,杜仲叶中丰富的PUFA对肝脏脂肪合成酶基因的表达也有较大的影响。据报道,n-3和n-6等可抑制肝脏生脂酶,如FASN、乙酰辅酶A羧化酶(ACC)和硬脂酰辅酶A去饱和酶(SCD)基因的表达,并促进脂肪β-氧化相关酶基因的表达,降低体内脂肪的含量和心脑血管疾病的风险[10, 43-44]。
PPARα是配体激活的核转录因子,属于过氧化物酶体增生激活受体(PPARs)家族成员,与糖和脂肪的代谢有关,长链脂肪酸(LCFA)是PPARs主要的内源性配体。PPARs主要包括PPARα、PPARβ/δ和PPARγ 3种亚型。PPARα主要调节脂肪酸的转运、酯化、氧化,抑制炎症反应,在肝细胞、心肌细胞中高表达[45]。PPARα的调控的基因有CPT1A、电子转移黄素蛋白脱氢酶(ETFDH)、线粒体三功能蛋白(HADHA)、羟甲基戊二酰辅酶A合成酶2(HMGCS2) 和LPL,前3个基因参与线粒体LCFA的β氧化,CPT1A是β氧化的关键调节酶,能将LCFA转运到线粒体[46]。本研究中,EUL1、EUL2组中肝脏PPARα的mRNA表达水平稍有升高,表示肝脏脂肪的氧化增强。
PPARγ主要在分化的脂肪细胞中表达,控制脂肪合成和能量贮存有关基因的转录,如脂肪酸结合蛋白(AFABP)、脂酰辅酶A合成酶、脂肪酸合成酶、硬酯酰辅酶A去饱和酶、LPL、脂肪酸转运蛋白1(FATP1) 等,调节脂肪的合成、转运、储存及脂肪细胞的分化等。当脂肪细胞中TG不足时,外源性LCFA会激活PPARγ,诱导TG储存相关基因的表达[47-48]。本研究中,EUL1、EUL2组中肝脏PPARγ的mRNA表达水平显著下降,表明肝脏中脂肪细胞的数量减少,同时也证明了杜仲叶中的有效成分对PPARγ基因的抑制作用。
SREBP-1c是核转录因子固醇调节元件结合蛋白(SREBPs)家族的重要成员,主要调节脂肪酸合成和葡萄糖代谢有关基因的表达,包括ACC、FASN、SCD1、低密度脂蛋白受体(LDLR)等,促进肝脏脂肪的合成[49]。本研究中,EUL1、EUL2组肝脏SREBP-1c的mRNA表达水平和蛋白水平降低预示脂肪酸合成相关酶的转录水平降低;肝脏FASN、ACC-α的mRNA表达水平变化不显著,肝脏SCD1的mRNA表达水平和蛋白水平均显著降低,总的态势为脂肪酸合成下降。SCD1是脂肪酸合成过程中的关键酶,棕榈酰辅酶A和硬脂酰辅酶A可经SCD1催化去饱和生成棕榈油酰辅酶A和油酰辅酶A。本研究中,肝脏SCD1的mRNA表达水平和蛋白水平显著降低,表示脂肪酸的合成受到抑制。此外,PPARα调控脂肪酸分解相关酶的转录。本研究中,肝脏PPARα的mRNA表达水平略有升高,预示脂肪酸分解酶的转录会升高。CPT1A、ATGL、LPL为脂肪分解过程中的酶,EUL1和EUL2组肝脏中脂肪分解相关酶基因CPT1A、ATGL、LPL的mRNA表达水平均有不同程度的升高(EUL2组中LPL除外),印证了PPARα的变化结果,表示肝脏脂肪的分解能力增强,与EUL1和EUL2组血浆中TG、VLDL、TC、LDL含量的降低相吻合,同时也暗示了EUL1、EUL2组肌肉中USFA含量的增加可能不是来自肝脏的合成,而杜仲叶的有效成分对肌内脂肪代谢的影响机制还不清楚,有待下一步研究。
4 结论① 杜仲叶可显著影响绵羊体内脂肪的代谢。
② 杜仲叶可调节肌肉中脂肪酸的组成,增加肌肉中USFA比例,改善羊肉品质。
③ 杜仲叶通过影响肝脏脂肪代谢相关酶和核转录因子基因的表达,调节肝脏内脂肪的代谢。
| [1] |
管淑玉, 苏薇薇. 杜仲化学成分与药理研究进展[J]. 中药材, 2003, 26(2): 124-129. |
| [2] |
杜香莉, 郭军战, 王立宏. 我国杜仲叶有效成分及加工利用的研究与发展方向[J]. 西南林学院学报, 2000, 20(3): 180-185. |
| [3] |
ZHOU J F, ZHANG T M, CHEN W A, et al. Comparative analysis of chemical components between barks and leaves of Eucommia ulmoides oliver[J]. Journal of Central South University of Technology, 2009, 16(3): 371-379. DOI:10.1007/s11771-009-0063-x |
| [4] |
张军民, 高振川, 张琪, 等. 杜仲叶及提取物营养价值和药用成分研究[J]. 氨基酸和生物资源, 2002, 24(1): 1-2. |
| [5] |
安秋荣, 郭志峰. 杜仲叶脂肪酸的GC-MS分析[J]. 河北大学学报:自然科学版, 1998, 18(4): 372-374. |
| [6] |
陈玉敏, 黄涛, 宋小珍, 等. 饲粮中添加杜仲叶提取物对爱拔益加肉鸡生长性能及免疫功能的影响[J]. 动物营养学报, 2015, 27(7): 2224-2230. |
| [7] |
王建辉, 贺建华, 易宣, 等. 杜仲提取物对猪胴体品质及肌肉氨基酸含量的影响[J]. 动物营养学报, 2007, 19(3): 269-276. |
| [8] |
刘云龙, 宋卓, 彭冰洁, 等. 绿原酸对高脂饲粮诱导非酒精性脂肪肝大鼠细胞凋亡相关基因表达的影响[J]. 动物营养学报, 2015, 27(7): 2140-2149. |
| [9] |
KOBAYASHI Y, HIROI T, ARAKI M, et al. Facilitative effects of Eucommia ulmoides on fatty acid oxidation in hypertriglyceridaemic rats[J]. Journal of the Science of Food and Agriculture, 2012, 92(2): 358-365. DOI:10.1002/jsfa.v92.2 |
| [10] |
郑国栋, 潘永芳, 黎冬明, 等. 杜仲叶对小鼠肝脏脂肪代谢酶活性的影响[J]. 中国食品学报, 2014, 14(11): 22-26. |
| [11] |
HAO S, XIAO Y, LIN Y, et al. Chlorogenic acid-enriched extract from Eucommia ulmoides leaves inhibits hepatic lipid accumulation through regulation of cholesterol metabolism in HepG2 cells[J]. Pharmaceutical Biology, 2016, 54(2): 251-259. DOI:10.3109/13880209.2015.1029054 |
| [12] |
杨改青, 王林枫, 廉红霞, 等. 杜仲叶对绵羊营养物质消化利用、生长性能及屠宰性能的影响[J]. 动物营养学报, 2017, 29(4): 1383-1391. |
| [13] |
N RC. Nutrient requirements of small ruminants:sheep, goats, cervids, and new world camelids[M]. Washington, D.C.: National Academies Press, 2017, 215-234.
|
| [14] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004, 97.
|
| [15] |
全国肉禽蛋制品标准化技术委员会. GB/T 9695. 11-2008肉与肉制品氮含量测定[S]. 北京: 中国标准出版社, 2009.
|
| [16] |
全国食品工业标准化技术委员会肉禽蛋制品分技术委员会. GB/T 9695. 7-2008肉与肉制品总脂肪含量测定[S]. 北京: 中国标准出版社, 2008.
|
| [17] |
张丽英. 饲料分析及饲料质量检测技术[M]. 2版.北京: 中国农业大学出版社, 2003, 49-147.
|
| [18] |
全国饲料工业标准化技术委员会. GB/T 20806-2006饲料中中性洗涤纤维(NDF)的测定[S]. 北京: 中国标准出版社, 2007.
|
| [19] |
中华人民共和国农业部. NY/T 1459-2007饲料中酸性洗涤纤维的测定方法[S]. 北京: 农业出版社, 2008.
|
| [20] |
赵有璋. 现代中国养羊[M]. 北京: 金盾出版社, 2005, 710-721.
|
| [21] |
全国肉禽蛋制品标准化技术委员会. GB/T 9695. 15-2008肉与肉制品水分含量测定[S]. 北京: 中国标准出版社, 2008.
|
| [22] |
全国食品工业标准化技术委员会肉禽蛋制品分技术委员会. GB/T 9695. 18-2008肉与肉制品总灰分测定[S]. 北京: 中国标准出版社, 2009.
|
| [23] |
中国商业联合会. GB/T 9695. 2-2008肉与肉制品脂肪酸测定[S]. 北京: 中国标准出版社, 2008.
|
| [24] |
中国计量科学研究院. GB/T 22220-2008食品中胆固醇的测定高效液相色谱法[S]. 北京: 中国标准出版社, 2008.
|
| [25] |
马驰聘, 魏天盛. 添加杜仲叶对生长、育肥猪生长性能、血液及肉品质特性的影响[J]. 中国饲料添加剂, 2009(11): 42-45. |
| [26] |
欧爱明, 薛立群, 邓治邦. 杜仲叶粉对鸡肉用性能影响的研究[J]. 动物医学进展, 2004, 25(5): 104-106. |
| [27] |
李文华, 宋东亮, 唐玉清, 等. 杜仲防治蛋鸡脂肪肝综合征的试验研究[J]. 中国畜牧兽医, 2010, 37(5): 181-182. |
| [28] |
晏媛, 郭丹. 杜仲叶的化学成分及药理活性研究进展[J]. 中成药, 2003, 25(6): 491-492. |
| [29] |
曹国文, 曾代勤, 戴荣国, 等. 猪用中草药饲料添加剂的研究[J]. 中兽医学杂志, 2008(S): 109-114. |
| [30] |
PARK S A, CHOI M S, KIM M J, et al. Hypoglycemic and hypolipidemic action of Du-zhong (Eucommia ulmoides Oliver) leaves water extract in C57BL/KsJ-db/db mice[J]. Journal of Ethnopharmacology, 2006, 107(3): 412-417. DOI:10.1016/j.jep.2006.03.034 |
| [31] |
CHOI M S, JUNG U J, KIM H J, et al. Du-zhong (Eucommia ulmoides Oliver) leaf extract mediates hypolipidemic action in hamsters fed a high-fat diet[J]. The American Journal of Chinese Medicine, 2008, 36(1): 81-93. DOI:10.1142/S0192415X08005606 |
| [32] |
HIRATA T, KOBAYASHI T, WADA A, et al. Anti-obesity compounds in green leaves of Eucommia ulmoides[J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(6): 1786-1791. |
| [33] |
ELMORE J S, MOTTRAM D S. The role of lipid in the flavour of cooked beef[J]. Developments in Food Science, 2006, 43: 375-378. DOI:10.1016/S0167-4501(06)80089-0 |
| [34] |
CAMPO M M, NUTE G R, WOOD J D, et al. Modelling the effect of fatty acids in odour development of cooked meat in vitro:part Ⅰ-sensory perception[J]. Meat Science, 2003, 63(3): 367-375. DOI:10.1016/S0309-1740(02)00095-5 |
| [35] |
MYER R O, JOHNSON D D, KNAUFT D A, et al. Effect of feeding high-oleic-acid peanuts to growing-finishing swine on resulting carcass fatty acid profile and on carcass and meat quality characteristics[J]. Journal of Animal Science, 1992, 70(12): 3734-3741. DOI:10.2527/1992.70123734x |
| [36] |
KEYS A, ANDERSON J T, GRANDE F. Serum cholesterol response to changes in the diet:Ⅳ.Particular saturated fatty acids in the diet[J]. Metabolism, 1965, 14(7): 776-787. DOI:10.1016/0026-0495(65)90004-1 |
| [37] |
SCHROEDER E A, BRUNET A. Lipid profiles and signals for long life[J]. Trends in Endocrinology & Metabolism, 2015, 26(11): 589-592. |
| [38] |
CALDER P C. n-3 Fatty acids and cardiovascular disease:evidence explained and mechanisms explored[J]. Clinical Science, 2004, 107(1): 1-11. DOI:10.1042/CS20040119 |
| [39] |
RUSSO G L. Dietary n-6 and n-3 polyunsaturated fatty acids:from biochemistry to clinical implications in cardiovascular prevention[J]. Biochemical Pharmacology, 2009, 77(6): 937-946. DOI:10.1016/j.bcp.2008.10.020 |
| [40] |
潘永芳, 郑国栋, 邱阳阳, 等. 杜仲叶对小鼠脂肪沉积和脂肪代谢的的影响[J]. 营养学报, 2014, 36(4): 398-400. |
| [41] |
李文娜, 韩宇东, 刘银花, 陈阳, 肖苑. 杜仲叶绿原酸提取物对脂代谢关键酶活性的影响[J]. 中药新药与临床药理, 2012, 23(1): 30-33. |
| [42] |
李文娜, 肖苑, 黄燮南, 等. 杜仲叶绿原酸提取物对大鼠的减肥作用机制[J]. 中国临床药理学杂志, 2012, 28(7): 534-535, 538. |
| [43] |
REN B, THELEN A P, PETERS J M, et al. Polyunsaturated fatty acid suppression of hepatic fatty acid synthase and S14 gene expression does not require peroxisome proliferator-activated receptor α[J]. Journal of Biological Chemistry, 1997, 272(43): 26827-26832. DOI:10.1074/jbc.272.43.26827 |
| [44] |
SAMPATH H, NTAMBI J M. Polyunsaturated fatty acid regulation of gene expression[J]. Nutrition Reviews, 2004, 62(9): 333-339. DOI:10.1111/nure.2004.62.issue-9 |
| [45] |
LEE C H, OLSON P, EVANS R M. Minireview:lipid metabolism, metabolic diseases, and peroxisome proliferator-activated receptors[J]. Endocrinology, 2003, 144(6): 2201-2207. DOI:10.1210/en.2003-0288 |
| [46] |
YOON M. The role of PPARα in lipid metabolism and obesity:focusing on the effects of estrogen on PPARα actions[J]. Pharmacological Research, 2009, 60(3): 151-159. DOI:10.1016/j.phrs.2009.02.004 |
| [47] |
JANANI C, KUMARI B D R. PPAR gamma gene-a review[J]. Diabetes & Metabolic Syndrome:Clinical Research & Reviews, 2015, 9(1): 46-50. |
| [48] |
SHIOMI Y, YAMAUCHI T, IWABU M, et al. A novel Peroxisome proliferator-activated receptor (PPAR) α agonist and PPARγ antagonist, Z-551, ameliorates high-fat diet-induced obesity and metabolic disorders in mice[J]. Journal of Biological Chemistry, 2015, 290(23): 14567-14581. DOI:10.1074/jbc.M114.622191 |
| [49] |
JEON T I, OSBORNE T F. SREBPs:metabolic integrators in physiology and metabolism[J]. Trends in Endocrinology & Metabolism, 2012, 23(2): 65-72. |




