2. 青海省都兰县畜牧兽医工作站, 都兰 816199;
3. 青海大学畜牧兽医科学院, 西宁 810016;
4. 兰州大学生命科学学院, 兰州 730000
2. Animal Husbandry and Veterinary Station of Dulan County, Dulan 816199, China;
3. College of Animal Science and Veterinary Medicine of Qinghai University, Xining 810016, China;
4. School of Life Sciences of Lanzhou University, Lanzhou 730000, China
与单胃动物相比,反刍动物最明显的特点是拥有一个体积庞大的瘤胃,其中栖息着数量惊人的微生物。瘤胃微生物不但能够分泌大量的消化酶来帮助宿主动物降解纤维性饲料,而且能够为其提供机体营养代谢所需的各种氨基酸资源。据报道,反刍动物小肠所吸收的氨基酸有1/2以上都来自瘤胃微生物[1],特别是在营养胁迫条件下,瘤胃微生物几乎就是宿主唯一的可消化蛋白质源[2]。鉴于此,瘤胃微生物氮(MN)的准确定量对评价反刍动物氮素的利用效率具有重要意义。
反刍动物MN产量通常都用标记物来进行估测,在早期的研究中,标记物主要有同位素(15NH3、35SO42-等)、2, 6-二氨基庚二酸、D-丙氨酸、核酸(DNA或RNA)、嘌呤等,而这些方法都需要用到瘘管动物,这不仅增加了试验成本、限制了动物数量,而且有违动物福利[3]。尿中嘌呤衍生物(purine derivatives,PD)法能够弥补上述方法的缺点,其不但简单易操作,而且准确性高,因而得到了较快的发展和应用[4]。自20世纪80~90年代开始,该方法在绵羊[5]、山羊[6]、黄牛[7]、水牛[8]、瘤牛[8]、牦牛(Bos grunniens)[9]等反刍动物上的应用模型相继被建立。
牦牛是青藏高原的特有畜种,其对高海拔、寒冷、缺氧、强紫外辐射和牧草生长期短的恶劣环境具有极强的适应能力[10]。经过成百上千年的自然和人工选择,牦牛体内可能已经形成了一系列特殊的营养代谢机制来抵抗冷季饲草料供应不足的威胁,从而保证了其种群的正常繁衍生息[11-12]。研究表明,牦牛的氮维持需要量较低[0.40~0.53 g/(kg W0.75·d)][13-14];牦牛饲粮氮的利用效率较黑白花奶牛高[15];在氮胁迫条件下,牦牛肝脏合成的尿素有87%可被循环进入消化道,为瘤胃微生物合成微生物蛋白质提供氮源[16]。上述这些研究结果都从一定程度上反映了牦牛微生物蛋白质合成效率可能较其他低海拔牛种要高。因此,本试验试图通过研究饲粮氮水平对牦牛尿PD排出规律的影响,并基于此来估测瘤胃MN产量,从而为揭示牦牛特殊的氮素营养代谢机制提供理论依据。
1 材料与方法 1.1 试验地点和时间野外饲养试验和样品采集工作于2013年11月至2014年1月在甘肃省天祝藏族自治县乌鞘岭牦牛试验站(北纬37°12.479′,东经102°51.695′,海拔3 154 m)完成;样品室内分析于2014年2月至5月在兰州大学青藏高原生态系统管理国际中心进行。
1.2 试验动物和饲粮选取4头体重[(192±12) kg]相近、年龄(3岁)相同的健康去势公牦牛,试验开始前对其作驱虫处理,并置于代谢笼内进行30 d的适应期,使其熟悉饲养条件、试验人员和周围环境。饲粮的精粗比为50:50,其中粗料为青稞秸秆,精料为4种代谢能和中性洗涤纤维基本相同而氮水平不同的颗粒料。4种饲粮氮水平分别为1.03%、1.95%、2.85%、3.76%(干物质基础)。试验饲粮组成及营养水平见表 1。通过前期的预试验确定牦牛的干物质食量为3 kg/d,约为体重的1.5%,饲粮的能量水平为1.1倍维持需要量[生长牦牛能量维持需求为458 kJ/(kg W0.75·d)][17]。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
本试验采用4×4拉丁方试验设计,整个试验分为4期,每期21 d(包括15 d的预试期和6 d的正试期)。试验牦牛于每天08:00和18:00各饲喂1次,每次干物质饲喂量为1.5 kg,自由饮水,在每个正试期的第1天和最后1天空腹称重。
1.4 样品采集与处理每期正试期第1天的晨饲前,采用全收尿法连续收集尿液5 d,并记录每天每头牦牛的排尿量。将每天收集的尿样混匀,按总尿量的10%取样,用50%的H2SO4酸化,使pH<3.0,以利于固定尿中氮和避免微生物生长,并在-20 ℃的冰箱中保存。每期正试期最后1 d晨饲前以及饲喂后的2、4、6、8 h,利用口腔式胃管抽取瘤胃液,每次大约取样100 mL,4层纱布过滤后装入离心管,在-20 ℃的冰箱中保存。
1.5 测定方法及计算公式牦牛尿中PD(尿囊素、尿酸、黄嘌呤、次黄嘌呤)含量利用高效液相色谱仪(Agilent,LC-1200) 测定,参考李晓鹏等[19]的方法。瘤胃微生物的提取参考Wickersham等[20]的方法,瘤胃细菌嘌呤碱基(RNA当量)、瘤胃细菌嘌呤氮(purine nitrogen,PN)含量的测定参考Zinn等[21]的方法,瘤胃细菌氮(bacterial nitrogen,BN)含量和尿氮排出量利用凯氏定氮法测定[22]。
牦牛瘤胃MN产量计算根据前人所建立[23]以及修正的模型[9]。牦牛小肠吸收嘌呤量(X,mmol/d)与尿中PD排出量(Y,mmol/d)的关系如下:
Y=0.85X+0.134BW0.75。
式中:BW0.75为代谢体重(kg)。
牦牛瘤胃MN产量估测公式如下:
MN(g/d)=(X×70)/[(PN:BN)×0.83×1 000]。
式中:X为小肠吸收嘌呤量(mmol/d);70指每毫摩尔嘌呤含70 mg氮;0.83指微生物核酸的消化率。
嘌呤氮指数(PNI)=尿嘌呤氮排出量/尿氮排出量[24]。
1.6 数据处理与分析试验数据利用SAS 9.2 PROC MIXED模块进行多项式正交对比来检验其差异显著性,其中饲粮氮水平为固定因子,试验动物和试验期为随机因子;线性相关性分析及其模型关系图制作采用R Studio 1.0.143软件进行。
2 结果与分析 2.1 尿中PD排出量及小肠吸收嘌呤量由表 2可见,牦牛尿中PD主要由尿囊素和尿酸组成,黄嘌呤和次黄嘌呤含量都极少且不受饲粮氮水平影响(P>0.05)。随着饲粮氮水平的升高,牦牛尿中尿囊素、尿酸和PD排出量以及小肠吸收嘌呤量均线性增加(P < 0.05)。尿囊素/PD为0.69~0.76,尿酸/PD为0.23~0.30,尿囊素/PD随着饲粮氮水平升高而线性增加(P < 0.05),而尿酸/PD的变化趋势与之相反。牦牛尿中马尿酸排出量随着饲粮氮水平的增加而线性升高(P < 0.05),而PNI却随之线性降低(P < 0.05),变化范围为0.06~0.22,并且在饲粮氮水平为1.03%时达到最高值。
|
|
表 2 饲粮氮水平对牦牛尿中PD排出量及小肠吸收嘌呤量的影响 Table 2 Effects of dietary N level on urine PD excretion and absorbed purine by small intestine of yaks |
由表 3可见,牦牛瘤胃细菌中瘤胃细菌嘌呤碱基(RNA当量)、瘤胃细菌PN、瘤胃BN含量以及瘤胃细菌PN/瘤胃BN都随着饲粮氮水平的升高而线性增加(P < 0.05),其中瘤胃细菌PN/瘤胃BN的变化范围在0.12~0.20。瘤胃MN产量也随着饲粮氮水平的升高而先增加后降低,当饲粮氮水平在2.85%时,牦牛瘤胃MN产量最高,为42.60 g/d。随着饲粮氮水平的升高,瘤胃MN/NI线性减小(P < 0.05),这表明饲粮氮用于合成MN的效率逐渐降低。
|
|
表 3 饲粮氮水平对牦牛瘤胃细菌参数及微生物氮产量的影响 Table 3 Effects of dietary N level on ruminal bacterial parameters and MN production of yaks |
由于饲粮食入氮(NI,g/d)与PD(mmol/d)、MN(g/d)均呈现较高的线性相关关系,通过线性回归分析建立了它们之间的数学模型(图 1),模型如下:PD=0.58NI+18.28(R2=0.93),MN=0.18NI+22.18(R2=0.60)。
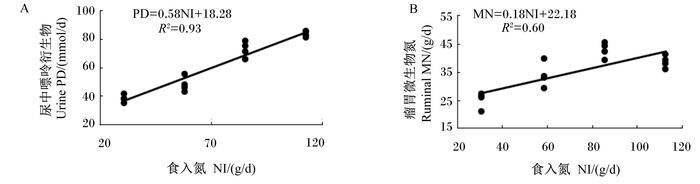
|
图 1 尿中PD排出量(A)和瘤胃微生物氮产量(B)与食入氮的相关关系 Figure 1 Correlation relationships between NI and urine PD excretion (A) or ruminal MN production (B) |
反刍动物尿中PD主要源自瘤胃微生物核酸[25],而瘤胃MN产量随饲粮氮水平升高而增加,从而导致尿中PD及其组分排出量的增加,这与Guo等[16]在牦牛和周建伟[26]在绵羊上的研究结果相一致。本试验小肠吸收嘌呤量随饲粮氮水平线性升高,这是因为氮采食量的升高促进了瘤胃中微生物核酸的合成代谢[27],当微生物核酸降解为嘌呤时,小肠黏膜吸收的嘌呤会因此升高。
反刍动物尿中PD由尿囊素、尿酸、黄嘌呤及次黄嘌呤构成,尿囊素和尿酸所占比重较大[28],而黄嘌呤和次黄嘌呤所占比重较小[29-30]。本试验结果显示,牦牛尿囊素/PD和尿酸/PD分别为0.69~0.76和0.23~0.30,与Long等[13]和Wang等[31]在牦牛中报道的结果一致,与Chen[30]关于黄牛等的报道基本相近。随着饲粮氮水平升高,尿囊素/PD线性上升,尿酸/PD线性下降,这与Long等[32]和王虎成[9]研究结果变化趋势相同。研究结果显示,牦牛尿中PD中黄嘌呤和次黄嘌呤很低或者几乎没有(含量<1%),与Chen[30]报道的黄牛的研究结果相近,但绵羊尿中PD中黄嘌呤与次黄嘌呤含量相对较高(为16.1%),这可能与动物体内的黄嘌呤氧化酶活性有关。与绵羊相比,牛科动物的肝脏、血液、小肠黏膜细胞具有较高的黄嘌呤氧化酶活性,其体内的黄嘌呤和次黄嘌呤很容易被氧化而形成尿酸[9, 27]。
3.2 瘤胃细菌嘌呤碱基、BN含量,MN产量及PNI对饲粮氮水平的响应规律本试验中牦牛瘤胃细菌嘌呤碱基(RNA当量)含量为5.42%~12.53%,平均值为8.97%,与韩兴泰等[33]在牦牛上的研究结果(8.3%~11.4%,平均值为9.85%)相近,较Smith等[34]在奶牛及绵羊中研究结果(5.2%~6.8%,平均值为5.7%)高;BN含量(4.28%~6.21%)也与韩兴泰等[33]研究的结果(4.64%~5.92%)相近,低于奶牛(5.76%~9.12%)[34]。周建伟[26]在藏羊对氮素胁迫适应性的研究中也发现,藏羊瘤胃微生物RNA含量(6.62%~8.17%)较细毛羊高,而BN含量(2.96%~3.18%)相对较低。因此,高海拔地区反刍动物(如藏羊、牦牛)瘤胃微生物具有高RNA和低氮素的特点,这可能是其长期适应青藏高原饲草营养胁迫的结果。在早期的研究中,瘤胃微生物的瘤胃细菌PN/瘤胃BN被认为比较稳定,平均值为0.116[23]。但随着研究地深入,发现该比值的变异较大,受到采食量、微生物群落组成、动物品种等因素的影响[35-37]。本试验中瘤胃细菌PN/瘤胃BN在0.12~0.20波动,说明饲粮氮水平也影响该比值。
随着氮水平升高,瘤胃MN产量线性升高,表现趋势与Sannes等[38]和Devant等[39]结果一致。在1.95%饲粮氮水平条件下,瘤胃MN产量为33.56 g/d,与Guo等[16]报道1.97%饲粮氮水平下瘤胃MN产量(31.1 g/d)相近。瘤胃MN/NI反映瘤胃微生物将饲粮氮转化为MN的效率,本试验中该比值在1.03%的低氮水平饲粮条件下达到最高(0.82),这表明在低氮水平饲粮条件下,饲粮氮转化为瘤胃MN的效率较高;同时也证实了在氮素营养胁迫下,微生物蛋白质是宿主动物最重要氨基酸来源。在3.76%的高氮水平饲粮条件下瘤胃MN/NI最低,为0.34,这是因为牦牛在采食高氮饲粮时,进入小肠的过瘤胃蛋白质数量增加,宿主对微生物蛋白质所提供的氨基酸的依赖性降低。
PNI是快速评价饲粮氮转化为MN效率的重要指标,PNI越高,表明瘤胃降解氮合成微生物蛋白质的效率较高。本试验PNI变化范围在0.06~0.22,与Wang等[31]的报道范围(0.07~0.15) 相近。PNI随着饲粮氮水平升高而降低,与Zhou等[40]在藏羊上的研究结果相同,但Wang等[31]却发现PNI随着干草采食量的增加而变大。低氮饲粮下较高的PNI表明,牦牛在氮素胁迫下,微生物能够有效利用瘤胃可降解蛋白质,以弥补饲粮氮素匮乏的限制,从而向牦牛提供更多的氨基酸。
3.3 尿中PD排出量和瘤胃MN产量的估测模型反刍家畜小肠吸收嘌呤量和基于PD法的瘤胃MN产量估测模型(表 4[5-9]、表 5[41-44]),参数变异较大,尤其是不同物种之间。本试验尿中PD排出量与估测瘤胃MN产量表现出强线性相关(R2=0.71),这与表 5中各研究所建立的估测模型结果相符。Reynal等[45]的研究发现,采用15N作标记物估测瘤胃MN产量较PD法具有更高的准确性,但Ma等[43]也证明了2种方法之间存在较高相关性(R2=0.82),说明了PD法的可靠性。尿中PD估测瘤胃MN产量需要校正瘤胃微生物的PN:BN。Perez等[46]报道,液相与固相微生物的PN:BN不同,而固相微生物约占其总量的70%[47],因此在测定该比值时应同时提取固相和液相微生物,并保持合适的比例。在本试验中只考虑了液相微生物,因此所估测瘤胃MN产量并不是十分准确。据报道,小肠吸收的氨基酸有11%来自原虫[48],并且细菌的PN:BN高于原虫[49]。在分离瘤胃微生物的过程中,原虫容易在离心时与饲料颗粒一起被沉淀,最后分离得到的瘤胃微生物主要是细菌而不包含原虫[49-50]。因此,利用细菌中的PN:BN来代替整个瘤胃微生物的比值,这会低估了瘤胃MN产量。
|
|
表 4 尿中PD排出量(mmol/d)与小肠吸收嘌呤量(X, mmol/d)的关系模型 Table 4 Relation models between urine PD production(mmol/d) and small intestine absorbed purine (X, mmol/d) |
|
|
表 5 尿中PD排出量(mmol/d)与瘤胃MN产量(g/d)的关系模型 Table 5 Relation models between urine PD production(mmol/d) and ruminal MN production |
苯甲酸和甘氨酸是合成马尿酸的前体物质,苯甲酸主要由肠道细菌分解小肠下游饲粮多酚类物质(瘤胃中较难降解)而产生,在肝脏中与甘氨酸共轭作用形成马尿酸[51-53],并以此来防止苯甲酸中毒。在本试验中,尿中马尿酸排出量随着饲粮氮水平的升高而增加,这与刘浩等[54]在藏羊上的研究结果一致。瘤胃中被降解的蛋白质是肠道酚类化合物的主要来源[55],饲粮氮水平增加,增加了苯甲酸合成的主要前体物,促进了苯甲酸的产生[56],进而增加了马尿酸的合成。
4 结论当牦牛饲粮氮水平为2.85%时,牦牛瘤胃MN产量最大,为42.60 g/d,而PNI以及饲粮氮用于合成MN的效率却在低氮(1.03%)条件下达到最高,这一结果揭示了牦牛对低氮饲粮中氮素营养高效利用的特点,解释了牦牛对青藏高原饲料营养匮乏的适应性的营养机理。
| [1] |
AF RC. Nutritive requirements of ruminant animal[J]. Nutrition Abstract Review Series, 1992, 62: 787-835. |
| [2] |
ØRSKOV E R. Protein nutrition in ruminants[M]. 2nd ed. London: Academic Press, 1992.
|
| [3] |
刘大森, 单安山. 尿液嘌呤衍生物法估测瘤胃微生物蛋白质产量及其评价[J]. 动物营养学报, 2004, 16(2): 1-4. |
| [4] |
王虎成, 龙瑞军, 马亚玲, 等. 尿嘌呤衍生物估测瘤胃微生物蛋白产量的原理及研究进展[J]. 饲料工业, 2008, 29(1): 47-51. |
| [5] |
CHEN X B, HOVELL F D, ØRSKOV E R, et al. Excretion of purine derivatives by ruminants:effect of exogenous nucleic acid supply on purine derivative excretion by sheep[J]. British Journal of Nutrition, 1990, 63: 131-142. DOI:10.1079/BJN19900098 |
| [6] |
BELENGUER A, YAÑEZ D, BALCELLS J, et al. Urinary excretion of purine derivatives and prediction of rumen microbial outflow in goats[J]. Livestock Production Science, 2002, 77(2): 127-135. |
| [7] |
VERBIC J, CHEN X B, MACLEOD N A, et al. Excretion of purine derivatives by ruminants.Effect of microbial nucleic acid infusion on purine derivative excretion by steers[J]. The Journal of Agricultural Science, 1990, 114(3): 243-248. DOI:10.1017/S0021859600072610 |
| [8] |
LIANG J B, PIMPA O, JELAN Z A, et al.An overview on the use of urinary purine derivatives excretion as a method for estimation of rumen microbial protein production in swamp buffaloes and zebu cattle[M]//MAKKAR H, CHEN X B.Estimation of microbial protein supply in ruminants using purine derivatives.Netherlands:Kluwer Academic Publishers, 2004:42-55.
|
| [9] |
王虎成. 尿嘌呤衍生物排出量估测青藏高原牦牛瘤胃微生物蛋白产量研究[D]. 博士学位论文. 兰州: 兰州大学, 2009: 60-64.
|
| [10] |
LONG R J, DING L M, SHANG Z H, et al. The yak grazing system on the Qinghai-Tibetan plateau and its status[J]. The Rangeland Journal, 2008, 30(2): 241-246. DOI:10.1071/RJ08012 |
| [11] |
王德朋. 家牦牛低氧诱导因子-1α(HIF-1α)基因的表达特征及其低氧适应意义[D]. 博士学位论文. 青海: 中国科学院西北高原生物研究所, 2007. http://cdmd.cnki.com.cn/Article/CDMD-82101-2010171077.htm
|
| [12] |
WANG H, LONG R, ZHOU W, et al. A comparative study on urinary purine derivative excretion of yak (Bos grunniens), cattle (Bos taurus), and crossbred (Bos taurus×Bos grunniens) in the Qinghai-Tibetan plateau, China[J]. Journal of Animal Science, 2009, 87(7): 2355. DOI:10.2527/jas.2008-1544 |
| [13] |
LONG R J, DONG S K, HU Z Z, et al. Digestibility, nutrient balance and urinary purine derivative excretion in dry yak cows fed oat hay at different levels of intake[J]. Livestock Production Science, 2004, 88(1/2): 27-32. |
| [14] |
胡令浩. 中国牦牛营养研究进展(二)-生长期牦牛的氮代谢[J]. 青海科技, 2001(6): 37-39. |
| [15] |
吕秉林, 扎西卓玛. 牦牛与黑白花牛的氮平衡比较研究[J]. 中国牛业科学, 2002, 28(2): 17-18. |
| [16] |
GUO X S, ZHANG Y, ZHOU J W, et al. Nitrogen metabolism and recycling in yaks (Bos grunniens) offered a forage-concentrate diet differing in N concentration[J]. Animal Production Science, 2012, 52(5): 287-296. DOI:10.1071/AN11208 |
| [17] |
韩兴泰, 谢敖云. 生长牦牛维持能量需要量验证报告[J]. 青海畜牧兽医杂志, 1991(1): 10-11. |
| [18] |
中国饲料数据库. 中国饲料成分及营养价值表(2013年第24版)[J]. 中国饲料, 2013(21): 38-42. |
| [19] |
李晓鹏, 周围, 王虎成, 等. 高效液相色谱法对牦牛血浆与尿中嘌呤衍生物及肌酐含量的测定[J]. 分析测试学报, 2009, 28(7): 867-871. |
| [20] |
WICKERSHAM T A, TITGEMEYER E C, COCHRAN R C, et al. Effect of rumen-degradable intake protein supplementation on urea kinetics and microbial use of recycled urea in steers consuming low-quality forage[J]. Journal of Animal Science, 2008, 86(11): 3079-3088. DOI:10.2527/jas.2007-0325 |
| [21] |
ZINN R A, OWENS F N. A rapid procedure for purine measurement and its use for estimating net ruminal protein synthesis[J]. Canadian Journal of Animal Science, 1986, 66(1): 157-166. DOI:10.4141/cjas86-017 |
| [22] |
AOAC.Offical methods of analysis of the association of official analytical chemists[S].15th ed.Washington, D.C.:Association of Official Analytical Chemists, 1990.
|
| [23] |
CHEN X B, GOMES M J. Estimation of microbial protein supply to sheep and cattle based on urinary excretion of purine derivatives[M]. Bucksburn: Rowett Research Institute, 1992, 18.
|
| [24] |
CHEN X B, SUBBA D B, ØRSKOV E R, et al.Nuclear based technologies for estimating microbial protein supply in ruminant livestock:purine nitrogen index, potentially a new parameter for rapid feed evaluation in ruminants[C]//Proceedings of the second research coordination meeting of a coordinated research project (FAO/IAEA division of nuclear techniques in food and agriculture).Vienna, Austria:FAO, 1998:97-110.
|
| [25] |
MCALLAN A B. The fate of nucleic acids in ruminants[J]. Proceedings of the Nutrition Society, 1982, 41(3): 309-316. DOI:10.1079/PNS19820046 |
| [26] |
周建伟. 藏羊对青藏高原氮素营养胁迫的适应性研究[D]. 博士学位论文. 兰州: 兰州大学, 2015: 55. http://cdmd.cnki.com.cn/Article/CDMD-10730-1015334205.htm
|
| [27] |
CHEN X B, ØRSKOV E R.Research on urinary excretion of purine derivatives in ruminants:past, present and future[M]//MAKKAR H P, CHEN X B.Estimation of microbial protein supply in ruminants using urinary purine derivatives.Netherlands:Springer, 2004:180-210.
|
| [28] |
BALCELLS J, GUADA J A, CASTRILLO C, et al. Urinary excretion of allantoin and allantoin precursors by sheep after different rates of purine infusion into the duodenum[J]. The Journal of Agricultural Science, 1991, 116(2): 309-317. DOI:10.1017/S002185960007773X |
| [29] |
钟伟, 龙瑞军, LIANGJ B, 等. 不同比例香根草日粮对沼泽性水牛尿嘌呤衍生物排出量的影响[J]. 甘肃农业大学学报, 2007, 42(1): 25-29. |
| [30] |
CHEN X B.Excretion of purine derivatives by sheep and cattle and its use for the estimation of absorbed microbial protein[D].Ph.D.Thesis.Aberdeen:University of Aberdeen, 1989.
|
| [31] |
WANG H, LONG R, LIANG J B, et al. Comparison of nitrogen metabolism in yak (Bosgrunniens) and Indigenous cattle (Bostaurus) on the Qinghai-Tibetan plateau[J]. Asian-Australasian Journal of Animal Sciences, 2011, 24(6): 766-773. DOI:10.5713/ajas.2011.10350 |
| [32] |
LONG R J, DONG S K, CHEN X B, et al. Preliminary studies on urinary excretion of purine derivatives and creatinine in yaks[J]. Journal of Agricultural Science, 1999, 133(4): 427-431. DOI:10.1017/S0021859699007169 |
| [33] |
韩兴泰, 胡令浩, 谢敖云, 等. 牦牛瘤胃细菌中核糖核酸含量及其与细菌总氮比值的研究[J]. 动物营养学报, 1998, 10(2): 35-40. |
| [34] |
SMITH R H.Nitrogen metabolism in the rumen and the composition and nutritive value of nitrogen compositions entering the duodenum[M]//MCDONALD I W, WANERAC I, SMITH R H.Digestion and metabolism in the ruminants.Armidale:The University of New England Publishing Unit, 1974:399-415.
|
| [35] |
VOLDEN H, MYDLAND L T, HARSTAD O M. Chemical composition of protozoal and bacterial fractions isolated from ruminal contents of dairy cows fed diets differing in nitrogen supplementation[J]. Acta Agriculturae Scandinavica, Section A:Animal Science, 1999, 49(4): 235-244. DOI:10.1080/090647099423999 |
| [36] |
RANILLA M J, CARRO M D. Diet and procedures used to detach particle-associated microbes from ruminal digesta influence chemical composition of microbes and estimation of microbial growth in Rusitec fermenters[J]. Journal of Animal Science, 2003, 81(2): 537-544. DOI:10.2527/2003.812537x |
| [37] |
MCALLAN A B, SMITH R H. Degradation of nucleic acid derivatives by rumen bacteria in vitro[J]. British Journal of Nutrition, 1973, 29(3): 467-474. DOI:10.1079/BJN19730122 |
| [38] |
SANNES R A, MESSMAN M A, VAGNONI D B. Form of rumen-degradable carbohydrate and nitrogen on microbial protein synthesis and protein efficiency of dairy cows[J]. Journal of Dairy Science, 2002, 85(4): 900-908. DOI:10.3168/jds.S0022-0302(02)74148-9 |
| [39] |
DEVANT M, FERRET A, GASA J, et al. Effects of protein concentration and degradability on performance, ruminal fermentation, and nitrogen metabolism in rapidly growing heifers fed high-concentrate diets from 100 to 230 kg body weight[J]. Journal of Animal Science, 2000, 78(6): 1667-1676. DOI:10.2527/2000.7861667x |
| [40] |
ZHOU J W, MI J D, DEGEN A A, et al. Urinary purine derivatives excretion, rumen microbial nitrogen synthesis and the efficiency of utilization of recycled urea in Tibetan and fine-wool sheep[J]. Animal Feed Science and Technology, 2017, 227: 24-31. DOI:10.1016/j.anifeedsci.2017.03.005 |
| [41] |
MOORBY J M, DEWHURST R J, EVANS R T, et al. Effects of dairy cow diet forage proportion on duodenal nutrient supply and urinary purine derivative excretion[J]. Journal of Dairy Science, 2006, 89(9): 3552-3562. DOI:10.3168/jds.S0022-0302(06)72395-5 |
| [42] |
VAGNONI D B, BRODERICK G A, CLAYTON M K, et al. Excretion of purine derivatives by holstein cows abomasally infused with incremental amounts of purines[J]. Journal of Dairy Science, 1997, 80(8): 1695-702. DOI:10.3168/jds.S0022-0302(97)76101-0 |
| [43] |
MA T, DENG K, JIANG C, et al. The relationship between microbial N synthesis and urinary excretion of purine derivatives in Dorper×thin-tailed Han crossbred sheep[J]. Small Ruminant Research, 2013, 112(1): 49-55. |
| [44] |
PUCHALA R, KULASEK G W. Estimation of microbial protein flow from the rumen of sheep using microbial nucleic acid and urinary excretion of purine derivatives[J]. Canadian Journal of Animal Science, 1992, 72(4): 821-830. DOI:10.4141/cjas92-094 |
| [45] |
GONZALEZ-RONQUILLO M, BALCELLS J, GUADA J A, et al. Purine derivative excretion in dairy cows:endogenous excretion and the effect of exogenous nucleic acid supply[J]. Journal of Dairy Science, 2003, 86(4): 1282-1291. DOI:10.3168/jds.S0022-0302(03)73712-6 |
| [46] |
PEREZ J F, FONDEVILA M, BALCELLS J, et al. Composition of liquid-and particle-associated bacteria and their contribution to the rumen outflow[J]. Crop and Pasture Science, 1998, 49(5): 907-914. DOI:10.1071/A97052 |
| [47] |
FORSBERG C W, LAM K. Use of adenosine 5'-triphosphate as an indicator of the microbiota biomass in rumen contents[J]. Applied and Environmental Microbiology, 1977, 33(3): 528-537. |
| [48] |
SHABI Z, TAGARI H, MURPHY M R, et al. Partitioning of amino acids flowing to the abomasum into feed, bacterial, protozoal, and endogenous fractions[J]. Journal of Dairy Science, 2000, 83(10): 2326-2334. DOI:10.3168/jds.S0022-0302(00)75120-4 |
| [49] |
FIRKINS J L, BERGER L L, MERCHEN N R, et al. Ruminal nitrogen metabolism in steers as affected by feed intake and dietary urea concentration[J]. Journal of Dairy Science, 1987, 70(11): 2302-2311. DOI:10.3168/jds.S0022-0302(87)80290-4 |
| [50] |
CASTILLO-LOPEZE, RAMIREZ H A R, KLOPFENSTEIN T J, et al. Ration formulations containing reduced-fat dried distillers grains with solubles and their effect on lactation performance, rumen fermentation, and intestinal flow of microbial nitrogen in Holstein cows[J]. Journal of Dairy Science, 2014, 97(3): 1578-1593. DOI:10.3168/jds.2013-6865 |
| [51] |
LORD R S, BRALLEY J A. Clinical applications of urinary organic acids.Part 2.Dysbiosis markers[J]. Alternative Medicine Review, 2008, 13(4): 292-306. |
| [52] |
GOODWIN B L, RUTHVEN C R J, SANDLER M. Gut flora and the origin of some urinary aromatic phenolic compounds[J]. Biochemical Pharmacology, 1994, 47(12): 2294-2297. DOI:10.1016/0006-2952(94)90268-2 |
| [53] |
SCALBERT A, MORAND C, MANACH C, et al. Absorption and metabolism of polyphenols in the gut and impact on health[J]. Biomedicine & Pharmacotherapy, 2002, 56(6): 276-282. |
| [54] |
刘浩, 周建伟, 张瑛, 等. 燕麦干草对藏羊尿中嘌呤衍生物、肌酐及马尿酸排出量的影响[J]. 家畜生态学报, 2014, 35(9): 38-44. |
| [55] |
MARTIN A K. The urinary aromatic acids excreted by sheep given S24 perennial ryegrass cut at six stages of maturity[J]. British Journal of Nutrition, 1970, 24(4): 943-959. DOI:10.1079/BJN19700098 |
| [56] |
MARTIN A K. Urinary excretion of aromatic acids by sheep given diets containing different amounts of protein and roughage[J]. British Journal of Nutrition, 1969, 23(2): 389-399. DOI:10.1079/BJN19690045 |




