2. 深圳市裕农科技股份有限公司, 深圳 518110
2. Shenzhen Yunong Science & Technology Co., Ltd., Shenzhen 518110, China
凡纳滨对虾(Litopenaeus vannamei)是世界三大主养虾类之一[1],其产量占全世界虾产量的2/3。近年来对虾养殖业的病害频发严重影响了产业的健康持续发展[2],开发新型的绿色饲料添加剂,以增强养殖对象的免疫力和抗病力,提高养殖经济效益,已逐渐成为饲料行业的研发重点。抗生素虽然能有效预防和治疗各种疾病,但其残留和环境污染问题使得安全高效绿色的抗生素替代品的研究迫在眉睫[3]。
壳寡糖(chitosan oligosaccharide,COS)又叫壳聚寡糖、低聚壳聚糖,为自然界中唯一带正电荷的碱性氨基低聚糖,是将壳聚糖经生物酶分解得到的一种聚合度在2~20之间的寡糖产品。COS有促进动物生长,改善机体肠道环境,抑制有害菌生长,促进肠道菌落形成的作用[4]。研究表明,壳聚糖与蒙脱石形成的高分子聚合物是一种性能非常优良的新型抗菌剂[5]。已有研究发现,饲料中添加COS可提高凡纳滨对虾的免疫能力并显著提高其生长性能和成活率[6];饲料中添加适量的COS可以提高罗非鱼(Oreochromis)[7]、卵形鲳鲹(Trachinotus ovatus)[8]的生长性能,增强其抗病力;壳聚糖可提高克氏原螯虾(Procambarus clarkia)[9]、银鲫(Carassius auratus gibelio)[10]、刺参(Apostichopus japonicus Selenka)[11]的生长性能。COS对陆生动物同样具有促生长、提高产品质量的作用[12]。饲料霉变是影响饲料品质的关键因素之一,动物食用了被霉菌毒素污染的饲料后,会产生霉菌毒素的急性或慢性中毒,导致机体免疫机能和抵抗力下降、饲料利用率降低、生产性能下降[13]。霉菌毒素吸附剂(mycotoxins adsorbent,MA)主要有改性的蒙脱石等硅铝酸盐类、复合矿物质类、特定酵母提取物类等。硅铝酸盐是指含有氧化铝和二氧化硅的一类黏土型矿物,如沸石、膨润土及高岭土等,硅铝酸盐因为具有较大的比表面积和离子交换能力而具有较强的吸附能力。有研究表明,饲粮中添加MA可以提高蛋鸡的产蛋性能,增强血清抗氧化功能,改善健康状况[14-16],并可降低肉鸡血清丙二醛(MDA)含量,逆转霉变饲料导致的氧化损伤和免疫毒性[16]。研究发现,硅铝酸盐产品与β-葡聚糖或甘露寡糖同时添加可以提高凡纳滨对虾生长性能,增强非特异性免疫力,改善消化酶活性,提高抗溶藻弧菌及耐低氧能力[17];酵母细胞壁多糖和硅铝酸盐复合物可提高生长猪的免疫功能[18]。任何单一的吸附剂都有其局限性,不能完全吸附所有的有害物质或毒素,通过将不同类型的吸附剂进行复配可以取得较好的效果,COS与硅铝酸盐类MA在提升养殖动物生长性能,增强免疫力方面具有一致性,但在水产动物中同时使用此2种添加剂的研究在国内尚无报道。因此,本试验在饲料中单独添加或联合添加COS与MA,通过测定凡纳滨对虾的生长指标、体成分、血清和肝胰腺非特异性免疫酶活性及抗病力,对COS与MA的合理使用进行评估。
1 材料与方法 1.1 试验材料试验所用COS(聚合度2~8,寡糖含量≥85%)、MA(100%水合硅铝酸盐)均由深圳市裕农科技股份有限公司提供。
1.2 试验饲料和试验设计首先配制基础饲料(C0组,作为对照组),然后在基础饲料中分别添加100 mg/kg COS(C0.1组)、250 mg/kg COS(C0.25组)、2 500 mg/kg MA(M2.5组)、100 mg/kg COS+2 500 mg/kg MA(C0.1+M2.5组)、250 mg/kg COS+2 500 mg/kg MA(C0.25+M2.5组),共制成6种等氮等脂的试验饲料,其组成及营养水平见表 1。将原料粉碎后过80目筛,按照配方要求准确称量,微量成分采取逐级扩大法混合均匀后,用F-26式双螺杆挤条机(华南理工大学,广州)加工成粒径为1.0和1.5 mm 2种规格的饲料,60 ℃烘箱熟化30 min。所制备饲料通风处风干后,用自封袋密封,放于-20 ℃冰箱中保存备用。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
养殖试验在广东海洋大学东海岛海洋生物研究基地进行,试验虾苗购于湛江中联虾苗场。试验前虾苗在室外水泥池(4.9 m×4.5 m×1.8 m)中暂养,养殖试验开始前禁食24 h后分组。根据试验设计,挑选体格健壮、活力强、平均初重为(0.23±0.02) g的虾苗,随机分为6组。采用室内海水养殖系统,每组3个重复,以重复为单位放养于0.3 m3的玻璃钢桶内,每桶放养40尾虾。每天分别在08:00、12:00、16:00和20:00各投喂1次,投喂1 h后观察对虾摄食情况,并根据摄食、天气等情况适当调整投喂量,保证食完(无残饵或极少)。试验前2周每2 d换水1次,后期每天换水1次。试验期间水温25.5~30.0 ℃,海水盐度为26.5~28.0,连续充氧,溶氧浓度>6.8 mg/L,pH 7.8~8.2,氨氮浓度<0.03 mg/L。试验期为8周。
1.4 样品采集养殖试验结束后禁食24 h后取样。对每桶虾称重、记数,用于计算生长性能指标。每桶随机取5尾虾封口袋分装,-20 ℃保存,备测体成分。每桶再随机取10尾虾,用1 mL无菌注射器自第5步足基部血窦抽血,将血淋巴注入1.5 mL的离心管后,迅速置于盛有碎冰的冰盒中,采样结束后于4 ℃冰箱静置过夜,然后4 ℃、8 000 r/min离心10 min,取上清液至离心管中,于-80 ℃冰箱保存备测相关指标;取血后迅速解剖取肝胰腺并置于液氮中,后转移至-80 ℃冰箱保存备测相关指标。
1.5 指标测定 1.5.1 饲料和全虾样品的常规分析对饲料和全虾样品进行常规养分分析,水分含量采用105 ℃烘干恒重法测定,粗蛋白质含量采用凯氏定氮法(KjeltecTM 8400,瑞典)测定,粗脂肪含量采用索氏抽提法(抽提剂为石油醚)测定,粗灰分含量采用马弗炉550 ℃灼烧法测定。
1.5.2 血清、肝胰腺样品相关指标检测肝胰腺粗酶液的制作:称取适量肝胰脏组织,准确记录重量。按重量(g):体积(mL)=1:9的比例加入9倍体积的预冷生理盐水,冰水浴条件下匀浆。匀浆液2 500 r/min、4 ℃离心10 min,小心吸取上清液并分装,-80 ℃冰箱保存备测。
血清、肝胰腺碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)、酚氧化酶(PO)、溶菌酶(LZM)活性及MDA含量的测定均使用南京建成生物工程研究所生产的试剂盒,测定方法按试剂盒说明书进行。
1.5.3 生长性能指标计算公式增重率(WGR,%)=100×(末均重-初均重)/初均重;
特定生长率(SGR,%/d)=100×(ln末均重-ln初均重)/饲养天数;
蛋白质效率(PER)=(终末体重-初始体重)/(饲料摄入量×饲料粗蛋白质含量);
饲料系数(FCR)=摄食饲料干重/(终末体重-初始体重);
成活率(SR,%)=100×试验结束时虾尾数/试验开始时虾尾数。
1.6 攻毒试验养殖试验结束后,每桶取10尾虾,用于攻毒试验(期间仍投喂对应试验饲料及换水)。攻毒所用哈维氏弧菌(Vibrio harveyi)由广东省水产经济动物病原生物学及流行病学重点实验室提供。通过预试验确定凡纳滨对虾的半致死浓度(LD50,7 d)为3.89×108 CFU/mL,攻毒时在对虾第2、3腹节背部注射30 μL该浓度的哈维氏弧菌液,统计7 d的死亡尾数并计算累积死亡率(CMR)。
累积死亡率(%)=100×累积死亡尾数/初始尾数。
1.7 数据处理试验数据用平均值±标准差(mean±SD)表示,数据采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),组间若有显著性差异,再用Duncan氏法进行多重比较,显著性水平为P < 0.05。
2 结果 2.1 饲料中添加COS和/或MA对凡纳滨对虾生长性能的影响由表 2可知,对虾的特定生长率在C0.25、C0.1+M2.5、C0.25+M2.5组之间无显著性差异(P>0.05),但上述3组均显著高于C0与M2.5组(P < 0.05),而C0.1组则与其他各组无显著性差异(P>0.05)。C0.1、C0.25、C0.1+M2.5和C0.25+M2.5组之间增重率无显著性差异(P>0.05),但三者均显著高于C0、M2.5组(P < 0.05)。C0.1+M2.5组的饲料系数显著低于其他各组(P < 0.05);C0.25+M2.5组的饲料系数显著高于C0.1+M2.5组(P < 0.05),但显著低于其他各组(P < 0.05);C0组的饲料系数与C0.25组无显著性差异(P>0.05),但显著高于C0.1+M2.5、C0.25+M2.5组(P < 0.05) 并显著低于C0.1、M2.5组(P < 0.05);C0.1组的饲料系数与C0.25组无显著性差异(P>0.05),但显著低于M2.5组(P < 0.05)。C0.1+M2.5组的蛋白质效率与C0.25+M2.5组无显著性差异(P>0.05),但显著高于其他各组(P < 0.05);C0、C0.1、M2.5组之间蛋白质效率无显著性差异(P>0.05),三者均显著低于C0.1+M2.5、C0.25+M2.5组(P < 0.05);C0.25组的蛋白质效率显著低于C0.1+M2.5组(P < 0.05),与其他各组无显著性差异(P>0.05)。各组成活率无显著性差异(P>0.05)。
|
|
表 2 饲料中添加COS和/或MA对凡纳滨对虾生长性能的影响 Table 2 Effects of dietary COS and/or MA on growth performance of Litopenaeus vannamei |
由表 3可知,各组对虾虾体水分、粗灰分含量无显著性差异(P>0.05)。C0.1+M2.5组虾体粗蛋白质含量与C0.25组无显著性差异(P>0.05),但显著高于其他各组(P < 0.05);C0、C0.1、M2.5组之间虾体粗蛋白质含量无显著性差异(P>0.05),但三者均显著低于C0.1+M2.5组并均显著高于C0.25+M2.5组(P < 0.05);C0.25+M2.5组虾体粗蛋白质含量显著低于其他各组(P < 0.05)。各添加组虾体粗脂肪含量均显著低于C0组(P < 0.05);M2.5、C0.1+M2.5和C0.25+M2.5组虾体粗脂肪含量与C0.25组无显著性差异(P>0.05),但均显著低于C0和C0.1组(P < 0.05);C0.1组虾体粗脂肪含量与C0.25组无显著性差异(P>0.05),但显著低于C0组并显著高于其他各组(P < 0.05)。
|
|
表 3 饲料中添加COS和/或MA对凡纳滨对虾体成分的影响 Table 3 Effects of dietary COS and/or MA on body composition of Litopenaeus vannamei |
由表 4可知,C0.25+M2.5组血清中AKP活性与M2.5组无显著性差异(P>0.05),但显著低于其他各组(P<0.05);C0.1+M2.5组血清中AKP活性与M2.5组无显著性差异(P>0.05),但显著高于C0.25+M2.5组(P<0.05) 并显著低于其他各组(P<0.05);C0.1组血清中AKP活性与C0组无显著性差异(P>0.05),但显著低于C0.25组(P<0.05) 并显著高于其他各组(P<0.05)。C0、C0.1和C0.25组之间血清中SOD活性无显著性差异(P>0.05),但三者均显著低于其他各组(P<0.05);M2.5组血清中SOD活性与C0.25+M2.5组无显著性差异(P>0.05),但显著低于C0.1+M2.5组(P<0.05) 并显著高于其他各组(P<0.05);C0.1+M2.5组血清中SOD活性与C0.25+M2.5组无显著性差异(P>0.05),但显著高于其他各组(P<0.05)。C0、C0.1、M2.5组之间血清中PO活性无显著性差异(P>0.05),但三者均显著低于C0.25和C0.1+M2.5组(P<0.05);血清中PO活性以C0.25组最高,与C0.1+M2.5组无显著性差异(P>0.05),但显著高于其他各组(P<0.05)。C0.1组血清中LZM活性显著高于M2.5和C0.25+M2.5组(P<0.05),与其他各组无显著性差异(P>0.05);血清中LZM活性以C0.25+M2.5组最低,显著低于C0.1和C0.1+M2.5组(P<0.05),与其他各组无显著性差异(P>0.05)。
|
|
表 4 饲料中添加COS和/或MA对凡纳滨对虾血清中非特异性免疫酶活性和MDA含量的影响 Table 4 Effects of dietary COS and/or MA on nonspecific immune enzyme activities and MDA conent in serum of Litopenaeus vannamei |
M2.5、C0.1+M2.5组血清中MDA含量与C0.25+M2.5组无显著性差异(P>0.05),但二者均显著低于其他各组(P<0.05);C0.1组血清中MDA含量与C0、C0.25组无显著性差异(P>0.05),但显著高于其他各组(P<0.05)。
2.4 饲料中添加COS和/或MA对凡纳滨对虾肝胰腺中非特异性免疫酶活性及MDA含量的影响由表 5可知,C0.1+M2.5组肝胰脏中AKP活性与C0.1、M2.5组无显著性差异(P>0.05),但显著高于其他各组(P<0.05);肝胰脏中AKP活性以C0.25组最低,与C0.25+M2.5和C0组无显著性差异(P>0.05),但显著低于其他各组(P<0.05)。肝胰脏中SOD活性仅C0.1组显著高于C0组(P<0.05),其他各组之间无显著性差异(P>0.05)。C0.25组肝胰脏中LZM活性与C0.1、M2.5组无显著性差异(P>0.05),但显著高于其他各组(P<0.05);C0组肝胰脏中LZM活性与C0.1+M2.5、C0.25+M2.5组无显著性差异(P>0.05),但显著低于其他各组(P<0.05);C0.1、M2.5、C0.1+M2.5、C0.25+M2.5组之间肝胰脏中LZM活性无显著性差异(P>0.05)。
|
|
表 5 饲料中添加COS和/或MA对凡纳滨对虾肝胰腺中非特异性免疫酶活性和MDA含量的影响 Table 5 Effects of dietary COS and/or MA on nonspecific immune enzyme activities and MDA content in hepatopancreas of Litopenaeus vannamei |
C0.25、M2.5、C0.1+M2.5、C0.25+M2.5组肝胰脏中MDA含量无显著性差异(P>0.05), 但均显著低于C0和C0.1组(P<0.05),而C0和C0.1组之间无显著性差异(P>0.05)。
2.5 饲料中添加COS和/或MA对凡纳滨对虾哈维氏弧菌攻毒后累积死亡率的影响如图 1所示,C0组的累积死亡率最高,显著高于各添加组(P<0.05);M2.5组的累积死亡率虽显著低于C0组(P<0.05),但显著高于其他添加组(P<0.05);C0.1、C0.25、C0.1+M2.5、C0.25+M2.5组之间累积死亡率无显著性差异(P>0.05),但均显著低于C0和M2.5组(P<0.05)。
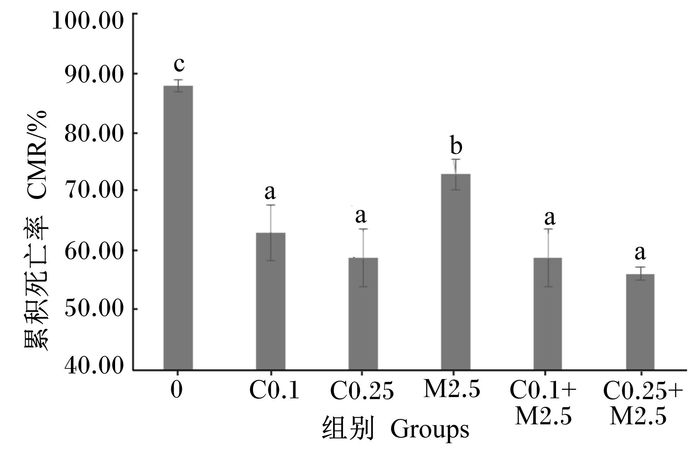
|
数据柱标注不同小写字母表示差异显著(P<0.05)。 Date columns with different small letters differ significantly (P < 0.05). 图 1 饲料中添加COS和/或MA对凡纳滨对虾哈维氏弧菌攻毒后累积死亡率的影响 Figure 1 Effects of dietary COS and/or MA on CMR of Litopenaeus vannamei after challenged by Vibrio harveyi |
由本试验结果可知,与对照组相比,饲料中单独添加COS和MA提高了凡纳滨对虾的特定生长率、增重率和饲料系数。李振达等[6]的研究表明COS可以显著提高凡纳滨对虾的增重率、特定生长率和饲料系数,Qin等[7]发现COS可以显著提升罗非鱼的β生长因子转录水平,Lin等[8]研究表明COS可以显著提高卵形鲳鲹的生长率,Zhou等[12]研究发现COS可提升肉鸡的增重和饲料利用率;MA同样可以提升动物的生长性能[14-15],饲料中添加沸石可以提高肉仔鸡的生长速度、提高饲料转化率[19],提升产蛋鸡的生产性能[20],这些研究结果与本试验结果基本一致。寡糖主要通过以下途径对动物的生长性能产生影响:促进小肠绒毛生长,维护肠黏膜完整性,促进营养物质吸收[7];优化肠道菌群结构,增加有益菌比例,抑制埃希氏杆菌属(Escherichia)增殖,改善肠道内环境,促进对营养物质的吸收,进而促进动物生长[21]。硅铝酸盐类吸附剂可能含有多种矿物元素,已有的报道指出Azomite(主要成分为水合硅铝酸盐)含有70种以上微量和常量元素,补充了原有饲料矿物元素的不足[18];微量元素与动物生长发育密切相关[22-24],硅铝酸盐吸附剂中含有稀土元素[17],可以激活体内生长因子,促进酶的转化,提高饲料转化率,加快动物的生长速度[25],并且其良好的吸附和离子交换能力对消化道有害菌有一定吸附作用,可优化肠道环境,提高动物肠道消化酶活性,促进养分的吸收[17, 26],从而促进动物生长。本试验中,与对照组或单独添加COS和MA组相比,COS与MA联合添加提高了凡纳滨对虾的特定生长率、增重率、蛋白质效率,并显著降低了饲料系数。此外,C0.1+M2.5组特定生长率或增重率显著高于M2.5组,但与C0.1组无显著性差异;C0.25+M2.5组特定生长率或增重率显著高于M2.5组但与C0.25组无显著性差异,M2.5组与C0组无显著性差异,这说明COS可能在复合添加中起了主导作用。寡糖是非消化糖类物质,动物不能或极少吸收,添加过量会引起动物不良性腹泻,造成负效应[27],C0.25+M2.5组相比C0组,特定生长率、增重率显著提高,相比C0.1+M2.5组则稍微下降但差异不显著,这说明C0.25+M2.5组同样改善了凡纳滨对虾的生长性能,但并不能说明COS是否过量,有关二者复配的比例问题还有待进一步研究。
3.2 饲料中添加COS和/或MA对凡纳滨对虾体成分的影响蔡胜昌等[28]的研究表明,饲料中单独添加COS对大菱鲆(Scophthalmus maximus)幼鱼全鱼水分及肌肉粗灰分含量均无显著影响;Niu等[29]研究发现,饲料中添加不同水平COS对凡纳滨对虾虾体水分、粗灰分含量均无显著影响,本试验结果与上述研究结果一致,即饲料中单独或联合添加COS和MA对凡纳滨对虾虾体水分、粗灰分含量均没有产生显著性影响。华雪铭等[30]的研究表明,饲料中单独或联合添加COS、益生菌可降低暗纹东方鲀(Fugu obscurus)体脂肪含量;Niu等[29]研究表明,饲料中壳聚糖添加量在1 g/kg以上时降低了凡纳滨对虾虾体粗脂肪含量;Zhou等[12]研究表明,COS可调节脂肪代谢,使鸡腹部总脂肪含量下降;宋涛[31]研究发现,饲料中添加300 g/t的COS可显著降低鸭体内脂肪沉积,腹部、肌肉间脂肪率显著下降。本试验所得结果与上述研究结果一致,表现为各添加组虾体粗脂肪含量均显著低于对照组。Kanauchi等[32]研究报道,壳聚糖可通过其带正电荷的碱性氨基在带负电荷的脂肪油滴周围构筑一层屏障,使脂肪油滴不能被机体消化吸收而排出体外,减少肠道内小肠上皮细胞对脂肪的吸收而降低脂肪的沉积[33]。COS的性能比壳聚糖更加卓越,因此这可能也是本试验中凡纳滨对虾虾体粗脂肪含量下降的原因。然而,任秀芳等[9]的试验结果为1%或3%的壳聚糖提高了克氏原螯虾肌肉中粗脂肪的含量,这可能与测试的部位(本试验测定的是全虾)以及试验对象或COS、壳聚糖聚合度差异有关。M2.5组虾体粗脂肪含量相比对照组显著下降,而C0.1+M2.5组以及C0.25+M2.5组相比C0.1、C0.25组虾体粗脂肪含量进一步下降,证明COS与MA联合添加时对体脂肪沉积的影响更大,原因可能是COS与吸附剂中的稀土元素结合形成稳定的配合物,调节了脂质的代谢[34]。
本试验中,C0.1+M2.5组虾体粗蛋白质含量比C0.1、M2.5组显著上升,说明COS和MA的联合添加促进了蛋白质的合成和累积。曹丹等[10]研究发现,摄食壳聚糖后鱼体内RNA/DNA值显著上升,而RNA/DNA值反映蛋白质的代谢速率,表明鱼体内肌肉蛋白质合成加快,刘梅[35]在饲粮中添加不同水平的壳聚糖,结果表明,随着壳聚糖添加水平的增加,肉鸡肌肉粗蛋白质含量呈增多趋势,这与本试验结果一致。壳聚糖能够提高水产动物机体粗蛋白质含量的原因可能是:壳聚糖能促进肠道对营养成分的吸收,提高饲料中蛋白质的利用效率,加快机体蛋白质合成;此外,壳聚糖可能还有提高细胞中RNA翻译效率的作用,从而加快细胞中多肽链的合成[11]。而硅铝酸盐类MA含有多种微量元素,在动物体内吸收后促进了物质代谢,其较大的表面积和吸附能力可延长饲料在消化道的停留时间,使机体消化吸收率提高[26]。本试验中,COS与MA协同作用提高了凡纳滨对虾虾体的粗蛋白质含量。
3.3 饲料中添加COS和/或MA对凡纳滨对虾非特异性免疫力及抗病力的影响COS具有促进巨噬细胞的吞噬功能、提高水解酶的活性、促进细胞因子的释放等作用。其增强养殖动物免疫的机制有如下解释:1) COS作为阳性趋向剂,可促进单核细胞形成巨噬细胞,使活性氧的含量增加,再通过活性氧的氧化性杀菌机制发挥免疫防御功能;2) COS含大量游离氨基,可吸附氢离子(H+),活化T淋巴细胞,诱导Ⅳ型超敏反应,致使细胞侵润和变形坏死,也可直接或间接激活巨噬细胞,增强其杀菌活性[34]。饲料中添加MA则主要是吸附了有害物质如细菌、重金属等,保护胃肠道,还可为机体补充矿物元素,更有一些微量元素可以激活酶的活性,从而提升动物的健康水平[36]。
甲壳动物以非特异性免疫为主,非特异性免疫包括细胞免疫和体液免疫,细胞免疫受体液免疫因子的介导和影响[27],体液免疫因子包括PO、SOD、LZM及AKP等,PO在血细胞内以酚氧化酶原的形式存在,能够被一些蛋白质或多糖激活而转变成有活性的PO[37],有活性的PO可以将苯酚氧化成醌,醌再转换成可以包裹入侵病原体的黑色素[38],从而清除有害物质。本试验中,各添加组血清和肝胰腺中PO活性相比对照组均有不同程度的提高,C0.1+M2.5组血清PO活性显著高于C0.1、M2.5组,说明COS与MA联合添加能更好地提高凡纳滨对虾的非特异免疫力。任秀芳等[9]研究报道,壳聚糖可以显著提高克氏原螯虾幼虾或亲虾血清中PO活性;李振达等[6]报道0.2% Azomite可以显著提高凡纳滨对虾血清中PO活性,COS显著提高了血细胞中小颗粒细胞数目。
SOD通过消除体内多余的自由基,从而免除自由基对生物体的伤害,增强吞噬细胞的防御能力,在预防机体衰老、抵抗生物分子损伤及改善机体的免疫功能等方面具有极为重要的作用[37]。MDA是膜脂过氧化的终产物之一,具有很强的生物毒性。MDA主要损伤生物膜结构,改变膜的通透性,影响生理生化反应,因此MDA含量可以反映出机体细胞受自由基氧化损伤的程度[39],作为考察细胞受胁迫严重程度的指标之一。本试验中C0.1+M2.5组血清中SOD活性最高并显著高于C0、C0.1和M2.5组,各添加组肝胰腺中SOD活性均有不同程度的提高,这与李振达等[6]研究中COS能提高凡纳滨对虾血清中总超氧化物歧化酶(T-SOD)活性以及Lin等[8]研究中COS能提高卵形鲳鲹血清中SOD活性的结果一致。MA也可提高动物的抗氧化能力,陈继发等[14]研究显示蒙脱石可以显著提升产蛋鸡血清中T-SOD活性和总抗氧化能力,谭崇桂[17]的研究表明0.2%Azomite可显著提高凡纳滨对血清中SOD活性。本试验中C0.1+M2.5组血清和肝胰腺中MDA含量显著低于C0和C0.1组,这与Niu等[40]在斑节对虾(Penaeus monodon)中的研究结果一致。
虾类血清中的AKP主要来源于肝脏,是一种重要的代谢调控酶,直接参与磷酸基团的转移及钙磷代谢,在动物活体内作为磷蛋白磷酸酶参与细胞中的物质代谢,是甲壳动物吞噬溶酶体的重要组成部分[37]。任秀芳等[9]、白阳[11]的试验中均显示低添加量的COS对试验动物血清中AKP活性无显著性影响,一定量的COS可以提高其活性,而本试验结果显示,C0.1+M2.5、C0.25+M2.5组血清中AKP活性均显著低于对照组。研究报道,当动物发生阻塞性黄疸、原发性肝癌、胆汁淤积性肝炎等疾病时,肝细胞过度制造AKP进入血液,同时由于肝内胆道胆汁排泄障碍,反流入血而引起血清AKP活性明显升高[41]。吴垠等[42]发现,患病的中国对虾血清AKP活性显著高于正常虾,重症期病虾血清中AKP活性提高幅度增至82.3%~93.7%。Omkar等[43]研究发现,将一种淡水虾Macrobrachium lamarrei暴露于敌敌畏后,发现其血清中AKP活性增强。因此,本试验中各添加组对虾血清中AKP活性维持在较低水平,而在肝胰腺中AKP活性较高,可能恰好说明机体处于一个健康的状态。
虾类血清中LZM主要来源血液,LZM是一种碱性蛋白,它能水解革兰氏阳性菌细胞壁中黏性多肽的乙酰氨基多糖,并使之裂解释放出来,形成一个水解酶体系,破坏和消除侵入虾体的异物,从而担负起机体防御的功能[37]。Suzuki等[44]发现COS可以增强T细胞表面白介素-2(IL-2) 受体的表达,加速T细胞的成熟以及分化成熟为效应T细胞。本试验结果显示,血清或肝胰腺中LZM活性C0.1、C0.1+M2.5组相比C0组均有不同程度提升。研究报道,饲料中添加COS可以提高凡纳滨对虾血清或肝胰腺中LZM活性[6],提高动物机体的免疫力[4]。任秀芳等[9]研究显示,一定量壳聚糖显著提高克氏原螯虾血清或肝胰腺中LZM活性,与本试验结果一致。因此,COS与MA联合添加提升了凡纳滨对虾血清中LZM活性,增强了凡纳滨对虾的非特异性免疫力。
哈维氏弧菌攻毒试验结果显示,单独或联合添加COS和MA均能显著提高凡纳滨对虾的抗病力,从累积死亡率结果可知,单独添加MA的抗病效果不如单独添加COS或联合添加COS与MA,且以高剂量联合添加COS与MA(250 mg/kg COS+2 500 mg/kg MA)的抗病效果最好。研究报道,COS能提高杂交罗非鱼抗嗜水气单胞菌(A. hydrophila)感染的能力[7],4.0 g/kg的COS可以显著提高卵形鲳鲹抗哈维氏弧菌感染的能力[8],Azomite可降低对虾攻毒溶藻弧菌后的死亡率[17],以上结果与本试验结果相似。对于COS的抑菌机理,主要是由于其具有质子化铵,能与细菌带负电荷的细胞膜作用,干扰细菌细胞膜功能,造成细菌体内细胞质流失,同时,水溶性的COS由于分子质量小,能进一步进入菌体内部,扰乱细胞的正常生理代谢[45]。
本试验中C0.25+M2.5组血清和肝胰腺中AKP、PO、SOD、LZM活性比C0.1+M2.5组均有所下降,而血清和肝胰腺中MDA含量有所升高,结合生长性能指标和哈维氏弧菌攻毒后的累积死亡率,说明250 mg/kg COS+2 500 mg/kg MA的促生长和免疫效果减弱,但具有最强的抗病力,有关二者联合添加比例还需进一步深入系统的研究。
4 结论本试验条件下,饲料中添加一定量的COS和/或MA均能促进凡纳滨对虾的生长、提高非特异性免疫力和抗病力,综合来看,以100 mg/kg COS和2 500 mg/kg MA联合添加时作用效果较佳。
| [1] |
WANG Z S, YAN C Z, YAN Y J, et al. Integrated assessment of biomarker responses in caged shrimps (Litopenaeus vannamei) exposed to complex contaminants from the Maluan Bay of China[J]. Ecotoxicology, 2012, 21(3): 869-881. DOI:10.1007/s10646-011-0849-0 |
| [2] |
LOTZ J M, SOTO M A. Model of white spot syndrome virus (WSSV) epidemics in Litopenaeus vannamei[J]. Diseases of Aquatic Organisms, 2002, 50(3): 199-209. |
| [3] |
李爱科, 林燕, 赵永欣. 饲用抗生素替代品研究进展[J]. 饲料工业, 2013(20): 1-6. |
| [4] |
高巍, 陈帅, 丁兆坤, 等. 饲料中添加壳寡糖对动物机体的影响[J]. 动物营养学报, 2014, 26(2): 322-326. |
| [5] |
陈明亮. 壳聚糖蒙脱石复合物的抗菌活性及抗菌机理研究[D]. 硕士学位论文. 郑州: 河南农业大学, 2012. http://www.cnki.com.cn/Article/CJFDTotal-HBYZ201621017.htm
|
| [6] |
李振达, 陈小娥, 廖智, 等. 壳寡糖对凡纳滨对虾生长和免疫力的影响[J]. 南方水产科学, 2011, 7(4): 36-42. |
| [7] |
QIN C B, ZHANG Y T, LIU W S, et al. Effects of chito-oligosaccharides supplementation on growth performance, intestinal cytokine expression, autochthonous gut bacteria and disease resistance in hybrid tilapia Oreochromis niloticus ♀×Oreochromis aureus ♂[J]. Fish & Shellfish Immunology, 2014, 40(1): 267-274. |
| [8] |
LIN S M, MAO S H, GUAN Y, et al. Dietary administration of chitooligosaccharides to enhance growth, innate immune response and disease resistance of Trachinotus ovatus[J]. Fish & Shellfish Immunology, 2012, 32(5): 909-913. |
| [9] |
任秀芳, 周鑫, 赵朝阳, 等. 壳聚糖对克氏原螯虾生长、血清相关免疫因子、肌肉成分和消化酶的影响[J]. 大连海洋大学学报, 2013, 28(5): 468-474. |
| [10] |
曹丹, 周洪琪. 壳聚糖对异育银鲫的生长、蛋白质合成及肌肉营养成分的影响[J]. 淡水渔业, 2004, 34(1): 6-9. |
| [11] |
白阳. 壳聚糖和壳寡糖及其配合物对刺参生长和品质相关指标的影响[D]. 硕士学位论文. 青岛: 中国海洋大学, 2015. http://www.cnki.com.cn/Article/CJFDTOTAL-AGRI200901027.htm
|
| [12] |
ZHOU T X, CHEN Y J, YOO J S, et al. Effects of chitooligosaccharide supplementation on performance, blood characteristics, relative organ weight, and meat quality in broiler chickens[J]. Poultry Science, 2009, 88(3): 593-600. DOI:10.3382/ps.2008-00285 |
| [13] |
谢晓鹏, 易卫, 庄智明, 等. 饲料中的霉菌毒素及其防制措施[J]. 中国畜牧兽医, 2013, 40(5): 101-106. |
| [14] |
陈继发, 罗玲, 曲湘勇, 等. 霉菌毒素吸附剂对产蛋鸡生产性能、蛋黄中微量元素含量、血清抗氧化和生化指标的影响[J]. 动物营养学报, 2016, 28(10): 3183-3191. DOI:10.3969/j.issn.1006-267x.2016.10.021 |
| [15] |
王芳. 蒙脱石对采食含霉变花生粕饲粮的肉仔鸡生产性能及健康的影响[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2016. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-SEKM201410001013.htm
|
| [16] |
张瑞星, 黄凯, 宋明明, 等. 霉变饲料中添加复合霉菌毒素吸附剂对肉鸡抗氧化和免疫功能的影响[J]. 饲料工业, 2015, 36(9): 32-35. |
| [17] |
谭崇桂. 几种添加剂对凡纳滨对虾生长、血清非特异性免疫及抗病力的影响[D]. 硕士学位论文. 上海: 上海海洋大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10264-1013000321.htm
|
| [18] |
张勇, 郑丽莉, 朱宇旌, 等. 酵母细胞壁多糖与铝硅酸盐复合物对猪生长性能、免疫指标及养分消化率的影响[J]. 动物营养学报, 2012, 24(9): 1799-1804. |
| [19] |
KARAMANLIS X, FORTOMARIS P, ARSENOS G, et al. The effect of a natural zeolite (Clinoptilolite) on the performance of broiler chickens and the quality of their litter[J]. Asian-Australasian Journal of Animal Sciences, 2008, 21(11): 1642-1650. DOI:10.5713/ajas.2008.70652 |
| [20] |
BILAL T, KAYGISIZ F, ESECELI H, et al. Effect of vitamin D3 and/or zeolite supplementation to laying hen rations added microbial phytase on performance and enterprise income[J]. Journal of Animal and Veterinary Advances, 2012, 8(5): 1013-1020. |
| [21] |
KOTANI T, WAKIYAMA Y, IMOTO T, et al. Improved larviculture of ocellate puffer Takifugu rubripes through control of stocking density[J]. Aquaculture, 2011, 312(1/2/3/4): 95-101. |
| [22] |
董晓慧, 杨原志, 郑石轩, 等. 不同形式钴对凡纳滨对虾生长和组织钴含量的影响[J]. 广东海洋大学学报, 2006, 26(6): 8-12. |
| [23] |
杨志强, 毛嗣岳, 董明显, 等. 稀土对肉鸡血中微量元素含量影响的研究[J]. 稀土, 1992(4): 20-23. |
| [24] |
景绍红, 胡占云, 黄微. 稀土元素的研究与应用现状[J]. 猪业科学, 2010, 27(4): 58-60. |
| [25] |
江振莹. 稀土元素对动物生长及抗病力影响的研究[J]. 华北农学报, 2004, 19(增刊1): 64-68. |
| [26] |
OUHIDA I, PÉREZ J F, PIEDRAFITA J, et al. The effects of sepiolite in broiler chicken diets of high, medium and low viscosity.Productive performance and nutritive value[J]. Animal Feed Science and Technology, 2000, 85(3/4): 183-194. |
| [27] |
孙忠保, 阎宏, 马永军. 寡糖在动物生产中的应用[J]. 农业科学研究, 2004, 25(4): 80-84. |
| [28] |
蔡胜昌, 张利民, 张德瑞, 等. 壳寡糖与低聚木糖对大菱鲆(Scophthalmus maximus)幼鱼生长、体组成和血液生化指标的影响[J]. 渔业科学进展, 2015, 36(6): 29-36. DOI:10.11758/yykxjz.20150605 |
| [29] |
NIU J, LIU L X, LIN Y J, et al. Effect of dietary astaxanthin on growth, survival, and stress tolerance of postlarval shrimp, Litopenaeus vannamei[J]. Journal of the World Aquaculture Society, 2011, 40(6): 795-802. |
| [30] |
华雪铭, 周洪琪, 张宇峰, 等. 饲料中添加壳聚糖和益生菌对暗纹东方鲀幼鱼生长及部分消化酶活性的影响[J]. 水生生物学报, 2005, 29(3): 299-305. |
| [31] |
宋涛. 日粮中不同水平壳寡糖对北京鸭生长性能、脂肪沉积以及肉品质的影响[D]. 硕士学位论文. 武汉: 华中农业大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10504-2005153243.htm
|
| [32] |
KANAUCHI O, DEUCHI K, IMASATO Y, et al. Mechanism for the inhibition of fat digestion by chitosan and for the synergistic effect of ascorbate[J]. Bioscience Biotechnology & Biochemistry, 1995, 59(5): 786-790. |
| [33] |
RAZDAN A, PETTERSSON D. Hypolipidaemic, gastrointestinal and related responses of broiler chickens to chitosans of different viscosity[J]. The British Journal of Nutrition, 1996, 76(3): 387-397. DOI:10.1079/BJN19960044 |
| [34] |
韩丽蓉. 壳寡糖、稀土及壳寡糖稀土配合物对刺参(Apostichopus japonicus Selenka)生长、免疫反应和抗病力的影响[D]. 硕士学位论文. 青岛: 中国海洋大学, 2014.
|
| [35] |
刘梅. 壳聚糖对肉仔鸡肉品质的影响[J]. 东北农业大学学报, 2011, 42(3): 25-28. |
| [36] |
吴亚男, 吴秋珏, 周岩民, 等. 沸石提高动物健康及其机制[J]. 中国粮油学报, 2013, 28(5): 105-111. |
| [37] |
王冰心, 叶均安. 虾类血清中免疫相关酶的研究进展[J]. 中国饲料, 2009(3): 27-28,36. |
| [38] |
AMPARYUP P, CHAROENSAPSRI W, TASSANAKAJON A. Two prophenoloxidases are important for the survival of Vibrio harveyi challenged shrimp Penaeus monodon[J]. Developmental & Comparative Immunology, 2009, 33(2): 247-256. |
| [39] |
DEL MAESTRO R F. An approach to free radicals in medicine and biology[J]. Acta Physiologica Scandinavica.Supplementum, 1980, 492: 153-168. |
| [40] |
NIU J, LIN H Z, JIANG S G, et al. Comparison of effect of chitin, chitosan, chitosan oligosaccharide and N-acetyl-D-glucosamine on growth performance, antioxidant defenses and oxidative stress status of Penaeus monodon[J]. Aquaculture, 2013, 372-375: 1-8. DOI:10.1016/j.aquaculture.2012.10.021 |
| [41] |
FERNANDEZ N J, KIDNEY B A. Alkaline phosphatase:beyond the liver[J]. Veterinary Clinical Pathology, 2007, 36(3): 223-233. DOI:10.1111/vcp.2007.36.issue-3 |
| [42] |
吴垠, 邢殿楼, 祝国芹, 等. 中国对虾暴发性流行病的血液病理研究[J]. 中国水产科学, 1998(3): 53-57. |
| [43] |
OMKAR, SHUKLA G S. Nature of dichlorvos intoxication in a freshwater prawn, Macrobrachium lamarrei (H. Milne Edwards)[J]. Environmental Research, 1985, 37(2): 349-354. DOI:10.1016/0013-9351(85)90115-X |
| [44] |
SUZUKI K, OKAWA Y, HASHIMOTO K, et al. Protecting effect of chitin and chitosan on experimentally induced murine candidiasis[J]. Microbiology and Immunology, 1984, 28(8): 903-912. DOI:10.1111/mim.1984.28.issue-8 |
| [45] |
严钦, 沈月新, 王慥. 壳寡糖的制备及其抑菌性能研究[J]. 食品研究与开发, 2003, 24(2): 26-29. |




