乳蛋白和乳脂是牛奶质量的关键指标。乙酸和β-羟丁酸来源于瘤胃发酵,它们是奶牛乳腺上皮细胞(bovine mammary epithelial cells, BMECs)脂肪酸从头合成的主要前体物,约50%的C16脂肪酸和长链脂肪酸(long chain fatty acids, LCFA)来源于饲料和体脂分解[1]。孔庆洋[2]在BMECs中添加乙酸和β-羟丁酸,结果表明提高了乙酰辅酶A羧化酶(ACC)和脂肪酸合成酶(FASN)基因的表达量及甘油三酯(triglyceride,TAG)的合成量,同时也提高了哺乳动物雷帕霉素靶蛋白(mTOR)和二酰甘油酰基转移酶2(DGAT2) 基因的表达量。梁梦瑶等[3]研究结果表明,低浓度的油酸促进BMECs ACC和FASN基因的表达,进而促进乳脂的合成。李红磊[4]研究表明,当油酸、亚油酸、亚麻酸的浓度比例为2.0(22.20 μmol/L):13.3(147.70 μmol/L): 1.0(11.10 μmol/L)时,上调了BMECs αS1-酪蛋白(CSN1S1)、κ-酪蛋白(CSN3) 和mTOR基因的表达量。由此可见,在泌乳过程中,脂肪酸起到重要的调控作用,对乳蛋白和乳脂的合成具有重要影响。Mach等[5]研究表明,饲粮中添加油菜籽、大豆、亚麻籽后,乳脂和乳蛋白的含量下降,产奶量增加。因此,可以假设乳脂合成前体物(MFP)中不饱和脂肪酸的比例可以调乳成分合成。综观国内外文献报道,在牛奶的分泌机制和营养调控乳成分含量方面取得了一些进展,但是营养素调控乳蛋白、乳脂合成分子生物学机制和信号转导途径仍然不清楚。单一脂肪酸的添加对BMECs乳蛋白和乳脂合成影响的研究最多,而短链脂肪酸(short chain fatty acids,SCFA)和LCFA的混合添加对BMECs乳成分合成影响的研究较少。因此,本试验混合添加不同比例的乙酸、β-羟丁酸、油酸、亚油酸、亚麻酸,研究其对BMECs乳蛋白和乳脂合成相关基因表达量的影响,旨在探寻促进乳蛋白和乳脂合成的脂肪酸组合添加模式,为调控乳成分合成提供理论依据。
1 材料与方法 1.1 BMECs的分离与纯化选取体况良好、处于泌乳高峰期的中国荷斯坦奶牛进行乳腺组织取样,剪取含有大量腺泡的乳腺组织约55 g放于含有双抗的磷酸盐缓冲液(PBS)中,通过Ⅱ型胶原酶消化获得原代BMECs。放于37 ℃、5% CO2的恒温培养箱中培养原代细胞,大约1周细胞长满培养瓶底部的80%左右时,利用胰酶对成纤维上皮细胞和乳腺上皮细胞的消化时间不同来纯化BMECs并传代。以第2代的BMECs为试验对象。
1.2 试验培养基试验培养基为添加氢化可的松、谷氨酰胺、胰岛素-转铁蛋白硒钠、催乳素的DMEM/F12的培养基,试剂均购自GIBCO公司。
1.3 试验设计本试验采用单因素完全随机试验设计。脂肪酸添加浓度比例参考李红磊[4]和塔娜等[6]的研究结果设置,当乙酸:β-羟丁酸的浓度比例为2.0:1.0、油酸:亚油酸:亚麻酸的浓度比例为2.0:13.3: 1.0时,对乳脂合成相关基因的表达有较好的促进作用;当乙酸:β-羟丁酸的浓度比例为1.0:1.0、油酸:亚油酸:亚麻酸的浓度比例为9.6:7.4: 1.0时,对乳蛋白合成相关基因的表达有较好的促进作用。因此,依据SCFA(乙酸、β-羟丁酸,总添加量为14.4 mmol/L)和LCFA(油酸、亚油酸、亚麻酸,总添加量为141 μmol/L)的总添加量相同,各脂肪酸间的比例不同的原则,交叉设计了5组,试验设计见表 1。
|
|
表 1 试验设计 Table 1 Experimental design |
采用四甲基偶氮唑盐(thiazoly blue tetrazolium bramide, MTT)比色法检测BMECs的细胞活力。每孔接种细胞悬浮液的密度为1×104个,将96孔板置于培养箱中培养,待细胞生长至培养瓶底部的80%左右时,添加不同浓度比例的乙酸、β-羟丁酸、油酸、亚油酸、亚麻酸的诱导培养基,放置于37 ℃、5% CO2培养箱中培养24 h,每组均设3个重复;培养结束前4 h,每孔加入MTT(5 mg/mL)20 μL;4 h后弃上清,每孔加入二甲基亚砜(DMSO)100 μL,振荡10 min后,用全自动酶标仪检测490 nm下吸光度值(OD490 nm)。
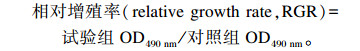
|
接种第2代BMECs悬浮液于75 cm2培养瓶中,每瓶吸取10 mL细胞悬浮液,每瓶细胞约为8×105个,放置在37 ℃、5% CO2培养箱中培养,待细胞生长至培养瓶底部的80%左右时,添加不同乙酸、β-羟丁酸、油酸、亚油酸、亚麻酸浓度比例的诱导培养基,置于37 ℃、5% CO2培养箱中继续培养24 h,每组均设3个重复,用胰蛋白酶/乙二胺四乙酸(EDTA)将细胞消化后离心8 min,弃上清,用PBS清洗1次,采用TAG试剂盒检测BMECs内TAG的合成量。
1.4.3 乳蛋白和乳脂合成相关基因表达量将第2代的BMECs置于37 ℃、5% CO2的恒温培养箱中培养,待细胞长满约70%时,添加不同浓度比例的乙酸、β-羟丁酸、油酸、亚油酸、亚麻酸的诱导培养基,每组设3个重复,培养24 h后,收集细胞,提取RNA(试剂盒为RNA isoplus,TaKaRa公司),反转录(试剂盒为prime scriptTM RT reagent kit,TaKaRa公司),应用RT-qPCR法(试剂盒购自TaKaRa公司),检测乳蛋白合成的相关基因(CSN1S1、CSN3)、信号通路相关基因[mTOR、转录激活因子5(STAT5)、真核翻译起始因子4E结合蛋白1(4EBP1)、核糖体蛋白S6激酶1(S6K1)、蛋白激酶B(AKT)]、乳脂合成的相关基因(ACC、FASN、DGAT2)、乳脂合成相关转录调控因子[过氧化物酶体增殖物激活受体γ(PPARγ)、固醇调节原件结合蛋白1(SREBP1)]的表达量。试验重复3次。本试验内参基因为甘油醛-3-磷酸脱氢酶(GAPDH)。引物序列及参数见表 2。各基因表达量用2-△△Ct值表示[6]。
|
|
表 2 引物序列及参数 Table 2 Primer sequences and parameters |
采用Excel 2007进行计算和整理试验数据,实时定量PCR试验结果采用2-△△Ct法进行相对定量数据分析。利用SAS 9.0软件的ANOVA程序对数据进行方差分析,P < 0.05表示差异显著。
2 结果 2.1 不同浓度比例脂肪酸对BMECs RAG和TAG合成量的影响由表 3可知,试验组BMECs的RGR和TAG合成量都显著高于对照组(P < 0.05)。Ⅰ组RGR和TAG合成量显著高于其他试验组(P < 0.05),Ⅱ组和Ⅳ组显著低于Ⅲ组(P < 0.05),Ⅱ组和Ⅳ组之间无显著差异(P>0.05)。
|
|
表 3 不同浓度比例脂肪酸对BMECs RAG和TAG合成量的影响 Table 3 Effects of different concentrations of fatty acids on RAG and TAG synthesis amount in BMECs |
由表 4可知,与对照组相比,Ⅰ组显著降低了BMECs CSN1S1、CSN3和STAT5基因的表达量(P < 0.05),而mTOR和4EBP1基因表达量显著提高(P < 0.05);Ⅱ组、Ⅲ组和Ⅳ组显著上调了CSN3和S6K1基因的表达量(P < 0.05),而STAT5基因表达量显著降低(P < 0.05);Ⅲ组和Ⅳ组AKT和4EBP1基因的表达量显著提高(P < 0.05);Ⅳ组CSN1S1基因表达量显著高于Ⅰ组、Ⅱ组和Ⅲ组(P < 0.05);Ⅱ组mTOR和4EBP1基因的表达量显著降低(P < 0.05)。
|
|
表 4 不同浓度比例的脂肪酸对BMECs乳蛋白合成相关基因表达量的影响 Table 4 Effects of different concentrations of fatty acids on expression levels of genes involved in milk protein synthesis in BMECs |
由表 5可知,与对照组相比,Ⅱ组、Ⅲ组和Ⅳ组ACC和试验组DGAT2基因的表达量显著高于对照组(P < 0.05),Ⅲ组和Ⅳ组ACC基因的表达量显著高于Ⅰ组和Ⅱ组(P < 0.05),Ⅱ组显著高于Ⅰ组(P < 0.05),Ⅱ组和Ⅳ组DGAT2基因的表达量显著高于Ⅰ组和Ⅲ组(P < 0.05),Ⅲ组显著高于Ⅰ组(P < 0.05);试验组FASN和SREBP1基因的表达量显著下降(P < 0.05);Ⅰ组PPARγ基因的表达量显著上升(P < 0.05),而其他试验组则显著降低(P < 0.05)。
|
|
表 5 不同浓度比例的脂肪酸对BMECs乳脂合成相关基因表达量的影响 Table 5 Effects of different concentrations of fatty acids on expression levels of genes involved in milk fat synthesis in BMECs |
脂肪酸是乳腺组织中的一种重要的营养素,对BMECs的生长增殖具有一定的作用。齐利枝等[7]研究表明, 低浓度的乙酸对BMECs的增殖有较好的促进作用,而高浓度则抑制BMECs的增殖。孙晓菊[8]研究表明,当油酸的浓度为50~400 μmo/L、亚油酸的浓度为25~100 μmol/L时,对BMECs的增殖有促进作用,但是当油酸和亚油酸的浓度分别达到800和200 μmol/L时,BMECs的增殖受到抑制;低浓度的亚油酸促进BMECs的增殖,而高浓度则表现出抑制作用。Yonezawa等[9]研究表明,当油酸和亚油酸的浓度均为100 μmol/L时,促进BMECs的增殖。有研究表明,当油酸浓度高于0.20 mmol/L时,细胞增殖受到了抑制[10-11]。AKT有助于细胞的存活和增殖[12]。本试验中,AKT基因的表达量与RGR的变化一致, 相关作用机理有待进一步研究。
3.2 不同浓度比例的脂肪酸对BMECs乳蛋白合成相关基因表达量的影响Janus激酶2(JAK2)/STAT5信号通路的主要调控机制是结合在受体上的STAT5被JAK磷酸化修饰,靶基因与以二聚体的形式进入细胞核的活化STAT5结合,从而调控基因的转录水平[13]。Bionaz等[14]的研究发现,泌乳阶段STAT5和Janus激酶(JAK)的基因表达量没有显著变化,表明JAK/STAT5对乳蛋白合成的调节作用较小。本试验中,试验组STAT5基因表达量均显著低于对照组,Ⅲ组和Ⅳ组4EBP1和S6K1基因表达量显著高于对照组,而且STAT5基因表达量的变化规律与CSN1S1和CSN3的基因表达量并不一致,这提示乳蛋白基因表达量的变化是mTOR信号通路和JAK2/STAT5信号通路综合作用的结果。CSN1S1、CSN3是2个主要的酪蛋白基因,其对BMECs乳蛋白的合成有很强的相关性[15]。Yonezawa等[16]研究发现,当油酸和亚油酸的浓度为400 μmol/L时,对CSN1S1的基因表达量有促进作用。Pauloin等[17]研究表明,在鼠的乳腺上皮细胞中添加不饱和脂肪酸降低CSN3基因的表达量。本试验研究得出,对于CSN1S1基因的表达量,Ⅳ组高于对照组,但差异不显著,Ⅱ组CSN3基因的表达量最高,表明油酸、亚油酸、亚麻酸的浓度比例为9.6: 7.4: 1.0时,对CSN1S1、CSN3基因的表达有显著的促进作用。mTOR是一种非典型的丝氨酸/苏氨酸蛋白激酶[18-19],除了内分泌信号外,mTOR信号途径还能调节乳蛋白合成、细胞能量水平和乳腺氨基酸的利用[20]。此信号通路上游受到AKT磷酸化的正调节,下游可促进S6K1和4EBP1的磷酸化调节翻译起始,下游的这2条通路是2条平行的信号通路,各自控制特定亚基的mRNA翻译过程[21];同时SREBP1作用的靶基因ACC和FASN的表达受到mTOR信号通路的抑制,表明mTOR参与了脂肪酸的从头合成[22]。本试验研究得出,Ⅰ组和Ⅲ组的mTOR和4EBP1基因表达量均显著高于对照组,说明油酸、亚油酸、亚麻酸的浓度比例为2.0: 13.3: 1.0时,上调了mTOR、4EBP1和S6K1基因的表达量,乙酸、β-羟丁酸浓度比例为2.0: 1.0时,对S6K1基因的表达有抑制作用。混合脂肪酸调控BMECs乳蛋白和乳脂合成的机理有待进一步研究。
3.3 不同浓度比例的脂肪酸对BMECs乳脂合成相关基因表达量及TAG合成量的影响AKT与mTOR信号通路不仅调控乳蛋白合成相关基因的表达,同时促进固醇调节原件结合蛋白(SREBP)信号转导,并进一步调控其靶基因ACC、FASN的表达从而影响乳脂的合成,ACC和FASN是乳脂从头合成中2个重要的基因[23]。Ma等[24]研究表明,BMECs中添加100 nmol/L,SREBP1的siRNA、ACC和FASN的mRNA水平下降。本试验结果得出,试验组AKT和ACC基因的表达量均高于对照组,而FASN和SREBP1基因的表达量下降,这表明加入混合脂肪酸后,AKT信号通路负反馈调节SREBP1,SREBP1正反馈调节FASN, 可能会负反馈调节ACC。大量的研究表明,SREBP1和PPARγ是调节乳脂合成相关基因重要的核受体和转录调控因子,而且PPARγ可能参与调控SREBP1基因的表达。在脂肪合成细胞调控因子通路中PPARγ处于枢纽位置,可以通过影响脂肪酸的摄取、转运、从头合成和酯化过程从而调控基因的表达[25]。本试验得出,Ⅰ组PPARγ基因表达量显著高于对照组,其他组显著低于对照组,从而证明PPARγ可能参与了SREBP1的调控,同时受到AKT和mTOR的调控。在内质网中DGAT2是一种完整的细胞微粒体酶,在催化TAG合成的过程中发挥着重要作用,在TAG合成过程中,它是唯一的限速酶[26]。本试验得出,Ⅱ组和Ⅳ组DGAT2基因的表达量都高于对照组,且其TAG合成量也显著高于对照组,这表明DGAT2对TAG的合成具有调控作用。乳脂大部分由TAG组成,来源于BMECs的乳糜微粒,TAG的合成量可以直接反映BMECs乳脂的合成状况。脂肪酸通过上述信号通路的调节合成TAG。崔瑞莲[27]研究指出,BMECs的活力不受抑制的条件下(脂肪酸添加浓度为0~10 μmol/L),TAG的合成与各十八碳脂肪酸添加浓度呈正相关。塔娜等[6]研究表明,适宜的乙酸和β-羟丁酸的浓度比例(2.0: 1.0和4.0: 1.0) 对BMECs中TAG的合成和乳脂合成相关基因的表达有较好的促进作用。Sheng等[28]研究指出,油酸、亚油酸和亚麻酸的添加浓度比例为2.0: 13.3:1.0时对BMECs的TAG合成有较好的促进作用。本试验结果表明,试验组TAG合成量显著高于对照组,表明添加适宜浓度比例的混合脂肪酸对BMECs内TAG的合成有促进作用。
4 结论乙酸、β-羟丁酸、油酸、亚油酸、亚麻酸的浓度分别为7.20 mmol/L、7.20 mmol/L、75.20 μmol/L、58.00 μmol/L、7.80 μmol/L时,提高了CSN1S1、CSN3、AKT、4EBP1、S6K1、DGAT2基因的表达量,对BMECs乳蛋白和乳脂的合成有较好的促进作用。
| [1] |
KALA Č P, SAMKOVÁ E. The effects of feeding various forages on fatty acid composition of bovine milk fat:a review[J]. Czech Journal of Animal Science, 2010, 55(12): 521-537. |
| [2] |
孔庆洋. 乙酸钠和丁酸钠对奶牛乳腺上皮细胞及腺泡乳脂合成相关基因表达的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10224-1012515660.htm
|
| [3] |
梁梦瑶, 高学军, 侯晓明, 等. 油酸和硬脂酸对奶牛乳腺上皮细胞中脂肪酸结合蛋白3表达和脂滴分泌的影响[J]. 中国畜牧兽医学报, 2014, 41(5): 137-141. |
| [4] |
李红磊. 二、三维培养模式下添加十八碳不饱和脂肪酸对奶牛乳腺上皮细胞乳成分合成的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016249844.htm
|
| [5] |
MACH N, JACOBS A A A, KRUIJT L, et al. Alteration of gene expression in mammary gland tissue of dairy cows in response to dietary unsaturated fatty acids[J]. Animal, 2011, 5(8): 1217-1230. DOI:10.1017/S1751731111000103 |
| [6] |
塔娜, 李红磊, 侯先志, 等. 乙酸钠和β-羟丁酸钠对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响[J]. 动物营养学报, 2014, 26(6): 1527-1534. |
| [7] |
齐利枝, 闫素梅, 生冉, 等. 乙酸对奶牛乳腺上皮细胞活力及CD36和FABP3基因表达的影响[J]. 饲料工业, 2013(11): 49-52. |
| [8] |
孙晓菊. 十八碳不饱和脂肪酸对乳腺上皮细胞脂肪代谢的影响及其机制研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10129-1013153894.htm
|
| [9] |
YONEZAWA T, SANOSAKA M, HAGA S, et al. Regulation of uncoupling protein 2 expression by long-chain fatty acids and hormones in bovine mammary epithelial cells[J]. Biochemical and Biophysical Research Communications, 2008, 375(2): 280-285. DOI:10.1016/j.bbrc.2008.08.021 |
| [10] |
VINCIGUERRA M, CARROZZINO F, PEYROU M, et al. Unsaturated fatty acids promote hepatoma proliferation and progression through downregulation of the tumor suppressor PTEN[J]. Journal of Hepatology, 2009, 50(6): 1132-1141. DOI:10.1016/j.jhep.2009.01.027 |
| [11] |
VOCK C, GLEISSNER M, KLAPPER M, et al. Oleate regulates genes controlled by signaling pathways of mitogen-activated protein kinase, insulin and hypoxia[J]. Nutrition Research, 2008, 28(10): 681-689. DOI:10.1016/j.nutres.2008.06.010 |
| [12] |
CHEN C C, BOXER R B, STAIRS D B, et al. AKT is required for STAT5 activation and mammary differentiation[J]. Breast Canser, 2010, 12: R72. |
| [13] |
李喜艳. 奶牛乳腺上皮细胞中赖氨酸蛋氨酸配比模式对酪蛋白合成的影响及机理研究[D]. 硕士学位论文. 北京: 中国农业科学院, 2011. http://d.wanfangdata.com.cn/Thesis/Y1932695
|
| [14] |
BIONAZ M, LOOR J J. Gene networks driving bovine mammary protein synthesis during the lactation cycle[J]. Bioinformatics and Biology Insights, 2011, 5: 83-98. |
| [15] |
LEE G Y, KENNYY P A, LEE E H, et al. Three-dimensional culture models of normal and malignant breast epithelial cells[J]. Nature Methods, 2007, 4(4): 359-365. DOI:10.1038/nmeth1015 |
| [16] |
YONEZAWA T, YONEKURA S, KOBAYASHI Y. Effects of long-chain fatty acids on cytosolic triacylglycerol accumulation and lipid droplet formation in primary cultured bovine mammary epithelial cells[J]. Journal of Dairy Science, 2004, 87(8): 2527-2534. DOI:10.3168/jds.S0022-0302(04)73377-9 |
| [17] |
PAULOIN A, CHAT S, PÉCHOUX C, et al. Oleate and linoleate stimulate degradation of β-casein in prolactin-treated HC11 mouse mammary epithelial cells[J]. Cell and Tissue Research, 2010, 340(1): 91-102. DOI:10.1007/s00441-009-0926-3 |
| [18] |
LATRES E, AMINI A R, AMINI A A, et al. Insulin-like growth factor-1(IGF-1) inversely regulates atrophy-induced genes via the phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin (P13K/Akt/mTOR) pathway[J]. The Journal of Biological Chemistry, 2005, 280(4): 2737-2744. DOI:10.1074/jbc.M407517200 |
| [19] |
LAPLANTE M, SABATINI D M. mTOR signaling at a glance[J]. Journal of Cell Science, 2009, 122(20): 3589-3594. DOI:10.1242/jcs.051011 |
| [20] |
BURGOS S A, DAI M, CANT J P. Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J]. Journal of Dairy Science, 2010, 93(1): 153-161. DOI:10.3168/jds.2009-2444 |
| [21] |
邢媛媛, 李大彪, 李红磊, 等. 催乳素对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响[J]. 动物营养学报, 2016, 28(8): 2439-2447. |
| [22] |
MA X M, BLENIS J. Molecular mechanisms of Mtor-mediated translational control[J]. Nature Reviews Molecular Cell Biology, 2009, 10(5): 307-318. DOI:10.1038/nrm2672 |
| [23] |
BIONAZ M, LOOR J J. ACSL1, AGPAT6, FABP3, LPIN1, and SLC27A6 are the most abundant isoforms in bovine mammary tissue and their expression is affected by stage of lactation[J]. Journal of Dairy Nutrion, 2008, 138(6): 1019-1024. |
| [24] |
MA L, CORL B A. Transcriptional regulation of lipid synthesis in bovine mammary epithelial cells by sterol regulatory element binding protein-1[J]. Journal of Dairy Science, 2012, 95(7): 3743-3755. DOI:10.3168/jds.2011-5083 |
| [25] |
崔瑞莲. 十八碳脂肪酸对泌乳奶牛乳腺上皮细胞甘油三酯合成的影响及机理研究[D]. 硕士学位论文. 北京: 中国农业科学院, 2012. http://cdmd.cnki.com.cn/Article/CDMD-82101-1012415780.htm
|
| [26] |
YU Y H, GINSBERG H N. The role of acyl-CoA:diacylglycerol acyltransferase (DGAT) in energy metabolism[J]. Annals of Medicine, 2004, 36(4): 252-261. DOI:10.1080/07853890410028429 |
| [27] |
THERING B J, BIONAZ M, LOOR J J. Long-chain fatty acid effects on peroxisome proliferator-activated receptor-α-regulated genes in Madin-Darby bovine kidney cells:optimization of culture conditions using palmitate[J]. Journal of Dairy Science, 2009, 92(5): 2027-2037. DOI:10.3168/jds.2008-1749 |
| [28] |
SHENG R, YANS M, QI L Z, et al. Effect of the ratios of unsaturated fatty acids on the expressions of genes related to fat and protein in the bovine mammary epithelial cells[J]. Animal, 2015, 51(4): 381-389. |




