2. 广东省农业科学院动物科学研究所, 广州 510640;
3. 广东省动物育种与营养公共实验室, 广州 510640;
4. 广东省畜禽育种与营养研究重点实验室, 广州 510640
2. Institute of Animal Science, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China;
3. Guangdong Public Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China;
4. Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China
黄颡鱼(Pelteobagrus fulvidraco)又名黄腊丁,属鲇形目、鲿科、黄颡鱼属,是我国淡水水体中分布较广的底层经济杂食性鱼类,含肉率较高,平均为67.53%,其中蛋白质含量为15.37%,脂肪含量为1.61%,极低的脂肪含量使得它备受消费者欢迎[1]。随着市场需求量的稳步提升,规模化和集约化养殖快速发展。但近年来,随着黄颡鱼养殖密度不断扩大,养殖环境中出现了大量的应激因子,使得鱼体生长性能降低、氧化应激增加,严重制约养殖产量的提升[2]。因此,运用营养免疫调控方式,在饲料中添加抗氧化物质提高黄颡鱼的生长性能和抗氧化应激能力,将对黄颡鱼的健康养殖产生积极作用。
谷胱甘肽(glutathione,GSH)是广泛存在于细胞中的生物活性肽,在机体中发挥着重要的生理功能。研究表明,谷胱甘肽能参与机体自由基清除、解毒、物质吸收、细胞生长、细胞免疫及DNA生物合成等,对鱼类的促生长、增强抗氧化应激能力有着重要作用[3]。研究发现,在饲料中添加谷胱甘肽能显著提高奥尼罗非鱼(Oreochromis niloticus×O.aureus)[4]、吉富罗非鱼(GIFT)[5]、凡纳滨对虾(Litopenaeus vannamei)[6-7]的生长和抗应激能力,但对皱纹盘鲍(Haliotis discus hannai)[8]的促生长效果不显著;亦有研究发现,不同添加量的谷胱甘肽对奥尼罗非鱼[9]、牙鲆(Paralichthys olivaceus)[10]的促生长和抗氧化性能作用效果不同,一定添加量的谷胱甘肽能显著改善鱼体的生长和抗氧化性能,过高的添加量会对机体造成负面影响。这表明,谷胱甘肽对水产动物具有良好的促生长和抗氧化应激效果,但其作用效果与动物的种类和添加量不同有关。目前,关于谷胱甘肽对黄颡鱼的营养生理作用尚未见报道。为此,本试验以黄颡鱼为研究对象,通过研究基础饲料中不同添加量谷胱甘肽对黄颡鱼生长性能、体成分、血清生化指标和抗氨氮应激能力的影响,以期为谷胱甘肽在黄颡鱼养殖中的应用提供理论依据。
1 材料与方法 1.1 试验饲料参考Chen等[11]的饲料配方,以鱼粉、豆粕为主要蛋白质源,高精面粉为主要糖源,鱼油和豆油为主要脂肪源配制基础饲料,其组成及营养水平见表 1。在基础饲料中分别添加100、300、500、700 mg/kg谷胱甘肽,配制4种试验饲料,4种试验饲料的粗蛋白质水平分别为41.17%、41.43%、41.44%、41.50%,粗脂肪水平分别为7.02%、7.35%、6.97%、7.03%。谷胱甘肽购自美国AMRESCO公司,还原型,纯度>98.0%。所有原料过60目筛,微量成分遵照逐级放大原则加入,谷胱甘肽溶水后加入各组饲料中。全部混合后用SLX-80型双螺杆挤压机制成直径为1.5 mm颗粒饲料,在55 ℃下烘干,冷却后放入密封袋中,于-20 ℃冰箱中保存待用。
|
|
表 1 基础饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验用黄颡鱼购自广东省清远市黄沙渔业基地。鱼苗先在室外水泥池暂养至1.3 g左右,每天投喂商品饲料2次。饲养试验在广东省农业科学院动物科学研究所水产研究室室内循环水养殖桶(体积约为300 L)内进行。选取体重为(1.32±0.02) g黄颡鱼幼鱼800尾,随机分成5个组,每组4个重复,每个重复40尾鱼。对照组投喂基础饲料,试验组分别投喂4种试验饲料,各组标记为G0、G100、G300、G500和G700组。每天08:30和18:30各投喂1次,投喂量为体重的4%~6%,根据摄食情况调整投喂量。每天排污,每2 d换1次水,换水量为1/3左右。试验期间水温28~32 ℃,氨氮浓度<0.2 mg/L,亚硝酸盐浓度<0.01 mg/L,溶氧含量>6.0 mg/L,pH为7.5~8.0。饲养试验为期56 d。
1.3 样品采集饲养试验结束时禁食24 h,记录每个重复的鱼尾数,并称量总重,计算增重和特定生长率。每个重复随机取15尾鱼,用MS-222麻醉,3尾置于-20 ℃冰箱中保存,用于全鱼体成分测定,6尾用于测定体重、体长、肝脏重和内脏重;6尾用于尾静脉取血,室温静置4 h,3 500 r/min离心10 min,取上清液制备血清,于-80 ℃冰箱保存备用。
1.4 指标测定 1.4.1 生长性能指标计算成活率(survival rate,SR,%)=[(终末尾数-初始尾数)/初始尾数]×100;
增重(weight gain,WG,g)=末均重-初均重;
特定生长率(specific growth rate,SGR,%/d)=100×(ln末均重-ln初均重)/饲养天数;
饲料系数(feed coefficient ratio,FCR)=摄入饲料总量/(终末体重-初始体重);
蛋白质效率(protein efficiency rate,PER,%)=[(终末总重-初始总重)/(摄入饲料总量×饲料粗蛋白质含量)]×100;
蛋白质沉积率(protein deposition rate,PDR,%)=(体组织蛋白质沉积量/蛋白质摄入量)×100;
肥满度(condition factor,CF,g/cm3)=(体重/体长3)×100;
肝体比(hepatosomatic index,HIS,%)=(肝脏重/体重)×100。
1.4.2 常规成分分析粗蛋白质含量利用半自动凯氏定氮仪采用凯氏定氮法(GB/T 6432—1994) 测定;粗脂肪含量采用乙醚抽提的方法(GB/T 6433—1994) 测定;粗灰分含量采用550 ℃灼烧至恒重的方法(GB/T 6438—1992) 测定;水分含量采用105 ℃烘箱烘干至恒重的方法(GB/T 6435—1986) 测定[12]。
1.4.3 血清生化指标分析血清总蛋白、胆固醇、甘油三酯、葡萄糖、尿素氮含量和谷草转氨酶、谷丙转氨酶活性由广州金域医学检验中心(广州)采用日立7600全自动生化分析仪测定。
1.5 氨氮应激试验饲养试验结束后,每个重复随机选取20尾鱼,以氯化铵作为应激源进行应激试验。向水体(体积约为150 L)中加入氯化铵母液(浓度为10 g/L),使总氨氮浓度达到105 mg/L,此时非离子氨的浓度为2.58 mg/L[pH为7.5,温度为(27±1) ℃],非离子氨的计算方法参考李波等[13]。试验开始时,每隔6 h检测水体温度、pH和氨氮浓度,并及时用氯化铵母液调整水体非离子氨浓度。观察并记录黄颡鱼的发病和死亡情况,及时清理死鱼,计算72和96 h内的累积死亡率(cumulative mortality rate,CMR):
累积死亡率(%)=100×应激结束时黄颡鱼死亡尾数/应激前黄颡鱼总尾数。
1.6 数据统计试验数据用平均值±标准差(mean±SD, n=4) 表示。采用SPSS 20.0软件对数据进行单因素方差分析(one-way ANOVA),组间差异显著,再作Duncan氏多重比较法检验,差异显著性水平为P < 0.05。其中,累积死亡率经过反正弦转换后再进行单因素方差分析。
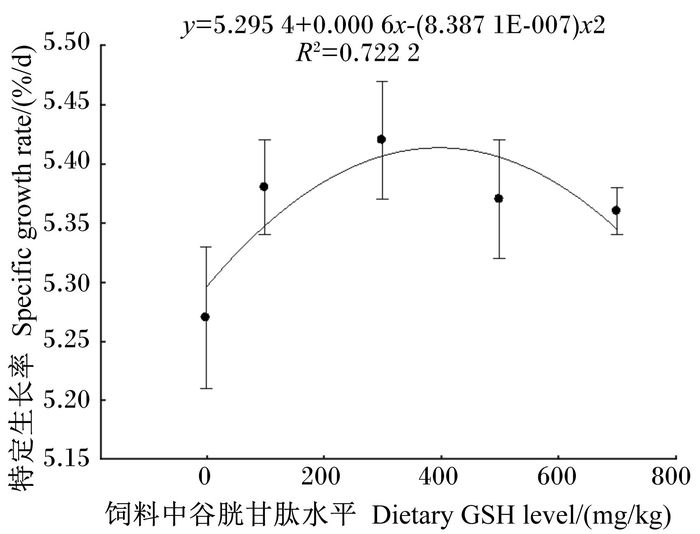
2 结果与分析 2.1 饲料中添加谷胱甘肽对黄颡鱼幼鱼生长性能的影响由表 2可知,随着饲料中谷胱甘肽添加量的增加,黄颡鱼的增重、特定生长率、蛋白质效率均呈现先升高后下降的趋势,均在G300组达到最大值,其中G100、G300、G500组均显著高于对照组(P < 0.05)。与对照组相比,试验组肥满度和肝体比均升高,但差异不显著(P>0.05)。以特定生长率为评价指标,得出黄颡鱼特定生长率(y)与谷胱甘肽添加量(x)之间的一元二次回归方程为y=-(8.3871E-007)x2+0.000 6x+5.295 4 (R2=0.722 2)(图 1)。经计算,得出谷胱甘肽在黄颡鱼幼鱼饲料中的适宜添加量为357.69 mg/kg。
|
|
表 2 饲料中添加谷胱甘肽对黄颡鱼幼鱼生长性能的影响 Table 2 Effects of dietary GSH on growth performance of juvenile yellow catfish (Pelteobagrus fulvidraco) |
|
图 1 饲料中谷胱甘肽水平与黄颡鱼幼鱼特定生长率的关系 Figure 1 Relationship between dietary GSH level and specific growth rate of juvenile yellow catfish (Pelteobagrus fulvidraco) |
由表 3可知,各试验组全鱼体粗蛋白质和粗脂肪含量均高于对照组,其中G300、G500、G700组全鱼体粗蛋白质含量显著高于对照组(P < 0.05),G100、G300、G500、G700组全鱼体粗脂肪含量显著高于对照组(P < 0.05)。各组的全鱼体干物质和粗灰分含量均无显著差异(P>0.05)。
|
|
表 3 饲料中添加谷胱甘肽对黄颡鱼幼鱼体成分的影响(干物质基础) Table 3 Effects of dietary GSH on body composition of juvenile yellow catfish (Pelteobagrus fulvidraco) (DM basis) |
由表 4可知,饲料中添加谷胱甘肽对黄颡鱼血清总蛋白、胆固醇、甘油三酯、葡萄糖、尿素氮含量和谷草转氨酶、谷丙转氨酶活性均无显著影响(P>0.05)。
|
|
表 4 饲料中添加谷胱甘肽对黄颡鱼幼鱼血清生化指标的影响 Table 4 Effects of dietary GSH on serum biochemical indices of juvenile yellow catfish (Pelteobagrus fulvidraco) |
氨氮应激后,黄颡鱼在72 h时出现较大量死亡。由表 5可知,应激72和96 h时,各试验组的累积死亡率均低于对照组,且随着谷胱甘肽添加量的增加累积死亡率呈现先降低后升高的趋势,并均在G300组达到最低,其中96 h时,G100和G300组均显著低于对照组(P < 0.05)。比较2个时间点各组鱼的累积死亡率可以发现,对照组在72 h时累积死亡率达到45.0%,而试验组达到40%以上的累积死亡率出现在96 h。
|
|
表 5 饲料中添加谷胱甘肽对黄颡鱼幼鱼抗氨氮应激能力的影响 Table 5 Effects of dietary GSH on anti-ammonia-nitrogen stress ability of juvenile yellow catfish (Pelteobagrus fulvidraco) |
本试验结果显示,饲料中添加一定量的谷胱甘肽能显著提高黄颡鱼幼鱼的增重、特定增长率和蛋白质效率,表明谷胱甘肽能改善黄颡鱼的生长性能,结果与焦彩虹[4]在奥尼罗非鱼、周婷婷等[14]在吉富罗非鱼、赵红霞等[15]在草鱼(Ctenopharyngodon idellus)、王芳倩等[10]在牙鲆、任胜杰等[16]在异育银鲫(Carassius auratus Sibelio)和Zambonino等[17]在鲈鱼(Lateolabrax japonicus)中的研究结果一致。目前,关于谷胱甘肽的促生长作用已有不少报道,其促生长的作用机制可能是多方面的。赵红霞等[15]在草鱼和王芳倩等[10]在牙鲆的研究中指出,谷胱甘肽的促生长机制可能与其分子结构有关,谷胱甘肽中的半胱氨酸是辅酶A的组成成分,它可以破坏生长抑素分子的二硫键,解除生长抑素对生长激素(GH)等激素的抑制,最终发挥促生长作用。另外,在猪、羊的研究中已经发现,谷胱甘肽可促进垂体GH的分泌,而GH可以上调肝脏生长激素受体(GHR)基因转录水平,提高肝脏、半腱肌类胰岛素生长因子1(IGF-1) 基因转录水平,使血清IGF-1含量提高,进而促进蛋白质合成和提高养分利用率[18-19]。周婷婷[5]在吉富罗非鱼的试验中发现,饲料中添加一定量的谷胱甘肽能提高血清GH、IGF-1的含量及肝脏GH、IGF-1 mRNA的表达量,并推测谷胱甘肽可通过消耗生长抑制素来促进GH分泌,作用于GHR产生IGF-1,由IGF-1作用于靶器官,最终促进动物生长。亦有报道显示,谷胱甘肽能在动物肠腔中起保护肠黏膜免受毒物和过氧化物损伤的作用,这可能将有助于肠道对营养物质的吸收,这在凡纳滨对虾和牙鲆中得到了证实。关于谷胱甘肽的促生长作用机制还有待进一步研究。
本试验以特定生长率为评价指标,计算出黄颡鱼幼鱼饲料中谷胱甘肽的适宜添加量为357.69 mg/kg,这一结果与草鱼(350.00 mg/kg)[15]、吉富罗非鱼(355.13 mg/kg)[14]的研究结果接近,但低于牙鲆(368.92 mg/kg)[10]和高于凡纳滨对虾(174.13 mg/kg)[21]的适宜添加量,由此说明,动物饲料中谷胱甘肽的适宜添加量可能会因动物种类的不同存在差异。在本试验中还发现,黄颡鱼的生长性能与饲料中谷胱甘肽添加量不是呈现直线相关关系,而是在适宜范围内,促生长效果明显,过高的添加量反而会使生长性能降低,这与刘晓华等[20]在凡纳滨对虾和王芳倩等[10]在牙鲆的研究结果类似,其原因可能在于过高的添加量会对黄颡鱼体产生毒性作用。有研究表明,虽然谷胱甘肽是良好的抗氧化剂,但过多的谷胱甘肽能与多种化合物(如醛类、醌类、卤烯烃等)结合产生毒性代谢物,这些代谢物可与DNA共价结合产生氧自由基,毒性代谢产物的长期积累对机体产生不利影响[21]。Sah等[22]和高姝娟等[23]还报道,谷胱甘肽作为氧化物的前体,浓度过高时会产生毒性,引起DNA损伤。
研究认为,鱼类的肝体比是鱼类短期和长期营养的敏感指标。有学者研究发现,植物蛋白质能使虹鳟[24]和黑鲷[25]的肝体比升高。本试验中,各试验组的黄颡鱼肝体比较对照组均有不同程度的升高,这可能是由于谷胱甘肽促进了肝脏RNA的表达,进而促进蛋白质在肝脏的合成。全鱼体成分分析显示,谷胱甘肽能显著提高全鱼体粗蛋白质含量,这进一步证明谷胱甘肽能增强黄颡鱼的蛋白质合成作用,周婷婷等[14]在吉富罗非鱼的研究中也有相似的报道。
3.2 谷胱甘肽对黄颡鱼幼鱼体成分和血清生化指标的影响本试验结果显示,各试验组全鱼体粗蛋白质和粗脂肪含量均高于对照组,其中G300~G700组全鱼体粗蛋白质、G100~G700组全鱼体粗脂肪含量达到显著水平,且养殖过程中各组试验饲料的粗蛋白质(41.17%~41.50%)和粗脂肪水平(6.97%~7.50%)基本一致,这说明,饲料中添加谷胱甘肽可显著提高黄颡鱼全鱼体粗蛋白质和粗脂肪含量,该结果与赵红霞等[15]在草鱼、周婷婷等[14]在吉富罗非鱼和储霞玲等[26]在凡纳冰对虾上的结果类似,但梁春梅等[9]在奥尼罗非鱼饲料中添加谷胱甘肽并没有发现有显著差异。关于谷胱甘肽对黄颡鱼体成分的影响还有待进一步研究。
葡萄糖是机体主要的供能物质,饲料的营养素会影响机体葡萄糖含量,总蛋白含量是反映机体蛋白质代谢和营养状态的重要指标,Kaushik等[27]研究表明,饲料蛋白质源的质量能显著影响血清总蛋白的含量,从而显著影响机体蛋白质代谢。本试验中,在饲料中添加谷胱甘肽并未对黄颡鱼血清葡萄糖和总蛋白含量产生显著影响,这与在草鱼[15]和吉富罗非鱼[14]上的研究结果一致,其原因可能与试验中各组饲料原料和营养水平基本一致有关。胆固醇和甘油三酯是体内重要的脂类物质,胆固醇可以合成胆汁和各种固醇类激素,而甘油三酯是细胞重要的代谢供能物质,它们含量的高低反映了脂类吸收状况和肝脏脂肪代谢状况。本试验中,G100~G500组血清胆固醇和甘油三酯含量均较对照组有不同程度的升高,结果与在草鱼[15]和吉富罗非鱼[14]上的研究一致。原因可能是谷胱甘肽促进GH的分泌,增强了脂肪代谢,进而升高了血清胆固醇和甘油三酯的含量。转氨酶在三大营养物质的转化和非必需氨基酸合成过程中有重要作用,谷丙转氨酶反映肝功能,谷草转氨酶反映心脏和肌肉的受损程度[28]。本试验中,饲料中添加谷胱甘肽对2种转氨酶均没有显著影响,但G300~G700组的转氨酶均高于对照组,这可能有助于转氨基作用,增强机体非必须氨基酸的合成能力。尿素氮与蛋白质代谢有关,是嘌呤代谢的终产物,尿素氮含量可以反映出蛋白质的代谢情况和氨基酸的平衡情况。在草鱼[15]、罗非鱼[14]和鲤鱼[29]上的研究发现,活性肽可以显著降低血清尿素氮的含量,但在断奶仔猪[30]上的研究并未发现有显著影响,本试验的研究结果与后者相似,其原因可能与试验对象、饲料蛋白质水平有关。
3.3 谷胱甘肽对黄颡鱼幼鱼抗氨氮应激能力的影响生物体存在完整的抗氧化防御系统,正常情况下,机体的自由基能被抗氧化系统清除,从而相对的动态平衡;当机体受到环境胁迫时,大量的活性氧会攻击附近的细胞,对机体造成氧化胁迫,使细胞中DNA断裂、酶失活,产生脂质过氧化,引起细胞凋亡[31]。随着高密度集约化养殖,水产养殖动物残饵和排泄物等氨化作用产生大量氨态氮,这会干扰鱼体内的抗氧化防御系统,从而诱发水产动物病害发生[32]。氨氮是离子氨和非离子氨的总称,氨氮的致毒性主要来自于非离子氨[33]。相关研究表明,机体受到氨氮胁迫会使体内抗氧化酶活力受到抑制,使大量的自由基不能清除,对机体产生毒副作用[34];亦有研究表明,长期处于氨氮应激下的鱼生长受阻、免疫力下降,甚至死亡[33]。本试验结果显示,氨氮应激72和96 h,添加谷胱甘肽组的黄颡鱼累积死亡率均低于对照组,其中G300组在2个时间点均显著低于对照组,随着添加量的增加,累积死亡率有所升高;而且,对照组在72 h时累计死亡率达到45.0%,而添加组达到40.0%以上的累积死亡率在96 h才出现。这说明,谷胱甘肽能够提高黄颡鱼幼鱼抗氨氮应激的能力,不仅能够降低氨氮应激后一定时间内黄颡鱼的死亡率,而且能够延缓黄颡鱼发生死亡的时间,同时,其对抗氨氮应激能力的提升与添加量有关,过高的添加量可能会降低黄颡鱼的抗氨氮应激能力,这与高添加量不利于黄颡鱼生长性能的提升效应相似,这与在凡纳滨对虾[6]上的研究结果一致。谷胱甘肽提高黄颡鱼抗氨氮应激能力可能与谷胱甘肽自身的活性基团及其激活的酶(超氧化物气化酶、过氧化氢酶、谷胱甘肽过氧化酶、谷胱甘肽硫转移酶等)系统在体内发挥的解毒作用有关[6, 35]。研究发现,谷胱甘肽作为一种抗氧化剂,能通过提高动物机体抗氧化酶活性来提高抗氧化性能[36]。谷胱甘肽能降低氨氮应激下黄颡鱼的死亡率,可能源于谷胱甘肽提高了鱼体内各种抗氧化酶活性,表现为提高抗氧化能力,进而减轻氨氮应激的氧化损伤,最终降低死亡率。此外,也有研究发现,谷胱甘肽硫转移酶能催化谷胱甘肽的硫醇基与各种亲电化合物相结合,增加亲电化合物的可溶性,从而有利于其从细胞内排出[37]。目前,对谷胱甘肽的解毒机制的研究还不够系统,且关于谷胱甘肽对黄颡鱼抗氨氮应激能力影响的研究尚未见报道,其作用机理有待深入。
4 结论饲料中添加谷胱甘肽可以提高黄颡鱼幼鱼的生长性能、全鱼粗蛋白质和粗脂肪含量以及抗氨氮应激能力。利用二次回归方程拟合特定生长率和谷胱甘肽添加量,分析表明谷胱甘肽在黄颡鱼幼鱼饲料中适宜添加量为357.69 mg/kg。
| [1] |
黄峰, 严安生, 熊传喜, 等. 黄颡鱼的含肉率及鱼肉营养评价[J]. 淡水渔业, 1999(10): 3-6. |
| [2] |
SMART G R.Aspects of water quality producing stress in intensive fish culture[M]//PICKERING A D.Stress and fish.London:Academic Press, 1981.
|
| [3] |
周艳玲, 孙育平, 黄燕华, 等. 水产动物谷胱甘肽营养生理作用的研究进展[J]. 饲料研究, 2016(19): 38-43, 53. |
| [4] |
焦彩虹. 谷胱甘肽对罗非鱼生长的影响及其机理研究[D]. 硕士学位论文. 广州: 华南农业大学, 2004. http://d.wanfangdata.com.cn/Thesis/Y665337
|
| [5] |
周婷婷. 谷胱甘肽对吉富罗非鱼生长性能和抗氧化功能的影响[D]. 硕士学位论文. 武汉: 华中农业大学, 2012. http://d.wanfangdata.com.cn/Thesis/Y2394177
|
| [6] |
XU D D, LIU X H, CAO J M, et al. Dietary glutathione as an antioxidant improves resistance to ammonia exposure in Litopenaeus vannamei[J]. Aquaculture Research, 2011, 43(2): 311-316. |
| [7] |
刘晓华. 谷胱甘肽对凡纳滨对虾抗氧化防御的调控机理[D]. 博士学位论文. 武汉: 华中农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10504-1011405639.htm
|
| [8] |
陈齐勇. 饲料中α-硫辛酸、谷胱甘肽和硒对皱纹盘鲍(Haliotis discus hannai Ino)生长和抗氧化反应的影响[D]. 硕士学位论文. 青岛: 中国海洋大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10423-1011027107.htm
|
| [9] |
梁春梅. 还原型谷胱甘肽对奥尼罗非鱼(Oreochromis niloticus×O. aureus)幼鱼生长、免疫功能的影响及其机理研究[D]. 硕士学位论文. 广州: 华南农业大学, 2006. http://d.wanfangdata.com.cn/Thesis/Y944395
|
| [10] |
王芳倩, 张文兵, 麦康森, 等. 饲料中添加还原型谷胱甘肽对牙鲆生长和抗氧化能力的影响[J]. 中国海洋大学学报:自然科学版, 2011, 41(4): 51-56. |
| [11] |
CHEN Q M, ZHAO H X, HUANG Y H, et al. Effects of dietary arginine levels on growth performance, body composition, serum biochemical indices and resistance ability against ammonia-nitrogen stress in juvenile yellow catfish (Pelteobagrus fulvidraco)[J]. Animal Nutrition, 2016, 2(3): 204-210. DOI:10.1016/j.aninu.2016.07.001 |
| [12] |
宋金昌, 牛一兵. 饲料分析与饲料质量检测技术[M]. 北京: 中国农业科学技术出版社, 2012.
|
| [13] |
李波, 樊启学, 张磊, 等. 不同溶氧水平下氨氮和亚硝酸盐对黄颡鱼的急性毒性研究[J]. 淡水渔业, 2009, 39(3): 31-35. |
| [14] |
周婷婷, 曹俊明, 黄燕华, 等. 饲料中添加谷胱甘肽对吉富罗非鱼生长、组织生化指标和非特异性免疫相关酶的影响[J]. 水产学报, 2013, 37(5): 742-750. |
| [15] |
赵红霞, 曹俊明, 朱选, 等. 日粮添加谷胱甘肽对草鱼生长性能、血清生化指标和体组成的影响[J]. 动物营养学报, 2008, 20(5): 540-546. |
| [16] |
任胜杰, 郑曙明, 宋艳, 等. 谷胱甘肽对异育银鲫生长及辛硫磷解毒的影响[J]. 西南农业学报, 2016, 29(12): 3009-3014. |
| [17] |
INFANTE Z J, CAHU C L, PERES A. Partial substitution of di-and tripeptides for native proteins in sea bass diet improves Dicentrarchus labrax larval development[J]. The Journal of Nutrition, 1997, 127(4): 608-614. |
| [18] |
刘平祥. 谷胱甘肽对断奶仔猪的促生长作用及其机制[D]. 博士学位论文. 广州: 华南农业大学, 2002. http://d.wanfangdata.com.cn/Thesis/Y468070
|
| [19] |
姜宁, 张爱忠, 宋增廷, 等. 谷胱甘肽对育肥羊生长性能及生长激素/胰岛素样生长因子-Ⅰ轴调控作用的研究[J]. 动物营养学报, 2009, 21(3): 312-318. |
| [20] |
刘晓华, 曹俊明, 朱选, 等. 谷胱甘肽对凡纳滨对虾生长、存活和饵料系数的影响[J]. 饲料工业, 2007, 28(8): 21-23. |
| [21] |
MONKS T J, ANDERS M W, DEKANT W, et al. Glutathione conjugate mediated toxicities[J]. Toxicology and Applied Pharmacology, 1990, 106(1): 1-19. DOI:10.1016/0041-008X(90)90100-9 |
| [22] |
SAH N K, KUMAR S, SUBRAMANIAN M, et al. Variation in the modulation of superoxide-induced single-strand breaks in plasmid pBR322 DNA by biological antioxidants[J]. Biochemistry and Molecular Biology International, 1995, 35(2): 291-296. |
| [23] |
高姝娟, 刘东波, 罗贵民, 等. 抗氧化剂抗脂质过氧化机制的ESR研究[J]. 波谱学杂志, 1998(2): 139-143. |
| [24] |
DREW M D, OGUNKOYA A E, JANZ D M, et al. Dietary influence of replacing fish meal and oil with canola protein concentrate and vegetable oils on growth performance, fatty acid composition and organochlorine residues in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2007, 267(1/2/3/4): 260-268. |
| [25] |
AZARM H M, LEE S M. Effects of partial substitution of dietary fish meal by fermented soybean meal on growth performance, amino acid and biochemical parameters of juvenile black sea bream Acanthopagrus schlegeli[J]. Aquaculture Research, 2014, 45(6): 994-1003. DOI:10.1111/are.2014.45.issue-6 |
| [26] |
储霞玲, 曹俊明, 赵红霞, 等. 饲料中联合添加硒和谷胱甘肽对凡纳滨对虾生长、饲料系数和体成分的影响[J]. 饲料工业, 2008, 29(12): 28-31. DOI:10.3969/j.issn.1003-6202.2008.12.012 |
| [27] |
KAUSHIK S J, CRAVEDI J P, LALLES J P, et al. Partial or total replacement of fish meal by soybean protein on growth, protein utilization, potential estrogenic or antigenic effects, cholesterolemia and flesh quality in rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 1995, 133(3/4): 257-274. |
| [28] |
陆阳, 杨雨虹, 王裕玉, 等. 不同比例膨化豆粕替代鱼粉对虹鳟生长、体成分及血液学指标的影响[J]. 动物营养学报, 2010, 22(1): 221-227. |
| [29] |
李清. 小肽对鲤鱼生产性能、肉质及血液理化指标的影响[D]. 硕士学位论文. 长沙: 湖南农业大学, 2004. http://d.wanfangdata.com.cn/Thesis/Y686172
|
| [30] |
孙占田, 李忠荣, 马秋刚, 等. 饲料肽对断奶仔猪生长及血液生化指标的影响[J]. 中国畜牧杂志, 2007, 43(9): 31-32. |
| [31] |
黄云. 维生素C、E对青鱼氨氮胁迫的营养调控研究[D]. 硕士学位论文. 长沙: 湖南农业大学, 2012.
|
| [32] |
胡毅, 黄云, 文华, 等. 维生素C对青鱼幼鱼生长、免疫及抗氨氮胁迫能力的影响[J]. 水产学报, 2013, 37(4): 565-573. |
| [33] |
张武肖, 孙盛明, 戈贤平, 等. 急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃、肝和肾组织结构的影响[J]. 水产学报, 2015, 39(2): 233-244. |
| [34] |
CHING B Y, CHEW S F, WONG W P, et al. Environmental ammonia exposure induces oxidative stress in gills and brain of Boleophthalmus boddarti (mudskipper)[J]. Aquatic Toxicology, 2009, 95(3): 203-212. DOI:10.1016/j.aquatox.2009.09.004 |
| [35] |
李利红, 袁宏利, 胡振平, 等. 黄河鲤谷胱甘肽对氨氮胁迫的生理响应[J]. 安徽农业科学, 2015, 43(26): 130-131. DOI:10.3969/j.issn.0517-6611.2015.26.048 |
| [36] |
刘晓华, 曹俊明, 吴建开, 等. 饲料中添加谷胱甘肽对凡纳滨对虾肝胰腺抗氧化指标和脂质过氧化物含量的影响[J]. 水产学报, 2007, 31(2): 235-240. |
| [37] |
LI G Y, XIE P, FU J, et al. Microcystin-induced variations in transcription of GSTs in an omnivorous freshwater fish, goldfish[J]. Aquatic Toxicology, 2008, 88(1): 75-80. DOI:10.1016/j.aquatox.2008.03.007 |




