2. 通威集团有限公司, 成都 610041
2. Tongwei Group Co., Ltd., Chengdu 610041, China
随着我国现代化养猪业的发展,提高公猪繁殖性能对现代化养猪业显得极其重要。研究表明,影响公猪繁殖性能的因素很多,包括遗传或内在因素,如品种[1]、年龄[2]和睾丸大小[3];外在的环境因素,如温度和光照[4-5];饲养因素,如精液采集频率、营养和社会环境[6]。然而现今规模化、集约化程度的大幅提高,环境条件和管理水平相对一致,所以营养的供给将直接影响到公猪繁殖潜力的发挥。维生素D3(vitamin D3,VD3)是动物机体的一种重要脂溶性维生素,Kwiecinski等[7]研究发现用VD3缺乏的雄性大鼠精液进行人工授精,雌性大鼠的受孕率比VD3充足的低71%。VD3在肝脏中的代谢产物为25-羟基维生素D3(25-hydroxycholecalciferol, 25-OHD3),是具有最大生物活性的VD3代谢产物[8]。Coffey等[9]和Hines等[10]在母猪饲粮中分别添加2 500 IU/kg VD3和500 IU/kg VD3+50 μg/kg 25-OHD3,发现添加500 IU/kg VD3+50 μg/kg 25-OHD3使产仔数得到提高,母猪骨骼状态得到改善。Zhou等[11]在母猪饲粮中添加2 000 IU/kg的25-OHD3时,发现25-OHD3可以改善后备母猪繁殖成绩及后代肌肉品质。然而目前有关维生素D在公猪上的研究资料较少。Audet等[12]在公猪上的研究表明,相比于每日提供3×106 IU的VD3饲粮时,每日提供10×106 IU的VD3饲粮增加了血液维生素水平,并有效改善精液质量。对于公猪饲粮维生素D添加形式对公猪繁殖性能的研究更是尚未见报道,有待进一步研究。因此,本研究分别在公猪饲粮中添加2 000 IU/kg VD3和2 000 IU/kg的25-OHD3,从而考察维生素D不同形式对公猪繁殖性能的影响,旨在为VD3在种用公猪饲养中的应用提供理论依据。
1 材料与方法 1.1 试验动物与试验设计选择(18.0±0.5)月龄的种用约克公猪16头,根据精液量和睾丸大小分为2组,每组8个重复,每个重复1头猪。分别在基础饲粮中添加VD3和25-OHD3, 使2者在饲粮中的含量均为50 μg/kg(即2 000 IU/kg)。
1.2 试验饲粮基础饲粮参照NRC(2012)成年种公猪营养需要进行配制,试验饲粮在基础饲粮中分别添加VD3和25-OHD3,其组成及营养水平见表 1。参考《中国饲料成分及营养价值表(2013)》(第24版)中原料营养水平计算饲粮营养水平。试验所用VD3和25-OHD3购自四川民生药业有限公司, 有效含量分别为6.2×105 IU/kg、1.25×105 μg/kg。VD3和25-OHD3在4 ℃保存直至试验结束,每次配制的饲粮饲喂不超过3周,饲粮避光干燥保存。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验在四川省名山区种公猪站进行,试验前对场地进行熏蒸消毒,保证场地的卫生条件,室内温度保持在15~25 ℃。试验期共为112 d,采用限制饲养,每头猪每天饲喂2.5 kg,每天饲喂2次,即08:00和14:00各喂1次。公猪单个饲养于面积为5.29 m2的单栏中;保证猪只足够的饮水,每次饲喂后0.5 h内清粪打扫卫生,保持圈舍与猪体清洁,合理运动;采样时注意保护其四肢不受损伤;保证圈舍通风良好,夏季做好防暑降温;每周对圈舍及周围进行2次消毒并做好公猪正常的免疫。
1.4 测定指标与方法 1.4.1 睾丸测量试验第1天、第56天和第112天对每头猪左右2侧睾丸的长、宽分别进行测量并记录。
睾丸长:单侧睾丸纵向2顶点的最大长度。
睾丸宽:单侧睾丸横向顶点到纵隔的最大距离。
睾丸体积(cm3)=0.523 6×睾丸长×睾丸宽2。
1.4.2 性欲测定试验种公猪严格按照徒手采精法采精,保持每周2次采精频率直至试验结束,用秒表记录种公猪射精反应时间和射精持续时间。
1.4.3 精液品质测定试验每周采集2次精液样品,依据世界卫生组织提供的标准方法[13]检测公猪精液的胶体重量、精液量、精子密度、精子活力、精子畸形率、顶体完整率、质膜完整率。
1.4.4 血浆生化指标测定试验第1天、第56天和第112天采集血液,测定血浆生化指标。血浆中25-OHD3、睾酮及雌二醇含量及芳香化酶活性采用酶联免疫吸附试验(ELISA)法测定,血浆钙离子(Ca2+)含量测定采用甲基百里香酚蓝法,血浆磷(P)含量测定采用磷钼酸法。所有血浆生化指标均采用试剂盒测定,芳香化酶活性及睾酮和雌二醇含量测定试剂盒购自美国R & D Systems公司,其他血浆生化指标测定试剂盒购自南京建成生物工程研究所。
1.4.5 精清生化指标测定试验第1天、第56天和第112天采集精液,测定精清生化指标。精清25-OHD3含量采用ELISA法测定,精清Ca2+含量测定采用甲基百里香酚蓝法,P含量测定采用磷钼酸法,果糖含量测定采用紫外分光光度法,酸性磷酸酶(acid phosphatase, ACP)活性测定采用磷酸苯二钠法,所有精清生化指标均采用试剂盒测定,试剂盒购自南京建成生物工程研究所。
1.4.6 精子基因表达量测定试验112天测定公猪精子基因表达量。精子中总RNA提取采用美国Invitrogen公司生产的TRLzol®LS Reagent,提取后采用2步法进行逆转录聚合酶链式反应(RT-PCR),首先将总RNA反转录为cDNA,接着对cDNA进行扩增。反转录使用宝生物工程有限公司生产的试剂盒,具体操作参照试剂盒说明书。cDNA用于实时定量PCR,采用6 μL反应体系,分别为:3 μL SYBR Premix Ex Taq Ⅱ,0.24 μL上游引物,0.24 μL下游引物,0.12 μL ROX Reference Dye,1.8 μL蒸馏水,0.6 μL cDNA。根据所测基因序列,在GenBank中查找所测基因全序列,采用Primer 3软件设计引物。基因和引物信息见表 2。引物由生工(上海)生物工程股份有限公司合成。实时定量PCR采用ABI 7900HT荧光定量PCR仪(美国)。目的基因的表达量为目的基因与内参基因[β肌动蛋白(β-actin)]基因表达量的比值,同时设定对照组目的基因表达量为1.0。
|
|
表 2 基因和引物信息 Table 2 Genes and primer information |
数据采用SPSS 20.0统计软件进行独立样本t检验,以P < 0.05为差异显著标准, 0.05≤P < 0.10为有差异显著的趋势。
2 结果 2.1 饲粮维生素D添加形式对睾丸体积的影响由表 3可知,不同饲粮维生素D添加形式对第1天、第56天、第112天公猪的睾丸体积均无显著影响(P>0.05)。
|
|
表 3 饲粮维生素D添加形式对睾丸体积的影响 Table 3 Effects of dietary vitamin D forms on testicular volume of boars |
由表 4可知,试验1~8周各组公猪的性欲表现无显著性差异(P>0.05)。1~8周25-OHD3组部分精液品质指标高于VD3组,其中精子前向性有增加的趋势(P=0.082),但2组公猪精液品质指标均无显著差异(P>0.05)。
|
|
表 4 饲粮维生素D添加形式对公猪性欲表现和精液品质的影响(1~8周) Table 4 Effects of dietary vitamin D forms on libido and semen quality of boars (1 to 8 weeks) |
由表 5可知,试验9~16周25-OHD3组精子活力、每次射精的有效精子数、顶体完整率和精子的直线速度显著高于VD3组(P < 0.05),而畸形率显著低于VD3组(P < 0.05)。25-OHD3组精子运动路径速度(P=0.089)和前向性(P=0.074)有高于VD3组的趋势,但2组其他精液品质和公猪性欲表现差异不显著(P>0.05)。
|
|
表 5 饲粮维生素D添加形式对公猪性欲表现和精液品质的影响(9~16周) Table 5 Effects of dietary vitamin D forms on libido and semen quality of boars (9 to 16 weeks) |
由表 6可知,全期1~16周25-OHD3组公猪精子活力和每次射精的有效精子数显著高于VD3组(P < 0.05),而25-OHD3组公猪精子畸形率显著低于VD3组(P < 0.05)。25-OHD3组精子前向性有增加的趋势(P=0.091),而饲粮维生素D添加形式对试验全期公猪的性欲表现和其他精液品质均无显著性影响(P>0.05)。
|
|
表 6 饲粮维生素D添加形式对公猪性欲表现和精液品质的影响(1~16周) Table 6 Effects of dietary vitamin D forms on libido and semen quality of boars (1 to 16 weeks) |
由表 7可知,血浆25-OHD3含量在试验第1天、第56天和第112天差异均不显著(P>0.05)。精清中,试验第56天、第112天25-OHD3组25-OHD3含量显著高于VD3组(P < 0.05);而第1天时精清25-OHD3含量2组间未出现显著差异(P>0.05)。
|
|
表 7 饲粮维生素D添加形式对公猪血浆及精清25-OHD3含量的影响 Table 7 Effects of dietary vitamin D forms on 25-OHD3 content of blood plasma and seminal plasma of boars |
由表 8可知,第1天和第56天2组血浆Ca2+、P、睾酮、雌二醇含量和芳香化酶活性均无显著性差异(P>0.05),其中在第56天,25-OHD3组血浆雌二醇含量与VD3组相比有升高的趋势(P=0.056)。试验第112天,25-OHD3组血浆雌二醇、Ca2+含量和芳香化酶活性显著高于VD3组(P < 0.05)。
|
|
表 8 饲粮维生素D添加形式对公猪血浆生化指标的影响 Table 8 Effects of dietary vitamin D forms on plasma biochemical indexes of boars |
由表 9可知,试验第1天,2组精清Ca2+、P、果糖含量和ACP活性之间没有显著差异(P < 0.05)。试验第56天,25-OHD3组精清果糖含量显著高于VD3组(P < 0.05);而2组精清Ca2+、P含量和ACP活性差异不显著(P>0.05)。试验第112天,25-OHD3组精清Ca2+、果糖含量和ACP活性显著高于VD3组(P < 0.05),2组精清P含量差异不显著(P>0.05)。
|
|
表 9 饲粮维生素D添加形式对公猪精清生化指标的影响 Table 9 Effects of dietary vitamin D forms on seminal plasma biochemical indexes of boars |
由图 1可知,25-OHD3组精子CYP19、CYP24A1和VDR的基因表达量显著高于VD3组(P < 0.05),而2组CYP2R1和CYP27B1的基因表达量差异不显著(P>0.05)。
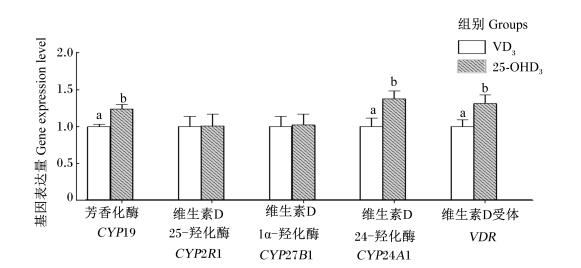
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。 Data columns with different small letters mean significant difference (P < 0.05). 图 1 饲粮维生素D添加形式对公猪精子基因表达量的影响 Figure 1 Effects of dietary vitamin D forms on sperm gene expression levels of boars |
在老鼠等动物中的研究表明, 维生素D可能影响精液质量和动物生育能力[7, 14]。本研究表明,不同饲粮维生素D添加形式对公猪各试验阶段的睾丸体积、精子密度与数量、性欲均无显著性影响。公猪每次射精的精子都是经过在睾丸中产生和附睾中成熟2个阶段。在公猪睾丸中,精子由生殖细胞形成并在产生过程中受支持细胞影响,研究表明,每个物种睾丸支持细胞对生殖细胞的承载能力在一定范围内是相对稳定的[15-16],而每个睾丸支持细胞的总数在睾丸发育期间已经确定,因此本试验2组公猪精子密度和睾丸体积无差异。
本研究首次比较得出了在相同维生素D水平下,以25-OHD3形式添加到饲粮后可使公猪精子活力、直线运动速度和每次射精的有效精子数显著高于VD3形式,公猪精子畸形率显著低于VD3形式,这与Hammoud等[17]和Jensen等[18]的研究结果基本一致。Hammoud等[17]在对170名健康男性血液维生素D含量分析后发现,血液25-OHD3含量在25~50 nmol/L时,精子活力高而畸形率低。此外,Jensen等[18]体外研究表明,1, 25-二羟基维生素D3[1, 25-(OH)2D3]使细胞内Ca2+含量增加,从而使人的精子能动性增加,诱导成熟精子的顶体反应。
本研究表明,相比于50 μg/kg VD3,公猪接受50 μg/kg 25-OHD3饲粮血浆25-OHD3的含量数值上增加,但2组间差异不显著,这与Bar等[19]和Weber等[20]研究结果不一致。本研究检测了公猪精清的25-OHD3含量,结果表明25-OHD3组的公猪精清25-OHD3含量显著高于VD3组。这就暗示饲粮中25-OHD3能够进入血液循环,进而更多地被生殖组织利用。Bar等[19]在肉鸡上的研究表明,与VD3相比,饲粮中添加的25-OHD3在肠道更易被吸收利用。此外,Weber等[20]给母猪分别饲喂添加200 IU/kg VD3、2 000 IU/kg VD3和50 μg/kg 25-OHD3的饲粮发现,饲喂50 μg/kg 25-OHD3饲粮的母猪血液中25-OHD3含量显著高于其他2组,这就进一步证实了饲粮中添加的25-OHD3更容易被胃肠吸收利用。
进一步研究发现,与添加VD3相比,饲粮添加25-OHD3增加了血浆中雌二醇和Ca2+的含量及芳香化酶的活性,同时精清中果糖、Ca2+含量和ACP活性也显著升高;而血浆P含量和精清中P含量无差异。这与Jensen等[18]的研究结果基本一致,说明饲粮添加25-OHD3能被更有效利用转化为活性形式的1, 25-(OH)2D3,从而提高血清中Ca2+含量。芳香化酶是睾酮转化为雌二醇的关键酶,活性形式的1, 25-(OH)2D3绑定到CYP19基因的启动子维生素D反应元件(VDRE),通过抑制乳腺或者诱导骨骼CYP19基因转录增加了芳香化酶的活性[21-22],芳香化酶活性的增加会促进睾酮转化为雌二醇。这说明睾酮被充分利用,25-OHD3组血浆中睾酮含量未出现显著增加,同时雌二醇含量显著增加。
研究表明,VDR和维生素D相关代谢酶基因CYP2R1、CYP27B1、CYP24A1在公猪睾丸支持细胞、生殖细胞、间质细胞、精子和雄性生殖组织上皮细胞内层都有表达[23-26]。本研究表明,25-OHD3组精子中VDR、CYP24A1和CYP19的基因表达量显著增加。Aquila等[27]等研究表明,1, 25-(OH)2D3在睾丸中有高度亲和力对性腺VDR和CYP24A1基因的表达有促进作用。因此说明饲粮添加25-OHD3能更有效地被吸收转化为维生素D的生物活性形式1, 25-(OH)2D3作用于精子和性腺组织。饲粮添加25-OHD3组精子CYP19基因的表达量增加,这与试验中增加的芳香化酶活性相对应,说明饲粮添加25-OHD3能更有效促进CYP19基因的表达。
4 结论与同等水平VD3相比,种公猪饲粮中添加25-OHD3能更有效增加血浆维生素D含量,从而改善精子的形态和运动能力,提高公猪的繁殖性能。
| [1] |
SMITAL J, WOLF J, DE SOUSA L L. Estimation of genetic parameters of semen characteristics and reproductive traits in AI boars[J]. Animal Reproduction Science, 2005, 86(1/2): 119-130. |
| [2] |
HUANG Y H, LO L L, LIU S H, et al. Age-related changes in semen quality characteristics and expectations of reproductive longevity in Duroc boars[J]. Animal Science Journal, 2010, 81(4): 432-437. DOI:10.1111/asj.2010.81.issue-4 |
| [3] |
CLARK S G, SCHAEFFER D J, ALTHOUSE G C. B-mode ultrasonographic evaluation of paired testicular diameter of mature boars in relation to average total sperm numbers[J]. Theriogenology, 2003, 60(6): 1011-1023. DOI:10.1016/S0093-691X(03)00127-4 |
| [4] |
YESTE M, SANCHO S, BRIZ M, et al. A diet supplemented with L-carnitine improves the sperm quality of Piétrain but not of Duroc and Large White boars when photoperiod and temperature increase[J]. Theriogenology, 2010, 73(5): 577-586. DOI:10.1016/j.theriogenology.2009.10.013 |
| [5] |
CASAS I, SANCHO S, BALLESTER J, et al. The HSP90AA1 sperm content and the prediction of the boar ejaculate freezability[J]. Theriogenology, 2010, 74(6): 940-950. DOI:10.1016/j.theriogenology.2010.04.021 |
| [6] |
KUNAVONGKRIT A, SURIYASOMBOON A, LUNDEHEIM N, et al. Management and sperm production of boars under differing environmental conditions[J]. Theriogenology, 2005, 63(2): 657-667. DOI:10.1016/j.theriogenology.2004.09.039 |
| [7] |
KWIECINSKI G G, PETRIE G I, DELUCA H F. Vitamin D is necessary for reproductive functions of the male rat[J]. The Journal of Nutrition, 1989, 119(5): 741-744. |
| [8] |
杨宏伟. 维生素D3在动物生产中研究进展[J]. 河南畜牧兽医, 2016(4): 16-18. |
| [9] |
COFFEY J D, HINES E A, STARKEY J D, et al. Feeding 25-hydroxycholecalciferol improves gilt reproductive performance and fetal vitamin D status[J]. Journal of Animal Science, 2012, 90(11): 3783-3788. DOI:10.2527/jas.2011-5023 |
| [10] |
HINES E A, COFFEY J D, STARKEY C W, et al. Improvement of maternal vitamin D status with 25-hydroxycholecalciferol positively impacts porcine fetal skeletal muscle development and myoblast activity[J]. Journal of Animal Science, 2013, 91(9): 4116-4122. DOI:10.2527/jas.2013-6565 |
| [11] |
ZHOU H, CHEN Y L, ZHOU Y, et al. Effects of 25-hydroxycholecalciferol supplementation in maternal diets on milk quality and serum bone status markers of sows and bone quality of piglets[J]. Animal Science Journal, 2017, 88(3): 476-483. DOI:10.1111/asj.2017.88.issue-3 |
| [12] |
AUDET I, LAFOREST J P, MARTINEAU G P, et al. Effect of vitamin supplements on some aspects of performance, vitamin status, and semen quality in boars[J]. Journal of Animal Science, 2004, 82(2): 626-633. DOI:10.2527/2004.822626x |
| [13] |
WHO. WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction[M]. Cambridge: Cambridge University Press, 1999.
|
| [14] |
HIRAI T, TSUJIMUAR A, UEDA T, et al. Effect of 1, 25-dihydroxyvitamin D on testicular morphology and gene expression in experimental cryptorchid mouse:testis specific cDNA microarray analysis and potential implication in male infertility[J]. The Journal of Urology, 2009, 181(3): 1487-1492. DOI:10.1016/j.juro.2008.11.007 |
| [15] |
WING T Y, CHRISTENSEN A K. Morphometric studies on rat seminiferous tubules[J]. American Journal of Anatomy, 1982, 165(1): 13-25. DOI:10.1002/(ISSN)1553-0795 |
| [16] |
RUSSELL L D, PETERSON R N. Determination of the elongate spermatid-Sertoli cell ratio in various mammals[J]. Journal of Reproduction and Fertility, 1984, 70(2): 635-641. DOI:10.1530/jrf.0.0700635 |
| [17] |
HAMMOUD A O, MEIKLE A W, PETERSON C M, et al. Association of 25-hydroxy-vitamin D levels with semen and hormonal parameters[J]. Asian Journal of Andrology, 2012, 14(6): 855-859. DOI:10.1038/aja.2012.77 |
| [18] |
JENSEN M B, BJERRUM P J, JESSEN T E, et al. Vitamin D is positively associated with sperm motility and increases intracellular calcium in human spermatozoa[J]. Human Reproduction, 2011, 26(6): 1307-1317. DOI:10.1093/humrep/der059 |
| [19] |
BAR A, RAZAPHKOVSKY V, VAX E, et al. Performance and bone development in broiler chickens given 25-hydroxycholecalciferol[J]. British Poultry Science, 2003, 44(2): 224-233. DOI:10.1080/0007166031000087029 |
| [20] |
WEBER G M, WITSCHI A K M, WENK C, et al. Effects of dietary 25-hydroxycholecalciferol and cholecalciferol on blood and vitamin D and mineral status, bone turnover, milk composition and reproductive performance of sows[J]. Journal of Animal Science, 2014, 92(11): 899-909. |
| [21] |
VERSTUYF A, CARMELIET G, BOUILLON R, et al. Vitamin D:a pleiotropic hormone[J]. Kidney International, 2010, 78(2): 140-145. DOI:10.1038/ki.2010.17 |
| [22] |
ERBEN R G, SOEGIARTO D W, WEBER K, et al. Deletion of deoxyribonucleic acid binding domain of the vitamin D receptor abrogates genomic and nongenomic functions of vitamin D[J]. Molecular Endocrinology, 2002, 16(7): 1524-1537. DOI:10.1210/mend.16.7.0866 |
| [23] |
BOUILLON R, CARMELIET G, VERLINDEN L, et al. Vitamin D and human health:lessons from vitamin D receptor null mice[J]. Endocrine Reviews, 2008, 29(6): 726-776. DOI:10.1210/er.2008-0004 |
| [24] |
JOHNSON J A, GRANDE J P, ROCHE P C, et al. Immunohistochemical detection and distribution of the 1, 25-dihydroxyvitamin D3 receptor in rat reproductive tissues[J]. Histochemistry and Cell Biology, 1996, 105(1): 7-15. DOI:10.1007/BF01450873 |
| [25] |
CORBETT S T, HILL O, NANGIA A K. Vitamin D receptor found in human sperm[J]. Urology, 2006, 68(6): 1345-1349. DOI:10.1016/j.urology.2006.09.011 |
| [26] |
MAHMOUDI A R, ZARNANI A H, JEDDI-TEHRANI M, et al. Distribution of vitamin D receptor and 1α-hydroxylase in male mouse reproductive tract[J]. Reproductive Sciences, 2013, 20(4): 426-436. DOI:10.1177/1933719112459235 |
| [27] |
AQUILA S, GUIDO C, MIDDEA E, et al. Human male gamete endocrinology:1alpha, 25-dihydroxyvitamin D3 (1, 25(OH)2D3) regulates different aspects of human sperm biology and metabolism[J]. Reproductive Biology and Endocrinology, 2009, 7: 140. DOI:10.1186/1477-7827-7-140 |




