2. 山东省畜禽疫病防治与繁育重点实验室, 济南 250100
2. Shandong Key Lab of Animal Disease Control and Breeding, Jinan 250100, China
脂肪细胞凋亡,即能量储存的死亡。通过凋亡来调整脂肪细胞的数目被认为是脂肪组织生长和分化过程中维持正常生理机能所必需的,细胞凋亡存在整个脂肪细胞分化过程中,和增殖分化共同维持机体细胞数目的恒定[1]。对脂肪细胞凋亡过程及其调节机制进行深入研究,为治疗人类肥胖相关疾病、控制动物体脂沉积进而改善肉品质,具有重要的研究意义。
20世纪90年代发现人类脂肪细胞凋亡后,才将减脂减重、脂肪细胞数目减少与脂肪细胞凋亡联系起来[2]。随后许多学者对脂肪细胞凋亡过程及其调节机制进行了更为深入的研究,但这些研究主要集中在3T3-L1脂肪细胞系[3]和人、鼠原代培养的脂肪细胞以及猪的前体脂肪细胞。本研究团队初步探讨了鲁西黄牛皮下前体脂肪细胞和肌内前体脂肪细胞的凋亡差异,发现去乙酰化酶1(sirtuin type 1,SIRT1)通过叉头转录因子1(forkhead box protein O1,FoxO1)及其靶基因来调控肉牛前体脂肪细胞凋亡,并且皮下脂肪细胞SIRT1基因表达量和凋亡率均高于肌间脂肪细胞[4],但调控机制需要进一步深入研究。SIRT1是依赖于烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的组蛋白去乙酰化酶,为沉默信息调节因子2(silent information regulator 2,Sir2)家族成员之一[5],与细胞增殖、分化、衰老、凋亡和代谢密切相关,已成为生命科学领域研究的热点之一。腺苷一磷酸激活的蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)能与腺苷一磷酸(adenosine monophosphate,AMP)结合,通过AMP感知细胞的能量水平和代谢平衡水平来调节酶的活性,被称为“能量开关”,参与细胞增殖和凋亡的调控[6]。AMPK作为能量感受器和调节器,成为众多热点信号通路的整合关键点,AMPK和SIRT1之间存在内在联系,从而在调节能量代谢过程中起着重要的调控作用。AMPK与SIRT1的复杂关系及其与上下游的信号分子在脂肪细胞凋亡中的作用值得进一步深入研究。
白藜芦醇(resveratrol,RES)作为一种非黄酮类多酚化合物,主要来源于花生、葡萄(红葡萄酒)、虎杖、桑椹等植物,具有多种生物活性和药理作用,如抗氧化、神经及心血管保护、抗肿瘤和抗衰老等作用[7-8]。RES常用来作为SIRT1的激活剂,在人和模型动物上进行了大量研究,尤其是在表观遗传学调控方面取得了令人瞩目的成果。但RES作为植物提取物,在动物尤其在反刍动物上进行的研究基本上集中在表现型方面,很少涉及到机理方面。如在绵羊上做了有关RES降低甲烷排放的研究[9];在奶牛饲粮中添加葡萄渣后,改变了瘤胃细菌和古菌菌落,同时降低了大约20%的甲烷产量[10]。RES对动物生长、营养物质消化以及与机体表观遗传机制调控之间作用的认识和研究还存在许多空白,需要系统详细的研究。因此,本试验通过研究RES对肉牛皮下脂肪细胞凋亡率以及SIRT1/AMPK信号通路关键基因的mRNA和蛋白质表达量的影响,旨在为通过营养调控技术降低肉牛皮下脂肪沉积提供一定的理论基础。
1 材料与方法 1.1 试验动物选择健康无病、450 kg左右、18月龄的鲁西黄牛阉公牛3头,屠宰后,无菌条件下分离皮下脂肪组织。试验得到山东省农业科学院动物保护和使用委员会的许可(IACUC20060101),并符合相关试验动物福利的规则和制度。
1.2 试验方法 1.2.1 牛皮下脂肪细胞培养[4]将牛皮下脂肪组织剪成1 mm3大小的组织块,加入胶原酶Ⅰ消化液[杜氏改良Eagle培养基/营养混合物F12(Dulbecco’s modified eagle medium/nutrient mixture F12,DMEM/F12)+1 g/L胶原酶Ⅰ],恒温振荡水浴37 ℃消化30 min。加入生长培养液[DMEM/F12+10%胎牛血清(fetal bovine serum,FBS)]终止消化,200目细胞筛过滤,滤液用低速离心机(TDL-40B,上海安亭科学仪器厂)1 385×g离心5 min,弃上清液,加入DMEM/F12洗(692.5×g,离心10 min)2次后,加入生长培养液混匀,制成细胞悬液,计数、接种,即获得牛前体脂肪细胞。待细胞汇合后,更换DMEM/F12生长培养液为诱导分化培养液[DMEM/F12+10% FBS+1%青、链霉素原液+5 μg/mL胰岛素(insulin,INS)+1 μmol/L地塞米松(dexamethasone,DEX)+0.5 mmol/L甲基异丁基黄嘌呤(1-methyl-3-isobutylmethylxanthine,IBMX)],诱导前脂肪细胞分化为脂肪细胞。48 h后,更换诱导分化培养液为基础分化培养液(DMEM/F12+10% FBS+1%青、链霉素原液+5 μg/mL INS),以后每2 d换1次基础分化培养液。一般在第8天,有80%以上的前体脂肪细胞分化为成熟的脂肪细胞。RES、胶原酶Ⅰ、FBS、DMEM/F12和青、链霉素原液均购自美国Gibico公司;INS、DEX和IBMX均购自美国Sigma公司。
1.2.2 Hoechst 33342染色制作细胞爬片,在细胞分化的第0天,更换为RES浓度分别为0(对照)、100、200和400 μmol/L的培养液,每组设3个重复,处理48 h后,倾去培养液,磷酸盐缓冲液(phosphate buffer saline,PBS)洗细胞3次。根据Hoechst 33342染色液(上海碧云天生物技术有限公司)说明书,进行染色,利用日本Olympus公司Microscope Digital Camera Model DP71显微镜成像系统及Olympus BX51荧光显微镜下观察拍照。
1.2.3 油红O染色制作细胞爬片,在细胞分化的第8天,更换为RES浓度分别为0(对照)、100、200和400 μmol/L的培养液,每组设3个重复。48 h后按油红O(南京建成生物工程研究所)染色法鉴定脂肪细胞:倾去培养液,PBS洗细胞3次,10%甲醛的等渗盐缓冲液固定40 min后,PBS漂洗,吸取油红O工作液10 mL,油红O染色30 min,60%异丙醇分色10~20 s,自来水冲洗,苏木精染色10 min,自来水冲洗,甘油明胶封片拍照[4]。
1.2.4 流式细胞术检测脂肪细胞凋亡以5×104个/cm2的密度将细胞接种于25 cm2培养瓶,在皮下前体脂肪细胞分化第0天,更换为RES浓度分别为0(对照)、100、200和400 μmol/L的培养液,每组设3个重复。48 h后取出培养瓶,分别收集细胞,以磷脂结合蛋白V异硫氰酸荧光素(annexin V fluorescein isothiocyanate,Annexin V FITC)/碘化丙啶(propidium iodide,PI)双染法检测细胞凋亡,按照Annexin V-FITC/PI双染细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司)说明进行操作。同时制备3个质控样本设定美国BD FACSCalibur流式细胞仪的荧光补偿和设置十字门范围:a)没有染色的细胞;b)仅用荧光标记的Annexin V FITC染色的细胞;c)仅用PI染色的细胞。结果利用BD FACSCalibur分析平台进行分析,通过计数凋亡区细胞数量得出凋亡率。
1.2.5 实时荧光定量PCR(quantitative real-time PCR,qPCR)以5×104个/cm2密度将细胞接种于25 cm2培养瓶,在细胞分化的第0天,更换为RES浓度分别为0(对照)、100、200和400 μmol/L的培养液,每组设3个重复。干预48 h后取出培养瓶,利用RNApure超纯总RNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取细胞总RNA,利用1%琼脂糖凝胶电泳和紫外分光光度计检测总RNA质量和纯度。采用TranscriptorTM First Strand cDNA Synthesis Kit(Roche)进行两步法qPCR反应体系。反转录后,采用ChamQTM SYBR® Color qPCR Master Mix荧光定量试剂盒(南京诺唯赞生物科技有限公司),取1 μL cDNA作模板,加样于96孔板,在Roche 480荧光定量PCR仪上进行反应。反应程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,循环40;熔解曲线95 ℃变性15 s,60 ℃退火60 s,95 ℃变性15 s。SIRT1及相关基因引物由上海铂尚生物技术有限公司设计合成,PCR引物序列参见表 1。以β-肌动蛋白(β-actin)为内参对照,其他检测基因的相对表达量根据基因表达量相比而推算出来,即相对表达量=2-△△Ct ,其中△Ct =Ct待测基因-Ct内参基因,△△Ct =△Ct试验组-△Ct 对照组,以对照组的基因表达水平设定为1[11]。
|
|
表 1 PCR引物序列 Table 1 Primer sequences of PCR |
以5×104个/cm2的密度将细胞接种于25 cm2培养瓶,在细胞分化的第0天,更换为RES浓度分别为0(对照)、100、200和400 μmol/L的培养液,每组设3个重复。处理48 h后取出培养瓶,提取细胞中的总蛋白,并定量。取30 μg蛋白质利用美国Bio-Rad公司电泳仪Mini-PROTEAN Tetra Cell进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳,然后利用美国Bio-Rad公司电转仪Mini Trans-Blot Electrophoretic transfer Cell转移到聚偏二氟乙烯膜(PVDF),一抗孵育4 ℃过夜,三羟甲基氨基甲烷吐温(TBST)缓冲液冲洗3次,每次10 min;二抗孵育2 h,缓冲液洗涤3次,发光液发光检测。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为总蛋白内参,利用美国Bio-Rad公司Gel Doc XR+凝胶成像系统检测蛋白质条带亮度以及Quantity One软件分析蛋白质条带密度值和表达量;将各目的蛋白质密度值数据与相应的GAPDH密度值比对蛋白质表达量,以各组灰度值与对照组灰度值的比值表示,作相对表达量的柱状分析图。抗体SIRT1、促凋亡蛋白Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、GAPDH为英国Abcam公司产品,半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,caspase)-3、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)为美国Cell Signaling Technology (CST)公司产品,FoxO1为美国Novus Biologicals公司产品,AMPKα为美国Gene Tex公司产品。
1.3 统计分析试验数据以平均值±标准误(mean±SE)表示,采用SPSS 21.0统计分析软件中的单因素方差分析(one-way ANOVA),两两比较采用Tukey检验。P < 0.05为差异显著,P < 0.01为差异极显著,P>0.05为差异不显著。
2 结果与分析 2.1 牛皮下脂肪细胞的鉴定油红O染色是鉴定脂肪细胞特异性方法,脂肪细胞内脂滴能被亲脂的油红O着色呈现红色,其他细胞因不含脂滴而无法被油红O染色,从而证明所培养的细胞为脂肪细胞。由图 1可见,对照组和RES组均能被油红O染色,说明试验所用细胞为脂肪细胞。随着RES浓度的增加,油红O染色减少。
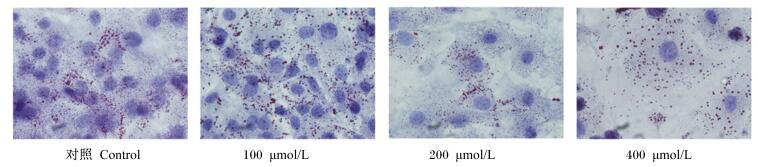
|
图 1 油红O染色 Figure 1 Oil red O staining (1 000×) |
由图 2-A和图 2-B可见,对照凋亡检测图和凋亡率,在牛皮下脂肪细胞分化第0天,用不同浓度的RES处理48 h,不同浓度的RES处理后的牛皮下脂肪细胞凋亡率均极显著高于对照组(P < 0.01)。
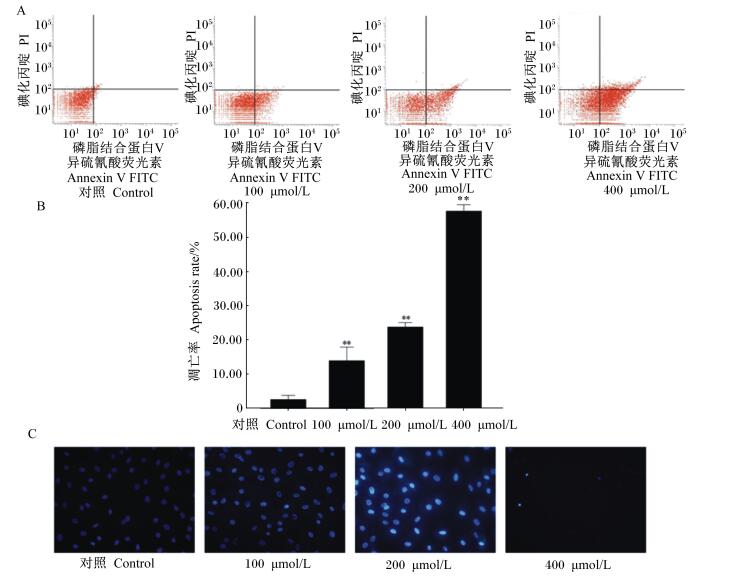
|
A:RES对牛皮下脂肪细胞凋亡流式细胞仪检测图。B:RES对牛皮下脂肪细胞凋亡率的影响。C:Hoechst 33342染色检测RES引起肉牛皮下脂肪细胞凋亡的形态学变化(200×)。 数据柱标*表示与对照组比较差异显著(P < 0.05),**表示与对照组比较差异极显著(P < 0.01),#表示与对照组比较差异不显著(P>0.05)。下图同。 A: Apoptotic detection of figure by flow cytometry treated with RES. B: Effects of RES on apoptosis ratio of bovine subcutaneous adipocytes. C: Morphological changes of bovine subcutaneous adipocytes apoptosis exposed to RES by Hoechst 33342 staining (200×). Value columns with * mean significant difference compared with control group (P < 0.05), and with ** mean extremely significant difference compared with control group (P < 0.01), while with # mean no difference compared with control group (P>0.05). The same as below. 图 2 白藜芦醇对肉牛皮下脂肪细胞凋亡的影响 Figure 2 Effects of RES on apoptosis of bovine subcutaneous adipocytes (n=3) |
Hoechst 33342可透过细胞膜,与DNA结合而发出强烈的蓝色荧光,常用于细胞凋亡检测。由图 2-C可见,与对照组相比,RES处理48 h后,在荧光显微镜下观察到凋亡细胞的细胞核呈致密浓染,400 μmol/L浓度下因较多细胞凋亡脱落,故只观察到少量细胞,但均呈碎块状致密浓染。
2.3 RES对牛皮下脂肪细胞SIRT1、AMPKα、FoxO1的mRNA和蛋白质表达量的影响由表 3和图 3可知,与对照组相比,SIRT1的mRNA表达量随着RES浓度增加显著或极显著提高(P < 0.05或P < 0.01),蛋白质表达量也是随着RES浓度增加极显著提高(P < 0.01);AMPKα的mRNA和蛋白质表达量显著或极显著提高(P < 0.05或P < 0.01);RES浓度为200和400 μmol/L时,FoxO1的mRNA和蛋白质表达量显著或极显著提高(P < 0.05或P < 0.01)。RES浓度为100 μmol/L时,FoxO1的mRNA和蛋白质表达量与对照组差异不显著(P>0.05)。基因和蛋白质表达量基本呈现浓度依赖性。
|
|
表 3 RES对牛皮下脂肪细胞基因mRNA表达量的影响 Table 3 Effects of RES on mRNA expression of bovine subcutaneous adipocytes genes (n=3) |
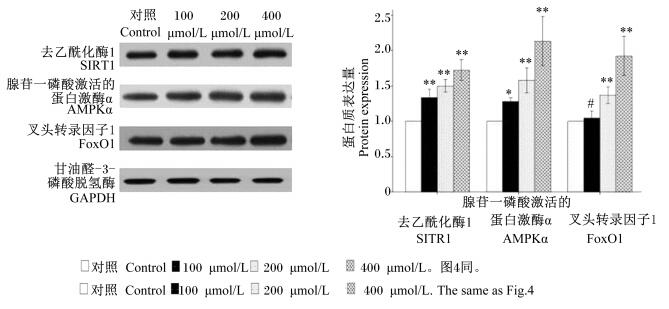
|
图 3 RES对SIRT1、AMPKα和FoxO1蛋白质表达量的影响 Figure 3 Effects of RES on protein expression of SIRT1, AMPKα and FoxO1 |
由表 3和图 4可知,与对照组相比,Bcl-2的mRNA表达量随着RES浓度增加极显著降低(P < 0.01);RES浓度为200和400 μmol/L时,Bcl-2的蛋白质表达量也极显著降低(P < 0.01);caspase-3的mRNA和蛋白质表达量显著或极显著提高(P < 0.05或P < 0.01);Bax的mRNA表达量显著或极显著提高(P < 0.05或P < 0.01),RES浓度为200和400 μmol/L时,Bax的蛋白质表达量极显著提高(P < 0.01)。RES浓度为100 μmol/L时,Bcl-2和Bax的蛋白质表达量与对照组差异不显著(P>0.05)。
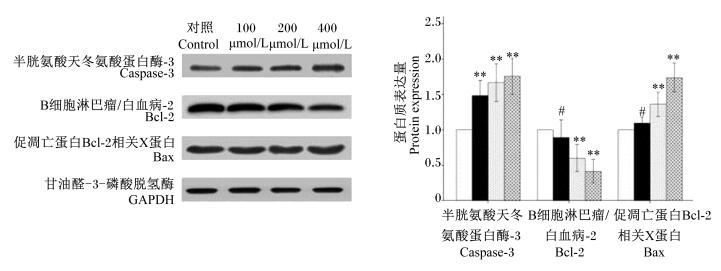
|
图 4 RES对caspase-3、Bcl-2和Bax蛋白质表达量的影响 Figure 4 Effects of RES on protein expression of caspase-3, Bcl-2 and Bax |
由于脂肪细胞内存在大量脂滴,可阻止细胞皱缩及凋亡小体的形成,再加上由于脂肪细胞密度较小,易漂浮在液面上,操作中不易洗涤和分离,所以脂肪组织细胞凋亡研究起步较晚。细胞凋亡是由基因控制的细胞主动死亡的过程,最重要的调节因子之一是Bcl-2家族,该家族根据功能不同分为2类:一类是促凋亡成员如Bax、Bad等,其通过提高线粒体的外膜通透性,增加线粒体中细胞色素C的释放,激活本身不具有生物催化活性的caspase酶原,最终导致细胞凋亡;另一类是抗凋亡成员如Bcl-2、Bcl-xl等,其能够通过稳定线粒体膜阻止细胞色素C的释放,从而对线粒体凋亡途径起负调控作用。
用RES处理3T3-L1前脂肪细胞研究凋亡现象,发现SIRT1的蛋白质表达量提高,caspase-3和caspase-9被激活[12]。RES特异性增加猪前体脂肪细胞SIRT1的表达活性,而SIRT1的上调影响caspase-3和Bcl-2家族因子的活性,同时参与调控肿瘤抑制因子p53和核转录因子kappa B(NF-κB)的转录表达,推测SIRT1调控凋亡相关因子表达是RES诱导前体脂肪细胞凋亡的关键原因[13]。本研究中RES特异性增加肉牛脂肪细胞SIRT1的表达活性,caspase-3和Bax的mRNA和蛋白质表达量升高,Bcl-2的mRNA和蛋白质表达量降低,说明RES诱导牛脂肪细胞凋亡过程中,促凋亡因子的作用显著加强,抑制凋亡发生因子的作用能力减弱,最终导致凋亡现象的发生,与上述的研究结果基本相似[13]。而将鼠H9c2细胞置于缺氧环境下24 h,发现细胞凋亡增加,而相同条件下再用RES处理24 h,凋亡细胞明显减少[14]。用RES处理人类退变椎间盘髓核(disc nucleus pulposus,NP)细胞48 h,可降低细胞的凋亡水平和caspase-3基因的激活,SIRT1主要通过蛋白激酶B(Akt)抗凋亡信号通路调控退变NP细胞的存活[15]。看来RES诱导的SIRT1对细胞凋亡的功能调节与细胞种类、细胞所处的阶段、环境等其他因素有很大关系。
RES作为SIRT1的激活剂,在人和模型动物上进行了大量研究,但作为植物提取物,在动物尤其在反刍动物上进行的研究基本上集中在降低甲烷排放方面,本研究在RES对肉牛皮下脂肪细胞凋亡方面进行了初步探讨,对肉牛脂肪沉积调控方面需要做进一步系统详细的研究。
3.2 SIRT1/AMPK信号通路与脂肪细胞凋亡由于哺乳动物的AMPK属于高度保守的蛋白激酶家族,是蛋白激酶级联系统中的中心元件,在调节能量代谢的信号转导机制中起着枢纽作用;而SIRT1作为一种NAD+依赖的组蛋白去乙酰化酶,通过细胞内氧化还原状态的改变而调控细胞的能量代谢平衡。研究表明,AMPK和SIRT1之间存在内在联系,从而在调节能量代谢过程中起着重要的调控作用。能量降低或AMPK激活导致SIRT1激活,可能是提高NAD+或NAD+/还原型烟酰胺腺嘌呤二核苷酸(NADH)和/或烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyl transferase,NAMPT),SIRT1去乙酰化并激活肝激酶B1(liver kinase B1,LKB1),随后激活AMPK[16-18];RES通过激活SIRT1影响AMPK[19-21]。利用RES研究鼠3T3-L1前体脂肪细胞凋亡中发现,SIRT1激活,抑制Akt活性,同时也提高了AMPK活性,SIRT1/AMPK信号通路激活了线粒体介导的信号通路[12]。另外SIRT1将FoxO1、生肌决定因子(mysgenic determination gene,MyoD)、p53等许多转录因子作为底物发挥作用。RES可上调人内脏脂肪细胞中SIRT1、FoxO1和脂联素(adiponectin)基因表达[22]。与上述的研究结果相类似,本研究中RES特异性增加肉牛脂肪细胞SIRT1的表达活性,AMPKα和FoxO1的mRNA和蛋白质表达量也相应增加,说明RES诱导肉牛脂肪细胞凋亡过程中,激活SIRT1/AMPK信号通路,同时激活通路下游的FoxO1,促凋亡的作用显著加强,导致凋亡现象。当然还有好多相反的研究结果,利用RES抑制人骨骼肌细胞中的AMPK信号通路[23]。研究发现AMPK的α2催化亚基异构体在肝细胞癌(HCC)中显著下调,AMPK的异位表达在肝癌细胞中增强了p53的乙酰化和稳定;p53去乙酰化使SIRT1的苏氨酸(Thr)-344位点可被AMPK所磷酸化,这造成SIRT1失活,从而促进p53的乙酰化和肝癌细胞的凋亡[24]。可见RES诱导的SIRT1/AMPK信号通路对细胞凋亡的功能调节比较复杂,既有抗凋亡作用,又有促凋亡作用,与细胞种类、处理的特异性、刺激的时间和强度等多种因素都有密切关联。
由于抗体的种属原因,本研究只检测了总蛋白水平,团队下一步将检测SIRT1/AMPK信号通路蛋白激酶及其亚基的磷酸化水平,以便了解白藜芦醇激活AMPK通路的具体作用机制。同时深入研究白藜芦醇对肉牛肌内脂肪细胞和肌细胞的影响以及大群饲养效果,为通过饲喂植物提取物等营养调控技术降低肉牛皮下脂肪沉积提供新思路。
4 结论RES通过激活SIRT1/AMPK信号通路,同时激活通路下游的FoxO1,促进肉牛皮下脂肪细胞的凋亡。
| [1] |
PRINS J B, O'RAHILLY S. Regulation of adipose cell number in man[J]. Clinical Science, 1997, 92(1): 3-11. DOI:10.1042/cs0920003 |
| [2] |
PRINS J B, WALKER N I, WINTERFORD C M, et al. Apoptosis of Human Adipocytes in vitro[J]. Biochemical and Biophysical Research Communications, 1994, 201(2): 500-507. DOI:10.1006/bbrc.1994.1730 |
| [3] |
XIAO Y Y, YUAN T C, YAO W Q, et al. 3T3-L1 adipocyte apoptosis induced by thiazolidinediones is peroxisome proliferator-activated receptor-γ-dependent and mediated by the caspase-3-dependent apoptotic pathway[J]. FEBS Journal, 2010, 277(3): 687-696. DOI:10.1111/j.1742-4658.2009.07514.x |
| [4] |
LIU X M, SONG E L, LIU G F, et al. Effect of SIRT1 on apoptosis of bovine preadipocytes[J]. Progress in Biochemistry and Biophysics, 2010, 37(3): 297-303. DOI:10.3724/SP.J.1206.2009.00583 |
| [5] |
IMAI S, ARMSTRONG C M, KAEBERLEIN M, et al. Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase[J]. Nature, 2000, 403(6771): 795-800. DOI:10.1038/35001622 |
| [6] |
MCCARTY M F. AMPK activation-protean potential for boosting healthspan[J]. AGE, 2014, 36(2): 641-663. DOI:10.1007/s11357-013-9595-y |
| [7] |
VANG O, AHMAD N, BAILE C A, et al. What is new for an old molecule? Systematic review and recommendations on the use of resveratrol[J]. PLoS One, 2011, 6(6): e19881. DOI:10.1371/journal.pone.0019881 |
| [8] |
BITTERMAN J L, CHUNG J H. Metabolic effects of resveratrol:addressing the controversies[J]. Cellular and Molecular Life Sciences, 2015, 72(8): 1473-1488. DOI:10.1007/s00018-014-1808-8 |
| [9] |
MA T, CHEN D D, TU Y, et al. Effect of dietary supplementation with resveratrol on nutrient digestibility, methanogenesis and ruminal microbial flora in sheep[J]. Journal of Animal Physiology and Animal Nutrition, 2015, 99(4): 676-683. DOI:10.1111/jpn.2015.99.issue-4 |
| [10] |
MOATE P J, WILLIAMS S R, TOROK V A, et al. Grape marc reduces methane emissions when fed to dairy cows[J]. Journal of Dairy Science, 2014, 97(8): 5073-5087. DOI:10.3168/jds.2013-7588 |
| [11] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [12] |
CHEN S F, XIAO X C, FENG X, et al. Resveratrol induces Sirt1-dependent apoptosis in 3T3-L1 preadipocytes by activating AMPK and suppressing AKT activity and survivin expression[J]. The Journal of Nutritional Biochemistry, 2012, 23(9): 1100-1112. DOI:10.1016/j.jnutbio.2011.06.003 |
| [13] |
PANG W J, XIONG Y, ZHANG Z, et al. Lentivirus-mediated Sirt1 shRNA and resveratrol independently induce porcine preadipocyte apoptosis by canonical apoptotic pathway[J]. Molecular Biology Reports, 2013, 40(1): 129-139. DOI:10.1007/s11033-012-2041-x |
| [14] |
CHEN C J, YU W, FU Y C, et al. Resveratrol protects cardiomyocytes from hypoxia-induced apoptosis through the SIRT1-FoxO1 pathway[J]. Biochemical and Biophysical Research Communications, 2009, 378(3): 389-393. DOI:10.1016/j.bbrc.2008.11.110 |
| [15] |
WANG D W, HU Z M, HAO J, et al. SIRT1 inhibits apoptosis of degenerative human disc nucleus pulposus cells through activation of Akt pathway[J]. AGE, 2013, 35(5): 1741-1753. DOI:10.1007/s11357-012-9474-y |
| [16] |
FULCO M, CEN Y N, ZHAO P, et al. Glucose restriction inhibits skeletal myoblast differentiation by activating SIRT1 through AMPK-mediated regulation of Nampt[J]. Developmental Cell, 2008, 14(5): 661-673. DOI:10.1016/j.devcel.2008.02.004 |
| [17] |
CANTÍ C, GERHART-HINES Z, FEIGE J N, et al. AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity[J]. Nature, 2009, 458(7241): 1056-1060. DOI:10.1038/nature07813 |
| [18] |
RUDERMAN N B, XU X J, NELSON L, et al. AMPK and SIRT1:a long-standing partnership?[J]. American Journal of Physiology-Endocrinology and Metabolism, 2010, 298(4): E751-E760. DOI:10.1152/ajpendo.00745.2009 |
| [19] |
CANTÍ C, JIANG L Q, DESHMUKH A S, et al. Interdependence of AMPK and SIRT1 for metabolic adaptation to fasting and exercise in skeletal muscle[J]. Cell Metabolism, 2010, 11(3): 213-219. DOI:10.1016/j.cmet.2010.02.006 |
| [20] |
UM J H, PARK S J, KANG H, et al. AMP-activated protein kinase-deficient mice are resistant to the metabolic effects of resveratrol[J]. Diabetes, 2010, 59(3): 554-563. DOI:10.2337/db09-0482 |
| [21] |
PARK S J, AHMAD F, PHILP A, et al. Resveratrol ameliorates aging-related metabolic phenotypes by inhibiting cAMP phosphodiesterases[J]. Cell, 2012, 148(3): 421-433. DOI:10.1016/j.cell.2012.01.017 |
| [22] |
COSTA C D S, ROHDEN F, HAMMES T O, et al. Resveratrol upregulated SIRT1, FOXO1, and adiponectin and downregulated PPARgamma1-3 mRNA expression in human visceral adipocytes[J]. Obesity Surgery, 2011, 21(3): 356-361. DOI:10.1007/s11695-010-0251-7 |
| [23] |
SKROBUK P, VON KRAEMER S, SEMENOVA M M, et al. Acute exposure to resveratrol inhibits AMPK activity in human skeletal muscle cells[J]. Diabetologia, 2012, 55(11): 3051-3060. DOI:10.1007/s00125-012-2691-1 |
| [24] |
LEE C W, WONG L L Y, TSE E Y T, et al. AMPK promotes p53 acetylation via phosphorylation and inactivation of SIRT1 in liver cancer cells[J]. Cancer Research, 2012, 72(17): 4394-4404. DOI:10.1158/0008-5472.CAN-12-0429 |




