2. 西北农林科技大学, 杨凌 712100;
3. 天津农学院, 天津 300384;
4. 山西省太谷县畜牲兽医技术服务中心范村站, 太谷 030801
2. Northwest A & F University, Yangling 712100, China;
3. Tianjin Agricultural University, Tianjin 300384, China;
4. Fancun Station, Animal Husbandry and Veterinary Technical Service Center of Taigu County in Shanxi Province, Taigu 030801, China
自发现以来,抗生素被用作药物来保持人和动物的健康[1]。近50年来,抗生素在实际生产中取得了明显的疾病预防和促生长作用,给畜牧业带来了巨大的经济效益。但近20年来,随着科学技术的发展和生活水平的提高,人们逐渐认识到滥用抗生素会引起其在畜禽产品中的残留、抗药性以及环境污染等负面问题[2-3]。因此,寻求绿色、高效、无污染和无残留的饲料添加剂以取代抗生素和化学合成药品已成为必然趋势,也是当前国内外饲料学科的一项重要研究内容。微生态制剂因其可提高动物免疫力和生产性能[4],被认为是抗生素的有效替代物之一,其中酵母菌和芽孢杆菌是2种应用较多的微生态制剂[5]。
酵母菌是一类单细胞真核微生物的总称,其泛指能够发酵糖类的各种单细胞真菌,是一个复杂的类群。研究报道证实,在母猪饲粮中添加活性酵母菌,能提高仔猪生长性能、免疫状况、仔猪断奶重以及仔猪窝重[6-7]。酵母培养物能够对生长猪的肠道健康和免疫系统产生有益作用[8]。研究发现,酿酒酵母作为有益菌,在增殖过程中能有效竞争抑制病原菌的繁殖,调节动物肠道微生态系统,促进肠道黏膜发育,提高动物对营养物质的消化和吸收[9]。酵母培养物在发酵生产过程中可产生细胞壁多糖、活性有益菌、次级代谢产物、矿物质、维生素和未知促生长因子等有益于动物肠道微生态平衡及增强免疫功能的成分,具有重要的研究价值[10-11]。芽孢杆菌是一类好氧或兼性厌氧的革兰氏阳性菌,是益生菌的一种,能直接代谢产生多种营养物质,并能分泌淀粉酶、果胶酶等酶类[12]。在不良环境胁迫下能以孢子形式存在,具有耐酸耐热能力[13];能够提高饲粮养分的消化率[14]、提高动物免疫力[15]、促进动物生长[16]、拮抗病原微生物[17]、改善排泄物氨逸失[18]等,现已广泛应用于各种畜禽和水产动物饲料,是具有广阔应用前景的益生菌。
不过,在微生态制剂研究领域中,许多学者都比较重视菌株的作用机理和作用效果的对比,但对菌株的选择和性能比较未做过多的研究;且酵母菌和芽孢杆菌均在断奶仔猪早期阶段应用较多[19-21],而对育肥猪阶段的研究报道较少。因此,本试验以育肥猪为研究对象,通过在饲粮中添加酵母菌和芽孢杆菌制剂,考察并比较这2种微生态制剂对育肥猪生长性能、养分表观消化率、肠道形态结构和肠道免疫的影响。
1 材料与方法 1.1 试验设计选取体重为(62.50±0.83) kg的“杜×长×大”杂交育肥猪72头,按体重相近、性别比例一致原则,随机分为3组,每组4个重复,每个重复6头猪。对照组饲喂基础饲粮,酿酒酵母组饲喂在基础饲粮中添加0.5 g/kg活性干酵母制剂(酵母菌活菌数1.0×1010 CFU/kg)的饲粮,芽孢杆菌组饲喂在基础饲粮中添加0.1 g/kg芽孢杆菌制剂(芽孢杆菌活菌数1.0×109 CFU/kg)的饲粮。试验期56 d。基础饲粮为粉料,参照NRC(2012)猪营养需要配制,其组成及营养水平见表 1。试验期间,每天喂料4次,自由采食和饮水。试验第56天时,20:00开始禁食12 h,每个重复选取1头体重接近平均值的育肥公猪进行屠宰。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
酵母菌由北京邦士富生物科技有限公司提供,其菌种为酿酒酵母,活菌数≥2.0×1010 CFU/g,适宜添加量为1.0×1010 CFU/kg。
芽孢杆菌由山东宝来利生物工程股份有限公司提供,其菌种为枯草芽孢杆菌和地衣芽孢杆菌,活菌数≥1.0×1010 CFU/g,适宜添加量为1.0×109 CFU/kg。
1.3 测定指标及方法 1.3.1 生长性能在试验开始和结束当天07:00分别对每栏猪逐头空腹称重,结算耗料量,以重复为单位,计算平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.3.2 养分表观消化率在试验开始第35天时进行消化试验,每个重复连续采集4 d粪样,每日采集3次,尽量采集到每头猪的粪便,每次约100 g,加入10%的酒石酸水溶液,防止氨气挥发,并采集饲粮样品,在65 ℃烘12 h、回潮24 h后粉碎,饲粮和粪样的粗蛋白质、钙和磷含量按文献的方法测定。养分表观消化率计算公式如下:
养分表观消化率(%)=100×[1-(A/B)×(C/D)]。
式中:A为粪中某养分含量;B为饲粮中该养分含量;C为饲粮中酸不溶性灰分含量;D为粪中酸不溶性灰分含量。
1.3.3 肠道形态结构和免疫细胞计数屠宰后,无菌剪取十二指肠、空肠、回肠段各0.5 cm,用生理盐水冲洗后,4%多聚甲醛进行固定,经石蜡包埋后切成5 μm切片,苏木精-伊红(HE)染色,每个样品观察2张非连续的切片,每张切片选取6个典型的视野,用光学显微镜进行观察测量,测定相应的绒毛高度以及隐窝深度,绒毛高度是指从其顶端至根部,隐窝深度是指从相邻2根绒毛根部至基底部,并计算绒毛高度/隐窝深度值。每头育肥猪测定6个不同肠段的绒毛,从基部开始计数,计算每100个柱状上皮细胞中杯状细胞的数目[23]。利用改良版甲苯胺蓝染色观察肠黏膜固有层中肥大细胞的数量,在400倍下随机取10个视野,并计数每个视野内肥大细胞的个数[24]。
1.3.4 肠道细胞因子含量样品前处理:称取适量肠道组织,置液氮预冷的研钵中研磨成粉末,然后按质量(g):体积(mL)=1:9,加入9倍体积的冷生理盐水,混匀,4 000 r/min离心10 min,吸取上清于1.5 mL EP管中。采用双抗夹心酶联免疫吸附试验(ELISA)法测定肠道组织上清液中分泌型免疫球蛋白A(SIgA)、肠三叶因子(ITF)、肿瘤坏死因子-α(TNF-α)和白细胞介素-8(IL-8)的含量,试剂盒购自上海西唐生物科技有限公司。
1.4 数据统计与分析运用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),以Duncan氏法进行多重比较,结果以平均值±标准误表示,以P<0.05表示差异显著,P<0.01表示差异极显著,0.05<P<0.10表示具有显著性趋势。
2 结果与分析 2.1 酿酒酵母和芽孢杆菌对育肥猪生长性能的影响由表 2可知,各组平均日采食量、平均日增重及料重比均差异不显著(P>0.05)。
|
|
表 2 酿酒酵母和芽孢杆菌对育肥猪生长性能的影响 Table 2 Effects of Saccharomyces cerevisiae and Bacillus on growth performance of finishing pigs (n=12) |
由表 3可知,与对照组相比,酿酒酵母组育肥猪钙的表观消化率显著提高(P < 0.05),而芽孢杆菌组育肥猪钙和磷的表观消化率均显著提高(P < 0.05);各组育肥猪粗蛋白质表观消化率差异不显著(P>0.05)。
|
|
表 3 酿酒酵母和芽孢杆菌对育肥猪养分表观消化率的影响 Table 3 Effects of Saccharomyces cerevisiae and Bacillus on nutrient apparent digestibility of finishing pigs (n=12) |
图 1为酿酒酵母和芽孢杆菌对育肥猪肠道形态结构的影响,图 2为十二指肠切片图,图 3为空肠切片图,图 4为回肠切片图。由图 1-a可知,各组猪十二指肠、空肠、回肠绒毛高度均差异不显著(P>0.05);由图 1-b可知,与对照组相比,酿酒酵母组空肠隐窝深度极显著降低(P < 0.01);由图 1-c可知,与对照组相比,酿酒酵母组空肠绒毛高度/隐窝深度值极显著提高(P < 0.01)。
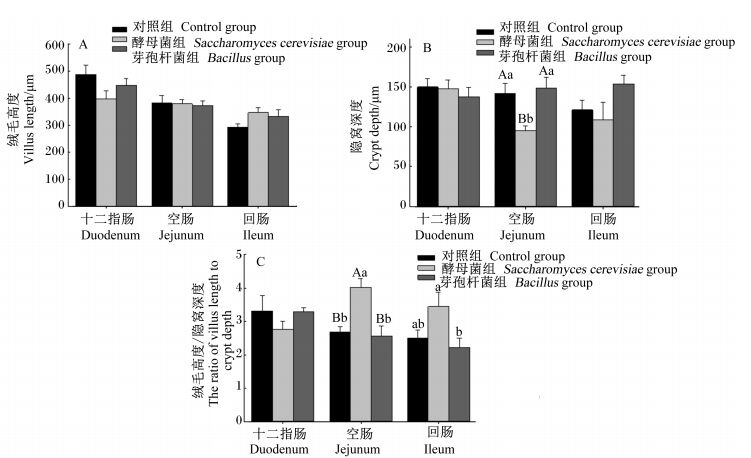
|
数据柱形标注不同小写字母表示差异显著(P < 0.05),不同大写字母表示差异极显著(P < 0.01)。下图同。 Value columns with different small letters mean significant difference (P < 0.05), with different capital letters mean extremely significant difference (P < 0.01). The same as below. 图 1 酿酒酵母和芽孢杆菌对育肥猪肠道形态结构的影响 Figure 1 Effects of Saccharomyces cerevisiae and Bacillus on intestinal morphological structure of finishing pigs |
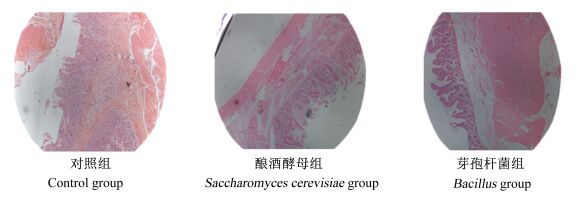
|
图 2 十二指肠切片图 Figure 2 Slice atlases of duodenum (40×) |
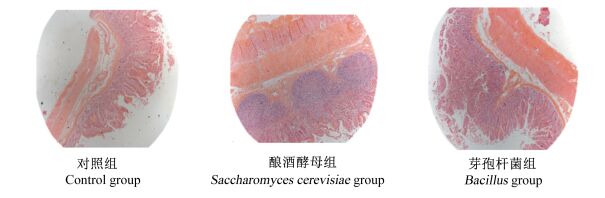
|
图 3 空肠切片图 Figure 3 Slice atlases of jejunum (40×) |
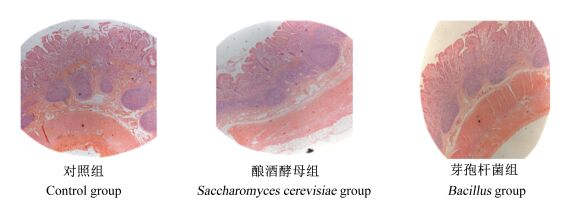
|
图 4 回肠切片图 Figure 4 Slice atlases of ileum (40×) |
由表 4可知,芽孢杆菌组猪空肠、回肠SIgA含量极显著高于对照组和酿酒酵母组(P < 0.01);与对照组相比,芽孢杆菌组空肠中IL-8含量有降低的趋势(0.05 < P < 0.10),酿酒酵母组回肠中IL-8含量有降低的趋势(0.05 < P < 0.10)。
|
|
表 4 酵母菌和芽孢杆菌对育肥猪肠道细胞因子含量的影响 Table 4 Effects of Saccharomyces cerevisiae and Bacillus on intestinal cytokine contents of finishing pigs (n=12) |
由表 5可知,各组育肥猪空肠、回肠肥大细胞和杯状细胞数量均无显著差异(P>0.05)。
|
|
表 5 酿酒酵母和芽孢杆菌对育肥猪肠道免疫细胞数量的影响 Table 5 Effects of Saccharomyces cerevisiae and Bacillus on the number of immune cells in intestine of finishing pigs (n=12) |
目前已经证明益生菌在仔猪生产中具有提高饲料转化率、促进动物生长和维持动物健康的积极作用[19-21]。酵母菌本身含有较高的蛋白质、氨基酸、赖氨酸以及维生素,且酵母本身含有的特性能够改善动物体内胃肠道的生态环境[25]。许多研究已证实活性酵母可以改善育肥猪的生长性能。蔡锐芳等[26]在体重为90~100 kg的育肥猪饲粮中添加300 g/t的活性酵母菌后发现其显著地提高了育肥猪的平均日增重并降低料重比。但黄珂等[27]研究表明,在基础饲粮中添加酵母培养物对育肥猪前期以及后期的平均日增重及平均日采食量均没有显著影响。芽孢杆菌进入机体胃肠道后,可代谢产生大量的消化酶及营养物质,供宿主消化利用,进而提高生长性能[12]。姜军坡等[28]和霍永久等[29]研究表明,在育肥猪饲粮中添加芽孢杆菌后,育肥猪的生长性能有提高的趋势,但差异不显著。
本试验研究表明,在育肥猪饲粮中添加酿酒酵母和芽孢杆菌对平均日增重、平均日采食量以及料重比均没有显著影响。这是由于益生菌的促生长作用与其能调节肠道菌群结构有关[30]。育肥猪肠道发育已完成,在固定的饲粮类型下肠道菌群已趋于稳定[31],所以外源菌群对其并没有发挥促生长作用。
3.2 酿酒酵母和芽孢杆菌对育肥猪养分表观消化率的影响消化率的测定可反映饲粮的可消化性以及动物的消化能力[32]。芽孢杆菌进入肠道后分泌活性较强的脂肪酶、蛋白酶、纤维素酶以及淀粉酶等,可促进营养物质的消化吸收[12]。姜军坡等[28]和华洵璐等[19]研究发现,芽孢杆菌制剂能提高猪对饲粮粗蛋白质、粗脂肪、粗纤维以及淀粉的消化吸收。酵母菌由于其含有丰富的蛋白质、纤维素、矿物质、B族维生素以及有机酸[33],在饲粮中添加酵母菌后,能促进猪对营养物质的消化吸收[34-35]。但陈生龙[20]试验结果表明,活酵母的添加对断奶仔猪的饲粮表观消化率未见显著影响。本试验结果表明,益生菌均有提高育肥猪对饲粮中粗蛋白质、钙和磷等营养物质的消化吸收,其中添加芽孢杆菌显著提高钙、磷的表观消化率并具有提高粗蛋白质表观消化率的趋势,而酿酒酵母显著提高了钙的表观消化率,但对粗蛋白质和磷的表观消化率没有显著影响。究其原因可能是由于芽孢杆菌进入肠道后能够产生大量的胞外酶,如蛋白质酶、淀粉酶以及纤维酶等,增加了育肥猪肠道中的酶活力,从而促进动物对营养物质的吸收[12]。此外,枯草芽孢杆菌进入肠道后可产生乳酸等有机酸类,这种偏酸环境也有利于被结合或螯合的矿物质元素以游离态释放,从而提高钙、磷等的利用率[36]。
3.3 酿酒酵母和芽孢杆菌对育肥猪肠道形态结构的影响小肠在营养物质的消化、吸收以及转运方面起着重要的作用[37]。正常的肠上皮结构在肠道屏障功能以及黏膜免疫反应中亦发挥着重要的作用[38-39]。肠道绒毛高度、隐窝深度和绒毛高度与隐窝深度的比值是衡量肠道消化吸收的重要指标[40]。小肠绒毛是小肠吸收营养物质的主要部位,绒毛越长,小肠对营养物质的吸收能力越高[41];隐窝深度反映细胞的生成率,隐窝变浅表明细胞成熟率上升,分泌功能增强。绒毛高度与隐窝深度比则综合反映小肠的功能状态,其值大,说明肠内膜面积较大,消化吸收能力较强[42]。
Baum等[43]、胡友军等[21]研究发现,给断奶仔猪饲喂酵母菌后其肠绒毛高度显著增加,但Bontempo等[44]在断奶仔猪饲粮中添加酿酒酵母后发现,猪肠道绒毛高度与隐窝深度发生明显变化,绒毛长度与隐窝深度的比值偏低。综合而言,关于酵母菌对猪肠道形态的影响报道不一,且对育肥猪肠道形态结构的报道较少,有关酵母菌改善小肠黏膜组织结构的确切机理还没有一致结论。本试验结果表明,添加1.0×1010 CFU/kg酵母菌可降低育肥猪空肠、回肠的隐窝深度,提高空肠、回肠绒毛高度/隐窝深度值。这可能与酿酒酵母细胞壁中含有β-葡聚糖和甘露聚糖有关。β-葡聚糖和甘露聚糖可通过吸附、吞噬、破坏和吸收入侵细菌等来减少胃肠道黏膜与抗原的结合,从而保护胃肠道黏膜免受破坏[45]。陈旭东[46]、辛娜等[47]在断奶仔猪的饲粮中添加不同剂量的芽孢杆菌后发现其对小肠的发育具有促进作用。本试验结果表明,添加1.0×109 CFU/kg芽孢杆菌对育肥猪肠道形态结构没有显著影响,这与上述试验结果相反,可能是由于本试验所添加芽孢杆菌属于外源菌且育肥猪肠道菌群稳定,外源性的芽孢杆菌对育肥猪肠道的剌激作用不及内源菌[48],其具体的作用效果还有待进一步地研究。
3.4 酵母菌和芽孢杆菌对育肥猪肠道细胞因子含量以及免疫细胞数量的影响肠黏膜是动物抵抗微生物和外源物质的重要屏障,正常的肠黏膜屏障是由机械屏障、化学屏障、免疫屏障以及生物屏障共同构成。细胞因子是由淋巴细胞、单核巨噬细胞以及相关免疫细胞产生的具有免疫调节功能的一类蛋白类物质,是免疫系统重要的信息分子[49]。ITF是由杯状细胞分泌在肠黏膜表面的一种小分子蛋白,可促进肠黏膜细胞的增殖,促进肠道修复[50]。肥大细胞是重要的免疫活性细胞,主要通过分泌细胞因子参与获得性免疫反应[51]。肥大细胞在抵御细菌感染中的作用主要与TNF-α有关,在细菌侵入的早期,肥大细胞释放的TNF-α在启动防御性免疫反应中发挥了重要的作用[52]。SIgA是在外分泌液中发现的一种免疫球蛋白A抗体,是黏膜免疫的主要抗体,在肠道黏膜防御中起到重要的作用,可阻止病原体黏附并在不激活系统免疫的前提下清除抗原[53-54]。IL-8是由巨噬细胞和上皮细胞分泌产生,能够趋化和激活中性粒细胞,导致黏膜水肿,白细胞浸润,血管损害及通透性增加,导致机体免疫炎性损伤[55]。
本试验测定了育肥猪肠道细胞因子ITF、SIgA、TNF-α、IL-8的含量以及肠道杯状细胞和肥大细胞的数量,结果显示,益生菌的添加对肠道细胞因子ITF、TNF-α含量以及肥大细胞、杯状细胞数量均无显著影响,但添加芽孢杆菌后有降低空肠中IL-8含量的趋势,而添加酵母菌有降低回肠中IL-8含量的趋势,且添加芽孢杆菌后可极显著提高空肠和回肠中SIgA含量。其中ITF、IL-8以及SIgA的结果与近年来的一些同类研究结果相类似:王亨等[56]研究表明,益生菌的添加不影响大鼠肠组织中ITF的分泌;肖宏德[57]研究表明,在断奶仔猪饲粮中添加益生菌(枯草芽孢杆菌和屎肠球菌)后其十二指肠和空肠中SIgA含量分别提高了51.5%和22.5%;任大勇[58]和江美玲[59]研究表明,给小鼠饲喂乳酸菌后可下调IL-8的转录水平。颜玉等[60]研究表明,益生菌通过抑制TNF-α活性从而达到抗炎治疗的作用。本试验与颜玉等[60]的结果相反,这可能是由于其所选择的菌种不同所导致。本试验研究结果显示,益生菌可以通过调节肠道内细胞因子的分泌来调节肠道稳态,从而提高机体免疫力。
4 结论饲粮中添加酿酒酵母和芽孢杆菌均可改善育肥猪对营养物质的消化吸收,其中酿酒酵母对育肥猪肠道形态结构具有一定的改善作用;而芽孢杆菌可显著提高肠道中的SIgA含量,提高肠道免疫水平。酿酒酵母和芽孢杆菌均有提高肠道免疫作用的能力。
| [1] |
D'COSTA V M, KING C E, KALAN L, et al. Antibiotic resistance is ancient[J]. Nature, 2011, 477(7365): 457-461. DOI:10.1038/nature10388 |
| [2] |
李延, 万津, 晨光, 等. 重组菌丝霉素发酵培养基筛选及重组菌丝霉素在断奶仔猪上的应用[J]. 动物营养学报, 2016, 28(1): 208-216. |
| [3] |
侬天涛. 重金属与金霉素对无公害猪肉生产和环境的影响分析[J]. 当代畜牧, 2014(20): 91-92. |
| [4] |
吕伟, 魏玉明, 齐明, 等. 几种复合微生态饲料添加剂对母猪生产和保育、育肥猪生长发育性能的影响[J]. 畜牧兽医杂志, 2016, 35(2): 4-7, 12. |
| [5] |
陶蕾, 周玉岩, 赵凤舞, 等. 微生物发酵饲料在畜禽养殖中的发展现状及应用[J]. 安徽农业科学, 2015, 43(13): 167-169. DOI:10.3969/j.issn.0517-6611.2015.13.058 |
| [6] |
龙广. 妊娠和泌乳日粮中添加布拉迪酵母菌对母猪及仔猪性能的影响[D]. 硕士学位论文. 武汉: 华中农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10504-1015387669.htm
|
| [7] |
汤飞飞. 母猪妊娠后期和仔猪日粮添加酵母培养物对母猪生产性能、仔猪肠道健康及免疫机能的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013286342.htm
|
| [8] |
SHEN Y B, PIAO X S, KIM S W, et al. Effects of yeast culture supplementation on growth performance, intestinal health, and immune response of nursery pigs[J]. Journal of Animal Science, 2009, 87(8): 2614-2624. DOI:10.2527/jas.2008-1512 |
| [9] |
王蜀金, 陈惠娜, 张正帆, 等. 酿酒酵母对断奶大鼠生产性能、肠道发育、血液理化指标及免疫功能的影响[J]. 家畜生态学报, 2014, 35(10): 41-45. DOI:10.3969/j.issn.1673-1182.2014.10.008 |
| [10] |
WANG S L, GUO C H, ZHOU L, et al. Effects of dietary supplementation with epidermal growth factor-expressing Saccharomyces cerevisiae on duodenal development in weaned piglets[J]. British Journal of Nutrition, 2016, 115(9): 1509-1520. DOI:10.1017/S0007114516000738 |
| [11] |
肖曼, 高振华, 李兴华, 等. 酵母培养物对肉仔鸡生长性能、肠黏膜结构及肠道菌群的影响[J]. 动物营养学报, 2013, 25(7): 1624-1631. |
| [12] |
曹煜成, 李卓佳, 文国樑, 等. 芽孢杆菌胞外产物的研究进展[J]. 广东海洋大学学报, 2005, 25(6): 97-100. |
| [13] |
董尚智, 王国霞, 陈远凤, 等. 饲用地衣芽孢杆菌的生物学特性研究[J]. 饲料研究, 2009(7): 14-18. |
| [14] |
贡筱, 郭俊刚, 吴学壮, 等. 饲粮中添加枯草芽孢杆菌和粪肠球菌对育成期蓝狐生长性能、营养物质消化率及氮代谢的影响[J]. 动物营养学报, 2014, 26(4): 1004-1010. |
| [15] |
裴跃明, 王迎松, 王世磊, 等. 枯草芽孢杆菌制剂对断奶獭兔生长性能和免疫的影响[J]. 饲料研究, 2016(6): 20-23, 28. |
| [16] |
赵娜, 申杰, 魏金涛, 等. 凝结芽孢杆菌对肉鸡生长性能、免疫器官指数、血清生化指标及肠道菌群的影响[J]. 动物营养学报, 2017, 29(1): 249-256. |
| [17] |
秦瑶, 王苇, 郭秉娇, 等. 2株枯草芽孢杆菌对大肠杆菌和沙门氏菌的体外抑菌试验研究[J]. 中国畜牧兽医, 2014, 41(1): 207-210. |
| [18] |
郭孝烨, 史明雷, 郑兰, 等. 复合芽孢杆菌制剂对肉鸡生长性能、盲肠菌群和排泄物氨逸失的影响[J]. 中国畜牧杂志, 2013, 49(11): 70-73. DOI:10.3969/j.issn.0258-7033.2013.11.020 |
| [19] |
华洵璐, 钱仁界, 张宪中, 等. 芽孢杆菌复合制剂对断奶仔猪生长、腹泻和饲料消化率的影响[J]. 安徽农业科学, 2015(3): 166-170. |
| [20] |
陈生龙. 活酵母对断奶仔猪生产性能、免疫功能和肠道微生物区系的影响[D]. 硕士学位论文. 福州: 福建农林大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10389-2009170375.htm
|
| [21] |
胡友军, 林映才, 余德谦, 等. 活性酵母对早期断奶仔猪肠道微生物区系、肠黏膜形态和挥发性盐基氮的影响[J]. 养猪, 2003(4): 3-5. |
| [22] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007.
|
| [23] |
任曼, 霍应峰, 杨凤娟, 等. 仔猪断奶前后肠道形态和相关免疫蛋白基因表达的变化[J]. 动物营养学报, 2014, 26(3): 614-619. |
| [24] |
王全溪, 李丽萍, 林秀妹, 等. 锌对雏番鸭消化道肥大细胞数量的影响[J]. 福建畜牧兽医, 2008(S1): 19-23. |
| [25] |
余国莲, 杜云平, 梁健良, 等. 酵母类饲料添加剂在猪养殖业中的应用[J]. 饲料广角, 2013(17): 41-42. DOI:10.3969/j.issn.1002-8358.2013.17.015 |
| [26] |
蔡锐芳, 李鹏, 张亚智, 等. 活酵母菌对生长育肥猪后期生长性能的影响[J]. 当代畜牧, 2011(6): 28-29. |
| [27] |
黄珂, 刘少娟, 王宏玲, 等. 酵母培养物对育肥猪生产性能和消化率的影响[J]. 饲料研究, 2015(24): 34-35, 50. |
| [28] |
姜军坡, 李毅, 王世英, 等. Z-27菌剂对育肥猪生长性能、肠道酶活力及消化性能的影响[J]. 河南农业科学, 2015, 44(6): 131-136. |
| [29] |
霍永久, 张艳云, 施青青, 等. 芽孢杆菌1259制剂对生长肥育猪生产性能及猪粪氨气产生量的影响[J]. 江苏农业科学, 2012, 40(2): 159-160. |
| [30] |
方美琪. 益生菌的研究进展及其对断奶仔猪的影响[J]. 畜牧兽医科技信息, 2016(2): 10-11. |
| [31] |
朱碧泉, 曹璐, 车炼强, 等. 植物提取物对育肥猪生长性能、胴体性状、猪肉品质及抗氧化能力的影响[J]. 中国饲料, 2011(14): 15-18. DOI:10.3969/j.issn.1004-3314.2011.14.006 |
| [32] |
张玲清. 影响猪消化率的因素分析[J]. 中国畜牧兽医, 2009, 36(9): 174-178. |
| [33] |
BUZZINI P, VAUGHAN-MARTINI A.Yeast biodiversity and biotechnology[M]//ROSA C A, PETER G.Biodiversity and Ecophysiology of Yeasts.Berlin Heidelberg:Springer, 1970:533-559.
|
| [34] |
洪奇华, 陈安国, 黄建平. 富酶活性酵母对仔猪生产性能的影响[J]. 养猪, 2005(2): 7-8. |
| [35] |
刘辉, 季海峰, 王四新, 等. 益生菌对生长猪生长性能、粪便微生物数量、养分表观消化率和血清免疫指标的影响[J]. 动物营养学报, 2015, 27(3): 829-837. |
| [36] |
HÖGBERGAND A, LINDBERG J E. The effect of level and type of cereal non-starch polysaccharides on the performance, nutrient utilization and gut environment of pigs around weaning[J]. Animal Feed Science and Technology, 2006, 127(3/4): 200-219. |
| [37] |
EL AIDY S, VAN DEN BOGERT B, KLEEREBEZEM M. The small intestine microbiota, nutritional modulation and relevance for health[J]. Current Opinion in Biotechnology, 2015, 32: 14-20. DOI:10.1016/j.copbio.2014.09.005 |
| [38] |
MAGALHAES J G, TATTOLI I, GIRARDIN S E. The intestinal epithelial barrier:how to distinguish between the microbial flora and pathogens[J]. Seminars in Immunology, 2007, 19(2): 106-115. DOI:10.1016/j.smim.2006.12.006 |
| [39] |
OSWALD I P. Role of intestinal epithelial cells in the innate immune defence of the pig intestine[J]. Veterinary Research, 2006, 37(3): 359-368. DOI:10.1051/vetres:2006006 |
| [40] |
贺永康. 中草药添加剂对肉鸡生产性能及肠道结构的影响[D]. 硕士学位论文. 保定: 河北农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-11920-2010138753.htm
|
| [41] |
DUNSFORD B R, KNABE D A, HAENSLY W E. Effect of dietary soybean meal on the microscopic anatomy of the small intestine in the early-weaned pig[J]. Journal of Animal Science, 1989, 67(7): 1855-1863. DOI:10.2527/jas1989.6771855x |
| [42] |
姚浪群, 萨仁娜, 佟建明, 等. 安普霉素对仔猪肠道微生物及肠壁组织结构的影响[J]. 畜牧兽医学报, 2003, 34(3): 250-257. |
| [43] |
BAUM B, LIEBLER-TENORIO E M, ENβ M L, et al. Saccharomyces boulardii and Bacillus cereus var. Toyoi influence the morphology and the mucins of the intestine of pigs[J]. Zeitschrift für Gastroenterologie, 2002, 40(5): 277-284. DOI:10.1055/s-2002-30116 |
| [44] |
BONTEMPO V, DI GIANCAMILLO A, SAVOINI G, et al. Live yeast dietary supplementation acts upon intestinal morpho-functional aspects and growth in weanling piglets[J]. Animal Feed Science and Technology, 2006, 129(3/4): 224-236. |
| [45] |
王斌星, 王蜀金, 郭春华, 等. 酿酒酵母发酵液对断奶仔猪生长性能、小肠发育及小肠黏膜免疫功能的影响[J]. 动物营养学报, 2016, 28(12): 4014-4022. |
| [46] |
陈旭东. 果寡糖和芽孢杆菌对断奶仔猪生产性能的影响及其机理[D]. 硕士学位论文. 北京: 中国农业大学, 2004. http://cdmd.cnki.com.cn/article/cdmd-10019-2004078240.htm
|
| [47] |
辛娜, 张乃锋, 刁其玉, 等. 芽孢杆菌制剂对断奶仔猪生长性能、胃肠道发育的影响[J]. 畜牧兽医学报, 2012, 43(6): 901-908. |
| [48] |
邓军. 枯草芽孢杆菌和猪源乳酸杆菌混合饲喂对新生仔猪先天免疫系统的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013283036.htm
|
| [49] |
邹云, 谢红兵, 禹琪芳, 等. 植物多糖对断奶仔猪淋巴细胞增殖和细胞因子分泌的影响[J]. 动物营养学报, 2014, 26(1): 210-218. |
| [50] |
HOFFMANN W. Trefoil factors[J]. Cellular and Molecular Life Sciences, 2005, 62(24): 2932-2938. DOI:10.1007/s00018-005-5481-9 |
| [51] |
寇涛, 吕佳琪, 李伟, 等. 母猪饲粮中添加精氨酸对仔猪肠道免疫细胞数量的影响[J]. 动物营养学报, 2014, 26(8): 2077-2084. |
| [52] |
孙泉, 佘锐萍, 王德成, 等. 肥大细胞在机体防御反应中的作用[J]. 动物医学进展, 2007, 28(8): 83-86. |
| [53] |
李欣, 岳冬辉, 毕岩. sIgA在黏膜免疫中的作用[J]. 河南中医, 2015, 35(12): 3212-3214. |
| [54] |
王晓东, 黄志华. SIgA在肠道免疫中的作用[J]. 国际消化病杂志, 2006, 26(5): 339-341. |
| [55] |
周英, 孙必强, 刘卫东, 等. 七味白术散及提取物对小鼠肠道菌群失调腹泻IL-8表达的影响[J]. 中国微生态学杂志, 2015, 27(9): 1009-1013. |
| [56] |
王亨, 于惠, 余光涛, 等. 益生菌对新生大鼠坏死性小肠结肠炎作用的试验[J]. 中国兽医杂志, 2015, 51(4): 27-30, 50. |
| [57] |
肖宏德. 用益生菌制剂代替断奶仔猪日粮中抗生素的实验研究[D]. 硕士学位论文. 武汉: 华中农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10504-1014213107.htm
|
| [58] |
任大勇. 益生乳酸杆菌的黏附及免疫调节作用研究[D]. 博士学位论文. 长春: 吉林大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10183-1013193885.htm
|
| [59] |
江美玲. 母乳源植物乳杆菌WLPL04的益生评价及其对小鼠免疫和肠道菌群的影响[D]. 硕士学位论文. 南昌: 南昌大学, 2016. http://d.g.wanfangdata.com.cn/Thesis_D01054585.aspx
|
| [60] |
颜玉, 郑强, 姜威, 等. 溃疡性结肠炎大鼠NF-κB及TNF-α的变化及益生菌的作用研究[J]. 黑龙江医药科学, 2012, 35(6): 5-6. |




