2. 南京农业大学动物科技学院, 南京 210095
2. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China
镰刀菌毒素是镰刀菌属真菌在生长过程中产生的各种次级代谢产物的总和,是导致全球饲料业和养殖业经济损失最大的一类霉菌毒素[1],其中最常见的包括玉米赤霉烯酮(ZEN)、呕吐毒素(DON)和伏马菌素(FUM)等[2]。镰刀菌毒素可对动物产生广泛的毒性效应,包括降低动物生产性能和营养物质消化率、导致组织器官的代谢紊乱及对各类细胞的细胞毒性效应等[3-5]。而镰刀菌毒素在经饮食摄入后,被运送到肝脏进行分解代谢[6],因此肝脏的组织形态和功能变化常被作为镰刀菌毒素中毒亚临床诊断的重要依据。前人研究表明,镰刀菌毒素能够引起动物肝脏功能受损[7],导致氧化应激[8]和炎症反应的发生,并且造成肝细胞肿胀变性[9]以及血管管壁增厚和管腔扩张[10]等组织病理学损伤。研究发现肝脏的损伤与细胞因子的增加具有一定的关系[11-12],但镰刀菌毒素引起的断奶仔猪肝脏损伤中细胞因子的表达量变化研究较少,且对肝脏损伤后自然恢复情况的研究也不明确。因此,本试验通过研究镰刀菌毒素对肝脏功能损伤的各项指标及分子水平上细胞因子白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6) mRNA相对表达量的影响,探讨镰刀菌毒素对仔猪肝脏损伤的影响及其自然恢复情况,为养猪生产提供理论依据。
1 材料与方法 1.1 试验动物与设计试验选用体重为(8.45±0.94) kg的35日龄“杜×长×大”雌性仔猪30头,随机分为3组,各组间仔猪初始体重差异不显著(P>0.05) ,每组10个重复,每个重复1头猪。对照组(control group)持续饲喂基础饲粮,镰刀菌毒素组(Fusarium toxins group)持续饲喂镰刀菌毒素污染饲粮(玉米赤霉烯酮0.90 mg/kg,呕吐毒素1.43 mg/kg,烟曲霉毒素5.85 mg/kg);自然恢复组(natural recovery group)在饲喂镰刀菌毒素污染饲粮35 d后,改饲喂基础饲粮。预试期7 d,正试期56 d。仔猪单栏饲养,每栏安装有料槽和乳头式饮水器便于仔猪自由采食和饮水。试验在山东农业大学动物科技学院实验站进行。
1.2 试验饲粮基础饲粮参考NRC(2012) [13]仔猪饲养标准并根据实际生产配制,镰刀菌毒素污染饲粮用霉变玉米和霉变玉米蛋白粉替代50%基础饲粮中的玉米和玉米蛋白粉配制,饲粮组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
所有试验饲粮在试验开始前一次性配齐,试验开始和结束后分别取样,用以分析饲粮中的毒素和粗蛋白质含量[14]。饲粮中玉米赤霉烯酮、黄曲霉毒素(AFL)、伏马毒素和T-2毒素采用酶联免疫吸附试验(ELISA)和荧光技术进行测定,呕吐毒素采用高效液相色谱法(HPLC)测定。试验饲粮中主要霉菌毒素的含量见表 2,黄曲霉毒素和T-2毒素未检出。
|
|
表 2 试验饲粮中主要霉菌毒素的含量 Table 2 Mycotoxins content of experimental diets |
试验结束当天早饲前对仔猪进行前腔静脉空腹采血。血样静置30 min后离心(3 000 r/min、10 min)制备血清,分装于Eppendorf管内,-20 ℃保存,待测。采血后的仔猪电击致死后放血,迅速剖开腹腔,在肝脏右叶内侧相同部位采集2份肝脏组织于冻存管中,迅速置于液氮中,再转入-80 ℃冰箱中保存,用于测定肝脏组织抗氧化指标和RNA的提取。最后分离整个肝脏并称重,计算肝脏相对重量。
肝脏相对重量(g/kg)=肝脏重量(g)/活体重量(kg)。
1.4 测定指标与方法 1.4.1 血清生化指标用Cobus-Mira-Plus全自动生化分析仪进行血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)活性及总蛋白(TP)、球蛋白(GLB)含量的测定,具体方法严格按照试剂盒(南京建成生物工程研究所)说明书进行。
1.4.2 血清和肝脏抗氧化指标称取一定量肝脏组织,在冰面上解冻,按重量体积比为1:9加入生理盐水,冰水浴条件下机械匀浆(10 000~15 000 r/min)后,3 000 r/min离心15 min,吸取上清液备用。血清和肝脏组织匀浆上清液中谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)活性和丙二醛(MDA)含量采用试剂盒检测,试剂盒购自南京建成生物工程研究所。
1.4.3 肝脏炎性细胞因子IL-6、IL-1β mRNA相对表达量肝脏组织总RNA的提取按Trizol试剂盒(TaKaRa, 大连)说明书进行,并用紫外分光光度计测定所提取总RNA的浓度和纯度(OD260/OD280:1.8~2.0) 。根据测得的浓度计算反转录体系中RNA需要量,按照PrimeScript® RT reagent Kit反转录试剂盒(TaKaRa, 大连)说明书反转录合成cDNA,并以此为模板采用实时荧光定量PCR方法测定IL-6和IL-1β mRNA相对表达量。采用SYBR GreenⅠ嵌合荧光法,按照SYBR Premix Ex TaqTM(TliRNaseH Plus)(TaKaRa, 大连)试剂盒的说明配制PCR反应体系:SYBR Premix Ex Taq (TliRNaseH Plus) (2×)10 μL,PCR Forward Primer (10 μmol/L) 0.4 μL,PCR Reverse Primer (10 μmol/L) 0.4 μL,ROX Reference DyeⅡ(50×)0.4 μL,cDNA模板2.0 μL,加dH2O(灭菌双蒸水)6.8 μL至反应总体积为20 μL。IL-1β、IL-6和甘油醛-3-磷酸脱氢酶(GADPH)基因的引物序列见表 3,由生工生物工程(上海)股份有限公司设计并合成。体系混匀离心后在ABI 7500实时荧光定量PCR仪上反应,反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸34 s,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,45个循环。根据所得目的基因和GAPDH的Ct值,利用2-△△Ct法[15]对目的基因的表达进行相对定量。
|
|
表 3 PCR反应的引物序列 Table 3 Primer sequence for PCR |
试验数据采用SAS 9.2统计软件进行单因素方差分析(one-way ANOVA),Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准。
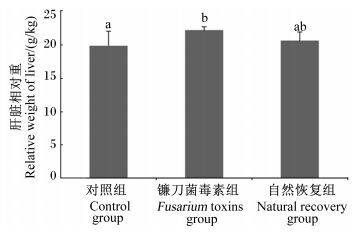
2 结果与分析 2.1 肝脏相对重量的分析由图 1可知,与对照组相比,镰刀菌毒素组的仔猪肝脏相对重量显著高于对照组(P<0.05) 。自然恢复组的仔猪肝脏相对重量低于镰刀菌毒素组而高于对照组,但差异均不显著(P>0.05) 。
|
数据柱标注不同小写字母表示差异显著(P<0.05) 。图 2同。 Value columns with different small letters mean significant difference (P<0.05) . The same as Fig. 2. 图 1 镰刀菌毒素污染饲粮对断奶仔猪肝脏相对重量的影响 Figure 1 Effects of Fusarium toxins contaminated diet on relative weights of liver of weaned gilts |
|
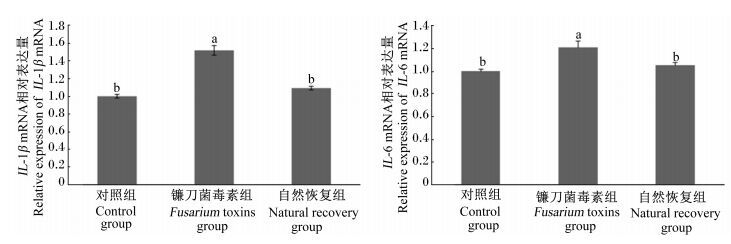
图 2 镰刀菌毒素污染饲粮对断奶仔猪肝脏IL-1β和IL-6 mRNA相对表达量的影响 Figure 2 Effects of Fusarium toxins contaminated diet on relative expression of IL-1β and IL-6 mRNA in liver of weaned gilts |
由表 4可知,与对照组相比,镰刀菌毒素组仔猪血清AST、ALT和ALP活性显著升高(P<0.05) ,血清TP和GLB含量则显著降低(P<0.05) 。与镰刀菌毒素组相比,自然恢复组仔猪血清AST、ALT和ALP活性显著降低(P<0.05) ,血清TP和GLB含量显著升高(P<0.05) ,但仍与对照组有显著差异(P<0.05) 。这说明镰刀菌毒素可造成肝脏蛋白质合成功能损伤,并在停止饲喂镰刀菌毒素污染饲粮后得到一定的恢复。
|
|
表 4 镰刀菌毒素污染饲粮对断奶仔猪血清生化指标的影响 Table 4 Effects of Fusarium toxins contaminated diet on serum biochemical indices of weaned gilts |
由表 5可知,与对照组相比,镰刀菌毒素组仔猪血清GSH-Px、T-SOD活性和肝脏T-SOD活性显著降低(P<0.05) ,血清和肝脏MDA含量显著升高(P<0.05) 。与镰刀菌毒素组相比,自然恢复组仔猪血清T-SOD活性显著升高(P<0.05) ,血清和肝脏MDA含量显著降低(P<0.05) ,且均与对照组差异不显著(P>0.05) 。自然恢复组血清GSH-Px活性和肝脏T-SOD活性与对照组和镰刀菌毒素组差异均不显著(P>0.05) 。这说明镰刀菌毒素造成了仔猪肝脏的氧化损伤,并在饲喂基础饲粮后得到一定程度的改善。
|
|
表 5 镰刀菌毒素污染饲粮对断奶仔猪血清和肝脏抗氧化指标的影响 Table 5 Effects of Fusarium toxins contaminated diet on serum and liver antioxidant indices of weaned gilts |
由图 2可知,与对照组相比,镰刀菌毒素组仔猪肝脏IL-1β和IL-6 mRNA相对表达量显著升高(P<0.05) 。与镰刀菌毒素组相比,自然恢复组仔猪肝脏IL-1β和IL-6 mRNA相对表达量显著降低(P<0.05) ,且与对照组差异不显著(P>0.05) 。
3 讨论本课题组于2013年相继从山东省多个饲料厂和养殖场抽检饲料原料样品共计153个,检测其霉菌毒素含量,从中选择自然霉变玉米和霉变玉米蛋白粉配制镰刀菌毒素污染饲粮,选择毒素水平低于检测限的原料配制基础饲粮。但是遗憾的是,在基础饲粮中依然检测到少量毒素,这进一步说明我国饲料原料普遍受到镰刀菌毒素的污染。由于基础饲粮中各毒素含量均远低于我国饲料卫生标准规定的小于0.5 mg/kg (GB 13078.2—2006) 、1 mg/kg (GB 13078.3—2007) (我国对于饲料中伏马菌素还没有制定相应的限量标准)以及欧盟关于仔猪饲粮中玉米赤霉烯酮、呕吐毒素和伏马菌素小于0.1、0.9和5.0 mg/kg[16]的最高限量规定,且镰刀菌毒素组毒素水平均超过上述标准,因此我们可以认为对照组镰刀菌毒素含量不影响对镰刀菌毒素组结果的判断。
肝脏是人和动物体解毒的重要器官,其功能的变化对动物健康具有重要意义。器官相对重量广泛应用于毒素对动物毒性大小的判断,本试验发现长期饲喂镰刀菌毒素污染饲粮的仔猪肝脏相对重量显著高于对照组,这与给仔猪饲喂镰刀菌毒素饲粮(试验期为35 d)的前期试验结果不同[17],可能是由于摄入镰刀菌毒素的时间延长而导致的肝脏代偿性肿大所致[18]。血清中ALT、AST和ALP活性的改变是肝脏受到损害的一种应答反应[19],血清中TP和GLB含量高低可直接反映肝脏蛋白质合成能力,它们都可作为判断肝脏中毒的指标[20]。有研究表明,用镰刀菌毒素污染的谷物配制的毒素饲粮饲喂仔猪35 d后,仔猪血清AST、ALT活性显著升高,但在正常检测范围内(AST活性:32~84 U/L,ALT活性:31~58 U/L)[21],而病理组织学观察发现肝脏受到了一定的损伤[7]。本试验中镰刀菌毒素组仔猪血清ALT、AST和ALP活性均显著升高,且血清ALT和AST活性仍在正常范围内,说明肝脏受到了一定程度的损伤,但具体损伤的程度还有待进一步研究。同时镰刀菌毒素组仔猪血清TP和GLB的含量显著降低,表明肝脏的蛋白质合成功能受到抑制,进一步说明镰刀菌毒素可使肝脏功能受损。血清T-SOD和GSH-Px活性能够反映机体的抗氧化能力[22-23],MDA是机体脂质氧化的代谢产物[24]。前人对呕吐毒素和玉米赤霉烯酮在细胞的联合毒性上的研究[25-26]表明,镰刀菌毒素能通过损害细胞的抗氧化系统和加速自由基的产生来加速细胞的过氧化反应[27],从而造成某些脏器的氧化损伤。与Jiang等[8]在肉鸡上的试验(黄曲霉毒素102 μg/kg,玉米赤霉烯酮281 μg/kg,伏马菌素5.87 mg/kg,呕吐毒素2.04 mg/kg)结果相似,本试验中镰刀菌毒素组仔猪血清和肝脏中T-SOD和GSH-Px活性显著降低,MDA含量显著升高,表明本试验条件下的镰刀菌毒素引起了仔猪的氧化应激,造成某些脏器包括肝脏在内的氧化损伤。
肝脏受损时,其含有的大量天然免疫细胞和获得性免疫细胞会释放大量细胞因子,并在体内激发一系列的级联反应[28]。研究表明三氯乙烯致敏豚鼠的肝脏损伤中,豚鼠肝脏组织内白细胞介素-1(IL-1) 和IL-6 mRNA表达量升高[29]。本试验中,镰刀菌毒素组肝脏中细胞因子IL-1β和IL-6 mRNA相对表达量均显著增加,从分子水平表明本试验条件下的镰刀菌毒素能够引起肝脏组织中细胞因子IL-1β和IL-6 mRNA相对表达量升高,进而可能导致机体免疫功能的紊乱,最终造成肝细胞的损伤,具体的损伤机制有待进一步研究。
本试验中,饲喂镰刀菌毒素污染饲粮35 d后改饲基础饲粮,仔猪肝脏相对重量有所降低,肝脏功能指标、蛋白质合成能力及抗氧化能力都有所改善,这一结果与谷氨酸和精氨酸等功能性氨基酸及各种霉菌毒素吸附剂在动物上的应用效果相似[30-31],表明仔猪肝脏损伤得到一定程度的缓解;同时,肝脏组织细胞因子IL-1β和IL-6 mRNA相对表达量相比毒素组均显著降低,且与对照组差异不显著,从分子水平上进一步说明镰刀菌毒素引起的仔猪肝脏损伤得到缓解,但具体的作用机制还需要进一步研究。
4 结论本试验条件下,长期饲喂镰刀菌毒素饲粮(玉米赤霉烯酮0.90 mg/kg,呕吐毒素1.43 mg/kg,伏马菌素5.85 mg/kg)能够造成仔猪肝脏损伤,影响肝脏的抗氧化、蛋白质合成和免疫功能,而经过21 d恢复期,仔猪肝脏抗氧化和免疫功能得到了一定程度的改善。
| [1] |
WOOD G E. Mycotoxins in foods and feeds in the United States[J]. Journal of Animal Science, 1992, 70(12): 3941-3949. DOI:10.2527/1992.70123941x |
| [2] |
龚阿琼, 戴晋军, 胡骏鹏. 2016年我国饲料原料及其毒素检测分析[J]. 中国饲料, 2017(4): 38-39. |
| [3] |
SWAMY H V L N, SMITH T K, MACDONALD E J, et al. Effects of feeding a blend of grains naturally contaminated with Fusarium mycotoxins on growth and immunological measurements of starter pigs,and the efficacy of a polymeric glucomannan mycotoxin adsorbent[J]. Journal of Animal Science, 2003, 81(11): 2792-2803. DOI:10.2527/2003.81112792x |
| [4] |
GRENIER B, LOUREIRO-BRACARENSE A P, LUCIOLI J, et al. Individual and combined effects of subclinical doses of deoxynivalenol and fumonisins in piglets[J]. Molecular Nutrition & Food Research, 2011, 55(5): 761-771. |
| [5] |
GETEZ J R, PINTON P, CALLU P, et al. Deoxynivalenol alone or in combination with nivalenol and zearalenone induce systemic histological changes in pigs[J]. Experimental and Toxicologic Pathology, 2015, 67(2): 89-98. DOI:10.1016/j.etp.2014.10.001 |
| [6] |
DÄNICKE S, BRVSSOW K P, VALENTA H, et al. On the effects of graded levels of Fusarium toxin contaminated wheat in diets for gilts on feed intake,growth performance and metabolism of deoxynivalenol and zearalenone[J]. Molecular Nutrition & Food Research, 2005, 49(10): 932-943. |
| [7] |
TIEMANN U, BTVSSOW K P, KVCHENMEISTER U, et al. Influence of diets with cereal grains contaminated by graded levels of two Fusarium toxins on selected enzymatic and histological parameters of liver in gilts[J]. Food and Chemical Toxicology, 2006, 44(8): 1228-1235. DOI:10.1016/j.fct.2006.01.021 |
| [8] |
JIANG S Z, LI Z, WANG G Y, et al. Effects of Fusarium mycotoxins with yeast cell wall absorbent on hematology,serum biochemistry,and oxidative stress in broiler chickens[J]. The Journal of Applied Poultry Research, 2014, 23(2): 165-173. DOI:10.3382/japr.2013-00830 |
| [9] |
何健.自然霉变玉米对肉鸭生产性能和免疫功能的影响及机制研究[D].博士学位论文.雅安:四川农业大学,2011.
|
| [10] |
CHEN F, MA Y, XUE C Y, et al. The combination of deoxynivalenol and zearalenone at permitted feed concentrations causes serious physiological effects in young pigs[J]. Journal of veterinary Science, 2008, 9(1): 39-44. DOI:10.4142/jvs.2008.9.1.39 |
| [11] |
HINTON D M, MYERS M J, RAYBOURNE R A, et al. Immunotoxicity of aflatoxin B1 in rats:effects on lymphocytes and the inflammatory response in a chronic intermittent dosing study[J]. Toxicological Sciences, 2003, 73(2): 362-377. DOI:10.1093/toxsci/kfg074 |
| [12] |
TACKE F, LYEDDE T, TTAUTWEIN C. Inflammatory pathways in liver homeostasis and liver injury[J]. Clinical Reviews in Allergy & Immunology, 2009, 36(1): 4-12. |
| [13] |
National Research Council. Nutrient requirements of swine[M]. 11th ed. Washington,D.C.: National Academy Press, 2012.
|
| [14] |
张丽英. 饲料分析及饲料质量检测技术[M]. 2版. 北京: 中国农业大学出版社, 2003.
|
| [15] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [16] |
COMMISSION E U. Commission Recommendation 2006/576/EC of 17 August 2006 on the presence of deoxynivalenol,zearalenone,ochratoxin A,T-2 and HT-2 and fumonisins in products intended for animal feeding[J]. Official Journal of the European Union, 2006, 229: 7-9. |
| [17] |
陈宁波, 张崇玉, 姜淑贞, 等. 镰刀菌毒素对断奶仔猪血清酶、肝脏抗氧化功能及组织病理学的影响[J]. 中国畜牧兽医, 2015, 42(9): 2384-2390. |
| [18] |
刘玉兰, 黄晶晶, 范伟, 等. L-精氨酸对脂多糖刺激断奶仔猪生产性能,血液生化指标和内脏器官重量的影响[J]. 动物营养学报, 2008, 20(2): 140-145. |
| [19] |
AYZA N J, WILLIAM G D, MICHAEL J M, et al. Diagnosis and treatment of copper toxicosis in ruminants[J]. Journal of the American Veterinary Medical Association, 1999, 214(11): 1624-1628. |
| [20] |
SHI Y H, XU Z R, FENG J L, et al. Efficacy of modified montmorillonite nanocomposite to reduce the toxicity of aflatoxin in broiler chicks[J]. Animal Feed Science and Technology, 2006, 129(1/2): 138-148. |
| [21] |
KANEKO J J, HATVEY J W, BRUSS M. Clinical biochemistry of domestic animals[M]. San Diego: Gulf Professional Publishing, 1997.
|
| [22] |
CHEUNG C C C, ZHENG G J, LI A M Y, et al. Relationships between tissue concentrations of polycyclic aromatic hydrocarbons and antioxidative responses of marine mussels,Perna viridis[J]. Aquatic Toxicology, 2001, 52(3/4): 189-203. |
| [23] |
闫俊书, 单安山, 王环宇. 五味子提取物对AA肉仔鸡抗氧化功能的影响[J]. 中国畜牧杂志, 2008, 44(17): 33-37. |
| [24] |
DRÖGE W. Free radicals in the physiological control of cell function[J]. Physiological Reviews, 2002, 82(1): 47-95. DOI:10.1152/physrev.00018.2001 |
| [25] |
KOUADIO J H, MOBIO T A, BAUDRIMONT I, et al. Comparative study of cytotoxicity and oxidative stress induced by deoxynivalenol,zearalenone or fumonisin B1 in human intestinal cell line Caco-2[J]. Toxicology, 2005, 213(1/2): 56-65. |
| [26] |
苏军.镰刀菌毒素对猪的抗营养效应及其机制研究[D].博士论学位文.雅安:四川农业大学,2008.
|
| [27] |
MCLEAN M. The phytotoxicity of Fusarium metabolites:An update since 1989[J]. Mycopathologia, 1996, 133(3): 163-179. DOI:10.1007/BF02373024 |
| [28] |
王凯.IL-6在炎症性肠病大鼠脑,结肠组织中表达及信号转导机制研究[D].博士学位论文.长春:吉林大学,2010.
|
| [29] |
冯晓亮.三氯乙烯致敏豚鼠肝组织中细胞因子TNF-α、IL-1、IL-6、IL-8水平研究[D].硕士学位论文.合肥:安徽医科大学,2009.
|
| [30] |
陈明洪, 段杰林, 尹杰, 等. 谷氨酸和精氨酸对饲喂霉变饲粮育肥猪所受损伤的缓解作用[J]. 动物营养学报, 2013, 25(9): 2101-2110. |
| [31] |
邓波, 万晶, 徐子伟, 等. 脱氧雪腐镰刀菌烯醇吸附剂对断奶仔猪生长性能、血清生化指标及肠道形态的影响[J]. 动物营养学报, 2014, 26(5): 1294-1301. |




