2. 生百兴业有限公司, 宜兰 26047
2. Life Rainbow Biotech Co., Ltd., Yilan 26047, China
玉米赤霉烯酮(zearalenone,ZEA)又称F-2毒素[1],是由谷物副产品和其他常见食物中的镰刀菌真菌生长产生的非甾体雌激素霉菌毒素[2]。调查显示,全世界动物饲料受ZEA污染严重[2]。研究发现,ZEA及其代谢产物如α-ZEA的主要毒性是其雌激素作用对后备母猪的生殖器官和繁殖的影响[3-5]。研究表明,用被ZEA污染的饲粮饲喂试验动物,作为抵御天然毒素的第一道屏障——胃肠道便暴露在ZEA中,成为ZEA首先作用的靶器官[6]。相关研究表明,猪采食低剂量ZEA (400 μg/kg)污染饲粮,肠黏膜形态结构无显著变化,但是囊泡中黏蛋白浓度和杯状细胞的活性提高,淋巴细胞浸润,同时小肠隐窝底部潘氏细胞和内分泌细胞活性增加,说明小肠黏膜局部防御机制已被调动[7]。经体内外试验研究发现,ZEA能抑制仔猪小肠细胞增殖并损害仔猪上皮细胞抗氧化系统使细胞受损[8]。由于ZEA对饲料的污染和对养殖业畜禽生产性能的影响日益严重,但是目前ZEA对动物消化道(小肠)功能影响的研究报道甚少,且不全面、系统。因此,本试验旨在从形态学角度探讨ZEA对断奶母仔猪血清酶、代谢产物和肠道形态的影响,为断奶母仔猪的实际生产提供科学的参考依据,也为进一步开展缓解其危害营养措施的研究打下基础。
1 材料与方法 1.1 试验材料本课题组从山东省多个饲料厂和养殖场抽检饲料原料样品,检测其霉菌毒素含量,调查霉菌毒素污染状况,从中选择毒素水平低于检测限的原料配制基础饲粮。ZEA纯品由以色列Fermentek公司生产,纯度保证值为98%。
1.2 试验动物与饲养管理选用28日龄、健康、平均体重(14.01±0.86) kg的三元杂交(杜×长×大)雌性断奶仔猪40头,随机分成4个组,每组10个重复,每个重复1头猪,各组间初始体重差异不显著(P>0.05) 。试验仔猪单栏饲养,自由采食和饮水。对照组饲喂基础饲粮(ZEA实测含量为0) ,试验1组、试验2组和试验3组饲喂在基础饲粮中添加0.5、1.0和1.5 mg/kg ZEA的试验饲粮[ZEA实测含量分别为(0.52±0.07) mg/kg、(1.04±0.03) mg/kg和(1.51±0.13) mg/kg]。预试期10 d,正试期35 d。所有试验饲粮在试验开始前一次性配齐,于干燥阴凉处保存。试验基础饲粮营养水平参考NRC (2012) 标准配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis)% |
在试验第35天仔猪全部屠宰,剖开腹腔,在肠道中段剪取10 cm左右的样品,用生理盐水洗净血液并将样品均匀裁切成2段,一段置于Bouin’s液中固定,待做苏木精-伊红(HE)染色和肠道形态测定。
1.4 检测指标及方法 1.4.1 饲粮中毒素的检测在试验开始前和结束后分别取样,用以分析饲粮中的毒素和粗蛋白质含量[9]。ZEA的测定采用酶联免疫吸附(ELISA)和荧光测定法。ZEA最低检测限为0.1 mg/kg,2次均未检测到其他毒素或者低于检测限水平。
1.4.2 血液的采集、处理与血清酶和代谢产物的测定于试验第35天晨饲前,每个重复随机选取断奶仔猪1头,使用真空促凝管采集血液15 mL。37 ℃水浴静置10 min,3 000 r/min下离心10 min,分离血清,-20 ℃保存待测,采用全自动生化分析仪(COBAS MIRA Plus,瑞士罗士公司)测定血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)和乳酸脱氢酶(LDH)活性以及总蛋白、尿素氮、总胆固醇、总甘油三酯、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)含量。
1.4.3 HE染色和肠道形态测定取Bouin’s液中固定好的脾脏组织进行流水冲洗,经乙醇逐级脱水,二甲苯透明,石蜡包埋制成石蜡组织块,用切片机(LEICA RM2135,德国)进行切片,片厚5 μm。将制备好的石蜡切片经二甲苯脱蜡,梯度酒精至蒸馏水。苏木素染色10 min;盐酸酒精分化5 s,自来水中蓝化15 min;伊红染色10 s,经95%乙醇、100%乙醇脱水,二甲苯透明,中性树胶封片,明视野显微镜下观察。用日本Nikon Eclipse 80i显微照相系统进行图像采集,使用Motic images 2000 1.3软件对仔猪的肠道绒毛高度及隐窝深度进行测量,每张切片测定15根最长、伸展良好、走向平直且完好的绒毛,测量绒毛高度,并测定绒毛周围相邻的隐窝深度,求取平均值,计算绒毛高度/隐窝深度值。
1.5 数据统计与分析试验数据采用SAS 9.2软件进行单因素方差分析(one-way ANOVA),用Duncan氏法进行多重比较,试验结果采用“平均值±标准差”表示,以P<0.05作为差异显著性判断标准。
2 结果与分析 2.1 不同水平ZEA对断奶母仔猪血清酶和代谢产物的影响不同水平ZEA对断奶母仔猪血清酶的影响见表 2。与对照组相比,试验1组血清AST和LDH活性显著升高(P<0.05) ,试验2组血清AST和LDH活性显著高于试验1组(P<0.05) ,试验3组血清AST和LDH活性又显著高于试验2组(P<0.05) 。与对照组相比,试验组血清ALP活性均显著升高(P<0.05) 。
|
|
表 2 不同水平ZEA对断奶母仔猪血清酶的影响 Table 2 Effects of different levels of ZEA on serum enzymes of weaned gilts (n=10) |
不同水平ZEA对仔猪血清代谢产物的影响见表 3。与对照组相比,试验2组血清总胆固醇含量显著升高(P<0.05) ;试验3组血清总胆固醇、HDL和尿素氮含量显著升高(P<0.05) ,而血清总蛋白含量显著下降(P<0.05) 。
|
|
表 3 不同水平ZEA对断奶母仔猪血清代谢产物的影响 Table 3 Effects of different levels of ZEA on serum metabolites of weaned gilts (n=10) |
血清酶和代谢产物的试验结果表明,ZEA能够在一定程度上影响断奶仔猪的健康生长。
2.2 不同水平ZEA对断奶母仔猪肠道形态的影响不同水平ZEA对断奶母仔猪肠道形态的影响见表 4。与对照组相比,饲粮中添加ZEA显著提高十二指肠的绒毛高度(P<0.05) ,1.5 mg/kg ZEA显著提高十二指肠的隐窝深度(P<0.05) ,0.5和1.0 mg/kg ZEA显著提高十二指肠的绒毛高度/隐窝深度值(P<0.05) 。各试验组仔猪空肠的绒毛高度和隐窝深度显著高于对照组(P<0.05) ,饲粮中添加0.5和1.0 mg/kg ZEA显著降低空肠的绒毛高度/隐窝深度值(P<0.05) 。与对照组相比,饲粮中添加0.5和1.0 mg/kg ZEA显著提高仔猪回肠绒毛高度和绒毛高度/隐窝深度值(P<0.05) 。以上结果说明ZEA对断奶母仔猪肠道造成一定程度的影响。
|
|
表 4 不同水平ZEA对断奶母仔猪肠道形态的影响 Table 4 Effects of different levels of ZEA on intestinal morphology of weaned gilts |
不同水平ZEA对断奶母仔猪十二指肠形态的影响见图 1。结果表明,对照组十二指肠绒毛排列紧密有序,小肠腺丰富,十二指肠腺发达,黏膜层较厚,肠黏膜上皮细胞的轮廓清晰、染色鲜明、排列规则;而试验组十二指肠的组织学形态发生了明显变化,肠绒毛明显变长且排列疏松无序,小肠腺数量减少,黏膜厚度变薄。十二指肠组织切片照片从形态学上证明ZEA对断奶母仔猪十二指肠造成了一定的影响。
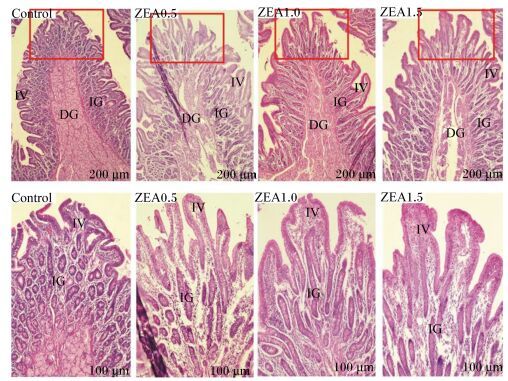
|
IV:小肠绒毛;IG:小肠腺;DG:十二指肠腺。Control:对照组;ZEA0.5:试验1组;ZEA1.0:试验2组;ZEA1.5:试验3组。200 μm表示在10×4的放大倍数下拍的照片;100 μm表示在10×10的放大倍数下拍的照片。下图同。 IV: intestinal villi; IG: intestinal glands; DG: duodenal glands. Control: control group; ZEA0.5: experimental group 1; ZEA1.0: experimental group 2; ZEA1.5: experimental group 3. 200 μm said under 10×4 original magnification photographs and 100 μm said under 10×10 original magnification photographs. The same as below. 图 1 不同水平ZEA对断奶母仔猪十二指肠形态的影响 Figure 1 Effects of different levels of ZEA on duodenum morphology of weaned gilts |
不同水平ZEA对断奶母仔猪空肠形态的影响见图 2。结果表明,对照组空肠绒毛排列紧密,小肠腺丰富。与对照组相比,试验组空肠绒毛长度明显增长且差异显著,绒毛直径较大,小肠腺减少,并且试验2组和试验3组空肠上皮脱落固有层裸露(黄圈)。空肠组织切片照片从形态学上证明ZEA对空肠造成了组织病理损伤。
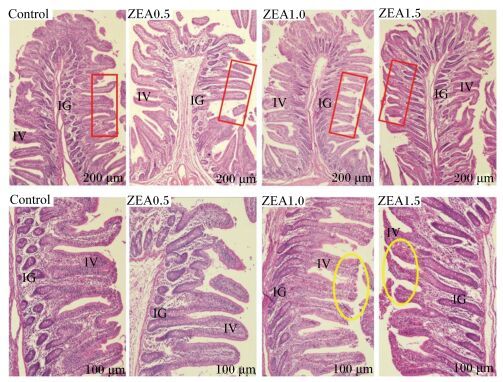
|
黄圈表示发生病变的肠绒毛 Yellow circles indicated lesion villus area。 图 2 不同水平ZEA对断奶母仔猪空肠形态的影响 Figure 2 Effects of different levels of ZEA on jejunum morphology of weaned gilts |
不同水平ZEA对断奶母仔猪回肠形态的影响见图 3。结果表明,与对照组相比,试验1组和试验2组回肠的肠绒毛变长,小肠腺无显著变化,且黏膜下层内的弥散淋巴细胞增多。回肠组织切片照片从形态学上证明ZEA对回肠造成了影响。
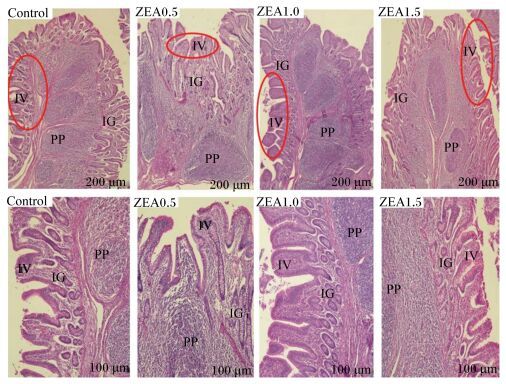
|
PP:集合淋巴小结 Peyerr’s patch。 图 3 不同水平ZEA对断奶母仔猪回肠形态的影响 Figure 3 Effects of different levels of ZEA on ileum morphology of weaned gilts |
本试验采用纯品ZEA配制ZEA污染饲粮,并且试验中使用的饲料原料都进行了精挑细选,但是由于霉菌毒素污染的普遍性[10-11],在各组饲粮中仍然检测到了呕吐毒素(DON)和黄曲霉毒素(AFL)的存在。由于本试验中各组饲粮中DON和AFL毒素含量均远低于我国饲料卫生标准规定的小于1.0 mg/kg[12]、10 μg/kg[13]以及欧盟关于仔猪饲粮中DON和AFL小于0.9和0.02 mg/kg[14]的最高限量规定,且试验组ZEA含量远超过上述标准,因此各个试验组的DON和AFL毒素水平不影响试验组结果的判断,我们可以认为本试验仔猪肠道形态的变化主要是由ZEA引起的。本研究生长性能的结果显示,各组间断奶仔猪末重、平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)差异均不显著[15]。
3.1 不同水平ZEA对断奶母仔猪血清酶和代谢产物的影响血清酶(ALT、AST、ALP和LDH)活性高低可以作为肝健康和应激反应的一个重要标志[16-17]。血清中ALT参与谷氨酸与丙酮酸之间的转氨作用,AST催化谷氨酸与草酰乙酸之间的转氨作用,ALP在骨骼形成的过程中起着重要作用,同时参与脂肪和蛋白质代谢[18-19]。本试验中,试验组断奶仔猪的血清AST、ALP和LDH活性显著高于对照组。研究发现,ZEA (40 mg/kg BW)能显著升高小鼠血清中ALT、AST和ALP活性[20];同时相关试验证明ZEA (1 mg/kg)能升高断奶仔猪血清中的AST、ALT和ALP活性[5],这与本试验结果一致。血清代谢产物是反映机体全身或局部代谢变化和组织生理功能的较为敏感的指标[21]。血清总蛋白含量的高低说明组织蛋白的合成能力以及组织器官的生长,血清尿素氮含量与体内蛋白质和氨基酸之间的平衡及肌肉组织的增长状况成负相关,血清HDL含量能反映脂类物质在体内的分解和转运状况,且在肝脏和小肠内合成。本试验中,试验组断奶仔猪血清中的总蛋白含量显著降低,而尿素氮、总胆固醇和HDL含量显著高于对照组。研究发现,用ZEA污染的饲粮饲喂断奶小母猪,其血液中的胆固醇含量显著升高而HDL显著降低[22]。研究发现,ZEA能够通过减少血液中总蛋白含量造成肝脏损伤,从而影响蛋白质和DNA的合成[23]。由此可推测ZEA能够一定程度上造成断奶仔猪肝脏细胞膜损伤,进而可能导致肝脏的组织损伤。血清酶和血清代谢产物的试验结果表明,ZEA能够影响断奶仔猪的健康生长。但是,ZEA影响断奶仔猪健康生长的机制尚需进一步证实。
3.2 不同水平ZEA对断奶母仔猪肠道形态的影响ZEA在动物体内代谢的主要场所是肠道和肝脏,不同物种的主要代谢场所和代谢过程有显著性差异。据报道,兔主要代谢场所为肝脏,ZEA在肝脏内被还原为α-玉米赤霉烯醇(ZEL)和β-ZEL[24]。而在人和猪上,主要在小肠细胞处进行ZEA代谢,并将其转化为α-ZEA、β-ZEA、α-ZEL和β-ZEL[25]。研究表明,小肠黏膜形态结构及功能由肠绒毛高度、隐窝深度和绒毛高度/隐窝深度值直接反映[26]。肠道作为猪代谢ZEA的主要器官,在代谢过程中ZEA (1.04 mg/kg)导致猪的小肠的形态发生了肠绒毛缩短和分支不全等变化[27]。本试验中,各试验组仔猪的十二指肠、空肠和回肠的绒毛高度、隐窝深度和绒毛高度/隐窝深度值都有所增大,表明ZEA对仔猪肠道造成了一定程度的影响。
断奶仔猪营养物质吸收和转运的主要部位是小肠,养分吸收的主要场所是小肠绒毛,绒毛上皮细胞是消化吸收的功能细胞,小肠黏膜形态结构的完整是保证仔猪正常消化吸收的基础[26, 28]。并且肠道形态在反映肠道消化吸收功能的同时也是反映动物健康状况的重要指标[29]。经研究发现,来自环境、霉菌毒素、养分缺失、生理、心理等因素,经常导致肠道形态发生严重损伤,降低营养物质的消化率,对生物产生危害[29-32]。据报道,食糜和肠道黏膜表面直接接触,因此来自食糜的各种反应能够及时通过肠道黏膜的形态变化来反映[33]。研究发现ZEA能够对小肠黏膜的防御机制产生影响,这在猪采食低浓度污染的饲粮对肠黏膜影响的试验已经得到证实[7]。相关体内外试验也表明,ZEA能通过抑制仔猪小肠细胞增殖、损害小肠抗氧化系统并导致小肠结构异常,通过下调相关消化酶及转运载体基因的表达,导致养分吸收降低、生产性能下降,表现出抗营养效应[8, 34]。在本试验中,各试验组的十二指肠的组织学形态发生了明显变化,肠绒毛明显变长且排列疏松无序,小肠腺数量减少,黏膜厚度变薄;空肠绒毛长度明显增长且差异显著,绒毛直径较大,小肠腺减少,并且试验2组和试验3组肠上皮脱落固有层裸露;试验1组和试验2组回肠的肠绒毛变长,小肠腺无显著变化,且黏膜下层内的弥散淋巴细胞增多。ZEA减少小肠腺的数量降低了肠道对能量和营养物质的消耗,而提高绒毛高度增加了小肠的消化吸收能力,从而改善仔猪的生产性能。这与前人的研究结果一致,从形态学水平说明ZEA对仔猪肠道造成显著影响,但是ZEA在肠道上作用的具体反应机制尚不清楚,这是我们现在正在深入研究和探索的目标。
4 结论在本试验条件下,ZEA (0.5、1.0和1.5 mg/kg)污染饲粮显著影响了断奶仔猪血清酶活性和血清代谢产物含量以及十二指肠、空肠和回肠的绒毛高度、隐窝深度、绒毛高度/隐窝深度值及其肠绒毛的组织形态,说明ZEA可以通过改变断奶仔猪的血清酶活性、血清代谢产物含量和肠道形态来影响断奶仔猪的健康生长。
| [1] |
程传民, 柏凡, 李云, 等. 2013年玉米赤霉烯酮在饲料原料中的污染分布规律[J]. 中国畜牧杂志, 2014, 50(16): 68-72. DOI:10.3969/j.issn.0258-7033.2014.16.014 |
| [2] |
ZINEDINE A, SORIANO J M, MOLTÍ J C, et al. Review on the toxicity,occurrence,metabolism,detoxification,regulations and intake of zearalenone:an oestrogenic mycotoxin[J]. Food and Chemical Toxicology, 2007, 45(1): 1-18. DOI:10.1016/j.fct.2006.07.030 |
| [3] |
YOUNG L G, PING H, KING G J. Effects of feeding zearalenone to sows on rebreeding and pregnancy[J]. Journal of Animal Science, 1990, 68(1): 15-20. DOI:10.2527/1990.68115x |
| [4] |
ETIENNE M, DOURMAD J Y. Effects of zearalenone or glucosinolates in the diet on reproduction in sows:a review[J]. Livestock Production Science, 1994, 40(2): 99-113. DOI:10.1016/0301-6226(94)90040-X |
| [5] |
JIANG S Z, YANG Z B, YANG W R, et al. Effects of feeding purified zearalenone contaminated diets with or without clay enterosorbent on growth,nutrient availability,and genital organs in post-weaning female pigs[J]. Asian-Australasian Journal of Animal Sciences, 2010, 23(1): 74-81. |
| [6] |
PRELUSKY D B,TRENHOLM H L,ROTTER B A,et al.Biological fate of fumonisin B1 in food-producing animals[M]//JACKSON J S,DEVRIES J W,BULLERMAN L B,eds.Fumonisins in food.US:Springer,1996:265-278.
|
| [7] |
OBREMSKI K, GAJECKA M, ZIELONLXA L, et al. Morphology and ultrastructure of small intestine mucosa in gilts with zearalenone mycotoxicosis[J]. Polish Journal of Veterinary Sciences, 2005, 8(4): 301-307. |
| [8] |
苏军.镰刀菌毒素对猪的抗营养效应及其机制研究[D].博士学位论文.雅安:四川农业大学,2008.
|
| [9] |
张丽英. 饲料分析及饲料质量检测技术[M]. 2版. 北京: 中国农业大学出版社, 2003.
|
| [10] |
韩振海, 欧长波, 于思玉, 等. 呕吐毒素、烟曲霉毒素和玉米赤霉烯酮对畜禽的危害及防治进展[J]. 中国家禽, 2016, 38(18): 42-46. |
| [11] |
陈茹. 国内外饲料真菌毒素限量规定及评析[J]. 中国饲料, 2013(17): 38-42. |
| [12] |
中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 13078.3-2007配合饲料中脱氧雪腐镰刀菌烯醇的允许量[S].北京:中国标准出版社,2007.
|
| [13] |
中华人民共和国国家质量监督检验检疫总局,中国家标准化管理委员会.GB 13078.2-2006饲料卫生标准饲料中赭曲霉毒素A和玉米赤霉烯酮的允许量[S].北京:中国标准出版社,2006.
|
| [14] |
European Commission. Commission recommendation of 17 August 2006 on the presence of deoxynivalenol,zearalenone,ochratoxin A,T-2 and HT-2 and fumonisins in products intended for animal feeding[J]. Official Journal of the European Union, 2006, 229: 7-9. |
| [15] |
杨立杰, 王淑静, 杨维仁, 等. 玉米赤霉烯酮对断奶小母猪生产性能、血清抗氧化功能和免疫功能的影响[J]. 动物营养学报, 2017, 29(8): 2843-2850. |
| [16] |
MANEN C A, COSTA M, SIPES I G, et al. Further evidence of cyclic amp-mediated hypertrophy as a prerequisite of drug-specific enzyme induction[J]. Biochemical Pharmacology, 1978, 27(2): 219-224. DOI:10.1016/0006-2952(78)90304-0 |
| [17] |
CHENG W H, VALENTINE B A, LEI X G. High levels of dietary vitamin E do not replace cellular glutathione peroxidase in protecting mice from acute oxidative stress[J]. Journal of Nutrition, 1999, 129(11): 1961-1967. |
| [18] |
高海霞.中草药添加剂对香猪生长性能、肉品质及血液生化指标的影响[D].硕士学位论文.兰州:甘肃农业大学,2010. http://www.xueweilunwen.com/doc/364510
|
| [19] |
王石.谷朊粉酶解物对断奶仔猪生长性能、免疫功能和小肠发育的影响[D].硕士学位论文.郑州:河南工业大学,2011.
|
| [20] |
SALAH-ABBÈS J B, ABBÈS S, OUANES Z, et al. Tunisian radish extract (Raphanus sativus) enhances the antioxidant status and protects against oxidative stress induced by zearalenone in Balb/c mice[J]. Journal of Applied Toxicology, 2008, 28(1): 6-14. DOI:10.1002/(ISSN)1099-1263 |
| [21] |
汪水平, 杨大盛, 李艳莎, 等. 葡萄籽提取物原花青素对肉兔抗氧化功能、脂质含量及血清代谢产物浓度的影响[J]. 中国粮油学报, 2014, 29(10): 72-76. |
| [22] |
JIANG S Z, YANG Z B, YANG W R, et al. Physiopathological effects of zearalenone in post-weaning female piglets with or without montmorillonite clay adsorbent[J]. Livestock Science, 2010, 131(1): 130-136. DOI:10.1016/j.livsci.2010.02.022 |
| [23] |
ABID-ESSEFI S, OUANES Z, HASSEN W, et al. Cytotoxicity,inhibition of DNA and protein syntheses and oxidative damage in cultured cells exposed to zearalenone[J]. Toxicology in Vitro, 2004, 18(4): 467-474. DOI:10.1016/j.tiv.2003.12.011 |
| [24] |
GAJECKI M. Zearalenone-undesirable substances in feed[J]. Polish Journal of Veterinary Sciences, 2002, 5(2): 117-122. |
| [25] |
BIEHL M L, PRELUSKY D B, KORITZ G D, et al. Biliary excretion and enterohepatic cycling of zearalenone in immature pigs[J]. Toxicology and Applied Pharmacology, 1993, 121(1): 152-159. DOI:10.1006/taap.1993.1140 |
| [26] |
李美君, 方成堃, 张凯, 等. 饲粮中添加乳铁蛋白对早期断奶仔猪生长性能、肠道菌群及肠黏膜形态的影响[J]. 动物营养学报, 2012, 24(1): 111-116. |
| [27] |
冷波.玉米赤霉烯酮对断奶仔猪小肠ghrelin、PCNA和Hsp70表达的影响[D].硕士学位论文.泰安:山东农业大学,2016.
|
| [28] |
KERNÉIS S, BOGDANOVA A, KRAEHENBUHL J P, et al. Conversion by Peyer's patch lymphocytes of human enterocytes into M cells that transport bacteria[J]. Science, 1997, 277(5328): 949-952. DOI:10.1126/science.277.5328.949 |
| [29] |
PLUSKE J R.Morphological and functional changes in the small intestine of the newly-weaned pig[M]//PIVA A,BACH K K E,LINDBERG J E.Gut environment of pigs.Nottingham:Nottingham University Press,2001:1-27.
|
| [30] |
OSSELAERE A, SANTOS R, HAUTEKIET V, et al. Deoxynivalenol impairs hepatic and intestinal gene expression of selected oxidative stress,tight junction and inflammation proteins in broiler chickens,but addition of an adsorbing agent shifts the effects to the distal parts of the small intestine[J]. PLoS One, 2013, 8(7): e69014. DOI:10.1371/journal.pone.0069014 |
| [31] |
QUINTEIRO-FILHO W M, RIBEIRO A, FERRAZ-DE-PAULA V, et al. Heat stress impairs performance parameters,induces intestinal injury,and decreases macrophage activity in broiler chickens[J]. Poultry Science, 2010, 89(9): 1905-1914. DOI:10.3382/ps.2010-00812 |
| [32] |
蒋竹英, 李丽立, 唐利华, 等. DON污染饲粮添加竹炭和竹醋液对断奶仔猪抗氧化性能及小肠黏膜形态的影响[J]. 西北农林科技大学学报:自然科学版, 2013, 41(12): 37-42. |
| [33] |
XU Z R, HU C H, XIA M S, et al. Effects of dietary fructooligosaccharide on digestive enzyme activities,intestinal microflora and morphology of male broilers[J]. Poultry Science, 2003, 82(6): 1030-1036. DOI:10.1093/ps/82.6.1030 |
| [34] |
HAUPTMAN K, TICHY' F, KNOTEK Z. Clinical diagnostics of hepatopathies in small mammals:evaluation of importance of individual methods[J]. Acta Veterinaria Brno, 2001, 70(3): 297-311. DOI:10.2754/avb200170030297 |




