肠球菌是人类和动物肠道正常菌群的一部分,既往认为肠球菌是对人类和动物无公害的共栖菌,但近年来研究证实肠球菌属的部分种属的菌株对人和动物有致病力,并且这些菌株引发的感染病例数量也在不断上升,已成为医院感染的常见条件致病菌,此外,越来越多的研究证实屎肠球菌(Enterococcus faecium)与临床上的一些病理学有关系,如菌血症、不定期心内膜炎和脓肿[1]。尽管,过去几十年益生菌的安全性评价是重要的研究热点,目前对屎肠球菌的安全性评价研究主要通过体外试验,如溶血性、毒力基因、抗生素抗性和产有毒代谢产物等;但是,很多情况下体外安全性评价的结果往往不能真实反映其体内的效果,而目前对体内的安全性评价的研究很少且不系统,并且至今仍没有益生菌体内安全性评价的标准和指南。目前食品用益生菌的临床前体内安全性评价包括急性毒性和亚慢性毒性试验,其中亚慢性毒性试验的检测指标主要有动物活跃状态、腹泻分数(毒性临床症状)和生长性能等[2-3],并且很多研究者也将这些指标用于安全性评价研究[4-5]。细菌易位是益生菌安全性评价又一被推荐使用的指标[6-7],因为它是很多内源性条件致病菌发病的第1步。肝脏、脾脏肿大和其他脏器的实质性病变是反映感染性和致病性的间接指标,肠道黏膜的完整性在阻止潜在致病菌或有毒物质侵袭全身组织上发挥重要的屏障作用,因而也作为安全性评价指标使用[8]。目前无论文献报道结果还是市场实践,均显示益生菌针对畜禽发挥益生功效的日常添加量为每克基础饲粮添加1×106 CFU的活性菌[9-10],本研究选择添加量为日常添加量10倍和100倍的剂量在断奶仔猪基础饲粮中添加本实验室分离的1株屎肠球菌WEI-10,通过仔猪活跃状态、腹泻分数、生长性能、菌血症以及组织病理学研究,对菌株WEI-10进行系统的针对断奶仔猪的体内安全性评价研究,旨在评价饲用屎肠球菌的体内安全性。
1 材料与方法 1.1 菌株本试验使用的菌株为屎肠球菌WEI-10(中国普通微生物菌种保藏管理中心编号7746) ,该菌株分离于60日龄健康仔猪肠道黏膜,已进行体外安全性和有效性评价研究[11]和针对小白鼠的急性毒性及亚急性毒性评价试验[3]。体外安全性试验表明,菌株WEI-10具有γ-溶血性、无胆汁盐水解酶活性、不产生物胺(组胺、酪胺和腐胺)、不含欧洲食品安全局(European Food Safety Authority, EFSA)在2012年制订的针对屎肠球菌毒力因素评价的规程[12]中要求检测的3个毒力基因(即IS16、esp和hylEFM)、不含可转移的抗生素抗性基因;小白鼠的急性毒性和亚急性毒性评价试验表明,无论采用原始发酵液(活菌数为3×109 CFU/mL)还是原菌粉(活菌数为3×1010 CFU/g)对小白鼠进行急性毒性和亚急性毒性试验,整个试验过程小白鼠均无死亡,与对照组相比没有出现体重降低,并在皮毛色泽,活跃状态,采食量及肝脏、脾脏、肺脏和肾脏器官指数上与对照组相比没有显著性差异(P>0.05) ,组织病理结果表明肝脏、脾脏、肺脏和肾脏也均无实质性病变。本研究使用的样品为本实验室生产的制粒菌粉,活菌数≥2×1010 CFU/g。
1.2 试验动物和试验设计试验场地位于黑龙江省哈尔滨市某养殖公司的规模猪场。试验采用单因素完全随机试验设计,共设计了2批试验,第1批试验选择体况相近、健康、平均体重为(7.44±1.02) kg的26日龄断奶仔猪(长白×大白×杜洛克三元杂交)253头,根据体重相近,公母比例基本一致的原则,随机分为2组:对照组Ⅰ饲喂基础饲粮(不添加抗生素和益生菌),试验组Ⅰ饲喂基础饲粮中添加菌株WEI-10(每克基础饲粮中菌株WEI-10的添加量为1×108 CFU)的试验饲粮,每组6个重复,每个重复(22±4) 头仔猪,每个重复1栏。第2批试验选择体况相近、健康、平均体重为(8.11±1.51) kg的26日龄断奶仔猪(长白×大白×杜洛克三元杂交)253头,根据体重相近,公母比例基本一致的原则,随机分为2组:对照组Ⅱ饲喂基础饲粮(不添加抗生素和益生菌),试验组Ⅱ饲喂基础饲粮中添加菌株WEI-10(每克基础饲粮中菌株WEI-10的添加量为1×107 CFU)的试验饲粮,每组6个重复,每个重复(22±4) 头仔猪,每个重复1栏。2批试验均为38 d。基础饲粮配方营养要求不低于NRC (2012) 推荐的最低标准[13],其组成及营养水平见表 1。根据猪场条件,为了保证试验结果的可靠性,设计2个独立批次试验,分别评价2个剂量的安全性。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验组和对照组在相同环境和管理条件下饲养,自由采食,自由饮水,试验期间按照猪场正常程序注射疫苗和驱虫。每天以重复为单位详细记录每头猪的活跃分数(activity score, AS),采用三标度法(1:懒,移动缓慢;2:中间状态;3:活跃移动并觅食)[5]。并以重复为单位计算每天的活跃分数平均值,试验结束统计分析全期试验组和对照组的活跃分数。每天记录每头猪的死淘和发病情况。在试验的第3、5、10、17、24和38天,以重复为单位记录每头猪的腹泻分数(0:球团;1:半球团;2:软便;3:水便)[14-15],并以重复为单位计算腹泻分数平均值。
1.4 测定指标及方法 1.4.1 生长性能以重复为单位,计录全程采食量,在试验的第1天和第38天进行空腹称重,并计算平均日增重、平均日采食量和料重比。同时,试验结束计算全期活跃分数和死淘率。
1.4.2 菌血症菌血症分析采用文献 [4-5]中的方法。试验第1、10、24和38天时,每个重复随机选择1头猪,通过前腔静脉无菌采血2 mL于加有柠檬酸钠抗凝剂的采血管中,取100 μL血液涂布于MRS琼脂平板,于37 ℃条件下培养48 h,观察MRS琼脂平板有无菌落长出,每份血液样品做3个重复。若试验组和对照组检测平板均未长菌落,则认为是菌血症阴性;若有疑似屎肠球菌的菌落长出,则先与对照组平板比较,若对照组平板也有相同菌落,并且通过16S rRNA基因序列分析,鉴定属于同一种属,则认为是野生菌株感染,同样判定结果为阴性;若对照组检测平板未长菌落,试验组检测平板有屎肠球菌菌落,则认为是菌株WEI-10感染,结果判定为阳性。
1.4.3 脏器指数从各重复选取1头接近平均体重的仔猪,采取直接刺杀心脏放血致死后,立即剖开腹腔,取其心脏、肝脏、脾脏、肺脏和肾脏,剔除脂肪后称取湿重,计算脏器指数。
脏器指数(g/kg)=器官湿重(g)/猪活体重(kg)。
1.4.4 组织病理检查结扎胃肠段后,于十二指肠和空肠的近端分别截取2 cm长肠段,剪取的心脏、肝脏、脾脏、肺脏和肾脏样品各2块,浸于10%甲醛固定,用梯度乙醇逐级脱水,二甲苯洗涤,石蜡包埋,分别在十二指肠和空肠肠段的3~6个位点,连续切取3~6个肠环横断面,分别在剪取的每块心脏、肝脏、脾脏、肺脏和肾脏样品的3个位点,连续切取3个横断面或纵断面,制备6 μm厚石蜡切片,苏木精-伊红(HE)染色,光学显微镜下观察肠组织和各脏器的基本形态和病理学改变,并用图像采集系统采集相应组织图像。
1.5 数据分析试验数据均用平均值±标准差表示,采用SPSS 16.0统计软件中的one-way ANOVA进行单因素方差分析,以P<0.05为差异显著。
2 结果 2.1 屎肠球菌WEI-10对断奶仔猪活跃状态的影响活跃状态用活跃分数表示,试验全期,2个批次试验的活跃分数如图 1所示,第1批试验,对照组Ⅰ和试验组Ⅰ的活跃分数分别是2.22和2.15;第2批试验,对照组Ⅱ和试验组Ⅱ的活跃分数分别是2.30和2.35,活跃分数均处于中间状态和活跃移动并觅食之间。2批试验的试验组和对照组在活跃状态上无显著性差异(P>0.05) ,且对照组和试验组均未发生死亡或疾病。
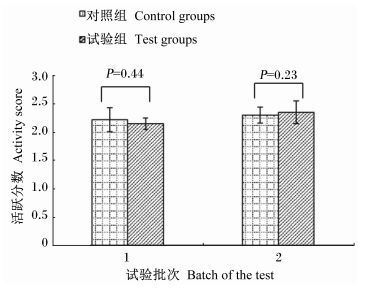
|
图 1 2批试验断奶仔猪的活跃分数 Figure 1 Activity score of weaned piglets in two batch tests |
2个批次试验的腹泻分数如图 2所示,试验组和对照组均在试验第5、10和38天腹泻分数有显著性差异(P<0.05) ;饲喂全期,2批试验均是试验组的腹泻分数低于对照组,并且在试验第38天时,2批试验的试验组的腹泻分数降为0,对照组腹泻分数在0.6左右,因此,即使选择日常添加量10倍和100倍的剂量饲喂屎肠球菌WEI-10也没有引起断奶仔猪腹泻,同时还降低了断奶仔猪的腹泻分数。
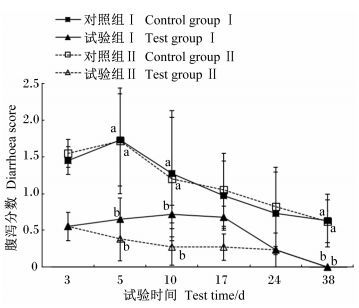
|
同一批试验、同一时间点,试验组和对照组的数据无字母标注表示差异不显著(P>0.05) ,标注不同小写字母表示差异显著(P<0.05) 。 In the same batch test and at the same time point, values of test group and control group with no letter mean no significant difference (P>0.05), while with different small letters mean significant difference (P<0.05) . 图 2 屎肠球菌WEI-10对断奶仔猪腹泻分数的影响 Figure 2 Effects of Enterococcus faecium WEI-10 on diarrhea score of weaned piglets |
饲粮中添加菌株WEI-10对断奶仔猪生长性能的影响见表 2,第1批试验,试验组Ⅰ的平均日采食量比对照组Ⅰ降低1.60%,平均日增重降低3.13%,料重比增加1.58%,2组间均无显著性差异(P>0.05) 。第2批试验,试验组Ⅱ的平均日采食量比对照组Ⅱ降低4.44%,平均日增重降低2.31%,料重比降低1.78%,2组间均无显著性差异(P>0.05) 。
|
|
表 2 屎肠球菌WEI-10对断奶仔猪生长性能的影响 Table 2 Effects of Enterococcus faecium WEI-10 on growth performance of weaned piglets |
平板培养结果显示,第1、10、24和38天的血液样品培养后均没有菌落长出,结果均为阴性,表明菌株WEI-10没有发生易位。
2.5 屎肠球菌WEI-10对断奶仔猪脏器指数和重要组织病理变化的影响解剖时通过临床观察,2批试验的试验组和对照组仔猪均没有出现肝脏肿大、脾脏肿大和盲肠扩大。内脏器官的脏器指数见表 3,2批试验的试验组和对照组均没有显著性差异(P>0.05) 。
|
|
表 3 屎肠球菌WEI-10对断奶仔猪脏器指数的影响 Table 3 Effects of Enterococcus faecium WEI-10 on organ indexes of weaned piglets |
通过组织病理切片分析,2批试验的试验组和对照组都没有出现脏器实质性病变、炎性细胞和相应淋巴细胞的增多以及结构疏松和水肿等。饲喂菌株WEI-10对仔猪的十二指肠和空肠的肠道黏膜的完整性没有受到影响,也没有造成黏膜上皮细胞脱落、固有层裸露,固有层疏松,以及淋巴细胞浸润造成炎性反应等。以肝脏、脾脏和十二指肠为例,具体分析2批试验的试验组和对照组的切片病理结果。2批试验的肝脏、脾脏和十二指肠的切片病理变化如图 3、4和5所示。由图 3可以看出,对照组和试验组仔猪肝脏组织正常,肝小叶结构可辨,肝索排列整齐,没有出现肝细胞空泡化、肝窦扩张以及淋巴细胞或炎性细胞浸润等病理特征。由图 4可以看出,对照组和试验组仔猪脾脏组织正常,白髓和红髓见的边缘带明显,白髓部未发生出血,红髓部脾索清晰,脾血窦未出现扩张等病理特征。由图 5可以看出,对照组和试验组仔猪十二指肠未出现黏膜上皮细胞脱落、固有层裸露、水肿、固有层和黏膜肌层与黏膜下层间疏松,也未出现嗜酸性粒细胞和浆细胞浸润等病理特征。
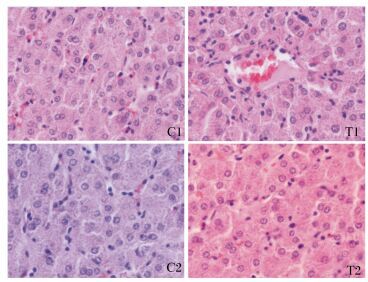
|
C1:对照组Ⅰ;T1:试验组Ⅰ;C2:对照组Ⅱ;T2:试验组Ⅱ。下图同。 C1: control groupⅠ; T1: test groupⅠ; C2: control group Ⅱ; T2: test group Ⅱ. The same as below. 图 3 屎肠球菌WEI-10对断奶仔猪肝脏组织病理变化的影响 Figure 3 Effects of Enterococcus faecium WEI-10 on liver histopathological changes of weaned piglets (400×) |
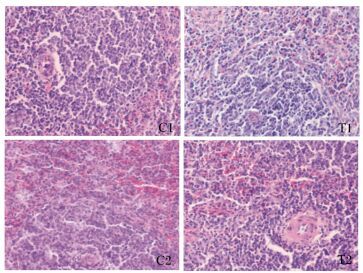
|
图 4 屎肠球菌WEI-10对断奶仔猪脾脏组织病理变化的影响 Figure 4 Effect of Enterococcus faecium WEI-10 on spleen histopathological changes of weaned piglets (400×) |
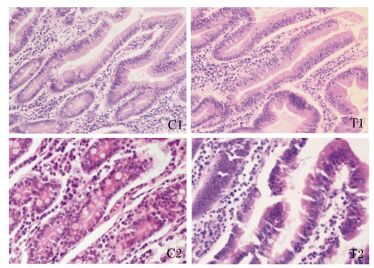
|
图 5 屎肠球菌WEI-10对断奶仔猪十二指肠组织病理变化的影响 Figure 5 Effect of Enterococcus faecium WEI-10 on duodenum histopathological changes of weaned piglets (400×) |
目前研究者对屎肠球菌在断奶仔猪上的评价研究多集中在有效性评价,测定的指标主要是生长性能[16-19]、腹泻率[17]、饲粮养分表观消化率[17]、各肠段及粪样pH与微生物菌群[17, 20-21]、血液生化指标[16-18]、免疫能力[18, 21]、小肠绒毛发育及养分吸收和抗病原菌感染[19, 21]等,并且饲喂的剂量大多数是每克基础饲粮添加106 CFU的活性屎肠球菌,而对屎肠球菌的安全性评价研究主要通过体外试验,如溶血性、毒力基因、抗生素抗性和产有毒代谢产物等。但是,很多情况下体外安全性评价的结果往往不能真实反映其体内的效果,而目前对体内的安全性评价的研究很少且不系统,因此,本研究选择的饲喂剂量是日常添加量(每克基础饲粮添加106 CFU益生菌)的10倍和100倍,即每克基础饲粮添加1×107和1×108 CFU菌株WEI-10,研究屎肠球菌对断奶仔猪的安全性。
3.1 屎肠球菌WEI-10对断奶仔猪整体活跃状态、腹泻分数和生长性能的影响食欲、活跃状态、腹泻状况和生长性能是反映动物健康状态的敏感性指标,本研究以动物的平均日采食量、平均日增重、料重比、活跃分数和腹泻分数为指标研究屎肠球菌WEI-10针对断奶仔猪的体内安全性评价。本研究选择的饲喂剂量是每克基础饲粮添加1×107和1×108 CFU菌株WEI-10(饲喂剂量为日常添加量的10倍和100倍),尽管2批试验的试验组的平均日采食量和平局日增重均略低于对照组,且第1批试验的试验组的料重比也比其相应的对照组略高,但2批试验的试验组和对照组均无显著性差异,因此,初步判断,菌株WEI-10并没有威胁断奶仔猪的健康。Hanczakowska等[19]在研究屎肠球菌NCIMB 10415对26~56日龄仔猪生长性能的影响时,也得出相似的结果,即饲喂屎肠球菌NCIMB 10415的试验组的平均日采食量和平均日增重均低于对照组,料重比也高于对照组,但组间无显著性差异。Zhou等[4]在对鼠李糖乳杆菌HN001、嗜酸乳杆菌HN017和双歧杆菌HN019进行毒性评价时,结果表明鼠李糖乳杆菌HN001、嗜酸乳杆菌HN017和双歧杆菌HN019与对照组及商业化的菌株鼠李糖乳杆菌GG和嗜酸乳杆菌LA-1相比,活跃分数均没有显著性差异。本研究2批试验的试验组与对照组相比,均降低了腹泻分数。这与很多前人的研究结果相似,如Chen等[22]报道在饲粮中添加益生菌可降低猪排泄物中氨的浓度,从而降低腹泻分数;同样,Thu等[23]报道在断奶仔猪的饲粮中按照3%的量添加植物乳杆菌的液体代谢物,可以显著降低断奶仔猪的腹泻分数。华均超等[17]报道在断奶仔猪饲粮中按照6%的量添加屎肠球菌T013复合制剂能显著降低腹泻率。
3.2 断奶仔猪的菌血症检测结果细菌易位或菌血症是大部分的肠道条件致病菌发病的先决条件,也是反映细菌的感染能力和致病性的重要指标[24]。本研究未在血液中检测到菌株WEI-10,因此,菌株WEI-10没有从肠道易位至全身的血液组织,不存在易位的风险。Zhou等[4]在研究鼠李糖乳杆菌HN001、嗜酸乳杆菌HN017和双歧杆菌HN019的毒性评价时也得出同样结论。因此,认为菌株WEI-10没有侵入性,对仔猪是安全的。
3.3 屎肠球菌WEI-10对断奶仔猪脏器指数和重要组织病理变化的影响感染性和致病性也是益生菌安全性评价的重要指标。肝脏肿大和脾脏肿大是反映感染性的间接指标,通过解剖临床观察2批试验的试验组和对照组的肝脏、脾脏和其他脏器均没有出现实质性病变和明显差异,并且进一步测定的脏器指数也说明试验组和对照组之间无显著性差异。外周血嗜中性粒细胞或嗜酸性粒细胞是反映细菌感染的有效指标,通过组织切片病理分析,没有观察到试验组的脏器实质性病变、炎性细胞和相应淋巴细胞的增多以及结构疏松和水肿等,并且和对照组之间无明显病理差异,说明菌株WEI-10没有引起仔猪感染和致病。肠道黏膜在阻止潜在致病菌或有毒物质侵袭全身组织上发挥重要的屏障作用[8]。本研究的菌株WEI-10对试验组仔猪的十二指肠和空肠的肠道黏膜的完整性没有不良影响,不会造成黏膜上皮细胞脱落、固有层裸露,固有层疏松,以及淋巴细胞浸润造成炎性反应等,因此说明菌株WEI-10没有感染性和致病性。Giannenas等[21]在研究屎肠球菌对育肥猪的肠道黏膜影响的毒性评价时也得出相似的结论。
4 结论① 即使选择饲喂剂量为日常添加量的10倍和100倍,屎肠球菌WEI-10饲喂断奶仔猪后各项指标(活跃分数、腹泻分数、平均日采食量、平均日增重和料重比)尽管略有变差,但均无显著性变化。
② 屎肠球菌WEI-10没造成在断奶仔猪肠道外组织的易位,也未造成内脏和肠道黏膜的组织性病变。
③ 屎肠球菌WEI-10不存在安全性问题。
| [1] |
SÁNCHEZ-SILOS R M, PÉREZ-GIRALDO C, MARTÍN P, et al. Pathogenicity of Enterococcus spp. Characteristics of 169 hospital isolates[J]. Enfermedades Infecciosas Y Microbiología Clínica, 2000, 18(4): 165-169. |
| [2] |
DONOHUE D C,SALMINEN S,MARTEAU P.Safety of probiotic bacteria[M]//SALMINEN S,VON WRIGHT A.Lactic acid bacteria.New York:Marcel Dekker,1998:369.
|
| [3] |
ENDRES J R, CLEWELL A, JADE K A, et al. Safety assessment of a proprietary preparation of a novel Probiotic,Bacillus coagulans,as a food ingredient[J]. Food and Chemical Toxicology, 2009, 47(6): 1231-1238. DOI:10.1016/j.fct.2009.02.018 |
| [4] |
ZHOU J S, SHU Q, RUTHERFURD K J, et al. Safety assessment of potential probiotic lactic acid bacterial strains Lactobacillus rhamnosus HN001,Lb.acidophilus HN017,and Bifidobacterium lactis HN019 in BALB/c mice[J]. International Journal of Food Microbiology, 2000, 56(1): 87-96. DOI:10.1016/S0168-1605(00)00219-1 |
| [5] |
ZHOU J S, SHU Q, RUTHERFURD K J, et al. Acute oral toxicity and bacterial translocation studies on potentially probiotic strains of lactic acid bacteria[J]. Food and Chemical Toxicology, 2000, 38(2/3): 153-161. |
| [6] |
MATTILA-SANDHOLM T. The PROBDEMO project:demonstration of the nutritional functionality of probiotic foods[J]. Trends in Food Science & Technology, 1999, 10(12): 385-386. |
| [7] |
FRIZZO L S, BERTOZZI E, SOTO L P, et al. Studies on translocation,acute oral toxicity and intestinal colonization of potentially probiotic lactic acid bacteria administered during calf rearing[J]. Livestock Science, 2010, 128(1/2/3): 28-35. |
| [8] |
MA L, DEITCH E, SPECIAN R, et al. Translocation of Lactobacillus murinus from the gastrointestinal tract[J]. Current Microbiology, 1990, 20(3): 177-184. DOI:10.1007/BF02091994 |
| [9] |
LIU X T, WANG Y, WANG H L, et al. Effect of a liquid culture of Enterococcus faecalis CGMCC1.101 cultivated by a high density process on the performance of weaned piglets[J]. Livestock Science, 2014, 170: 100-107. DOI:10.1016/j.livsci.2014.08.011 |
| [10] |
王杰, 艾萍萍, 刁其玉, 等. 复合益生菌和纤维寡糖对断奶仔猪生长性能、粪便微生物及血清指标的影响[J]. 动物营养学报, 2016, 28(3): 881-890. |
| [11] |
FENG Y Y, QIAO L, LIU R, et al. Potential probiotic properties of lactic acid bacteria isolated from the intestinal mucosa of healthy piglets[J]. Annals of Microbiology, 2017, 67(3): 239-253. DOI:10.1007/s13213-017-1254-6 |
| [12] |
FEEDAP. Guidance on the safety assessment of Enterococcus faecium in animal nutrition[J]. EFSA Journal, 2012, 10(5): 2682. DOI:10.2903/j.efsa.2012.2682 |
| [13] |
NRC.Nutrient requirements of swine[S].11th ed.Washington,D.C.:National Academy Press,2012.
|
| [14] |
LOH T C, CHOO P Y, CHEONG Y H. Effects of organic acids and natural herbs on performance and incidence of diarrhoea in post-weaning pigs[J]. Malaysian Journal of Animal Science, 2002, 7(2): 25-30. |
| [15] |
DOWARAH R, VERMA A K, AGARWAL N, et al. Effect of swine based probiotic on performance,diarrhoea scores,intestinal microbiota and gut health of grower-finisher crossbred pigs[J]. Livestock Science, 2016, 195: 74-79. |
| [16] |
文静, 孙建安, 周绪霞, 等. 屎肠球菌对仔猪生长性能、免疫和抗氧化功能的影响[J]. 浙江农业学报, 2011, 23(1): 70-73. |
| [17] |
华均超, 张邦辉, 周明, 等. 屎肠球菌T013复合制剂在断奶仔猪生产中的应用研究[J]. 安徽农业科学, 2012, 40(11): 6519-6523. DOI:10.3969/j.issn.0517-6611.2012.11.068 |
| [18] |
王永, 杨维仁, 张桂国. 饲粮中添加屎肠球菌对断奶仔猪生长性能、肠道菌群和免疫功能的影响[J]. 动物营养学报, 2013, 25(5): 1069-1076. |
| [19] |
HANCZAKOWSKA E, Ś WIATKIEWICZ M, NATONEK-WI ŚNIEWSKA M, et al. Medium chain fatty acids (MCFA) and/or probiotic Enterococcus faecium as a feed supplement for piglets[J]. Livestock Science, 2016, 192: 1-7. DOI:10.1016/j.livsci.2016.08.002 |
| [20] |
PAJARILLO E A B, CHAE J P, BALOLONG M P, et al. Effects of probiotic Enterococcus faecium NCIMB 11181 administration on swine fecal microbiota diversity and composition using barcoded pyrosequencing[J]. Animal Feed Science and Technology, 2015, 201: 80-88. DOI:10.1016/j.anifeedsci.2015.01.011 |
| [21] |
GIANNENAS I, DOUKAS D, KARAMOUTSIOS A, et al. Effects of Enterococcus faecium,mannan oligosaccharide,benzoic acid and their mixture on growth performance,intestinal microbiota,intestinal morphology and blood lymphocyte subpopulations of fattening pigs[J]. Animal Feed Science and Technology, 2016, 220: 159-167. DOI:10.1016/j.anifeedsci.2016.08.003 |
| [22] |
CHEN Y J, SON K S, MIN B J, et al. Effects of dietary probiotic on growth performance,nutrients digestibility,blood characteristics and fecal noxious gas content in growing pigs[J]. Asian-Australasian Journal of Animal Sciences, 2006, 18(10): 1464-1468. |
| [23] |
THU T V, LOH T C, FOO H L, et al. Effects of liquid metabolite combinations produced by Lactobacillus plantarum on growth performance,faeces characteristics,intestinal morphology and diarrhoea incidence in postweaning piglets[J]. Tropical Animal Health and Production, 2011, 43(1): 69-75. DOI:10.1007/s11250-010-9655-6 |
| [24] |
FORD H R, AVANO ǦLU A, BOECHAT P R, et al. The microenvironment influences the pattern of bacterial translocation in formula-fed neonates[J]. Journal of Pediatric Surgery, 1996, 31(4): 486-489. DOI:10.1016/S0022-3468(96)90480-7 |




