阿魏酸(ferulic acid, FA)是桂皮酸的衍生物之一,是禾本科植物中普遍存在的一种酚酸,主要与细胞壁多糖和木质素交联构成细胞壁的一部分[1]。阿魏酰低聚糖(feruloyl oligosaccharides, FOs)是FA的羧基与低聚糖的羟基通过酯键连接而成的一类重要化合物。由于通过酯键连接的低聚糖种类不同,FOs的种类较多,主要有阿魏酸阿拉伯糖基木糖、阿魏酸阿拉伯糖基阿拉伯糖、阿魏酸半乳糖基半乳糖、阿魏酸阿拉伯糖基木二糖、阿魏酸阿拉伯糖基木三糖和阿魏酸阿拉伯糖基木四糖[2]。FOs由于其结构中特殊的酯键,使得某些生理活性有所增强。研究表明FOs在抗氧化、抑菌、消炎等方面均有良好作用,葛丽花[3]和曾凤彩[4]体外研究均发现FOs对1, 1-二苯基-2-三硝基苯肼(1, 1-diphenyl-2-picrylhydrazyl, DPPH)、2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2, 2′-azinobis-3-ethylbenzthiazoline-6-sulphonate, ABTS)和羟自由基(·OH)具有较强的清除能力。Yao等[5]研究发现,在经过氧化氢(H2O2)处理的细胞培养基中添加FOs,细胞生长良好,贴壁细胞数量增多,圆形细胞减少,细胞突触恢复正常,同时可提高细胞内超氧化物歧化酶(SOD)活性。Zhang等[6]研究发现,酶解麦麸获得的FOs可以缓解由氮二异丁脒盐酸盐[2, 2′-azobis (2-methylpropionamidine) dihydrochloride, AAPH]诱导的大鼠氧化应激,提高氧化应激大鼠组织中过氧化氢酶(CAT)、超氧化物气化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和谷胱甘肽(GSH)含量。解春艳[7]和陈洲[8]进一步发现FOs不仅对金黄色葡萄球菌、大肠杆菌及沙门氏菌有抑制作用,同时对几种乳杆菌和乳酸链球菌也有一定的增殖作用。
目前,FOs的制备方法包括酸水解、酶解及微生物发酵,而微生物发酵法采用的菌种多为食用菌和霉菌[3, 9],以非霉系菌种作为发酵菌种的报道较少。本课题以酿酒酵母CGMCC 2.119(Saccharomyces cerevisiae CGMCC 2.119)和枯草芽孢杆菌CGMCC 1.0892(Bacillus subtilis CGMCC 1.0892)作为混合菌种发酵小麦麸皮,通过Amberlite XAD-2柱分离纯化制备麦麸FOs。大量研究表明腹腔注射敌草快可诱导大鼠[10]、断奶仔猪[11]和肉鸡[12]等产生氧化应激,维生素C作为公认的抗氧化剂之一,具有缓解敌草快引起的氧化应激的作用[13]。因此,本试验通过腹腔注射敌草快建立大鼠氧化应激模型,以维生素C为正对照,研究制备的麦麸FOs对氧化应激大鼠的保护作用,以期为在生产中将麦麸FOs应用于改善动物健康状况、促进其生长提供理论支撑。
1 材料与方法 1.1 麦麸FOs的制备与分析 1.1.1 麦麸FOs的制备利用Saccharomyces cerevisiae CGMCC 2.119和Bacillus subtilis CGMCC 1.0892混菌发酵小麦麸皮制备麦麸FOs,发酵样品于烘箱中烘干(45 ℃,24 h)后粉碎,按料水比1:20(质量比)80 ℃水浴浸提,离心(5 000 r/min,10 min)后取上清,参照姚惠源等[14]的提纯方法,通过Amberlite XAD-2柱进行分离纯化,依次用2倍柱体积的蒸馏水、3倍柱体积的50%甲醇水溶液和2倍柱体积的无水甲醇进行洗脱,收集50%甲醇水溶液洗脱组分浓缩,冷冻干燥,获得麦麸FOs进行动物试验。
1.1.2 麦麸FOs紫外光谱分析取适量50%甲醇溶液洗脱组分,进行紫外光谱扫描,扫描波长范围200~400 nm。
1.1.3 纯化样品中麦麸FOs浓度测定参照文献[15],利用双波长法测定纯化样品中麦麸FOs浓度。取0.1 mL麦麸FOs水溶液与0.9 mL的硼砂-甘氨酸缓冲溶液(0.1 mol/L,pH=10)混合,分别于345和375 nm波长处测定吸光度(OD)值。根据阿魏酸的摩尔吸光系数∊′345=19 662、∊′375=7 630和FOs的摩尔吸光系数∊345=23 064、∊375=31 430,计算麦麸FOs浓度。
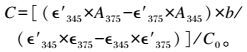
|
式中:C为麦麸FOs浓度(mmol/g);b为比色皿厚度(cm);A345为波长345 nm处OD值;A375为波长375 nm处OD值;C0为麦麸FOs水溶液浓度(mg/mL)。
1.2 试验动物与试验设计试验选取48只健康的断奶雄性Wistar大鼠(购于内蒙古大学动物实验中心),按体重相近的原则以完全随机设计分为6个组,分别为未攻毒组、攻毒组、攻毒+100 mg/kg BW麦麸FOs组、攻毒+200 mg/kg BW麦麸FOs组、攻毒+300 mg/kg BW麦麸FOs组和攻毒+100 mg/kg BW维生素C组,每组8个重复,每个重复1只。麦麸FOs和维生素C配制成水溶液,采用定时灌胃的方式给予,未攻毒组、攻毒组用生理盐水替代,灌胃体积0.2 mL,连续灌胃15 d。各组大鼠均饲喂相同的基础饲粮,灌胃结束当天,未攻毒组大鼠腹腔注射0.3 mL生理盐水,其他5组按0.1 mmol/kg BW的剂量腹腔注射等体积的敌草快建立氧化应激模型。大鼠基础饲粮购于江苏协同医药生物工程有限公司,主要营养成分指标保证值(每千克饲粮中的含量)如下:水分≤100 g,粗蛋白质≥180 g,粗脂肪≥40 g,粗纤维≤50 g,粗灰分≤80 g,钙10~18 g,总磷6~12 g,蛋氨酸+半胱氨酸≥5.3 g。敌草快购于重庆树荣化工有限公司(有效浓度200 g/L)。试验在内蒙古农业大学动物科学学院进行,常规饲养管理,自由采食、饮水。
1.3 测定指标及方法 1.3.1 样品采集与制备敌草快攻毒12 h后,对大鼠进行心脏采血,将采集的血液置于肝素钠抗凝管中,4 ℃冰箱中静置30 min,3 000 r/min离心10 min制备血浆,于-80 ℃保存待测。采血后,迅速取出肝脏、回肠和肾脏组织,并用冰冷的生理盐水漂洗,液氮速冻,-80 ℃保存。
1.3.2 抗氧化相关指标测定方法取适量组织,加磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.4)制备10%(质量)组织匀浆,3 000 r/min离心10 min,取上清液用于抗氧化相关指标测定。总抗氧化能力(total antioxitant capacity, T-AOC)及SOD、CAT活性测试盒均为南京建成生物工程研究所产品;GSH-Px活性及GSH和8-羟基脱氧鸟苷(8-hydroxy deoxyguanosine, 8-OHdG)含量测试盒均为武汉基因美生物科技有限公司产品。所有操作均按说明书进行。
1.4 统计分析试验数据采用SAS 9.2中的一般线性模型(GLM)进行方差分析,并采用Duncan氏法进行组间多重比较,所有指标以每只鼠为统计单位。结果用“平均值±标准差”表示,P < 0.05表示差异显著。
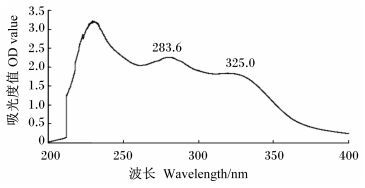
2 结果与分析 2.1 麦麸FOs紫外光谱分析及纯化样品中麦麸FOs浓度利用Saccharomyces cerevisiae CGMCC 2.119和Bacillus subtilis CGMCC 1.0892混菌发酵小麦麸皮,通过Amberlite XAD-2柱进行分离纯化获得麦麸FOs,其紫外光谱扫描结果见图 1,可见在283.6和325.0 nm附近有明显特征吸收峰,由此推测样中含有酯化的阿魏酸和游离阿魏酸。由双波长法测得纯化样品中FOs浓度为0.059 mmol/g。
|
图 1 麦麸FOs紫外光谱吸收图 Figure 1 Ultraviolet spectrum absorption figure of wheat bran FOs |
不同剂量的麦麸FOs对敌草快致氧化应激大鼠血浆抗氧化相关指标的影响见表 1。腹腔注射敌草快显著降低大鼠血浆中SOD活性以及GSH含量(P < 0.05),显著提高8-OHdG含量(P < 0.05)。与攻毒组相比,灌胃100 mg/kg BW麦麸FOs显著降低大鼠血浆中CAT活性(P < 0.05);灌胃400 mg/kg BW麦麸FOs显著提高大鼠血浆中SOD活性(P < 0.05);灌胃100、200 mg/kg BW麦麸FOs显著提高大鼠血浆中GSH-Px活性和GSH含量(P < 0.05);灌胃100、200、400 mg/kg BW麦麸FOs均可以显著降低大鼠血浆中8-OHdG含量(P < 0.05)。与攻毒组相比,除8-OHdG含量外,灌胃100 mg/kg BW维生素C对大鼠血浆中其他抗氧化指标无显著影响(P>0.05)。
|
|
表 1 不同剂量的麦麸FOs对敌草快致氧化应激大鼠血浆抗氧化指标的影响 Table 1 Effects of different doses of wheat bran FOs on plasma antioxidant indices of diquat-induced oxidative stress rats |
不同剂量的麦麸FOs对敌草快致氧化应激大鼠肝脏抗氧化指标的影响见表 2。腹腔注射敌草快显著降低大鼠肝脏中T-AOC,CAT、GSH-Px活性以及GSH含量(P < 0.05),显著提高8-OHdG含量(P < 0.05)。与攻毒组相比,灌胃100、200、400 mg/kg BW麦麸FOs均可以显著提高大鼠肝脏中T-AOC,SOD、GSH-Px活性以及GSH含量(P < 0.05);灌胃200、400 mg/kg BW麦麸FOs显著提高大鼠肝脏中CAT活性(P < 0.05);灌胃100 mg/kg BW麦麸FOs显著降低大鼠肝脏中8-OHdG含量(P < 0.05)。与攻毒组相比,灌胃100 mg/kg BW维生素C显著提高大鼠肝脏中T-AOC、CAT活性以及GSH含量(P < 0.05),显著降低8-OHdG含量(P < 0.05)。
|
|
表 2 不同剂量的麦麸FOs对敌草快致氧化应激大鼠肝脏抗氧化指标的影响 Table 2 Effects of different doses of wheat bran FOs on liver antioxidant indices of diquat-induced oxidative stress rats |
不同剂量的麦麸FOs对敌草快致氧化应激大鼠肾脏抗氧化指标的影响见表 3。腹腔注射敌草快显著降低大鼠肾脏中T-AOC,CAT和SOD活性(P < 0.05),显著提高8-OHdG含量(P < 0.05)。与攻毒组相比,灌胃400 mg/kg BW麦麸FOs显著提高大鼠肾脏中T-AOC、GSH-Px活性和GSH含量(P < 0.05);灌胃200 mg/kg BW麦麸FOs显著提高大鼠肾脏中CAT和GSH-Px活性(P < 0.05);灌胃100、200、400 mg/kg BW麦麸FOs均可以显著降低大鼠肾脏中8-OHdG含量(P < 0.05)。与攻毒组相比,灌胃100 mg/kg BW维生素C显著提高大鼠肾脏中T-AOC和GSH-Px活性(P < 0.05),显著降低8-OHdG含量(P < 0.05)。
|
|
表 3 不同剂量的麦麸FOs对敌草快致氧化应激大鼠肾脏抗氧化指标的影响 Table 3 Effects of different doses of wheat bran FOs on kidney antioxidant indices of diquat-induced oxidative stress rats |
不同剂量的麦麸FOs对敌草快致氧化应激大鼠回肠抗氧化指标的影响见表 4。腹腔注射敌草快显著降低大鼠回肠中T-AOC,SOD和GSH-Px活性以及GSH含量(P < 0.05),显著提高8-OHdG含量(P < 0.05)。与攻毒组相比,灌胃200 mg/kg BW麦麸FOs显著提高大鼠回肠中T-AOC (P < 0.05);灌胃400 mg/kg BW麦麸FOs显著提高大鼠回肠中SOD活性(P < 0.05);灌胃100、200、400 mg/kg BW麦麸FOs均可以显著提高大鼠回肠中GSH-Px活性以及GSH含量(P < 0.05);灌胃100、200、400 mg/kg BW麦麸FOs均可以显著降低大鼠回肠中8-OHdG含量(P < 0.05)。与攻毒组相比,灌胃100 mg/kg BW维生素C显著提高大鼠回肠中T-AOC活性和GSH含量(P < 0.05),显著降低8-OHdG含量(P < 0.05)。
|
|
表 5 不同剂量的麦麸FOs对敌草快致氧化应激大鼠回肠抗氧化指标的影响 Table 5 Effects of different doses of wheat bran FOs on ileum antioxidant indices of diquat-induced oxidative stress rats |
小麦麸皮中含有丰富的阿魏酸,但因其通过酯键连接在木质素及纤维素侧链上,难以被动物利用。许多研究表明通过适度的酸水解、酶解及微生物发酵处理可以获得FOs。葛丽花[3]利用草酸水解麦麸,制备的FOs浓度为1.45×10-5 mol/g。陈洲[8]和袁小平[16]通过不同来源的木聚糖酶水解麦麸获得浓度分别为1.326和1.546 mmol/L的FOs。解春艳[7]通过药用真菌茶薪菇发酵麦麸获得浓度为35.4 μmol/L的FOs。利用酸水解法制备FOs,经济成本较低,但存在提取试剂残留和提取率较低等问题,故较少使用。酶解法制备FOs是目前较常见的方法,生物酶法虽反应温和,但会产生大量废水,生产成本较高。微生物发酵法将产各种糖酶的微生物直接应用于FOs制备中,使微生物发酵产酶过程与酶解过程合二为一,可省去酶的分离纯化,降低生产成本。本试验利用Saccharomyces cerevisiae CGMCC 2.119和Bacillus subtilis CGMCC 1.0892混菌发酵小麦麸皮,通过Amberlite XAD-2柱进行分离纯化,制备的麦麸FOs浓度较高,达到0.059 mmol/g。
机体在代谢过程中会产生大量的活性氧族(ROS),如超氧阴离子自由基(O2-·)、·OH和H2O2。在正常状态下,体内ROS的产生与清除处于平衡状态,但在遭受各种有害刺激或诱导时,ROS代谢发生紊乱,氧化还原动态平衡被破坏,对机体产生氧化应激[17]。体内存在着由酶促与非酶促组成的防御体系以抵抗氧化应激对机体造成的损伤,酶促防御体系主要由抗氧化酶构成,包括常见的CAT、SOD、GSH-Px等,非酶促防御体系中主要为GSH、维生素等[18]。SOD能催化O2-·产生H2O2和氧气(O2)。H2O2被CAT转化成无毒的H2O和O2,或在GSH-Px氧化GSH的过程中被转化成H2O或酒精[19],同时,GSH被GSH-Px催化变为氧化型谷胱甘肽(GSSG),在该催化反应中,具有强氧化性的过氧化物被还原成对机体无害的羟基化合物,从而使细胞不被过氧化物干扰及损害,保护了细胞膜的结构及功能的完整性[20]。8-OHdG是ROS氧化DNA链中的鸟嘌呤8位碳原子产生,只能通过DNA氧化损伤产生,在体内稳定存在,不易代谢,是目前国际上公认的评价DNA氧化损伤和氧化应激状态的敏感指标[21]。
敌草快能利用分子氧产生O2-·和H2O2,继而产生其他自由基,诱导细胞过氧化反应的发生[22],已被广泛应用于氧化应激模型的建立[10-12]。因此,本试验选取敌草快作为氧化应激诱导剂,攻毒剂量为0.1 mmol/kg BW,攻毒后12 h后测定血浆及组织抗氧化指标。结果发现,腹腔注射敌草快大鼠血浆和肝脏、肾脏、回肠中T-AOC,CAT、SOD和GSH-Px活性以及GSH含量急剧下降,8-OHdG含量显著上升,表明氧化应激模型建立成功。
研究发现FOs对二价铁离子(Fe2+)、H2O2和·OH均具有较强的清除能力[23-25]。本试验结果显示,灌胃一定量的麦麸FOs可显著提高敌草快致氧化应激大鼠血浆和肝脏、肾脏、回肠中的T-AOC,SOD和GSH-Px活性以及GSH含量,显著降低DNA氧化损伤产物8-OHdG的含量,表明麦麸FOs可以通过提高抗氧化酶活性和抗氧化物质含量,有效缓解大鼠氧化应激。Wang等[26]研究发现,饲喂160 mg/kg FOs 4周后,大鼠血清中SOD、CAT和GSH-Px活性与对照组相比分别提高56.7%、24.4%和23.0%。余晓红等[27]研究也表明FOs对小鼠红细胞体外自氧化溶血有显著抑制效果,且存在剂量效应关系,并且进一步研究发现FOs可以显著提高荷瘤小鼠组织中SOD和GSH-Px活性,降低MDA含量。Rondini等[28]研究显示,给AAPH诱导的氧化应激大鼠饲喂FOs显著提高了其血浆中SOD、CAT和GSH-Px活性。上述研究结果均表明FOs可通过清除自由基,增强非酶成分和抗氧化酶系表达,保护机体免受氧化应激损伤。
FOs是由阿魏酸和低聚糖两部分通过酯键结合而成的化合物,进入体内经消化道部分可代谢分解成游离阿魏酸和低聚糖[29],同时具有酚类物质的活性和低聚糖的特点[16],且疏水性的阿魏酸和亲水性的低聚糖存在协同作用,FOs的抗氧化功能明显强于阿魏酸。阿魏酸不饱和侧链中含有的酚羟基和苯氧基可终止自由基连链反应,防止自由基破坏细胞膜,保持细胞完整性[30]。Gerin等[31]试验表明阿魏酸(50 mg/kg)可以缓解由甲醛造成的大鼠肝脏损伤,显著提高肝脏中T-AOC,GSH-Px和SOD活性;廖长秀等[32]和计一平[33]进一步研究发现阿魏酸钠同样具有显著提高大鼠组织中SOD活性的功能。同时,低聚糖也具有很强的抗氧化作用,可以通过促进SOD和GSH-Px等抗氧化酶的表达,消除体内的O2-·[34]。此外,研究发现小麦麸皮经木聚糖酶水解和出芽短梗霉发酵均可获得阿魏酰低聚木糖[14, 35]。低聚木糖同样具有很强的抗氧化功能,研究显示灌胃低聚木糖可以显著提高小鼠血液和肝脏中CAT和GSH-Px活性[36];饲粮中添加0.02%低聚木糖可提高生长猪血清中GSH-Px活性,增强血清抗氧化性能[37]。本试验结果表明,灌胃200、400 mg/kg BW麦麸FOs后,敌草快致氧化应激大鼠血浆、肝脏、肾脏和回肠中部分抗氧化指标可恢复到正常生理状态水平,一定程度上表明麦麸FOs可以提高抗氧化酶活性和抗氧化物质含量,有效缓解因氧化应激所造成的机体抗氧化能力下降;但灌胃100 mg/kg BW麦麸FOs的大鼠肝脏中T-AOC高于灌胃200、400 mg/kg BW麦麸FOs的大鼠,具体原因有待进一步研究。此外,本试验中肝脏中多种抗氧化酶活性及GSH含量对灌胃麦麸FOs响应较其他组织更为显著,已有研究表明敌草快对动物产生毒性的主要靶器官是肝脏[22],这可能是本试验中灌胃麦麸FOs对肝脏组织氧化损伤具有更好缓解效果的原因。
维生素C作为公认的抗氧化剂之一,在氧化还原代谢反应中起重要的调节作用[38]。本试验发现,灌胃100 mg/kg BW维生素C对氧化应激大鼠肝脏中CAT、SOD和GSH-Px活性和GSH含量无显著影响,但可显著提高大鼠肾脏中T-AOC和GSH-Px活性以及回肠中T-AOC活性和GSH含量,显著降低肝脏、肾脏和回肠中8-OHdG含量,表明灌胃维生素C在一定程度上可缓解敌草快诱导的氧化应激,但对机体抗氧化能力降低的缓解作用不及灌胃200、400 mg/kg BW麦麸FOs。该结果与Zhang等[6]研究结果不相符,原因可能是本试验中维生素C灌胃剂量(100 mg/kg BW)相对较低。
4 结论① 混菌发酵小麦麸皮并利用Amberlite XAD-2柱进行分离纯化获得的麦麸FOs浓度较高,达到0.059 mmol/g。
② 腹腔注射敌草快抑制大鼠抗氧化酶分泌并造成机体的氧化损伤。
③ 在敌草快引起的应激状态下,灌胃麦麸FOs可以有效提高大鼠血浆和组织中抗氧酶活性和GSH含量,降低DNA氧化应激代谢产物8-OHdG含量,有效改善机体抗氧化能力的降低。
| [1] |
赵东平, 杨文钰, 陈兴福. 阿魏酸的研究进展[J]. 时珍国医国药, 2008, 19(8): 1839-1841. |
| [2] |
ISHⅡ T. Structure and functions of feruloylated polysaccharides[J]. Plant Science, 1997, 127(2): 111-127. DOI:10.1016/S0168-9452(97)00130-1 |
| [3] |
葛丽花. 阿魏酸低聚糖的制备及其抗氧化性质的研究[D]. 硕士学位论文. 哈尔滨: 东北林业大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10225-2007187856.htm
|
| [4] |
曾凤彩. 酶解玉米麸皮制备阿魏酰低聚糖及抗氧化性质的研究[D]. 硕士学位论文. 齐齐哈尔: 齐齐哈尔大学, 2012. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=lsys201202008&dbname=CJFD&dbcode=CJFQ
|
| [5] |
YAO S W, WEN X X, HUANG R Q, et al. Protection of feruloylated oligosaccharides from corn bran against oxidative stress in PC 12 Cells[J]. Journal of Agricultural and Food Chemistry, 2014, 62(3): 668-674. DOI:10.1021/jf404841c |
| [6] |
ZHANG H J, ZHANG S S, WANG J, et al. Wheat bran feruloyl oligosaccharides protect against AAPH-induced oxidative injury via p38MAPK/PI3K-Nrf2/Keap1-MafK pathway[J]. Journal of Functional Foods, 2017, 29: 53-59. DOI:10.1016/j.jff.2016.12.009 |
| [7] |
解春艳. 茶薪菇发酵制备麦麸膳食纤维与阿魏酰低聚糖及其生物活性研究[D]. 博士学位论文. 南京: 南京农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012271329.htm
|
| [8] |
陈洲. 济麦22麦麸制备阿魏酰低聚糖及其生理活性研究[D]. 硕士学位论文. 泰安: 山东农业大学, 2014. http://d.g.wanfangdata.com.cn/Thesis_Y3031967.aspx
|
| [9] |
焦昆鹏, 朱文学, 马丽苹, 等. 玉米麸皮发酵法制备阿魏酰低聚糖及膳食纤维的研究[J]. 食品科技, 2014(8): 172-176. |
| [10] |
石璟. 白藜芦醇对肥胖妊娠SD大鼠胚胎存活及后代抗氧化能力的研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2012.
|
| [11] |
郑萍, 余冰, 田刚, 等. 精氨酸对氧化应激仔猪生长性能和血浆游离氨基酸浓度的影响[J]. 中国畜牧杂志, 2012, 48(21): 38-42. DOI:10.3969/j.issn.0258-7033.2012.21.011 |
| [12] |
郭志有. α-硫辛酸对肉鸡抗氧化的影响及其作用机制研究[D]. 博士学位论文. 南京: 南京农业大学, 2014.
|
| [13] |
LU T, PIAO X L, ZHANG Q, et al. Protective effects of Forsythia suspensa extract against oxidative stress induced by diquat in rats[J]. Food and Chemical Toxicology, 2010, 48(2): 764-770. DOI:10.1016/j.fct.2009.12.018 |
| [14] |
姚惠源, 胡敏, 袁小平, 等. 小麦麸皮阿魏酰低聚糖的分离与结构分析[J]. 食品工业科技, 2009(3): 79-83. |
| [15] |
SAULNIER L, VIGOUROUX J, THIBAULT J F. Isolation and partial characterization of feruloylated oligosaccharides from maize bran[J]. Carbohydrate Research, 1995, 272(2): 241-253. DOI:10.1016/0008-6215(95)00053-V |
| [16] |
袁小平. 酶解麦麸制备阿魏酰低聚糖及其生物活性的研究[D]. 博士学位论文. 无锡: 江南大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10295-2006191798.htm
|
| [17] |
王秋林, 王浩毅, 王树人. 氧化应激状态的评价[J]. 中国病理生理杂志, 2005, 21(10): 2069-2074. DOI:10.3321/j.issn:1000-4718.2005.10.049 |
| [18] |
魏涛, 高玉鹏, 杜忍让, 等. 复合酶制剂对蛋鸡血清抗氧化酶系与肠道形态学影响[J]. 饲料与畜牧, 2011(1): 13-16. |
| [19] |
VALKO M, RHODES C J, MONCIL J, et al. Free radicals, metals and antioxidants in oxidative stress-induced cancer[J]. Chemico-Biological Interactions, 2006, 160(1): 1-40. DOI:10.1016/j.cbi.2005.12.009 |
| [20] |
张丹丹, 娄鹏博, 李振. GPxs家族的研究进展[J]. 农业技术与装备, 2012(15): 66-67. |
| [21] |
梅礼军, 王林川. 8-羟基脱氧鸟苷水平对糖尿病患者胰岛功能损害的相关性研究[J]. 昆明医科大学学报, 2013(8): 84-87. |
| [22] |
HIGUCHI M, OSHIDA J, ORINO K, et al. Wheat bran protects fischer-344 rats from diquat-induced oxidative stress by activating antioxidant system:selenium as an antioxidant[J]. Bioscience, Biotechnology, and Biochemistry, 2011, 75(3): 496-449. DOI:10.1271/bbb.100719 |
| [23] |
KATAPODIS P, VARDAKOU M, KALOGERIS E, et al. Enzymic production of a feruloylated oligosaccharide with antioxidant activity from wheat flour arabinoxylan[J]. European Journal of Nutrition, 2003, 42(1): 55-60. DOI:10.1007/s00394-003-0400-z |
| [24] |
RAO R S P, MURALIKRISHNA G. Water soluble feruloyl arabinoxylans from rice and ragi:changes upon malting and their consequence on antioxidant activity[J]. Phytochemistry, 2006, 67(1): 91-99. DOI:10.1016/j.phytochem.2005.09.036 |
| [25] |
YUAN X P, WANG J, YAO H Y, et al. Antioxidant activity of feruloylated oligosaccharides from wheat bran[J]. Food Chemistry, 2005, 90(4): 759-764. DOI:10.1016/j.foodchem.2004.05.025 |
| [26] |
WANG J, SUN B G, CAO Y P, et al. Wheat bran feruloyl oligosaccharides enhance the antioxidant activity of rat plasma[J]. Food Chemistry, 2010, 123(2): 472-476. DOI:10.1016/j.foodchem.2010.05.033 |
| [27] |
余晓红. 出芽短梗霉发酵麦麸制备阿魏酰低聚糖及其生物活性研究[D]. 博士学位论文. 南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016042022.htm
|
| [28] |
RONDINI L, PEYRAT-MAILLARD M N, MARSSET-BAGLIERI A, et al. Bound ferulic acid from bran is more bioavailable than the free compound in rat[J]. Journal of Agricultural and Food Chemistry, 2004, 52(13): 4338-4343. DOI:10.1021/jf0348323 |
| [29] |
HAOHUI Z H, YUKARI E, HIROO S. Ferulic acid sugar esters are recovered in rat plasma and urine mainly as the sulfoglucuronide of ferulic acid[J]. The Journal of Nutrition, 2003, 133(5): 1355-1361. |
| [30] |
KANASKI J, AKSENOVA M, STOYANOVA A, et al. Ferulic acid antioxidant protection against hydroxyl and peroxyl radical oxidation in synaptosomal and neuronal cell culture systems in vitro:structure-activity studies[J]. The Journal of Nutritional Biochemistry, 2002, 13(5): 273-281. DOI:10.1016/S0955-2863(01)00215-7 |
| [31] |
GERIN F, ERMAN H, ERBOGA M, et al. The effects of ferulic acid against oxidative stress and inflammation in formaldehyde-induced hepatotoxicity[J]. Inflammation, 2016, 39(4): 1377-1386. DOI:10.1007/s10753-016-0369-4 |
| [32] |
廖长秀, 汪晖, 彭仁琇, 等. 阿魏酸钠对甘油致小鼠肾脏氧化性损伤的拮抗效应[J]. 药学学报, 2003, 38(12): 900-903. DOI:10.3321/j.issn:0513-4870.2003.12.006 |
| [33] |
计一平. 阿魏酸钠抗肝纤维化体内作用研究[D]. 硕士学位论文. 上海: 第二军医大学, 2001. http://cdmd.cnki.com.cn/article/cdmd-90024-2001003170.htm
|
| [34] |
吴海涛, 王新峰, 刘云芳. 低聚糖对麻花鸡肝脏抗氧化功能的影响[J]. 中国饲料, 2012(5): 21-23. |
| [35] |
YU X H, GU Z X. Aureobasidium pullulans fermented feruloyl oligosaccharide:optimization of production, preliminary characterization, and antioxidant activity[J]. BioResources, 2014, 9(1): 241-255. |
| [36] |
晁正. 麦麸中低聚木糖的制备及性质研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2014. http://d.wanfangdata.com.cn/Thesis/J0121273
|
| [37] |
冯静. 低聚果糖和低聚木糖对荣昌断奶仔猪生产性能和血液理化指标的影响[D]. 硕士学位论文. 重庆: 重庆大学, 2010.
|
| [38] |
杨建辉. 维生素C生物学活性研究进展[J]. 现代诊断与治疗, 2012, 23(5): 434-437. |




