单糖在肠道的吸收主要依靠转运载体实现跨膜运输,目前已发现三大类单糖转运载体家族,分别为Na+依赖性葡萄糖转运载体(sodium-dependent glucose transporters,SGLTs)、易化葡萄糖转运载体(facilitated glucose transporters,GLUTs)以及最近在植物和细菌中鉴定发现的糖外排转运蛋白(sugars will eventually be exported transporters, SWEETs)[1-2]。SGLTs对单糖的转运依赖于Na+浓度梯度,与葡萄糖、半乳糖等实现同向转运,目前已发现6个亚基型,其中肠道中主要有SGLT1介导葡萄糖和半乳糖的跨膜转运。GLUTs属于主要易化超家族(major facilitator superfamily,MFS),是一类含有约500个氨基酸的蛋白质,已发现14个GLUTs成员,根据氨基酸序列相似性分为3个亚群[3],第1类(class1)包括GLIT1~4和14;第2类(class2)包括GLUT5、7、9和11;第3类(class3)包括GLUT6、8、10、12和13(HMIT)。其中GLUT5主要存在于小肠上皮细胞顶膜,实现果糖的跨膜转运,GLUT2在基底侧膜转出葡萄糖、果糖和半乳糖等单糖。对SWEETs的研究主要集中在细菌和植物,有关哺乳动物小肠上皮SWEETs转运载体的结构和功能研究较少,其可能主要转运单糖和二糖。
葡萄糖是生命活动的主要能源物质,它在肠道的消化吸收是其利用的关键。葡萄糖在肠道上皮的转运主要依赖于SGLT1,但在进食后,肠腔葡萄糖浓度急剧升高,SGLT1达最大转运速度,高转运能力的GLUT2会短时间内募集到肠道上皮细胞顶膜参与葡萄糖吸收。最新研究表明,GLUT2募集到顶膜的调控过程依赖于蛋白激酶CβⅡ(PKCβⅡ)。机体通过这一适应机制使葡萄糖的吸收最大化。高浓度的葡萄糖通过SGLT1和GLUT2的吸收还能作为一种信号途径调节胃肠激素的释放。葡萄糖的转运是其利用的一个限速步骤,也是一个受高度调控的过程,很多影响葡萄糖吸收的因素都是通过影响葡萄糖转运载体的基因转录水平、mRNA稳定性和蛋白水平发挥作用的。本文将从SGLT1和GLUT2的结构、功能和影响其表达的因素这几个方面综述葡萄糖在肠道上皮的吸收机制。
1 肠道上皮主要葡萄糖转运载体 1.1 SGLT1SGLT1,也称为Na+-葡萄糖转运载体1或Na+/葡萄糖共转运载体1,由人类SLC5A1基因编码,属于APC(amino acid polyamine)超家族[4],在不同物种间同源性较高。结构上,SGLT1含有14个跨膜螺旋(transmembrane helices,TMs),含有1个APC超家族的核心结构——“LeuT”折叠,由TM2~6和TM7~11组成1对“5+5”反向重复序列,这些TM束共同形成了SGLT1的活性中心,活性中心有许多保守残基,这些氨基酸残基通过氢键与葡萄糖分子结合[5]。这些结构特征是SGLT1转运功能的基础,SGLT1的转运过程主要依赖于外向开放构型(outward-facing structure)和内向开放构型(inward-facing structure)2种构型的变化,通过2种构型的变化实现Na+与葡萄糖共转运[6]。SGLT1在成年动物小肠绒毛上皮细胞多表达,也在隐窝细胞高效表达[7]。SLGT1在小肠中的表达水平依次为空肠 > 十二指肠 > 回肠,在大肠上皮没有SLGT1表达。SGLT1的主要底物为葡萄糖和半乳糖[米氏常数(Km)≈0.5 mmol/L],以Na+:葡萄糖为2:1和Na+:半乳糖为1:1的化学计量比实现同向跨膜转运。SGLT1转运的单糖都必须是吡喃糖和环形结构形式,减少单糖上1~6个羟基数量会降低与SGLT1的表观亲和力5~200倍,糖环上的某些羟基被替代后会显著降低与SGLT1的亲和力,除葡萄糖和半乳糖外,SGLT1还能转运β-疏水性糖苷类物质,如苯基-β-D-葡萄糖[4]。另外,SGLT1还能通过葡萄糖转运途径被动运输水分子,由于检测方法的不同,渗透性在4.5×10-16~2.7×10-13 cm3/s之间,比水通道低1~3个数量级,但由于SGLT1在肠道上皮的高表达,SGLT1可能作为水在肠道的主要吸收途径[8]。根皮苷属于黄酮类,是SGLT1典型的竞争性抑制剂,已被用于SGLT1功能研究和二型糖尿病的预防和治疗。
1.2 GLUT2GLUT2,也称为易化单糖转运蛋白2或Na+非依耐性单糖转运蛋白2,由人类SLC2A2基因编码,属于MFS。结构上,GLUT2含有12个跨膜α螺旋,N端TM1~6和C端TM7~12束组成1对反向重复结构——MFS折叠,GLUT2活性中心氨基酸残基以氢键方式与葡萄糖分子结合,通过构象改变完成对单糖的转运[9]。GLUT2的信息最早来自小鼠和人肝脏cDNA库。它广泛分布在体内组织细胞,包括肝脏、小肠、肾脏、胰岛β细胞,同时还存在于神经细胞、星形胶质细胞和脑室膜细胞,而且功能各异[10]。GLUT2在肠道的功能主要是位于肠道上皮细胞基底侧膜负责转出细胞内单糖,在肠腔高葡萄糖诱导下,也能募集到顶膜参与葡萄糖吸收。但是相比其他葡萄糖转运体,它对葡萄糖的表观亲和力很低(Km≈17 mmol/L),还能以半乳糖(Km≈92 mmol/L)、甘露糖(Km≈125 mmol/L)、果糖为底物(Km≈76 mmol/L),但是对葡萄糖胺却有高亲和力(Km≈0.8 mol/L)[3]。Corpe等[11]报道,GLUT2还能转运维生素C及其氧化态形式脱氢抗坏血酸(Km≈2.33 mmol/L)。细胞松弛素b和根皮素是GLUT2的强抑制剂。
2 葡萄糖转运载体的功能及作用机制 2.1 SGLT1葡萄糖和半乳糖在小肠上皮主要依靠SGLT1转运吸收,SGLT1通过细胞外高Na+浓度建立的电化学梯度驱动底物分子与Na+共转运,细胞膜内外电化学梯度和细胞内的渗透压的平衡主要通过Na+, K+-ATP酶的作用来维持[12]。首先,葡萄糖分子的特异性结合位点位于1组反向重复TMs(TM2~6和TM7~11)构成的结构中心,在磷脂双分子层近中心的位置,在其周围还有2个不同亲和力的Na+结合位点,这些TMs束上有很多保守的氨基酸残基,它们大多是极性或芳香族氨基酸,极性氨基酸残基通过氢键与糖环上羟基结合,芳香族氨基酸与吡喃糖环发生堆叠,这些氨基酸残基突变会导致严重的葡萄糖和半乳糖吸收障碍;然后,另一些保守的疏水性氨基酸位于TMs的膜内外两端形成封闭的“门”,将单糖分子包围在中心部位,形成“三明治”结构,在转运过程中,SGLT1首先形成外向开放构型,Na+从外侧进入SGLT1并与结合位点结合,促进TMs束的重新排列,暴露底物结合位点,增大与葡萄糖分子的亲和力,葡萄糖分子结合后进一步引起TMs重排使膜外侧门封闭;随之,TMs细胞内侧片段构象发生改变,细胞内侧门打开形成内向开放构型,向细胞内释放糖分子和Na+;最后,SGLT1回到转运前构象,重新暴露其特异性结合位点,完成下一个转运周期[5]。
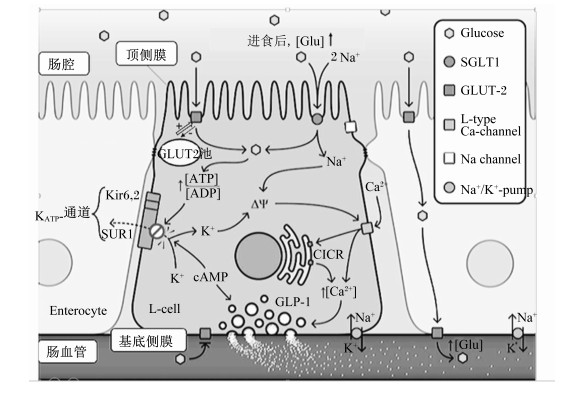
进食后,为了维持血糖浓度的稳定,消化道分泌细胞能够分泌胃肠激素促进胰岛素分泌,其中抑胃肽(GIP)和胰高血糖样多肽1(GLP-1)的作用最强。GIP与GLP-1在肠道上皮的释放与SGLT1与GLUT2的功能密切相关。Röder等[13]报道,SGLT1缺陷小鼠GIP和GLP-1浓度分别降低了近6和10倍。进食后,肠腔葡萄糖浓度升高会诱导GLUT2募集到顶膜与SGLT1共同参与葡萄糖吸收,一方面,SGLT1共转运葡萄糖分子和Na+,使肠L细胞去极化,电压门控Ca2+通道打开,Ca2+内流,并引发细胞内Ca2+从钙库释放,刺激GLP-1通过胞吐作用释放(图 1);另一方面,葡萄糖进入细胞后代谢产生的ATP使ATP敏感性K+通道关闭,提高膜内外电势差,增加GLP-1的释放[14]。味觉受体T1R2+T1R3能够与肠腔葡萄糖或葡萄糖类似物结合,使α-味导素活化,通过下游信号途径参与GIP和GLP-1的释放[15]。事实上,很多可促进胰岛素分泌的胃肠激素如胆囊收缩素(CCK)、酪酪肽(PYY)和胰高血糖样多肽2(GLP-2)以及神经降压素等在肠内分泌细胞的分泌都依赖于上述机制[16-17]。总之,SGLT1和GLUT2的功能不仅是作为单糖的转运载体,还能作为肠腔葡萄糖浓度变化的传感器,诱导体内糖代谢激素释放,维持正常血糖浓度,SGLT1也因此成为了尝试治疗二型糖尿病的靶点。
|
Enterocyte:肠道上皮细胞; L-cell:L-细胞; [Glu]:葡萄糖浓度; Glucose:葡萄糖分子; L-type Ca-channel:L型Ca通道; Nav-channel:电压敏感性钠通道voltage-sensitive Na channel; Na+/K+-pump:Na+/K+-泵; CICR:钙诱导的钙释放Ca-induced Ca release; GLP-1:胰高血糖样多肽1 glucagon-like peptide-1;KATP-通道:ATP敏感性钾通道ATP-sensitive K channels; Δψ:电势差electric potential difference; Kir6, 2和SUR1为KATP-通道的2个亚基Kir6, 2 and SUR1 were subunits for ATP-sensi-tive K channels。 图 1 SGLT1和GLUT2在肠道上皮的功能 Figure 1 The functions of SGLT1 and GLUT2 in intestinal epithelia[14] |
大肠杆菌D-木糖转运体XylE与人GLUTs有着20%~29%的同源序列,XylE结晶体作为MFS超家族的模型蛋白来研究。GLUT2的转运机制与XylE的转运机制相似,在转运过程中,细胞外溶质通过一个很狭窄的通道进入转运中心,并与转运中心极性氨基酸通过氢键结合,这些氨基酸残基的任何一个发生错义突变都会完全废止其转运活性,之后GLUT2发生构象改变,这种构象改变使得底物结合位点交替暴露在膜内外两侧,从而完成对底物的转运,这一系列的构象改变依赖于TMs的重新排列、位置移动和TMs束内盐桥的形成和断裂[18]。相比SGLT1对葡萄糖的主动运输,GLUT2通过不耗能的方式顺浓度梯度转运葡萄糖。
在葡萄糖吸收的经典模型中,认为GLUT2只在肠道上皮细胞基底侧膜表达,主要从上皮细胞转出单糖进入血液循环系统。GLUT2是否能募集到肠道上皮顶侧膜参与葡萄糖和果糖的吸收一直具有争议,而且很多体外试验报道并未在顶侧膜检测到GLUT2,或GLUT2密度很低,这可能是检测手段的差异。顶膜GLUT2能通过4种抗体分别在其结构的C端、N端区域以及细胞内外侧环表位检测到,但是通过C端抗体免疫组织化学方法不能检测到顶膜GLUT2[19]。进食后,肠腔葡萄糖浓度的急剧升高能够诱导GLUT2瞬时嵌入肠道上皮细胞顶膜,由于GLUT2有高转运能力和不易饱和的特点,能够协同SGLT1加快葡萄糖吸收[20]。GLUT2募集到顶膜具有重要的生理意义,一方面,适应肠腔的高浓度葡萄糖提高葡萄糖的吸收,另一方面,对肠道上皮细胞本身来说,GLUT2对葡萄糖的Na+非依赖性被动转运不会给肠细胞增加由于SGLT1转运带来的离子和渗透负担。
3 影响葡萄糖转运载体表达的因素 3.1 底物水平动物体在进食前后,肠腔中葡萄糖的浓度变化巨大,进食后,食物中的碳水化合物大量分解产生葡萄糖,使肠腔葡萄糖浓度显著升高。相比进食前,SGLT1和GLUT2在肠道上皮细胞顶膜的表达也显著增加,以加强对葡萄糖的吸收[21]。肠腔中葡萄糖分子是SGLT1和GLUT2表达调控的关键。葡萄糖分子与肠道上皮细胞味觉受体T1R2+T1R3结合,通过活化偶联的G蛋白(α-味导素)激活下游信号途径。一方面,激活磷脂酶Cβ2(PLCβ2)或蛋白激酶A(PKA),PLCβ2产生第二信使甘油二酯,它与细胞中的Ca2+共同活化PKCβⅡ,活化的PKCβⅡ是GLUT2募集到顶膜过程的关键[22]。PKCβⅡ通过磷酸化激活和泛素化降解适应肠腔葡萄糖浓度,调控GLUT2由细胞内储备池通过胞吐作用瞬时嵌入到肠道上皮细胞顶膜[23];另一方面,T1R2+T1R3激活,引起味蛋白等下游信号转导途径,导致GLP-2释放,GLP-2通过作用于肠神经元的受体胰高血糖素样肽2受体(GLP-2R),将冲动信号传导到小肠上皮细胞基底侧,肠神经元释放神经肽,作用于吸收上皮细胞的G蛋白偶联受体,使细胞内环磷酸腺苷(cAMP)水平升高[24]。cAMP通过RNA结合蛋白HuR与mRNA非编码区3′富含尿苷元件(URE)形成cAMP依赖性复合物调节mRNA半衰期,增加SGLT1 mRNA稳定性,上调SGLT1蛋白的表达[25]。机体还通过组蛋白修饰调控SGLT1的葡萄糖依赖性表达。研究表明,高淀粉低脂饲粮通过SGLT1组蛋白H3K4的先甲基化和H3/H4的后乙酰化在转录水平调节SGLT1表达[26]。肠细胞内合成的SGLT1蛋白约2/3存在于胞内的SGLT1池,SGLT1由储备池通过胞吐途径嵌入到细胞膜的过程为葡萄糖的吸收提供另一种蛋白水平调节途径。最近的研究发现,与胞吐相关的蛋白RS1(由人类RSC1A1基因编码)的N端域有许多磷酸化位点,不同位点的磷酸化以及与不同受体结合与抑制不同转运蛋白以胞吐方式运输至细胞膜有关,当肠腔存在高浓度葡萄糖时,葡萄糖通过抑制RS1与高尔基体反面网络上的受体鸟氨酸脱羧酶(ODC1)结合,减弱RS1对SGLT1囊泡以胞吐途径释放SGLT1到细胞膜上的阻碍作用,短期内上调SGLT1蛋白的表达[27]。
3.2 激素水平激素对于体内能量平衡的维持尤为重要,它通过调节葡萄糖的合成与分解以及葡萄糖的吸收来维持血糖浓度的平衡。SGLT1启动子上有许多转录因子结合元件,其中特异性蛋白1(specificity protein,SP-1)、肝细胞核因子(hepatocyte nuclear factor,HNF-1)、核转录因子-κB(nuclear factor-kappa B,NF-κB)结合序列和cAMP应答元件是重要的SGLT1启动子序列[28-29]。表皮生长因子(EGF)对肠道具有保护作用,能够增加营养物质的吸收,降低炎症反应。EGF通过与其受体表皮生长因子受体(EGFR)结合,激活EGFR内在的酪氨酸激酶活性,引起下游信号转导途径,使cAMP效应结合蛋白(CBEP)磷酸化并与SGLT1的启动子结合,增加SGLT1转录,CBEP还可能在维持SGLT1基础表达上起关键作用[30]。Lane等[31]在初生小鼠母乳替代品中添加胰岛样生长因子(IGF)Ⅰ、Ⅱ,发现IGFⅠ、Ⅱ显著增加了空肠中段SGLT1和GLUT2 mRNA的表达量。IGF对SGLT1的调节与EGF模式相似,IGF与酪氨酸激酶受体胰岛素样生长因子Ⅰ受体(IGF-ⅠR)结合后调节SGLT1基因的表达[32]。生长素通过生长激素促分泌素受体1a(GHS-R1a)以及磷脂酶C(PLC)和蛋白激酶C(PKC)途径提高SGLT1和GLUT2的转录水平[33]。肠道存在相对独立的局部肾素-血管经张素系统,Casselbrant等[34]通过药理学分析发现,血管紧张素Ⅱ(AngⅡ)2型受体激活提高了SGLT1介导的空肠黏膜对葡萄糖的吸收,AngⅡ1型受体激活则起抑制作用。而这种调节作用是否是通过调节SGLT1转录以及其调节通路来实现的还需要进一步研究。事实上,很多与机体能量平衡相关的激素(胰岛素、胰高血糖素和甲状腺素)都通过影响SGLT1的转录来调节肠道葡萄糖吸收[35-36]。
3.3 炎症肠道炎症是重要的肠道疾病,脂多糖(LPS)诱导的体内炎症或败血症模型中,通过NF-κB和丝裂原活化蛋白激酶(MAPK)(包括3个亚族:p38、ERK和JNK)途径引发下游PKC和PKA信号途径等一系列级联反应,促进促炎因子白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)以及其他介质一氧化氮的产生[37]。其中,LPS、TNF-α和IL-1β都会抑制葡萄糖和半乳糖的吸收。这种抑制作用涉及PKC、PKA、MAPK和NF-κB途径以及蛋白酶体对SGLT1的调控,其中,PKC降低SGLT1蛋白的周转速率,调节含有SGLT1的囊泡的内吞作用;与PKC相反,PKA激活能够提高SGLT1蛋白的转运速率,这种调控作用主要发生在SGLT1蛋白水平和转运活性水平[38]。也有报道,炎症条件下,SGLT1基因表达下调同SP-1和HNF-1与SGLT1启动子元件特异性结合有关[39]。
3.4 应激大鼠长期的心理应激和肉仔鸡腹腔注射地塞米松模拟的应激条件下,GLUT2蛋白和mRNA水平在空肠上皮细胞顶膜中显著增加,而SGLT1的最大转运速率和mRNA水平显著降低,蛋白水平未改变[40-41]。与上述报道不同,Shepherd等[42]报道,环境应激和地塞米松诱导的应激模型中,GLUT2蛋白的表达在大鼠肠上皮细胞顶膜受抑制,与之矛盾的是与GLUT2转位有关的PKCβⅡ表达却增加。另外,生长猪在长期热应激条件下表现出十二指肠和空肠SGLT1 mRNA表达的增加[43]。在Ebrahimi等[44]的报道中,铅诱导肉仔鸡产生氧化应激下,SGLT1和GLUT2 mRNA的表达都显著降低。由于动物种类和应激源的不同,动物可能反映出不同的应激机制。通常,在应激条件下,下丘脑-垂体-肾上腺皮质轴激活并释放糖皮质激素。糖皮质激素主要作用是促进葡萄糖的生成和吸收。Reichardt等[45]报道,糖皮质激素主要通过细胞质内的糖皮质激素受体(GR)二聚化并与DNA启动子上的结合元件结合途径上调SGLT1、血清和糖皮质激素诱导蛋白激酶1(SGK1)和钠氢交换蛋白3基因的表达。SGK1介导了SGLT1蛋白的糖皮质激素依赖性上调,它通过抑制SGLT1的泛素化降解增加其蛋白水平[46],钠氢交换蛋白3与SGLT1转运活性有关。
总之,在应激状态下,一定程度降低由SGLT1介导的葡萄糖耗能转运过程,提高GLUT2介导的易化转运对动物是有利的。
3.5 肠道内环境肠道是营养物质消化吸收的场所,肠道的内环境直接影响肠道上皮对葡萄糖的吸收。α-淀粉酶是主要的胰腺蛋白酶和淀粉水解酶,它能与十二指肠高度糖基化的刷状缘膜上的糖蛋白配体特异性结合,其中包括蔗糖-麦芽糖同工酶和SGLT1。α-淀粉酶和蔗糖-麦芽糖同工酶结合会加快淀粉分解产生大量葡萄糖。但高浓度α-淀粉酶会与SGLT1结合抑制其对葡萄糖的吸收,这可能与α-淀粉酶与SGLT1结合产生位阻有关[47],但抑制作用是短暂的,α-淀粉酶会通过胞吞途径内化至细胞质经溶酶体降解,解除对SGLT1的抑制作用[48]。这种短时间内对葡萄糖吸收的抑制可能具有2个生理意义,一方面,避免淀粉的快速分解使血糖浓度急剧升高;另一方面,α-淀粉酶内吞后经溶酶体分解可为细胞提供氨基酸补充。SGLT1的转运过程是Na+和电压依赖性的,肠道中的电解质平衡和酸碱平衡必然影响SGLT1的转运功能。Kane等[49]发现,SGLT1对葡萄糖的亲和力随pH的增加而增加。肠道微生物是肠道功能的一部分,微生物区系的改变也会引起肠道吸收功能的改变。Diao等[50]发现不同猪种肠道微生物在属水平上存在明显差异,这些差异会导致肠道形态和SGLT1的表达量改变。
3.6 其他SGLT1的表达还受昼间节率的影响。Fatima等[51]发现小鼠小肠的SGLT1和GLUT2蛋白水平在03:00—09:00达峰值。这种生理节律可能与生物钟基因相关,这些基因通过正向负向反馈环路调控SGLT1启动子区域,维持24 h生理周期[52]。SGLT1的表达还与动物生长阶段有关。另外,用来治疗肥胖症和二型糖尿病的手术,如十二指肠空肠吻合术、胃空肠吻合术、袖状胃减容术、空肠回肠吻合术和回肠切除术等,都会适应性改变肠道上皮细胞SGLT1和GLUT2的表达[53-54]。其中,回肠切除术通过增加醛固酮分泌,经下游信号途径调节SGLT1和GLUT2表达[55]。环境因素对肠道形态和功能也有一定的影响,Yalcin等[56]报道,种蛋孵化前的存放时间、孵化温度都会影响仔鸡孵化过程中SGLT1的表达。
4 小结肠道葡萄糖转运是葡萄糖吸收代谢的重要因素,也是调节血糖浓度稳定、治疗肥胖症和高血糖的药物靶点。为了适应肠道内环境和外界环境刺激,机体在转录、mRNA和蛋白各个水平调节SGLT1和GLUT2在肠道上皮顶膜的表达,但各个因素作用的信号通路、调节水平等分子机制尚不明确,还有待于进一步研究。结构特征是SGLT1和GLUT2功能的基础,目前SGLT1和GLUT2的晶体结构还未直接获得,结构信息都来源于其同源体。另外,能否通过葡萄糖转运载体的调节,从分子层面提高葡萄糖在肠腔的消化利用率,调节体内的葡萄糖平衡也是未来分子营养学研究的方向。总之,了解肠道上皮葡萄糖转运载体的作用和调节的分子机制不仅具有很好的理论意义,还能为动物营养过程的精细化调控提供思路。
| [1] |
FENG L, FROMMER W B. Structure and function of semisweet and sweet sugar transporters[J]. Trends in Biochemical Sciences, 2015, 40(8): 480-486. DOI:10.1016/j.tibs.2015.05.005 |
| [2] |
CHEN L Q, CHEUNG L S, FENG L, et al. Transport of sugars[J]. Annual Review of Biochemistry, 2015, 84(1): 865-894. DOI:10.1146/annurev-biochem-060614-033904 |
| [3] |
MUECKLER M, THORENS B. The SLC2(GLUT) family of membrane transporters[J]. Molecular Aspects of Medicine, 2013, 34(2/3): 121-138. |
| [4] |
WRIGHT E M, LOO D D, HIRAYAMA B A. Biology of human sodium glucose transporters[J]. Physiological Reviews, 2011, 91(2): 733-794. DOI:10.1152/physrev.00055.2009 |
| [5] |
FAHAM S, WATANABE A, BESSERER G M, et al. The crystal structure of a sodium galactose transporter reveals mechanistic insights into Na+/sugar symport[J]. Science, 2008, 321(5890): 810-814. DOI:10.1126/science.1160406 |
| [6] |
SALA-RABANAL M, HIRAYAMA B A, LOO D D, et al. Bridging the gap between structure and kinetics of human SGLT1[J]. American Journal of Physiology Cell Physiology, 2012, 302(9): C1293-C1305. DOI:10.1152/ajpcell.00397.2011 |
| [7] |
YANG C B, ALBIN D M, WANG Z R, et al. Apical Na+-D-glucose cotransporter 1(SGLT1) activity and protein abundance are expressed along the jejunal crypt-villus axis in the neonatal pig[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2010, 300(1): G60-G70. |
| [8] |
EROKHOVA L, HORNER A, OLLINGER N, et al. The sodium glucose cotransporter SGLT1 is an extremely efficient facilitator of passive water transport[J]. Journal of Biological Chemistry, 2016, 291(18): 9712-9720. DOI:10.1074/jbc.M115.706986 |
| [9] |
SUN L F, ZENG X, YAN C Y, et al. Crystal Structure of a bacterial homologue of glucose transporters GLUT1-4[J]. Nature, 2012, 490(7420): 361-366. DOI:10.1038/nature11524 |
| [10] |
THORENS B. GLUT2, glucose sensing and glucose homeostasis[J]. Diabetologia, 2015, 58(2): 221-232. DOI:10.1007/s00125-014-3451-1 |
| [11] |
CORPE C P, ECK P, WANG J, et al. Intestinal dehydroascorbic acid (DHA) transport mediated by the facilitative sugar transporters, GLUT2 and GLUT8[J]. Journal of Biological Chemistry, 2013, 288(13): 9092-9101. DOI:10.1074/jbc.M112.436790 |
| [12] |
CHEN L H, TUO B G, DONG H. Regulation of intestinal glucose absorption by ion channels and transporters[J]. Nutrients, 2016, 8(1): 43-53. DOI:10.3390/nu8010043 |
| [13] |
RÖDER P V, GEILLINGER K E, ZIETEK T S, et al. The role of SGLT1 and GLUT2 in intestinal glucose transport and sensing[J]. Plos One, 2014, 9(2): e89977. DOI:10.1371/journal.pone.0089977 |
| [14] |
KUHRE R E, FROST C R, SVENDSEN B, et al. Molecular mechanisms of glucose-stimulated GLP-1 secretion from perfused rat small intestine[J]. Diabetes, 2015, 64(2): 370-382. DOI:10.2337/db14-0807 |
| [15] |
MARGOLSKEE R F, DYERJ, KOKRASHVILI Z, et al. T1R3 and gustducin in gut sense sugars to regulate expression of Na+-glucose cotransporter 1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(38): 15075-15080. DOI:10.1073/pnas.0706678104 |
| [16] |
KUHRE R E, BECHMANN L E, ALBRECHTSEN N J W, et al. Glucose stimulates neurotensin secretion from the rat small intestine by mechanisms involving SGLT1 and GLUT2, leading to cell depolarization and calcium influx[J]. American Journal of Physiology:Endocrinology and Metabolism, 2015, 308(12): E1123-E1130. DOI:10.1152/ajpendo.00012.2015 |
| [17] |
EGEROD K L, ENGELSTOFT M S, GRUNDDAL K V, et al. A major lineage of enteroendocrine cells coexpress CCK, secretin, GIP, GLP-1, PYY, and neurotensin but not somatostatin[J]. Endocrinology, 2012, 153(12): 5782-5795. DOI:10.1210/en.2012-1595 |
| [18] |
YAN N. Structural advances for the major facilitator superfamily (MFS) transporters[J]. Trends in Biochemical Sciences, 2013, 38(3): 151-159. DOI:10.1016/j.tibs.2013.01.003 |
| [19] |
AFFLECK J A, HELLIWELL P A, KELLETT G L. Immunocytochemical detection of GLUT2 at the rat intestinal brush-border membrane[J]. Journal of Histochemistry & Cytochemistry, 2003, 51(11): 1567-1574. |
| [20] |
KELLETT G L, BROT-LAROCHE E, MACE O J, et al. Sugar absorption in the intestine:the role of GLUT2[J]. Annual Review of Nutrition, 2008, 28(1): 35-54. DOI:10.1146/annurev.nutr.28.061807.155518 |
| [21] |
MORAN A W, AL-RAMMAHI M A, ARORA D K, et al. Expression of Na+/glucose co-transporter 1(SGLT1) in the intestine of piglets weaned to different concentrations of dietary carbohydrate[J]. British Journal of Nutrition, 2010, 104(5): 647-655. DOI:10.1017/S0007114510000954 |
| [22] |
COHEN M, KITSBERG D, TSYTKIN S, et al. Live imaging of GLUT2 glucose-dependent trafficking and its inhibition in polarized epithelial cysts[J]. Open Biology, 2014, 4(7): 140091. DOI:10.1098/rsob.140091 |
| [23] |
HELLIWELL P A, RUMSBY M G, KELLETT G L. Intestinal sugar absorption is regulated by phosphorylation and turnover of protein kinase C βⅡ mediated by phosphatidylinositol 3-kinase-and mammalian target of rapamycin-dependent pathways[J]. Journal of Biological Chemistry, 2003, 278(31): 28644-28650. DOI:10.1074/jbc.M301479200 |
| [24] |
SHIRAZI-BEECHEY S P, MORAN A W, BATCHELOR D J, et al. Glucose sensing and signalling; regulation of intestinal glucose transport[J]. Proceedings of the Nutrition Society, 2011, 70(2): 185-193. DOI:10.1017/S0029665111000103 |
| [25] |
LOFLIN P, LEVER J E. Hur binds a cyclic nucleotide-dependent, stabilizing domain in the 3' untranslated region of Na+/glucose cotransporter (SGLT1) mRNA[J]. FEBS Letters, 2001, 509(2): 267-271. DOI:10.1016/S0014-5793(01)03176-3 |
| [26] |
INOUE S, HONMA K, MOCHIZUKI K, et al. Induction of histone H3K4 methylation at the promoter, enhancer, and transcribed regions of the Si and SGLT1 genes in rat jejunum in response to a high-starch/low-fat diet[J]. Nutrition, 2015, 31(2): 366-372. DOI:10.1016/j.nut.2014.07.017 |
| [27] |
CHINTALAPATI C, KELLER T, MUELLER T D, et al. Protein Rs1(RSC1A1) downregulates the exocytotic pathway of glucose transporter SGLT1 at low intracellular glucose via inhibition of ornithine decarboxylase[J]. Molecular Pharmacology, 2016, 90(5): 508-521. DOI:10.1124/mol.116.104521 |
| [28] |
MARTÍN M G, WANG J, SOLORZANO-VARGAS R S, et al. Regulation of the human Na+-glucose cotransporter gene, SGLT1, by HNF-1 and Sp1[J]. American Journal of Physiology Gastrointestinal & Liver Physiology, 2000, 278(4): G591-G603. |
| [29] |
LEE H M, LEE O H, KIM K J, et al. Ginsenoside Rg1 promotes glucose uptake through activated AMPK pathway in insulin-resistant muscle cells[J]. Phytotherapy Research, 2012, 26(7): 1017-1022. DOI:10.1002/ptr.v26.7 |
| [30] |
WANG C W, CHANG W L, HUANG Y C, et al. An essential role of camp response element-binding protein in epidermal growth factor-mediated induction of sodium/glucose cotransporter 1 gene expression and intestinal glucose uptake[J]. The International Journal of Biochemistry & Cell Biology, 2015, 64: 239-251. |
| [31] |
LANE R H, DVORAK B, MACLENNAN N K, et al. IGF alters jejunal glucose transporter expression and serum glucose levels in immature rats[J]. American Journal of Physiology:Regulatory Integrative and Comparative Physiology, 2002, 283(6): R1450-R1460. DOI:10.1152/ajpregu.00172.2002 |
| [32] |
JANKU F, HUANG H J, ANGELO L S, et al. A kinase-independent biological activity for insulin growth factor-1 receptor (IGF-1R):implications for inhibition of the IGF-1R signal[J]. Oncotarget, 2013, 4(3): 463-473. DOI:10.18632/oncotarget.v4i3 |
| [33] |
BLANCO A M, BERTUCCI J I, RAMESH N, et al. Ghrelin facilitates GLUT2-, SGLT1-and SGLT2-mediated intestinal glucose transport in goldfish (Carassius Auratus)[J]. Scientific Reports, 2017, 7: 45024. DOI:10.1038/srep45024 |
| [34] |
CASSELBRANT A, MALINAUSKAS M, MARSCHALL H U, et al. Angiotensin Ⅱ exerts dual actions on sodium-glucose transporter Ⅰ-mediated transport in the human jejunal mucosa[J]. Scandinavian Journal of Gastroenterology, 2015, 50(9): 1068-1075. DOI:10.3109/00365521.2015.1019557 |
| [35] |
LI Z W, SUN F, ZHANG Y H, et al. Tacrolimus induces insulin resistance and increases the glucose absorption in the jejunum:a potential mechanism of the diabetogenic effects[J]. PLoS One, 2015, 10(11): e0143405. DOI:10.1371/journal.pone.0143405 |
| [36] |
MATOSIN-MATEKALO M, MESONERO J E, DELEZAY O, et al. Thyroid hormone regulation of the Na+/glucose cotransporter SGLT1 in Caco-2 cells[J]. Biochemical Journal, 1998, 334(3): 633-640. DOI:10.1042/bj3340633 |
| [37] |
吴疑, 匡梅, 周红, 等. TLR4信号通路及其负调控研究进展[J]. 现代医药卫生, 2016, 32(18): 2821-2824. DOI:10.3969/j.issn.1009-5519.2016.18.013 |
| [38] |
BARRENETXE J, SÁNCHEZ O, BARBER A, et al. TNFα regulates sugar transporters in the human intestinal epithelial cell line Caco-2[J]. Cytokine, 2013, 64(1): 181-187. DOI:10.1016/j.cyto.2013.07.004 |
| [39] |
KEKUDA R, SAHA P, SUNDARAM U. Role of Sp1 and HNF1 transcription factors in SGLT1 regulation during chronic intestinal inflammation[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2008, 294(6): G1354-G1361. DOI:10.1152/ajpgi.00080.2008 |
| [40] |
BOUDRY G, CHEESEMAN C I, PERDUE M H. Psychological stress impairs Na+-dependent glucose absorption and increases GLUT2 expression in the rat jejunal brush-border membrane[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2006, 292(2): R862-R867. |
| [41] |
LI Y, CAI H Y, LIU G H, et al. Effects of stress simulated by dexamethasone on jejunal glucose transport in broilers[J]. Poultry Science, 2009, 88(2): 330-337. DOI:10.3382/ps.2008-00257 |
| [42] |
SHEPHERD E J, HELLIWELL P A, MACE O J, et al. Stress and glucocorticoid inhibit apical GLUT2-trafficking and intestinal glucose absorption in rat small intestine[J]. Journal of Physiology, 2004, 560(1): 281-290. DOI:10.1113/jphysiol.2004.072447 |
| [43] |
CERVANTES M, COTA M, ARCE N, et al. Effect of heat stress on performance and expression of selected amino acid and glucose transporters, Hsp90, leptin and ghrelin in growing pigs[J]. Journal of Thermal Biology, 2016, 59: 69-76. DOI:10.1016/j.jtherbio.2016.04.014 |
| [44] |
EBRAHIMI R, JAHROMI M F, LIANG J B, et al. Effect of dietary lead on intestinal nutrient transporters MRNA expression in broiler chickens[J]. Biomed Research International, 2015, 2015: 149745. |
| [45] |
REICHARDT S D, FÖLLER M, REXHEPAJ R, et al. Glucocorticoids enhance intestinal glucose uptake via the dimerized glucocorticoid receptor in enterocytes[J]. Endocrinology, 2012, 153(4): 1783-1794. DOI:10.1210/en.2011-1747 |
| [46] |
GRAHAMMER F, HENKE G, SANDU C, et al. Intestinal function of gene-targeted mice lacking serum-and glucocorticoid-inducible kinase[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2006, 290(6): 1114-1123. DOI:10.1152/ajpgi.00231.2005 |
| [47] |
ASANUMA-DATE K, HIRANO Y, LE N, et al. Functional regulation of sugar assimilation by N-glycan-specific interaction of pancreatic α-amylase with glycoproteins of duodenal brush border membrane[J]. Journal of Biological Chemistry, 2012, 287(27): 23104-23118. DOI:10.1074/jbc.M111.314658 |
| [48] |
DATE K, SATOH A, ⅡDA K, et al. Pancreatic α-amylase controls glucose assimilation by duodenal retrieval through N-glycan-specific binding, endocytosis, and degradation[J]. Journal of Biological Chemistry, 2015, 290(28): 17439-17450. DOI:10.1074/jbc.M114.594937 |
| [49] |
KANE S, SEATTER M J, GOULD G W. Functional studies of human GLUT5:effect of pH on substrate selection and an analysis of substrate interactions[J]. Biochemical and Biophysical Research Communications, 1997, 238(2): 503-505. DOI:10.1006/bbrc.1997.7204 |
| [50] |
DIAO H, YAN H L, XIAO Y, et al. Intestinal microbiota could transfer host gut characteristics from pigs to mice[J]. BMC Microbiology, 2016, 16(1): 238. DOI:10.1186/s12866-016-0851-z |
| [51] |
FATIMA J, IQBAL C W, HOUGHTON S G, et al. Hexose transporter expression and function in mouse small intestine:role of diurnal rhythm[J]. Journal of Gastrointestinal Surgery, 2009, 13(4): 634-641. DOI:10.1007/s11605-008-0776-4 |
| [52] |
BALAKRISHNAN A, STEARNS A T, ASHLEY S W, et al. Per1 modulates SGLT1 transcription in vitro independent of E-Box status[J]. Digestive Diseases and Sciences, 2012, 57(6): 1525-1536. DOI:10.1007/s10620-012-2166-8 |
| [53] |
CAVIN J B, COUVELARD A, LEBTAHI R, et al. Differences in alimentary glucose absorption and intestinal disposal of blood glucose after roux-En-Y gastric bypass vs sleeve gastrectomy[J]. Gastroenterology, 2016, 150(2): 454-464. DOI:10.1053/j.gastro.2015.10.009 |
| [54] |
WANG Y M, ZHANG X, LIU T, et al. Jejunum-ileum circuit procedure improves glucose metabolism in diabetic rats independent of weight loss[J]. Obesity, 2016, 24(2): 342-351. DOI:10.1002/oby.21339 |
| [55] |
KHACHAB M, KANAAN A, AWAD D, et al. Colectomy induces an aldosterone-mediated increase in jejunal glucose uptake in rats[J]. Life Sciences, 2017, 174: 43-49. DOI:10.1016/j.lfs.2017.02.012 |
| [56] |
YALCIN S, GURSEL I, BILGEN G, et al. Effect of egg storage duration and brooding temperatures on chick growth, intestine morphology and nutrient transporters[J]. Animal:An International Journal of Animal Bioscience, 2017, 11(10): 1791-1797. DOI:10.1017/S1751731117000404 |




