自然水域生境中,由于食物空间分布的不均匀性及出现时间的季节更替,水生动物在其生活史中遭遇饥饿的现象非常普遍。饥饿会影响动物的生理代谢活性及内源性能量贮存物质的消耗[1]。管角螺(Hemifusus tuba Gmelin)隶属于软体动物门(Mollusca),腹足纲(Gastropoda),中腹足目(Mesogastropoda),盔螺科(Galeodidae),角螺属(Hemifusus),是浅海较大型经济螺类,由于其肉食性,所以肉味鲜美、营养价值高,是一类名贵海珍品,近年来引起了国内外学者的广泛关注。关于管角螺的研究,国内主要集中在人工育苗[2-3]、繁殖生物学[4-5]、生态习性[6-7]、营养成分分析[8-9]、抗肿瘤活性[10]等方面,国外主要集中贝壳的结构[11]、力学性能[12]和分子生物学[13]等方面。由于资源匮乏,价格飞涨,特别是禁渔期货源供不应求,浙江舟山、象山沿海的渔民常在3—4月份从海区大量采捕或收购管角螺成螺,集中用网筐吊在水深3~8 m的海上,采取不投饵方法暂养,等到6—7月份禁渔期抛售,由于长时间不投饵和高密度吊养,造成暂养效益盈亏不一。为此,本研究采用单因素饥饿试验,探究不同饥饿时间对管角螺生长、营养成分、消化酶活性和抗氧化指标的影响,为管角螺的海上规模化暂养提供理论依据。
1 材料与方法 1.1 试验材料试验用管角螺于2016年8月采自象山海域(东经122.13°、北纬28.54°),一次性同批底拖网获得,共280 kg。在浙江省象山来发水产育苗厂的水泥池(6.0 m×4.0 m×1.4 m,水深65 cm)中暂养1周,水泥池培养条件为水温29~31 ℃、盐度19‰~25‰、pH 7.6~8.4,日投饵1次,饵料为鲜活缢蛏(Sinonovacula constricta),过量投饵,肉眼观察管角螺不再摄食时停止投喂,日换水1次,换水量100%,换水时清除残饵,连续充气,饲养1周。
1.2 试验方法根据暂养情况,试验设置饥饿时间分别为0(对照组)、5、10、20、30、40 d的5个组,每组设3个重复,以重复为单位养殖于白色泡沫箱(44 cm×34 cm×25 cm)内,每箱放管角螺20只[体重(28.33±1.27) g、壳宽(36.28±1.27) mm;壳高(67.27±1.88) mm]。试验期间水温为29~31 ℃、盐度19‰~25‰、pH 7.6~8.4,连续充气,溶氧浓度在4.0 mg/L以上,每天换水1/2,所用海水为试验前贮备,经沉淀、砂滤和脱脂棉过滤。各饥饿组和对照组在饥饿处理开始前、结束后分别测定每只管角螺的体重、壳宽、壳高,并在相应饥饿时间后各从各组的每个重复中随机选取3只(每组共9只)解剖,分离出足肌、肝胰腺,液氮速冻后-80 ℃保存。
1.3 足肌常规营养成分、糖原含量及脂肪酸组成分析为消除个体误差,在每组的3个重复中各取3只管角螺的足肌剪碎后混合取样。水分含量的测定采用烘箱(105 ℃)恒温干燥法,粗蛋白质含量的测定采用杜马斯燃烧法测定;粗脂肪含量的测定采用索氏(无水乙醚)抽提法,粗灰分含量的测定采用马福炉(550 ℃)焚烧法,糖原含量采用购自南京建成生物工程研究所的试剂盒(蓖酮试剂显色法)测定,脂肪酸组成测定采用GB/T 9695.2—2008方法,使用岛津气相色谱质谱联用仪(GCMS-QP2010,岛津公司,日本)测定。
1.4 肝胰腺消化酶活性和抗氧化指标及糖原含量测定为消除个体误差,在每组的3个重复中各取3只管角螺的肝胰腺剪碎后混合取样。将肝胰腺匀浆取上清夜分装后置于-80 ℃保存待用,所有测定指标均按试剂盒所述方法进行测定,试剂盒购自南京建成生物工程研究所。蛋白酶活性采用福林-酚法测定,脂肪酶活性采用稀氢氧化钠溶液滴定测量反应产物中脂肪酸的酸价法测定,淀粉酶活性采用3,5-二硝基水杨酸显色法测定,超氧化物歧化酶(superoxide dismutase,SOD)活性采用WST-1法测定,过氧化氢酶(catalase,CAT)活性采用钼酸铵显色法测定,谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)活性采用二硫代二硝基苯甲酸(DTNB)法测定,丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸(TBA)法测定,糖原含量采用蓖酮试剂显色法测定。
1.5 数据统计与分析数据均以平均值±标准差(mean±SD)表示,用SPSS 13.0统计软件对各组数据进行单因素方差分析(one-way ANOVA),当差异达显著性水平(P < 0.05)时,用Tukeys-b(k)多重比较分析组间的差异显著性。
2 结果 2.1 饥饿时间对管角螺生长的影响由表 1可知,不同饥饿时间对管角螺存活率的影响不显著(P>0.05),整个试验期间各组管角螺均未出现死亡;同样,不同饥饿时间对管角螺的壳高和壳宽也无显著影响(P>0.05);饥饿0、5、10 d的各组间体重无显著差异(P>0.05),但均与饥饿20、30、40 d的各组差异显著(P < 0.05),饥饿40 d后体重减少了21.14%。
|
|
表 1 管角螺在饥饿期间的存活率及体重、壳宽和壳高变化 Table 1 Survival rate and changes of body weight, shell width and shell height of Hemifusus tuba Gmelin during starvation |
由表 2可知,饥饿时间在0~30 d时足肌水分和粗蛋白质含量无显著差异(P>0.05),但饥饿40 d时足肌水分含量较饥饿0~5 d时显著升高(P < 0.05),足肌粗蛋白质含量较饥饿0~30 d时显著降低(P < 0.05);随着饥饿时间的延长,足肌粗脂肪含量逐渐下降,饥饿0、5、10 d的各组间差异显著(P < 0.05),但饥饿10和20 d的2组、饥饿20和30 d的2组以及饥饿30和40 d的2组间无显著差异(P>0.05);随着饥饿时间的延长,足肌粗灰分含量逐渐上升,但饥饿时间在5~20 d时无显著差异(P>0.05)。
|
|
表 2 管角螺足肌在饥饿期间的营养成分变化 Table 2 Changes of general nutritional components in pedal muscle of Hemifusus tuba Gmelin during starvation |
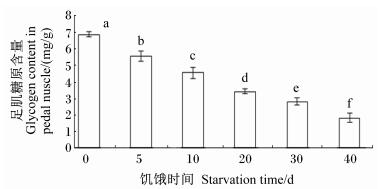
随着饥饿时间的延长,足肌糖原含量显著下降(P < 0.05);饥饿40 d组足肌糖原含量仅为(1.83±0.28) mg/g[对照组为(6.90±0.15) mg/g],只有对照组的26.52%(图 1)。
|
数据柱标注不同字母表示差异显著(P < 0.05), 相同字母或无字母表示差异不显著(P>0.05)。图 2同。 Date columns with different letter superscripts mean sig-nificant difference (P < 0.05), while with the same letter or no letter superscripts mean no significant difference (P > 0.05).The same as Fig. 2. 图 1 饥饿时间对管角螺足肌糖原含量的影响 Figure 1 Effects of starvation time on glycogen content in pedal muscle of Hemifusus tuba Gmelin |
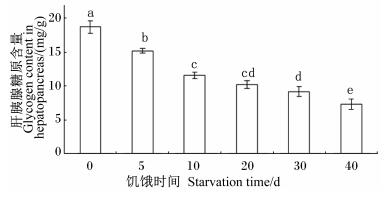
随着饥饿时间的延长,肝糖原含量呈下降趋势,除饥饿10和20 d的2组间以及饥饿20和30 d的2组间无显著差异(P>0.05)外,其他组间差异显著(P < 0.05);饥饿40 d组肝胰腺糖原含量下降到(7.26±0.77) mg/g[对照组为(18.70±0.90) mg],只有对照组的38.82%(图 2)。
|
图 2 饥饿时间对管角螺肝胰腺糖原含量的影响 Figure 2 Effects of starvation time on glycogen content in hepatopancreas of Hemifusus tuba Gmelin |
由表 3可知,随着饥饿时间的延长,饱和脂肪酸和单不饱和脂肪酸的含量逐渐下降,而多不饱和脂肪酸的含量却相对上升。而在饱和脂肪酸中,偶数碳原子个数的脂肪酸含量逐渐下降,而奇数碳原子个数的脂肪酸含量却相对上升,饥饿40 d后C15 : 0、C17 : 0的含量分别从0.89%和1.87%上升到3.92%和4.52%。
|
|
表 3 饥饿时间对管角螺足肌脂肪酸组成的影响 Table 3 Effects of starvation time on fatty acid composition in pedal muscle of Hemifusus tuba Gmelin |
由表 4可知,肝胰腺脂肪酶和胰蛋白酶活性在饥饿5 d时显著高于对照组(P<0.05),随后逐渐下降,在饥饿40 d时显著低于对照组[分别为(31.9±0.9) U/g prot、(408.8±64.1) U/g prot](P<0.05),分别下降至(18.2±0.1) U/g prot和(1 143.5±86.4) U/g prot,而肝胰腺淀粉酶活性在饥饿10 d时显著高于对照组和饥饿5 d组(P < 0.05),在饥饿40 d时显著低于对照组[(148.5±6.9) U/g prot](P < 0.05),下降至(117.5±7.9) U/g prot。
|
|
表 4 饥饿时间对管角螺肝胰腺消化酶活性的影响 Table 4 Effects of starvation time on digestive enzyme activities in hepatopancreas of Hemifusus tuba Gmelin |
由表 5可知,肝胰腺超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶的活性在饥饿5~30 d时都处于上升趋势,并均显著高于对照组(P<0.05),而饥饿40 d时则出现急剧下降,均显著低于对照组(P<0.05);肝胰腺丙二醛含量在饥饿30 d前都处于稳定状态,无显著性差异(P>0.05),而在饥饿30 d后开始显著升高(P<0.05),并于饥饿40 d时上升至(28.99±1.12) nmol/mg。
|
|
表 5 饥饿时间对管角螺肝胰腺抗氧化指标的影响 Table 5 Effects of starvation time on antioxidant indexes in hepatopancreas of Hemifusus tuba Gmelin |
在饥饿状态下,大多数动物会动用自身储存物质,从而会导致体重的下降。张波等[14]发现,饥饿15 d的真鲷(Pagrosomus major)的体重下降了7.05%,并未出现死亡现象。杜小涛等[15]研究表明,南美白对虾(Penaeus vannamei)饥饿6 d后湿重下降了10.55%。而本试验中发现,管角螺在饥饿40 d后其体重下降了21.14%,但却未出现死亡现象,这表明管角螺是一种比较耐饥饿的海洋动物。软体动物贝壳的主要成分是由碳酸钙和少量的壳基质组成,这些物质是由外套膜上皮细胞分泌形成的[16],其形成机理目前尚不清楚,饥饿是否会对软体动物的壳高和壳宽造成影响也未见相关报道,仅见郭清等[17]研究表明在短时期干湿交替的条件下福寿螺(Pomace acanaliculata)的壳高会发生部分补偿生长现象,这种补偿主要是饥饿后摄食水平提高而实现的,而本试验中各组管角螺的壳高和壳宽在饥饿前后并未表现出显著性差异,表明饥饿对管角螺的壳高和壳宽并无显著影响。
3.2 饥饿时间对管角螺营养成分的影响饥饿状态下,动物会消耗自身储存物质来维持自身的生理代谢,多数动物主要通过消耗糖原和脂肪来供能,有少数是消耗蛋白质,随着体内储存物质的不断消耗,水分的含量会不断上升[18-21]。本研究发现,饥饿状态下,管角螺的足肌中水分含量从饥饿10 d后开始上升,从73.53%上升到77.41%;粗蛋白质含量在饥饿前30 d未发生显著变化,但饥饿40 d组却显著低于其他各组;粗脂肪含量在饥饿5 d时就开始下降,从最初的3.08%下降到饥饿40 d时的1.32%;随着饥饿时间的延长,足肌粗灰分含量逐渐上升,从最初的9.15%增长到饥饿40 d时17.11%。上述结果说明管角螺在饥饿时先消耗脂肪和糖原,在饥饿10 d到30 d是消耗少量的脂肪,主要消耗糖原,而蛋白质作为结构性物质被相对保留,这与薛明等[1]的研究结果一致。而在脂肪酸的消耗上,本试验发现管角螺足肌中饱和脂肪酸和单不饱和脂肪酸的含量均有所降低,而多不饱和脂肪酸的含量却相对上升,这表明管角螺在饥饿胁迫下主要利用饱和脂肪酸和单不饱和脂肪酸,而多不饱和脂肪酸却相对保留,可能是因为大量的多不饱和脂肪酸作为磷脂双分子层的重要组成成分,对于维持细胞膜结构和功能是必不可少的[22]。同时,近年来,越来越多的证据表明,脂肪酸尤其是多不饱和脂肪酸能够通过调控基因表达来维持脂肪代谢的平衡[23]。这与柳敏海等[24]关于鱼(Miichthys miiuy)的研究结果是一致的。在饱和脂肪酸中,偶数碳原子个数的脂肪酸的含量下降,而奇数碳原子个数的脂肪酸含量相对上升,表明管角螺在饥饿胁迫时,优先利用偶数碳原子个数的脂肪酸。从能量利用的角度考虑,偶数碳原子个数的脂肪酸β-氧化更经济,而奇数碳原子个数的脂肪酸β-氧化到最后剩下1个丙酰辅酶A,还需要额外的能量把它变形为偶数琥珀酰辅酶A进行下一步氧化[25];此外,奇数碳原子个数的脂肪酸可能因参与生物膜的结构建成而较少发挥贮能作用[24]。
3.3 饥饿时间对管角螺消化酶活性和抗氧化指标的影响大多数水产动物在饥饿胁迫下都会通过调节各种消化酶的活性来积极利用体内的储存物质维持日常代谢[1, 26-27]。本试验发现,在饥饿胁迫下,管角螺的肝胰腺中3种消化酶(胰蛋白酶、脂肪酶和淀粉酶)的活性总体上都呈下降趋势,这与薛明等[1]关于方斑东风螺(Babylonia areolata)的研究结果是一致的,但蛋白酶和脂肪酶的活性在饥饿5 d时就开始显著升高,这可能是在饥饿早期管角螺为了更好地利用体内残留的食物,增强了消化酶的分泌来提高食物的转化率,这与管角螺复杂的消化系统结构有重要关系[28],但饥饿10 d后脂肪酶和蛋白酶的活性都有所下降,这可能是由于残留的食物已被消化完,而又没有外界食物对管角螺嗅检器进行刺激,导致消化系统的酶分泌量减少。管角螺是肉食性动物,其对碳水化合物的利用能力较低,淀粉酶活性较低,但本试验发现管角螺肝胰腺中淀粉酶的活性却比脂肪酶的活性高,这可能是由于管角螺早期有摄食底栖硅藻的食性,导致幼体植食性消化系统的残余[29],而饥饿10 d后淀粉酶活性却出现升高,这可能是因为肝胰腺加大了对体内肝糖原和肌糖原的利用以供日常代谢,但在饥饿40 d后却低于对照组,这可能与糖原的利用程度相关。
氧自由基是新陈代谢和抗应激时产生的一种物质,正常情况下,氧自由基在生物体内都保持着动态稳定,即自由基不断产生,但也会不断地被超氧化物歧化酶等抗氧化酶和抗氧化剂组成的抗氧化体系清除[30]。环境胁迫会打破体内的氧自由基平衡,体内的氧自由基过多导致疾病的发生,生物体主要通过2种防御物质对氧自由基的损害产生保护的,一是超氧化物歧化酶等抗氧化酶,二是维生素C和维生素E等低分子质量的抗氧化剂[31]。本试验结果表明,管角螺肝胰腺超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性在饥饿30 d前具有良好的一致性且都处于上升趋势,这种一致性在其他研究中也有发现,Morales等[32]报道,细点牙鲷(Dentex dentex)在饥饿5周时肝脏中上述3种酶的活性均显著上升,而经3周恢复喂食后均恢复至对照组水平。饥饿40 d后管角螺肝胰腺超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶的活性都低于对照组的水平,这表明饥饿达到一定限度导致组织细胞中的氧自由基积累超过一定限度,体内的代谢发生紊乱,对生物膜和酶系统产生了破坏,抑制了相关基因的表达。丙二醛是自由基作用于脂质发生过氧化反应的代谢产物,具有细胞毒性,丙二醛含量的高低间接反映了机体细胞受损伤的严重程度[33]。在本试验中,在饥饿20 d前,管角螺肝胰腺丙二醛的含量基本稳定在25 nmol/mg prot,这是由于体内的抗氧化体系和其他防御形式适应的结果,但饥饿30 d后,特别是饥饿40 d时,肝胰腺丙二醛的含量出现显著性的上升,这表明抗氧化体系已经无法负担过量的氧自由基,导致氧化胁迫的产生。
4 结论① 管角螺是一种耐饥饿的海洋动物,饥饿40 d不会出现死亡现象。
② 管角螺饥饿20 d后体重开始显著下降,饥饿40 d后体重减少21.14%,暂养过程中饥饿时长不可超过20 d,不然会带来一定的经济损失。
③ 管角螺饥饿10~30 d时消耗少量的脂肪,主要消耗糖原,而蛋白质被相对保留,其中脂肪酸主要利用饱和脂肪酸和单不饱和脂肪酸,而多不饱和脂肪酸被相对保留,并且优先利用偶数碳原子的脂肪酸;饥饿10 d后管角螺的营养成分开始流失,暂养时饥饿10 d后就应该开始投饵。
④ 在饥饿过程中,管角螺的肝胰腺消化酶活性都有所下降,但蛋白酶和脂肪酶活性在饥饿5 d时显著升高;饥饿40 d后管角螺的超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性均显著降低,丙二醛含量显著上升,表明管角螺体内已出现了氧化胁迫。
| [1] |
薛明, 柯才焕, 魏永杰. 饥饿对方斑东风螺幼螺生化组成和消化酶活力的影响[J]. 热带海洋学报, 2010, 29(3): 120-125. DOI:10.11978/j.issn.1009-5470.2010.03.120 |
| [2] |
潘英, 王强哲, 庞有萍, 等. 管角螺全人工育苗试验[J]. 水产科技情报, 2007, 34(2): 84-85. |
| [3] |
张正道. 管角螺的人工育苗[J]. 科学养鱼, 2001(4): 25. |
| [4] |
潘英, 庞有萍, 罗福广, 等. 管角螺的繁殖生物学[J]. 水产学报, 2008, 32(2): 217-222. |
| [5] |
林志华, 王铁轩, 夏彩国. 管角螺生态及繁殖习性观察[J]. 海洋科学, 1998, 13(5): 11-12. |
| [6] |
罗杰, 刘楚吾, 黄翔鹄. 盐度对管角螺胚胎发育的影响[J]. 广东海洋大学学报, 2007, 27(3): 24-28. |
| [7] |
杜涛, 罗杰, 刘楚吾, 等. 温度对管角螺Hemifusus tuba (Gmelin)胚胎发育的影响[J]. 海洋科学, 2010, 34(6): 44-49. |
| [8] |
朱爱意, 赵向炯, 杨运琪. 东极海区管角螺软体部的营养成分分析[J]. 南方水产, 2008, 4(2): 63-68. |
| [9] |
陶平, 许庆陵, 谭淑荣. 大连沿海几种腹足类和双壳类的营养成分分析[J]. 辽宁师范大学学报(自然科学版), 2000, 23(2): 182-186. |
| [10] |
傅余强, 顾谦群, 刘睿, 等. 管角螺肌肉中性糖蛋白的化学组成及抗肿瘤活性研究[J]. 中国海洋药物, 2002, 21(6): 20-24. |
| [11] |
LIANG Y, ZHAO J, WU C W. The micro/nanostructure characteristics and the mechanical properties of Hemifusus tuba conch shell[J]. Journal of Bionic Engineering, 2010, 7(4): 307-313. DOI:10.1016/S1672-6529(10)60261-2 |
| [12] |
ZHAO J, CHEN C, LIANG Y, et al. Mechanical properties and structure of Haliotis discus hannai Ino and Hemifusus tuba conch shells:a comparative study[J]. Acta Mechanica Sinica, 2010, 26(1): 21-25. DOI:10.1007/s10409-009-0308-9 |
| [13] |
WU L, LI R H, WANG C L, et al. Isolation and characterization of 42 microsatellite loci from the Hemifusus tuba Gmelin[J]. Conservation Genetics Resources, 2014, 6(3): 707-710. DOI:10.1007/s12686-014-0193-9 |
| [14] |
张波, 孙耀, 唐启升. 饥饿对真鲷生长及生化组成的影响[J]. 水产学报, 2000, 24(3): 206-210. |
| [15] |
杜小涛, 周小壮, 于赫男, 等. 饥饿对南美白对虾生化组成及补偿生长的影响[J]. 水产学报, 2004, 28(1): 47-53. |
| [16] |
刘凌云, 郑光美. 普通动物学[M]. 3版. 北京: 高等教育出版社, 2006: 198-199.
|
| [17] |
郭清, 章家恩, 罗颢, 等. 干湿交替对福寿螺摄食和生长的影响[J]. 生态环境学报, 2013, 22(5): 774-779. |
| [18] |
姜志强, 贾泽梅, 韩延波. 美国红鱼继饥饿后的补偿生长及其机制[J]. 水产学报, 2002, 26(1): 67-72. |
| [19] |
BARELAY M C, DALL W, SMITH D M. Changes in lipid and protein during starvation and the moulting cycle in the tiger prawn, Penaeus esculentus Haswell[J]. Fisheries Research Board Canada, 1983, 68(3): 229-244. |
| [20] |
KIM M K, LOVELL R T. Effect of restricted feeding regimens on compensatory weight gain and body tissue changes in channel catfish Ictalurns punctatus in poods[J]. Aquaculture, 1995, 135(4): 285-293. DOI:10.1016/0044-8486(95)01027-0 |
| [21] |
MADDOCK D M, BURTON M P M. Some effects of starvation on the lipid and skeletal muscle layers of the winter flounder, Pleuronectes americanus[J]. Canadian Journal Zoology, 1994, 72(9): 1672-1679. DOI:10.1139/z94-223 |
| [22] |
GYLFASON G A, KNTSDÓTTIR E, ÁSGEIRSSON B. Isolation and biochemical characterization of lipid rafts from Atlantic cod (Gadus morhua) intestinal enterocytes[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2010, 155(2): 86-95. |
| [23] |
JUMP D B. Dietary polyunsaturated fatty acids and regulation of gene transcription[J]. Current Opinion Lipidology, 2002, 13(4): 155-164. |
| [24] |
柳敏海, 罗海忠, 傅荣兵, 等. 短期饥饿胁迫对鮸鱼生化组成、脂肪酸和氨基酸组成的影响[J]. 水生生物学报, 2009, 33(2): 230-235. |
| [25] |
麦康森, 李鹏, 赵建民, 等. 鱼类与甲壳类营养需要[M]. 北京: 科学出版社, 2015: 115-116.
|
| [26] |
乔秋实. 周期性饥饿再投喂对团头鲂和建鲤生长性能、体组成、消化酶及抗氧化酶的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2011: 34-35. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012269712.htm
|
| [27] |
李志华, 谢松, 王军霞, 等. 间歇性饥饿对日本沼虾生长和几种消化酶的影响[J]. 水产学报, 2007, 31(4): 456-462. |
| [28] |
张林林, 万涓涓, 母昌考, 等. 管角螺消化系统的组织学研究[J]. 台湾海岸, 2011, 30(4): 540-545. |
| [29] |
勒立兵, 张林林, 李荣华, 等. 不同饵料对管角螺生长、肝脏消化酶活性及软体部营养成分的影响[J]. 海洋科学, 2013, 37(6): 66-72. |
| [30] |
方允中, 杨胜, 伍国耀. 自由基稳衡性动态[J]. 生理科学进展, 2004, 35(3): 199-204. |
| [31] |
PASCUAL P, PEDRAJAS J R, TORIBIO F, et al. Effect of food deprivation on oxidative stress biomarkers in fish (Sparus aurata)[J]. Chemico-Biological Interactions, 2003, 145(2): 191-199. DOI:10.1016/S0009-2797(03)00002-4 |
| [32] |
MORALES A E, PÉREZ-JIMÉNEZ A, HIDALGO M C, et al. Oxidative stress and antioxidant defenses after prolonged starvation in Dentex dentex liver[J]. Comparative Biochemistry Physiology Part C:Toxicology & Pharmacology, 2004, 139(1/2/3): 153-161. |
| [33] |
GRUNDY J E, STOREY K B. Antioxidant defenses and lipid peroxidation damage in estivating toads, Scaphiopus couchii[J]. Comparative Biochemistry Physiology Part B:Biochemical and Molecular Biology, 1998, 168(2): 132-142. |




