2. 大庆高新区华美科技有限公司, 大庆 163316
2. Daqing High-Tech Zone Huamei Technology Co., Ltd., Daqing 163316, China
超氧化物歧化酶模拟物(superoxide dismutase simulant,SODm)是人工合成的模拟物。SODm除了具有超氧化物歧化酶(superoxide dismutase,SOD)防衰老、抗逆性、抗氧化和提高免疫力等这些特性外[1],还弥补了SOD分子质量大、热稳定性差、易失活的不足。SOD主要分为3类:铁超氧化物歧化酶(Fe-SOD)、铜-锌超氧化物歧化酶(Cu/Zn-SOD)和锰超氧化物歧化酶(Mn-SOD)[2]。SODm则主要是根据Mn-SOD的结构进行人工合成的。SODm在植物上的应用已经得到了一定程度上的推广。SODm可以提高甜菜的含糖率,同时改善其生长状态[3],同时还可以提高玉米和棉花的产量[4-6]。在植物上的应用多集中体现了SODm抗逆性等特性,SODm抗氧化和抗衰老的特性如果可以作用在畜禽机体上,提高其肌肉品质以及抗氧化等能力,将会进一步促进畜牧行业的发展。肌纤维是肌肉的组成部分,是衡量肉品质的一个重要指标。因此,对肌纤维的密度和直径的研究与评价肉品质的优劣有很大的意义。Maltin等[7]研究结果显示,对于家禽肉品质的研究中,肌纤维是衡量肌肉嫩度的重要指标之一。同时,在陈宽维等[8]的研究中,肌肉的纤维值越大,肌肉中的肌苷酸含量就相对越高,肉质越好。而肌纤维密度越大,其肌纤维直径越小[9]。对于添加外源的抗氧化剂对肉品质的研究也有报道,Ma等[10]通过在饲粮中添加0.01%的肌肽(L-carnosine, LC),发现它可以提高育肥猪肌肉中SOD和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)的表达量。Zhong等[11-12]的研究表明,儿茶素可以提高山羊肌肉中多不饱和脂肪酸含量,延长货架期。将SODm也作为一种外源性抗氧化剂应用于家禽生产中,能否达到抗氧化的效果,值得探究。
因此,本研究通过在肉仔鸡饲粮中添加不同水平的SODm,研究其对肉仔鸡生长性能、肌纤维特性以及肌肉内SOD活性的影响,以期为SODm在家禽饲粮中的应用提供理论依据和参考。
1 材料与方法 1.1 试验动物与试验设计SODm由大庆高新区华美科技有限公司提供。试验选取1日龄爱拔益佳(AA)肉仔鸡公雏360只,随机分为6个组,每个组6个重复,每个重复10只鸡。试验从1日龄开始,至42日龄结束,试验期42 d。试验采用单因素试验设计,试验设计见表 1。
|
|
表 1 试验设计 Table 1 Experimental design |
参照NRC(1994)肉鸡营养需要和《中国饲料成分及营养价值表》(2015年第26版)配制玉米-豆粕型基础饲粮,基础饲粮组成及营养水平见表 2。采用3层叠层式笼养,按照正常肉仔鸡饲养标准饲养。
|
|
表 2 基础饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of basal diets (air-dry basis) |
从试验开始到试验结束,每天记录各组的采食量,用于计算平均日采食量。记录肉仔鸡始末体重,用于计算平均日增重和料重比。
1.3.2 肌肉组织切片样的采集与处理6周龄时,每个重复中选取接近平均体重的健康肉仔鸡2只,进行颈部放血屠宰,分离左侧胸肌和腿肌,用手术刀在相同部位按肌纤维走向采样,大小为1.5 cm×0.6 cm×0.6 cm。样品剪取后立即放入福尔马林试剂液中固定。之后进行修块处理。组织修块后,流水冲洗30 min,去除多余固定液;放入70%、80%、90%、100%(一)和100%(二)中酒精各脱水1 h;放入二甲苯(一)中15 min,二甲苯(二)中10 min进行透明处理;将透明后的组织放入恒温箱中已溶化的石蜡(一)、石蜡(二)和石蜡(三)中,每个1 h;最后进行包埋处理;使用德国菜卡2135型切片机,进行切片,切片厚6 μm,经二甲苯2次各5 min,无水酒精2次各5 min;90%、80%、70%酒精各5 min,蒸馏水浸5 min,苏木素染色5 min,自来水冲洗,在含1%盐酸的70%酒精中分化20 s,蒸馏水浸5 min,70%、80%酒精各5 min,90%伊红醇溶液中5 min,无水酒精2次各5 min;二甲苯2次各5 min,中性树胶封片,利用美国moticam-3000显微摄影成像系统进行显微镜下观察。
1.3.3 肌肉组织匀浆液的制备6周龄时,每个重复中选取接近平均体重的健康肉仔鸡2只进行颈部放血屠宰,分离左侧胸肌和腿肌,分别称取0.5 g鲜肉样,在生理盐水中清洗干净,放入10 mL EP管中,加入4.5 mL的0.9%的冷生理盐水,利用组织匀浆机,匀浆时间10 s/次,间隔10 s,连续5次。研磨制成10%匀浆液,-20 ℃保存备用。
1.3.4 肌肉嫩度样品的制备6周龄时,每个重复中选取接近平均体重的健康肉仔鸡2只进行颈部放血屠宰,取左侧胸肌和腿肌,分离其中一部分于自封袋4 ℃保存备用。
1.4 测定指标与方法 1.4.1 肌纤维直径在400倍下摄片,每组每例选取3个视野,每个视野选取20个肌纤维,利用Image-pro plus-6.0病理图像分析系统测量其横截面积(Si),并取其平均值。
1.4.2 肌纤维密度在400倍下摄片,每组每例选取3个视野,利用Image-pro plus-6.0病理图像分析系统测量单个视野的总面积(S),取其平均值;并统计3个视野中肌纤维数目(N),计算纤维密度。
1.4.3 肌肉SOD活性采用水溶性四唑盐试剂SOD活性检测试剂盒(WST-1法)测定肉仔鸡肌肉中SOD的活性。按照试剂盒说明书的步骤进行测定。
1.4.4 肌肉嫩度测定将胸大肌和腿肌置于自封袋内,挤尽自封袋中空气后封闭自封袋,完全浸泡在80 ℃的水浴锅中加热0.5 h,之后15 ℃流水处冷却40 min,肉样取出,用滤纸擦去表面水分,使用C-LM3B型数显式肌肉嫩度仪(东北农大工程学院研制)测定剪切力。每个肉样剪切3次,并取平均值。
1.5 数据分析用Excel 2016软件进行数据整理,采用SAS 9.4软件对数据进行处理,采用单因素方差分析和Duncan氏法进行多重比较。测定结果以“平均值±标准差”表示,P < 0.05为差异显著。利用Excel 2016软件拟合三次曲线回归方程。
2 结果与分析 2.1 SODm对肉仔鸡生长性能的影响由表 3可知,饲粮中添加不同水平SODm对肉仔鸡生长性能指标没有显著影响(P>0.05)。
|
|
表 3 饲粮中添加不同水平SODm对肉仔鸡生长性能的影响 Table 3 Effects of dietary different supplemental levels of SODm on growth performance of broilers |
|
|
表 4 饲粮中添加不同水平SODm对肉仔鸡胸肌纤维密度和纤维直径的影响 Table 4 Effects of dietary different supplemental levels of SODm on breast fiber density and fiber diameter of broilers |
|
|
表 5 饲粮中添加不同水平SODm对肉仔鸡腿肌纤维密度和纤维直径的影响 Table 5 Effects of dietary different supplemental levels of SODm on leg fiber density and fiber diameter of broilers |
|
|
表 6 饲粮中添加不同水平SODm对肉仔鸡肌肉剪切力的影响 Table 6 Effects of dietary different supplemental levels of SODm on muscle shear force of broilers |
由表 4可知,1.0‰SODm组肉仔鸡胸肌纤维密度显著高于其他各组(P < 0.05),对照组肉仔鸡胸肌纤维密度居中。1.5‰SODm组肉仔鸡胸肌纤维直径最大,显著高于除2.0‰SODm组外的其他各组(P < 0.05);1.0‰SODm组肉仔鸡胸肌纤维直径最小,显著低于其他各组(P < 0.05);对照组肉仔鸡胸肌纤维直径居中。
从图 1的切片结果也可以直观地看出,饲粮中添加不同水平SODm对肉仔鸡胸肌纤维密度和纤维直径有一定的影响。1.0‰SODm组肉仔鸡胸肌纤维密度较大,1.5‰SODm组肉仔鸡胸肌纤维直径较大。
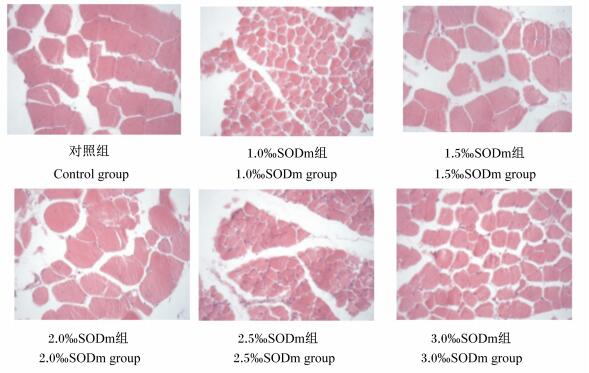
|
图 1 肉仔鸡胸肌纤维切片 Figure 1 Breast muscle fiber slices of broilers (400×) |
由表 5可知,1.5‰SODm组肉仔鸡腿肌纤维密度显著高于其他各组(P < 0.05);1.0‰SODm组肉仔鸡腿肌纤维密度居中。1.5‰SODm组肉仔鸡腿肌纤维直径最小,与其他各组差异显著(P < 0.05);3.0‰SODm组肉仔鸡腿肌肌纤维直径最大,对照组肉仔鸡腿肌肌纤维直径略低于3.0‰SODm组,差异不显著(P>0.05)。
从图 2的切片结果也可以直观地看出,饲粮中添加不同水平SODm对肉仔鸡腿肌纤维密度和纤维直径有一定的影响。1.5‰SODm组肉仔鸡腿肌纤维密度较高,1.5‰SODm组肉仔鸡腿肌纤维直径较小。
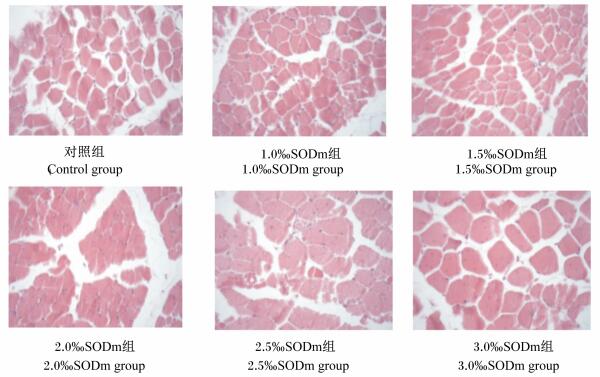
|
图 2 肉仔鸡腿肌纤维切片 Figure 2 Leg muscle fiber slices of broilers (400×) |
由表 6可知,2.0‰SODm组胸肌剪切力最低,显著低于对照组(P < 0.05),其他各组差异不显著(P>0.05)。1.5‰SODm组腿肌剪切力略低于对照组,但差异不显著(P>0.05)。
2.4 SODm对肉仔鸡肌肉SOD活性的影响由表 7可知,3.0‰SODm组肉仔鸡胸肌SOD活性最高,与其他各组差异显著(P < 0.05);2.5‰SODm组和1.0‰SODm组肉仔鸡胸肌SOD活性居中,但与对照组相比差异不显著(P>0.05);对照组肉仔鸡胸肌SOD活性活性最低。1.5‰SODm组肉仔鸡腿肌SOD活性最高,显著高于除3.0‰SODm组外的其他各组(P < 0.05)。
|
|
表 7 饲粮中添加不同水平SODm对肉仔鸡肌肉SOD活性的影响 Table 7 Effects of dietary different supplemental levels of SODm on muscle SOD activity of broilers |
由以上结果可以看出,通过单因素方差分析,饲粮中添加不同水平SODm除了对生长性能影响不显著(P>0.05)外,对胸肌和腿肌纤维直径和纤维密度、肌肉嫩度以及肌肉中SOD活性均有显著影响(P < 0.05)。因此对其进行了曲线拟合。
由表 8可知,通过拟合回归方程计算,对于胸肌纤维特性,饲粮中SODm适宜添加水平为0.4‰~1.8‰,特别指出,对于胸肌SOD活性,饲粮中SODm添加水平在0~1.5‰之间时,胸肌SOD活性是呈先增高后降低的趋势,其中饲粮中SODm添加水平为0.9‰时,胸肌SOD活性最好;饲粮中SODm添加水平在1.5‰~3.0‰时,胸肌SOD活性呈上升趋势。对于腿肌纤维特性,饲粮中SODm添加水平为0.9‰~1.6‰,特别指出,对于腿肌SOD活性,与胸肌的增减趋势一致。综上可知,能够显著改善肉仔鸡肌纤维特性的饲粮SODm适宜添加水平为0.4‰~1.8‰。
|
|
表 8 SODm在肉仔鸡饲粮中的适宜添加水平 Table 8 Suitable SODm supplemented level in diet of broilers |
近年来,对于外源性抗氧化剂在动物生产上的应用已有不少研究,Hamano等[13]对硫辛酸的研究发现,它可以有效降低血浆中甘油三酯的含量,但是,对于肉仔鸡的平均日增重和料重比影响不大[14]。邹杨等[15]的研究发现,饲粮中添加外源性抗氧化剂可以提高肉仔鸡血清中SOD的活性,但对肉仔鸡的生产性能没有显著影响。在本试验中,饲粮中添加SODm对肉仔鸡的生长性能也没有显著影响,这与上述研究结果相一致,推测原因可能是SODm的功效侧重于提高机体的免疫力和防衰老方面,另外SODm气味小,近乎无味,对饲粮的诱食性没有显著改善,所以对肉仔鸡生长性能的影响相对较小。
3.2 SODm对肉仔鸡肉品质的影响抗氧化剂对于家禽肉品质也可以起到促进作用,而肉品质的好坏,一定程度上体现在肌肉的肌纤维特性上。其中,肌纤维的直径越小,密度越大,肉品质就越好[16-18]。肌纤维可分为慢速氧化型(Ⅰ型)、快速氧化型(Ⅱa型)、快速酵解型(Ⅱb型)与中间型(Ⅱx型)4种类型[19-20]。其中Ⅰ型纤维直径较细,剪切力更低,嫩度特性更好[21]。有研究证明,过氧化物酶体增殖物活化受体(PGC-1α)可诱导线粒体合成[22]以及Ⅰ型肌纤维特异基因的表达,能有效的将快型肌纤维转化为慢型肌纤维[23]。而过氧化物酶增殖受体δ(PPARδ)是PGC-1α的上游调控因子之一,可以与其他的转录因子共同促进PGC-1α的表达,诱导慢型肌纤维的形成[24]。一定的运动可以使的PGC-1α与PPARδ应答增加,促进肌纤维的转化[25]。而SODm具有抗氧化、提高机体抵抗力等作用。机体健康状态的保持,相对的运动量也会有所增加。在本试验中,SODm确实可以有效降低肌纤维的直径,提高其纤维密度,改善肌肉嫩度的作用。刘冰等[26]的研究也发现,肌纤维直径和肌肉的嫩度呈现正相关的趋势,而肌纤维的密度则与其呈现相反的趋势。韩海霞等[27]的研究也发现,肌纤维密度和肉品质呈显著的正相关性,密度越大,肉越嫩。本次试验结果也显示出,纤维直径和密度是呈反比的,纤维直径和肌肉嫩度的结果也与刘冰等[26]的研究结果基本一致。可以看出,SODm在家禽生产中具有一定的实际意义。
3.3 SODm对肉仔鸡肌肉SOD活性的影响SODm作为一种外源性抗氧化剂,同其他抗氧化剂一样,可以提高肌肉的总抗氧化能力(T-AOC)和SOD活性,增强肉鸡屠宰后肌肉的抗氧化能力[28]。添加高水平的蛋氨酸,可以提高胸肌的T-AOC[29]。SOD是机体的抗氧化酶之一,SOD的活性可以代表机体清除自由基的能力[30],保持细胞正常生长[31]。本试验中,肌肉中SOD的活性随着饲粮中SODm的添加水平呈现先上升中间下降然后上升的趋势,提高了肌肉中SOD的活性,从而改善肌肉的抗氧化能力。
而在此次试验结果中,SODm对胸肌和腿肌的肉品质影响不具有同步性,即在添加同一水平的SODm时,不能同时改善胸肌和腿肌的肌纤维特性这一结果,由于SODm在动物体上的应用较少,对于影响不同步的原因还有待进一步的研究。
4 结论饲粮中添加SODm对肉仔鸡的生长性能没有显著影响,但对肌肉的嫩度和纤维以及肌肉中SOD活性有一定的改善作用。当饲粮中SODm添加水平在0.4‰~1.8‰时,可以相应地提高胸肌和腿肌的纤维密度,降低纤维直径,改善肌肉的嫩度,同时提高肌肉中SOD的活性。
| [1] |
张欣. 超氧化物歧化酶(SOD)及其研究进展[J]. 内蒙古石油化工, 2010, 16: 14-15. |
| [2] |
董亮, 何永志, 王远亮, 等. 超氧化物歧化酶(SOD)的应用研究进展[J]. 中国农业科技报, 2013, 15(5): 53-58. |
| [3] |
郝奎, 王世喜, 张淑兰, 等. SODm叶面肥在甜菜上的应用效果[J]. 中国糖料, 2011, 4: 54-55. DOI:10.3969/j.issn.1007-2624.2011.04.019 |
| [4] |
章法源. SODm尿素在东乡县玉米上的肥效试验示范总结[J]. 农业科技与信息, 2015, 6: 42-44. |
| [5] |
叶锋, 苏桂华. SODm尿素在玉米上的肥效试验初报[J]. 新疆农垦科技, 2016, 3: 55-56. |
| [6] |
曹健, 张珊珊. SODm尿素在棉花上的示范[J]. 农村科技, 2014, 4: 22-23. |
| [7] |
MALTIN C, BALEERZKA D, TILLEY R, et al. Detemrinants of meat quality:tenderness[J]. The Proceedings of the Nutrition Society, 2003, 62(2): 337-347. DOI:10.1079/PNS2003248 |
| [8] |
陈宽维, 李慧芳, 张学余, 等. 肉鸡肌纤维与肉质关系研究[J]. 中国畜牧杂志, 2002, 38(6): 6-7. |
| [9] |
陈洁波, 陶林, 吴薇薇, 等. 不同品种优质鸡肌纤维特性与肉品质关系的研究[J]. 中国家禽, 2013, 35(16): 12-15. DOI:10.3969/j.issn.1004-6364.2013.16.004 |
| [10] |
MA X Y, JIANG Z Y, LIN Y C, et al. Dietary supplementation with carnosine improves antioxidant capacity and meat quality of finishing pigs[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94: 286-295. DOI:10.1111/jpn.2010.94.issue-6 |
| [11] |
ZHONG R Z, TAN C Y, HAN X F, et al. Effect of dietary tea catechins supplementation in goats on the quality of meat kept under refrigeration[J]. Small Ruminant Research, 2009, 87(1/23): 122-125. |
| [12] |
ZHONG R Z, ZHOU D W, TAN C Y, et al. Effect of tea catechins on regulation of antioxidant enzyme ex-pression in H2O2-induced skeletal muscle cells of goat in vitro[J]. Journal of Agricultural and Food Chemistry, 2011, 59(20): 11338-11343. DOI:10.1021/jf202839t |
| [13] |
HAMANO Y, SUGAWARA S, KAMOTA Y, et al. Involvement of lipoic acid in plasma metabolites, hepatic oxygen consumption, and metabolic response to a beta-agonist in broiler chickens[J]. British Journal of Nutrition, 1999, 82: 497-503. |
| [14] |
张勇. 硫辛酸、乙酰肉碱对肉仔鸡肉品质及肌纤维类型分布的营养调控[D]. 博士学位论文. 北京: 中国农业大学. 2010.
|
| [15] |
邹杨, 杨在宾, 杨维仁, 等. 不同抗氧化剂和添加水平对肉仔鸡生产性能和抗氧化性影响的研究[J]. 家禽科学, 2011, 8: 7-10. |
| [16] |
翁茁先, 李威娜, 钟鸣, 等. 五华三黄鸡不同生态养殖模式效果评价[J]. 饲料研究, 2016, 12: 1-5, 45. |
| [17] |
苏琳, 辛雪, 刘树军, 等. 苏尼特羊肉肌纤维特性与肉质相关性研究[J]. 食品科学, 2014, 35(7): 7-11. DOI:10.7506/spkx1002-6630-201407002 |
| [18] |
张崇志, 高爱武, 侯先志, 等. 不同营养水平对羔羊肌肉组织学性状的影响[J]. 动物营养学报, 2011, 23(2): 336-342. |
| [19] |
SCHIAFFINO S, GORZA L, SARTORE S, et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres[J]. Journal of Muscle Research and Cell Motility, 1989, 10: 197-205. DOI:10.1007/BF01739810 |
| [20] |
LAFRAMBOISE W A, DAOOD M J, GUTHRIE R D, et al. Electrophoretic separation and immunological identification of type 2X myosin heavy chain in rat skeletal muscle[J]. Biochimica et Biophysica Acta, 1990, 1035: 109-112. DOI:10.1016/0304-4165(90)90181-U |
| [21] |
李伯江, 李平华, 吴望军, 等. 骨骼肌肌纤维形成机制的研究进展[J]. 中国农业科学, 2014, 47(6): 1200-1207. |
| [22] |
WU Z, PUIGSERVERP P, ANDERSSON U, et al. Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1[J]. Cell, 1999, 98: 115-124. DOI:10.1016/S0092-8674(00)80611-X |
| [23] |
LIN J, WU H, TARRY B, et al. Transcriptional co-activator PGC-1α drives the formation of slow-twitch muscle fibers[J]. Nature, 2002, 418: 797-801. DOI:10.1038/nature00904 |
| [24] |
SCHULER M, ALI F, CHAMBON C, et al. PGC1 alpha expression is controlled in skeletal muscles by PPAR beta, whose ablation results in fiber-type switching, obesity, and type 2 diabetes[J]. Cell Metabolism, 2006, 4(5): 407-414. DOI:10.1016/j.cmet.2006.10.003 |
| [25] |
方海琴, 张勇, 许佑君, 等. PPARδ激动剂GW501516调节小鼠骨骼肌线粒体生物合成和纤维类型转换的作用[J]. 中国药理学通报, 2010, 26(10): 1290-1295. |
| [26] |
刘冰, 杨君, 杨宁. 不同品种鸡肌纤维的发育规律及杂种优势研究[J]. 畜牧兽医学报, 2006, 37(8): 829-833. |
| [27] |
韩海霞, 曹顶国, 雷秋霞, 等. 日粮营养水平对鲁禽3号麻鸡肌纤维直径和密度的影响[J]. 饲料研究, 2008(1): 47-49. |
| [28] |
杨敏馨, 寇涛, 李悦, 等. 解淀粉芽孢杆菌ES-2对肉鸡屠宰性能和肉品质及肌肉抗氧化能力的影响[J]. 南京农业大学学报, 2016, 39(2): 255-261. DOI:10.7685/jnau.201505040 |
| [29] |
蒋雪樱, 张相伦, 陆鹏, 等. 蛋氨酸对肉鸡屠宰性能、肉品质及肌肉抗氧化的影响[J]. 食品科学, 2016, 37(21): 114-118. DOI:10.7506/spkx1002-6630-201621020 |
| [30] |
CHAN K M, DECKER E A, FEUSTMAN C. Endogenous skeletal muscle antioxidants[J]. Critical Reviews in Food Science and Nutrition, 1994, 34(4): 403-426. DOI:10.1080/10408399409527669 |
| [31] |
SATOSHI S, KIYOJII T, HIROVO K, et al. Exercise-induced lipid peroxidation and leakage of enzymes before and after vitamin E supplementation[J]. International Journal of Biochemistry, 1989, 21(8): 835-838. DOI:10.1016/0020-711X(89)90280-2 |




