随着我国畜牧养殖业的快速发展,常规饲料原料尤其是蛋白质原料供应紧缺,传统型的玉米-豆粕型动物饲粮结构正在发生变化,引入菜籽粕等杂粕的多元化饲粮结构将会成为我国畜牧养殖业的新常态[1]。菜籽粕是油菜籽在榨油过程中生产的副产物,其粗蛋白质含量在35%~45%,是一种较为常见的饲料蛋白质原料资源[2],但由于含有硫甙(glucosinolate,GS)、单宁、植酸等抗营养因子,且粗纤维含量较高[3],限制了其在动物饲粮中的饲用价值。为了提高菜籽粕的饲用价值,研究人员针对菜籽粕抗营养因子的脱毒和降解开展了大量的研究。早期的菜籽粕脱毒方法主要有物理法与化学法[4],通过物理加热和溶剂浸提虽然能有效地减少菜籽粕中的硫甙含量,但操作成本高,且存在着营养物质损失大、试剂残留等问题[5]。近年来,生物发酵脱毒法由于具有成本低、营养物质损失小、脱毒的同时改善菜籽粕的营养价值等优点而得到了广泛的关注[6-8]。Rozan等[9]使用少孢根霉菌发酵处理菜籽粕,发酵40 h后可降解30%的木质素,降解47%的硫甙。研究发现,采用混菌发酵可以产生多种酶系,达到协同效果[10-11]。目前用于发酵菜籽粕的菌株多为黑霉、曲霉及芽孢类等非农业部允许添加在饲料中的微生物,其安全性有待进一步考证;其次,大部分发酵菜籽粕的研究主要侧重于硫甙的降解,而对于菜籽粕营养指标及风味指标的研究报道相对较少[12]。因此,本试验旨在从发酵青贮与土壤混合液中筛选出能高效降解硫甙且符合农业部添加规定的微生物,并结合酿酒酵母发酵以提高菜籽粕风味,配合枯草芽孢杆菌以改善菜籽粕营养结构,对菜籽粕进行混菌固态发酵,于脱毒的同时改善菜籽粕营养价值与风味。
1 材料与方法 1.1 试验材料菜籽饼(高毒)取自云南大理,硫甙含量108 μmol/g,用于硫甙的提取;发酵用菜籽粕取自北京金盛祥科技发展有限公司,硫甙含量37 μmol/g,用于微生物发酵培养基基质;枯草芽孢杆菌、酿酒酵母取自山东大学微生物技术国家重点实验室;硫甙由本实验室粗提获得。
1.1.1 硫甙的粗提硫甙的粗提参照文献[13],在70 ℃水浴条件下,采用质量分数70%的乙醇溶液提取6 h,离心、过滤并旋转蒸发上清液后获得硫甙粗品。
1.1.2 培养基乳酸细菌培养基(MRS培养基)+硫甙固体筛选培养基:蛋白胨10 g/L,酵母膏5 g/L,牛肉膏10 g/L,硫甙5 g/L,磷酸氢二钾2 g/L,乙酸钠5 g/L,柠檬酸三铵2 g/L,硫酸镁0.1 g/L,硫酸锰0.05 g/L,吐温-80 1 g/L,琼脂20 g/L,121 ℃灭菌20 min。
MRS培养基+硫甙液体复筛培养基:蛋白胨10 g/L,酵母膏5 g/L,牛肉膏10 g/L,硫甙5 g/L,磷酸氢二钾2 g/L,乙酸钠5 g/L,柠檬酸三铵2 g/L,硫酸镁0.1 g/L,硫酸锰0.05 g/L,吐温-80 1 g/L,121 ℃灭菌20 min。
MRS培养基:蛋白胨10 g/L,酵母膏5 g/L,牛肉膏10 g/L,葡萄糖20 g/L,磷酸氢二钾2 g/L,乙酸钠5 g/L,柠檬酸三铵2 g/L,硫酸镁0.1 g/L,硫酸锰0.05 g/L,吐温-80 1 g/L,121 ℃灭菌20 min。
酵母膏胨葡萄糖(YPD)琼脂培养基:蛋白胨20 g/L,酵母膏10 g/L,葡萄糖20 g/L,121 ℃灭菌20 min。
细菌基础培养基(LB培养基):蛋白胨10 g/L,酵母膏5 g/L,氯化钠10 g/L,121 ℃灭菌20 min。
菜籽粕发酵培养基:菜籽粕50 g,无菌水50 mL,105 ℃灭菌15 min。
1.2 试验方法 1.2.1 硫甙降解菌的初筛取发酵青贮20 g、土壤10 g接种于装有120 mL无菌水的250 mL锥形瓶中,于37 ℃,200 r/min的摇床充分振荡20 min,随后静置30 min,并取上清液20 mL接种于菜籽粕发酵培养基中,于37 ℃恒温静置培养48 h。用灭菌玻璃棒搅拌均匀后,取出5 g用无菌水振荡稀释,取上清液1 mL按10-1、10-2、10-3、10-4倍比稀释涂布于MRS培养基+硫甙固体筛选培养基上,于37 ℃恒温静置培养48 h,挑取数量多、生长快、菌落大的菌株进行划线、分离、纯化保存,进行复筛。
挑取分离纯化后的菌株单菌落于MRS培养基并于37 ℃恒温静置培养24 h后,按5%体积比的接种量接种于MRS培养基+硫甙液体复筛培养基,37 ℃恒温静置培养48 h,3 000 r/min离心15 min,取上清液测硫甙含量,选取硫甙降解率最高的5个菌株保存。
1.2.2 硫甙降解菌的复筛将初筛得到的5株硫甙降解菌扩大培养后,按10%体积质量比的接种量,1:1体积质量比的料水比接种于菜籽粕发酵培养基,37 ℃恒温静置发酵48 h,试验设3个重复;发酵结束后一部分60 ℃烘干粉碎后测硫甙含量,另一部分-20 ℃保存。选取5株菌中硫甙降解效果最好的1株菌株与枯草芽孢杆菌、酵母菌配伍混合发酵。
1.2.3 菌株鉴定根据菌株菌落特征及形态观察,参照《食品卫生微生物学标准鉴定图谱》对筛选到的菌株进行初步鉴定。菌株通过引物1492R:5′-GGTTACCTTGTTACCACTT-3′和27F:5′AGAGTTTGATCCTGGCTCA-3′进行16S rDNA扩增,将纯化后的PCR产物交于青岛擎科生物技术有限公司测序,测序结果在GenBank核酸序列数据库中进行BLAST比对分析,寻找同源序列。
1.2.4 菌株生长曲线测定将分离得到的目的菌株平板划线培养,挑取平板上单菌落于10 mL液体MRS培养基中37 ℃恒温培养24 h制成种子液,并按1%体积质量比的接种于150 mL液体MRS培养基中,37 ℃静置培养48 h,每3 h取样1次,在紫外可见分光光度计600 nm处测其光密度(OD)值,并绘制OD600与时间的关系曲线图。
1.2.5 硫甙降解菌与枯草芽孢杆菌、酿酒酵母的混菌发酵将该菌株培养液与枯草芽孢杆菌、酿酒酵母的培养液按4:3:3的体积比、10%体积质量比的总接种量、1:1体积质量比的料水比对菜籽粕进行配伍发酵,34 ℃恒温静置发酵48 h,试验设3个重复。测定发酵后的硫甙以及粗蛋白质、粗纤维、粗脂肪、多肽、总酸含量。
1.3 测定指标及方法参照文献[14-15],采用氯化钯比色法测定菜籽粕发酵前后硫甙的含量;采用杜马斯全自动定氮仪测定样品粗蛋白质含量;滤袋法测定粗纤维含量;索氏抽提法测定粗脂肪含量;参照GB/T 22492—2008大豆肽粉的测定方法测定多肽含量;采用滴定法测定发酵后总酸含量(结果以乳酸计)[16-17]。
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)法测定蛋白质分子量的分布,具体操作为:精确称取粉碎过60目筛的菜籽粕1.000 0 g,用0.1 mol/L的Tris-HCl(pH 8.0)的缓冲液浸提后离心取上清,吸取20 μL蛋白质提取液加入到由5%浓缩胶、15%分离胶组成的从上到下2层SDS-PAGE胶泳道中,20 mA、80 V恒流电泳2 h后,考马斯亮蓝染色观察电泳条带。
1.4 数据统计与分析试验数据分为2部分。菌株筛选部分数据通过直观分析即可得出结论;发酵菜籽粕相关指标数据通过软件SPSS 19.0中的一般线性模型分析,结合Duncan氏法进行多重比较,试验结果采用平均值±标准误表示,以P < 0.05作为差异显著性判断标准。采用Excel 2007绘制散点图。
2 结果与分析 2.1 初筛与复筛结果以硫甙为唯一碳源,通过MRS+硫甙固体培养基分离得到54株菌落大、生长快、能较好利用硫甙的微生物菌株。以MRS+硫甙液体培养基复筛测定硫甙降解率,如表 1所示,硫甙降解率大于30%的有9株,最大降解率为39.25%,选取效果最好的5株菌进行下一步的发酵,其编号分别为A1、A9、D6、E6、F3,对应的降解率分别为39.25%、34.57%、34.58%、34.58%、35.51%。
|
|
表 1 复筛菌株硫甙降解率 Table 1 Degradation rate of GS by re-screening |
将初筛得到的5株菌株做菜籽粕单菌固态发酵试验,试验设3个重复,发酵结束后测定发酵前后菜籽粕硫甙含量变化,计算硫甙降解率。如表 2所示,初筛得到的5株菌中,菌株A9硫甙降解率最高,为23.69%。
|
|
表 2 固态发酵硫甙降解率 Table 2 Degradation rate of GS with solid state fermentation |
将初筛、复筛得到的A9菌株在分离平板上培养24 h后观察形成圆形透明菌落,边缘整齐,菌落光滑,在倒置显微镜下观察菌体细胞呈棒状。通过PCR扩增得到长度为948 bp的序列,将该序列与GenBank数据库中已收录的DNA序列进行BLAST比较分析可知,该菌株属于乳酸菌杆属(Lactobacillus),与嗜酸乳杆菌(Lactobacillus farciminis)KJ04的相似性达99%,在GenBank中的登记号为KX139184.1,由此确定菌株A9为嗜酸乳杆菌。
2.4 菌株生长曲线如图 1所示,嗜酸乳杆菌经过短暂的延滞期,在3~21 h进入对数生长期,在30 h达到最大生长浓度,随后进入衰亡期。因此,在后续培养与发酵试验中均选取培养21 h的活化菌液作为种子液。
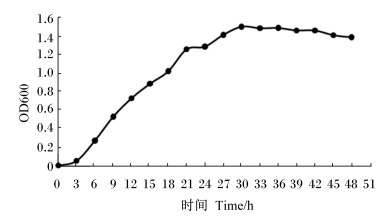
|
图 1 嗜酸乳杆菌生长曲线 Figure 1 Growth curve of Lactobacillus farciminis |
将嗜酸乳杆菌培养液与枯草芽孢杆菌、酿酒酵母的培养液按4:3:3的体积比、10%的体积质量比的总接种量、1:1体积质量比的料水比对菜籽粕进行混菌发酵,34 ℃恒温静置发酵48 h,发酵后菜籽粕硫甙含量由37.48 μmol/g降低到25.67 μmol/g,硫甙降解率为30.73%,符合农业部关于低硫甙菜籽粕硫甙含量的规定。
2.6 不同发酵方式对硫甙降解率的影响如表 3所示,不同的发酵方式对硫甙的降解效果不同。嗜酸乳杆菌的液体筛选培养基硫甙降解率为39.25%,而单菌发酵组与混菌发酵组硫甙降解率分别为23.69%和30.73%,均低于筛选培养基的硫甙降解率;混菌发酵的硫甙降解效果要优于单菌发酵。
|
|
表 3 不同发酵方式对硫甙降解率的影响 Table 3 Degradation rate of GS with different fermentation modes |
微生物发酵菜籽粕脱毒的同时也改善了菜籽粕的营养价值。菜籽粕经单菌发酵与混菌发酵后,其粗蛋白质、多肽和总酸含量有了不同程度地提高,粗纤维和粗脂肪等成分的含量也得到了不同程度地改变。如表 4所示,菜籽粕经单菌发酵和混菌发酵后,粗蛋白质含量显著提高(P < 0.05),由38.41%分别提高到44.94%和45.59%,但单菌发酵组和混菌发酵组之间差异不显著(P>0.05);多肽和总酸含量显著提高(P < 0.05),混合发酵的效果要优于单菌发酵,且差异显著(P < 0.05)。
|
|
表 4 微生物发酵对菜籽粕营养成分的影响 Table 4 Effects of microbial fermentation on nutritional components of rapeseed meal |
如图 2所示,菜籽粕蛋白质分子质量主要分布在17~34 ku之间,菜籽粕经发酵后,A区域大分子蛋白质(17~34 ku)含量减少,B区域小分子蛋白质含量明显增加,尤其是分子质量在10 ku以下的小分子蛋白质。单菌发酵与混菌发酵有相似的效果。
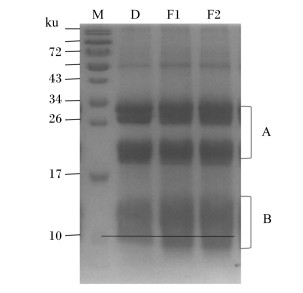
|
M:蛋白质分子质量标准;D:对照组;F1:单菌发酵组;F2:混菌发酵组。 M: protein molecular weight marker; D: control group; F1: single bacteria fermented group; F2: mixed bacteria fermented group. 图 2 菜籽粕发酵后蛋白质分子组成变化 Figure 2 Changes of protein molecular composition of rapeseed meal after fermentation |
菜籽粕经嗜酸乳杆菌发酵48 h以后,表面呈黄褐色蓬松状,大量有机酸的存在使菜籽粕产生一种浓郁的酸香味,酸香味是评价饲料风味的重要指标[18]。菜籽粕经单菌发酵和混菌发酵后,总酸含量显著提高(P < 0.05),由1.01%分别提高到3.10%和3.91%。
3 讨论 3.1 不同发酵方式对菜籽粕中硫甙降解率的影响微生物发酵可以有效降解菜籽粕中的硫甙, 其降解原理是微生物可直接利用硫甙为碳源进行代谢活动,同时微生物代谢过程中产生了大量不同种类的酶,硫甙在酶的催化作用下可水解生成多种易挥发的异硫氰酸盐等物质[19]。MRS培养基+硫甙液体筛选培养基中,硫甙是唯一可被微生物利用的碳源,微生物可直接利用硫甙,对硫甙的降解效果要优于菜籽粕发酵培养基;菜籽粕发酵培养基中硫甙并非为唯一碳源,微生物选择性地先利用容易被利用的碳源,然后再利用硫甙为碳源进行生命代谢活动,且MRS培养基+硫甙液体筛选培养基的生长环境更利于微生物的生长。试验发现,混菌发酵对硫甙的降解效果要优于单菌发酵,原因可能是由硫甙的结构特征决定的,根据R基结构的不同,硫甙可分为120多种[20],单一菌种分泌的酶只能降解某一部分类型的硫甙,混菌发酵产生更为丰富的酶系则能同时降解多种不同类型的硫甙,达到协同发酵的效果[21]。王晓凡等[22]研究表明,多菌种混合发酵效果优于单菌发酵,当植物乳杆菌、枯草芽孢杆菌、米曲霉的接种比例为9%:9%:6%,水料比为1.3:1.0,33 ℃发酵96 h后,菜籽粕硫甙降解率可达91.36%;鞠兴荣等[23]研究发现,枯草芽孢杆菌与宇佐美曲霉混合发酵的菜籽粕硫甙降解率都要优于其单菌发酵的菜籽粕硫甙降解率,这与本试验的研究结果一致。
3.2 发酵菜籽粕蛋白质品质的改善微生物发酵是改善菜籽粕蛋白质品质的重要途径之一。菜籽粕蛋白质含量虽高,但其蛋白质分子质量比较大,消化吸收率低,尤其是由压榨工艺获得的菜籽粕[24]。菜籽粕蛋白质主要是12S球蛋白,由6个亚基对组成,这6个亚基对由2条分子质量在20~30 ku之间的多肽链组成。研究表明,嗜酸乳杆菌和枯草芽孢杆菌在生长代谢过程中会产生一系列的α-淀粉酶、中性蛋白酶及其他胞外蛋白酶[25],这些酶能够不同程度地将不易被动物消化吸收的大分子蛋白质降解为易被利用的小分子多肽类物质,还能将不易被动物消化吸收的植物蛋白质转化为更为优质的微生物菌体蛋白质及功能性多肽[26]。动物对蛋白质及氨基酸的消化率是评价饲料蛋白质品质的重要标准,蛋白质分子质量越小,多肽含量越高,越容易被动物消化吸收利用。从蛋白质电泳图可以观察到,发酵后菜籽粕小分子蛋白质含量增加,多肽含量显著增加。多肽具有更好的营养价值,相比于氨基酸,多肽更易被动物吸收利用,且对氨基酸和矿物元素的消化吸收有促进作用[27],同时,多肽还具有免疫活性、神经活性、抗氧化作用等功能[28]。发酵后,菜籽粕蛋白质质量得到改善,大大提高了菜籽粕蛋白质的营养价值,这与付敏等[26]和王刚等[29]的研究相似。
3.3 微生物发酵改善菜籽粕营养价值机理菜籽粕经微生物发酵后,表面蓬松多孔,原因可能是微生物分泌的酶的水解作用破坏了菜籽粕表面纤维结构,同时枯草芽孢杆菌与酿酒酵母在代谢过程中发生大量的气体交换,又加快了这种结构破坏,从而增加了微生物分泌的消化酶与菜籽粕的接触面积[30],对菜籽粕进行消化,使得菜籽粕各营养物质能被动物更高效地吸收与利用。
微生物混菌固态发酵对菜籽粕营养价值与风味的改善是各菌株协同发酵的结果。菜籽粕经微生物发酵后,粗蛋白质和多肽含量得到了不同程度地提高,这主要因为前期发酵体系中枯草芽孢杆菌生长迅速,分泌了大量的α-淀粉酶、中性蛋白酶及其他胞外蛋白酶,这些蛋白酶在将菜籽粕粗蛋白质转化为易被动物消化吸收的微生物菌体蛋白质及多肽的同时消耗的碳源、能源物质也相应增加,造成发酵菜籽粕的部分干物质损失,出现了蛋白质的“浓缩效应”,最终导致了发酵产物粗蛋白质含量的提高,这与蒋边[31]的研究结果一致。发酵后,菜籽粕总酸含量显著增加,并且产生一种酸香味,改善了菜籽粕的风味。这是因为在嗜酸乳杆菌和酿酒酵母的生长代谢过程中消耗蛋白质和脂肪等营养物质的同时产生了大量的乳酸、芳香酸和不饱和脂肪酸类物质。此外,酸香味可以缓解因环境变化、饲料原料改变等应激产生的采食量下降,同时刺激动物的嗅觉器官,进而促进采食量,调节饲粮适口性[32]。乳酸等有机酸是一种良好的酸化剂,在改善饲料适口性、降低动物胃肠道pH和提高动物采食量等方面已有相关报道[33]。除此之外,进入消化系统的乳酸能够激活胃蛋白酶原,促进胆汁分泌和胆囊收缩,在促进动物对营养物质的消化吸收、抑制动物胃肠道病原菌繁殖、促进肠道微生物平衡等方面有积极作用[34]。菜籽粕发酵过程中微生物产生的丰富酶系对菜籽粕进行预消化,降低抗营养因子含量,提高蛋白质含量与质量,增加多肽含量,并显著提高总酸及各种有机酸组分含量,改善适口性与风味,使其能够更好地被动物消化吸收与利用。
4 结论① 本试验筛选出一株能够高效降解硫甙的天然微生物菌株,经鉴定该菌株为嗜酸乳杆菌,对菜籽粕中硫甙的降解率为39.25%。
② 通过嗜酸乳杆菌单菌发酵以及与枯草芽孢杆菌、酿酒酵母混菌发酵均可有效降低菜籽粕硫甙含量,降解率分别为23.69%和30.73%;同时能显著提高菜籽粕中粗蛋白质、多肽和总酸的含量,有效地改善了菜籽粕的营养价值与风味。
| [1] |
蔡辉益. 新型日粮技术体系可解决饲料资源短缺问题[J]. 农业知识:科学养殖, 2013(2): 50-51. |
| [2] |
胡永娜, 李爱科, 王之盛, 等. 微生物固态发酵菜籽粕营养特性的研究[J]. 中国粮油学报, 2012, 27(3): 76-80. |
| [3] |
AIDER M, BARBANA C. Canola proteins:composition, extraction, functional properties, bioactivity, applications as a food ingredient and allergenicity-A practical and critical review[J]. Trends in Food Science & Technology, 2011, 22(1): 21-39. |
| [4] |
YANG X X, CHEN H Z, GAO H L, et al. Bioconversion of corn straw by coupling ensiling and solid-state fermentation[J]. Bioresource Technology, 2001, 78(3): 277-280. DOI:10.1016/S0960-8524(01)00024-4 |
| [5] |
王小三, 金青哲, 王兴国. 菜籽粕硫甙生物降解和脱毒研究进展[J]. 粮食与油脂, 2009(12): 1-3. DOI:10.3969/j.issn.1008-9578.2009.12.001 |
| [6] |
RAMACHANDRAN S, ROOPESH K, NAMPOOTHIRI K M, et al. Mixed substrate fermentation for the production of phytase by Rhizopus spp.using oilcakes as substrates[J]. Process Biochemistry, 2005, 40(5): 1749-1754. DOI:10.1016/j.procbio.2004.06.040 |
| [7] |
ARO S O. Improvement in the nutritive quality of cassava and its by-products through microbial fermentation[J]. African Journal of Biotechnology, 2008, 7(25): 4789-4797. |
| [8] |
COUTO S R, SANROMÁN M A Á. Application of solid-state fermentation to food industry-A review[J]. Journal of Food Engineering, 2006, 76(3): 291-302. DOI:10.1016/j.jfoodeng.2005.05.022 |
| [9] |
ROZAN P, VILLAUME C, BAU H M, et al. Detoxication of rapeseed meal by Rhizopus oligosporus sp-T3:a first step towards rapeseed protein concentrate[J]. International Journal of Food Science and Technology, 1996, 31(1): 85-90. DOI:10.1111/ifs.1996.31.issue-1 |
| [10] |
MADEIRA M J Jr, MACEDO J A, MACEDO G A. A new process for simultaneous production of tannase and phytase by Paecilomyces variotii in solid-state fermentation of orange pomace[J]. Bioprocess and Biosystems Engineering, 2012, 35(3): 477-482. DOI:10.1007/s00449-011-0587-y |
| [11] |
叶龙祥, 牛兴亮. 菜籽粕混菌发酵脱毒研究[J]. 粮食与食品工业, 2010, 17(4): 41-44. |
| [12] |
熊锋, 何荣海, 张韦唯, 等. 饼粕生物发酵饲料产业发展现状与趋势[J]. 粮食与饲料工业, 2016, 12(5): 39-43. |
| [13] |
石萍, 卜路霞, 徐园园, 等. 油菜籽中硫苷提取的影响因素研究[J]. 天津农学院学报, 2016, 23(2): 41-43. |
| [14] |
刘绚霞, 杨莉. 分光光度法测定油菜籽中硫代葡萄糖甙[J]. 陕西农业科学, 2002(6): 5-7. |
| [15] |
王宁惠. 油菜籽(饼粕)中硫代葡萄糖甙总量速测方法-氯化钯法[J]. 青海农林科技, 2009(3): 58-59. |
| [16] |
安华明, 刘明, 杨曼, 等. 刺梨有机酸组分及抗坏血酸含量分析[J]. 中国农业科学, 2011, 44(10): 2094-2100. |
| [17] |
罗建, 林标声, 何玉琴, 等. 微生物发酵饲料中乳酸含量的测定方法比较分析[J]. 饲料博览, 2012(5): 37-39. |
| [18] |
张鑫, 刘馨忆, 李方方, 等. 风味剂在猪配合饲料上的应用[J]. 猪业科学, 2016, 33(1): 86-87. |
| [19] |
魏晶石, 汪正华, 沈俭. 菜籽粕生物降解法脱毒及综合利用[J]. 西部粮油科技, 1999, 24(6): 49-52. |
| [20] |
GRUBB C D, ABEL S. Glucosinolate metabolism and its control[J]. Trends in Plant Science, 2006, 11(2): 89-100. DOI:10.1016/j.tplants.2005.12.006 |
| [21] |
邱良伟, 顾拥建, 沙文锋, 等. 复合微生物固态发酵菜籽粕的研究[J]. 安徽农业科学, 2015(3): 209-211. |
| [22] |
王晓凡, 王海滨, 熊光权, 等. 多菌种复合固态发酵对菜籽粕硫甙去除效果的研究[J]. 食品科技, 2012(3): 196-200. |
| [23] |
鞠兴荣, 王雪峰, 王立峰, 等. 混菌固态发酵菜籽粕制备菜籽肽的菌种筛选[J]. 食品与发酵工业, 2011, 37(9): 104-108. |
| [24] |
TRIPATHI M K, MISHRA A S. Glucosinolates in animal nutrition:a review[J]. Animal Feed Science and Technology, 2007, 132(1/2): 1-27. |
| [25] |
JOO H S, CHANG C S. Production of an oxidant and SDS-stable alkaline protease from an alkaophilic Bacillus clausii I-52 by submerged fermentation:feasibility as a laundry detergent additive[J]. Enzyme and Microbial Technology, 2006, 38(1/2): 176-183. |
| [26] |
付敏, 何军, 余冰, 等. 混菌固态发酵对菜籽饼营养价值及抗营养因子含量的影响[J]. 动物营养学报, 2013, 25(7): 1579-1586. |
| [27] |
顾斌, 马海乐, 刘斌. 菜籽粕混菌固态发酵制备多肽饲料的研究[J]. 中国粮油学报, 2011, 26(1): 83-87. |
| [28] |
张志刚, 李小兵, 孙国权, 等. 动物小肽营养研究进展[J]. 饲料博览, 2008(8): 15-18. |
| [29] |
王刚, 蔡国林, 陆健. 微生物发酵改善菜籽粕品质的研究[J]. 中国油脂, 2011, 36(7): 24-28. |
| [30] |
GILANI G S, COCKELL K A, SEPEHR E. Effects of antinutritional factors on protein digestibility and amino acid availability in foods[J]. Journal of AOAC International, 2005, 88(3): 967-987. |
| [31] |
蒋边. 菜籽粕固态发酵制备多肽及降解硫苷的试验研究[D]. 硕士学位论文. 镇江: 江苏大学, 2014. http://d.wanfangdata.com.cn/Thesis/Y2537517
|
| [32] |
张鑫, 李方方, 朱宇旌, 等. 饲粮中添加风味剂对猪采食量的影响及其作用机理[J]. 动物营养学报, 2016, 28(5): 1332-1338. |
| [33] |
石宝明, 单安山. 饲用酸化剂的作用与应用(续)[J]. 饲料工业, 1999(2): 4-7. |
| [34] |
黄庆生, 王加启. 饲料乳酸菌类益生素的作用机制和应用[J]. 动物营养学报, 2002, 14(4): 12-17. |




