2. 四川华德生物工程有限公司, 成都 610063
2. Sichuan Rota Bioengineering Co., Ltd., Chengdu 610063, China
生命形成过程中,精子和卵母细胞均提供了遗传物质,而卵母细胞还为早期胚胎的发育提供了大量必需的营养物质。因而,作为生命发生的基础,卵母细胞质量的高低直接关系到受精率、卵裂率、早期胚胎存活、妊娠建立和维持、胎儿发育,甚至新生个体一生的命运。对卵母细胞质量的评定主要是分析卵母细胞的形态结构和其成熟度,评定的基础是卵母细胞在生长发育过程中结构和生化变化[1]。锌(Zn)是动物必需的微量元素之一,虽然动物机体对锌的需要量甚微,但其生理生化功能却非常重要,包括基因转录、翻译,细胞凋亡、增殖、分化及信号传导等生理过程都需要依赖锌才能正常进行[2]。缺锌在繁殖上常表现为卵巢发育异常、促黄体素/卵泡刺激素(LH/FSH)合成和分泌受阻、情期循环紊乱和胎儿先天性畸形,目前关于锌对卵母细胞质量影响的研究已取得较大进展。本文就锌对雌性动物卵母细胞质量的影响及其可能的作用机制作一综述。
1 锌及其稳态调控锌是动物必需的微量元素之一。1789年Klaproth发现锌元素,1934年,Todd等首次证明锌是动物必需的营养元素。1955年,Tuker和Salmem发现并证实缺锌导致猪皮肤不全角质化症。至今,已有大量研究证实锌元素参与机体生命活动的各个环节。首先,锌与300多种生物酶的结构和活性调节相关,如DNA合成酶、乙醇脱氢酶和碱性磷酸酶等。其次,锌是生物膜所必需的结构离子,与蛋白质合成密切相关。再次,锌参与组成锌指结构,在内分泌功能调节和基因表达方面有特殊作用,同时锌对细胞分裂也有明显作用。最后,锌还与许多重要激素有关,如甲状腺素、睾酮、胰岛素等,进而促进机体性器官和性功能的发育。近年来研究发现,锌稳态调控主要通过金属硫蛋白(metallothioneins,MTs)和锌转运蛋白完成[3]。
1.1 金属硫蛋白调控锌稳态金属硫蛋白是一类富含半胱氨酸的小分子质量的金属结合蛋白,含60多个氨基酸,可与7个锌离子结合。金属硫蛋白既可以是锌受体,也可作为锌供体在锌离子浓度超出一定范围时对锌离子进行调控(图 1)[4]。细胞中金属硫蛋白的不同状态取决于锌被利用程度和氧化还原平衡状态。金属硫蛋白中巯基配体为中心的化学特征调控着锌离子结合能力[5],通过这种方式,金属硫蛋白成为氧化还原蛋白,并且可以将氧化还原信号转换成锌信号。强氧化力条件下增加了金属硫蛋白作为锌离子供体的可能性,而在还原能力强的条件下,金属硫蛋白则作为潜在锌受体。目前为止,除金属硫蛋白外尚未发现细胞中存在临时储存锌的其他蛋白。
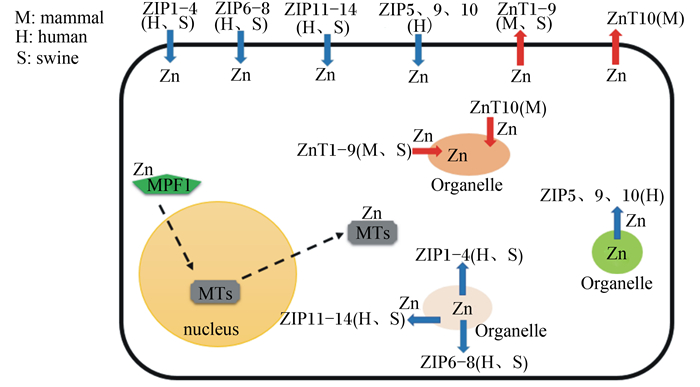
|
mammal:哺乳动物;human:人类;swine:猪;nucleus:细胞核;Orangelle:细胞器;Zn:锌znic;MPF1:成熟促进因子1 maturation promoting factor 1;MTs:金属硫蛋白metallothioneins。 箭头表示锌的转运方向。 Arrows show the predicted direction of zinc mobilization. 图 1 金属硫蛋白和锌转运蛋白在细胞内的功能 Figure 1 Functions of metallothioneins and zinc transporters in the cell |
锌转运蛋白通过控制细胞锌的流入与流出,协调对锌的需求来维持锌稳态[6]。哺乳动物锌转运蛋白包含2个家族,即SLC30(solute-linked carrier 30,ZnT)家族和SLC39(solute-linked carrier 39,ZIP)家族。ZnT家族协助锌离子从细胞质内流出细胞外或转运到细胞器内(图 1)。ZnT家族又可被分为3个亚家族:亚家族Ⅰ、Ⅱ和Ⅲ,其成员广泛分布在原核细胞及真核生物中。迄今为止,在哺乳动物中已发现10个ZnT家族成员(ZnT1~10)。猪上已克隆ZnT1~9,且mRNA水平上ZnT1~7、9在猪卵巢中均有表达[7]。与ZnT家族相反,ZIP家族促进细胞外或细胞器中的锌进入细胞质(图 1)。哺乳动物ZIP家族分为4个亚家族:亚家族Ⅰ、Ⅱ、LIV-1和gufA。目前,在人上已发现14个ZIP成员(ZIP1~14),在猪上已确定11个ZIP序列(ZIP1~4、6~8、11~14)。机体正是靠这2种锌转运系统来维持细胞内锌稳态平衡[8]。
2 锌对卵母细胞质量的影响通过体外培养猪卵母细胞,并进行体细胞核转移胚胎移植,发现卵母细胞体外成熟培养(IVM)液中加锌(0.8 μg/mL)后显著提高分娩克隆猪的数目[9]。在体外培养液中添加锌培养马卵母细胞,发现对卵母细胞的卵裂率无显著影响,但提高了培养7 d的囊胚率(45% vs. 8%)[10]。缺锌状态下卵母细胞在IVM时出现异常分裂[11-13],且体内研究也证实了该结果[14]。缺锌培养猪卵母细胞,细胞中微丝形成异常,达到第2次减数分裂中期(MⅡ期)的比率显著降低[15]。由此表明锌对卵母细胞质量至关重要。
2.1 锌对卵母细胞减数分裂和成熟的影响研究发现卵母细胞减数分裂起始(生发泡期,GV期)至成熟期(MⅡ期)间锌含量显著升高,在受精卵和2细胞胚胎阶段开始下降[11],说明锌在卵母细胞成熟到早期胚胎过程中可能发挥了重要作用。在鼠卵母细胞IVM体系中添加N, N, N’, N’-四-(2-吡啶基甲基)乙二胺(TPEN,与锌具有高亲和力),发现试验组32%卵母细胞出现对称分裂[11],表明TPEN扰乱了卵母细胞内的锌稳态,细胞内锌紊乱干扰了卵母细胞的不对称分裂。另有研究发现,在IVM时锌不足导致出现较大的极体,表明这些卵母细胞在减数分裂中纺锤体水平存在缺陷[12-13]。分析减数分裂时卵母细胞的纺锤体形态,发现对照组卵母细胞正常通过第1次减数分裂中期(MⅠ期),染色体分离并在MⅡ期发生减数分裂阻滞。锌不足试验组卵母细胞通过MⅠ期、染色体分离,但没有继续发育至MⅡ期,且存在末期纺锤体并在两极均有被降解的染色体[11, 16]。以上研究表明卵母细胞内锌紊乱造成纺锤体异常,使得卵母细胞减数分裂不能正常进行,导致卵母细胞过早地停滞在第1次减数分裂末期。
另有研究发现,体外培养卵母细胞时锌抑制(TPEN处理)导致卵母细胞第1次减数分裂休止期过早重新启动,但免疫荧光分析纺锤体形态发现,尽管缺锌促使细胞出现细胞核膜破裂(GVBD),但存在染色体凝结,因而不能完成第1次减数分裂[14]。体内研究表明,缺锌饲粮导致小鼠42.5%的卵母细胞在没有排卵信号时经历着GVBD期,而对照组卵母细胞完全处于GV期。缺锌组小鼠卵母细胞共聚焦免疫荧光显示了其纺锤体结构异常包括停留在第1次减数分裂中期和末期[14, 17]。以上体内、体外研究表明锌是卵母细胞减数分裂正常进行所必需的元素,缺锌导致卵母细胞减数分裂成熟障碍。
2.2 锌对卵母细胞排卵率、受精率以及早期胚胎发育的影响卵丘扩展是卵母细胞成熟排卵所必需的一个过程[18]。TPEN处理IVM的卵丘-卵母细胞复合物(COCs),发现TPEN阻止了表皮细胞生长因子(EGF)诱导的卵丘扩展,而加锌后恢复了EGF诱导的卵丘扩展[14]。体内研究发现,用缺锌饲粮饲喂小鼠10 d,超数排卵小鼠的输卵管中没有卵母细胞,说明缺锌导致了小鼠排卵障碍。体外评估缺锌小鼠卵母细胞的受精能力发现,缺锌处理3或5 d均导致受精率降低[19]。以上结果表明锌对哺乳动物排卵和受精有不可替代的作用。
用不同浓度锌处理猪IVM卵母细胞,1.2 μg/mL的锌增加体外孤雌激活的囊胚形成率,且0.8 μg/mL的锌提高人工授精处理后囊胚形成率[20],表明锌处理卵母细胞有利于提高卵母细胞质量,进而促进囊胚发育。胚胎附植前的研究也发现生命初始的有丝分裂需要严格的锌平衡和调节[21]。在卵母细胞IVM时添加TPEN造成缺锌并考察胚胎发育状况,发现TPEN和TPEN+Zn组中几乎所有的卵母细胞都处于1细胞阶段且TPEN和TPEN+Zn组没有囊胚形成[22]。玻璃化冷冻小鼠卵巢,冷冻液加锌后提高了冷冻复苏卵巢来源的卵母细胞活力和其体外成熟-受精的比率[23]。小鼠排卵配种前5 d饲喂缺锌饲粮导致非囊胚比例增加,囊胚比例降低[19]。另有研究发现,小鼠配种前缺锌4~5 d,妊娠10.5 d时显著降低胚胎顶臀长度,且着床点无胚胎或胚胎无心跳的比例极显著提高(46% vs. 2%)[24]。
以上体内、体外研究表明,锌通过影响哺乳动物卵母细胞质量、活力进而影响卵母细胞的排卵率、受精率和早期胚胎的发育,锌对于卵母细胞以及早期胚胎的发育具有不可或缺的作用,而有效锌浓度对不同物种的哺乳动物而言存在差异。
3 锌影响卵母细胞质量的途径 3.1 锌与卵母细胞减数分裂和成熟成熟促进因子(maturation promoting factor, MPF)和丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)是卵母细胞成熟过程的关键调控因子[25]。MPF由催化亚基P34cdc2和调节亚基周期蛋白B(cyclin B)组成,其活性的大小决定了卵母细胞能否由G2期过渡到M期并发生GVBD。MAPK又称细胞外调节蛋白激酶(ERK),分为ERK1和ERK2,MAPK与其上游信号分子原癌基因蛋白(Mos)以及下游信号分子核糖体S6激酶(RSK)构成的Mos-MEK-MAPK-RSK信号途径能激活MPF,对卵母细胞成熟起着极其重要的作用。
在卵母细胞IVM时扰乱细胞锌稳态,造成卵母细胞MⅠ休止期过早的重新启动即发生GVBD,检测试验组GVBD发生前(6 h)和GVBD发生时(10 h)卵母细胞中环磷酸腺苷(cAMP)的含量以及MPF活性,发现GVBD发生前(6 h)cAMP含量显著增加,到10 h时对照组和试验组卵母细胞的cAMP含量无显著差异,而在10~14 h时,试验组MPF活性显著升高,表明缺锌诱导GVBD发生是通过提高MPF的活性来实现的[14]。
缺锌(添加TPEN)处理卵母细胞后检测MoS的蛋白质水平及其下游成分MAP2K1/2和MAPK3/1的磷酸化水平,发现TPEN处理的卵母细胞在MPF活化和GVBD发生之前Mos和磷酸化的MAPK3/1(pMAPK3/1)的蛋白质水平显著升高。为进一步验证抑制Mos-MAPK通路中蛋白质的合成是否阻止TPEN诱导的GVBD发生,在含有TPEN的卵母细胞培养基中加入环乙酰亚胺[抑制MoS、磷酸化的MAP2K1/2(pMAP2K1/2)和pMAPK3/1蛋白质的表达]培养14 h,结果表明各浓度的环乙酰亚胺均显著抑制了TPEN诱导的GVBD发生[17]。由此表明,缺锌诱导GVBD发生期间,Mos-MAPK通路中的所有成分均被激活,抑制Mos-MAPK通路中相关蛋白质合成解除了TPEN诱导卵母细胞GVBD的发生,说明Mos-MAPK通路的过早激活介导了锌缺乏对卵母细胞减数分裂成熟的不利影响。
以上研究表明,缺锌导致GVBD过早发生,影响卵母细胞成熟。锌主要通过调节MPF的活化以及Mos-MAPK通路的激活,影响卵母细胞MⅠ前期停滞的维持以及减数分裂的重新启动,从而影响卵母细胞的质量。
3.2 锌与卵母细胞抗氧化谷胱甘肽(GSH)在卵母细胞成熟的过程中有重要作用,胞内GSH水平是评价卵母细胞胞质成熟的重要指标[26]。在小鼠[27]和牛[28]卵母细胞体外成熟培养基中添加抗氧化剂上调了GSH水平,有利于胚胎发育。在IVM基中添加半胱氨酸和β-巯基乙醇通过增加卵母细胞内GSH水平提高牛胚胎发育能力[29]。
IVM锌不足时,牛卵母细胞和卵丘细胞GSH水平显著降低[30]。在猪卵母细胞IVM基中添加不同浓度的锌,检测卵母细胞中GSH和活性氧(ROS)水平,发现0.8和1.2 μg/mL锌提高了卵母细胞GSH水平,降低了ROS水平[20],进一步考察孤雌激活和人工授精得到的胚胎,发现这2组的囊胚形成率最高。
尽管以上研究表明锌可通过提高卵母细胞的抗氧化能力改善卵母细胞质量,然而不同的锌源对卵母细胞质量的影响却存在不一样的结果。与常规锌相比,研究发现,经纳米氧化锌处理后,体内卵巢组织和体外细胞内均能检测到完整的纳米颗粒[31]。用纳米氧化锌处理发育成熟阶段的卵母细胞,发现其通过γ-H2AX(DNA双链断裂的分子标志物)和核转录因子-κB(NF-κB)信号通路抑制该细胞早期胚胎的发育[31]。此外,纳米颗粒还可导致ROS增加,进而影响卵母细胞质量。综上可见,锌对卵母细胞发育不可替代,但纳米氧化锌应尽量避免在繁殖动物中应用。
3.3 锌与卵母细胞表观遗传母体表观遗传对提高胚胎发育能力和生后健康影响重大。卵母细胞的表观遗传在其形成过程中发生显著改变,早期卵子形成时总的DNA甲基化水平较低,卵母细胞发育完全时达到高峰。卵母细胞表观遗传主要包括组蛋白修饰以及胞嘧啶甲基化[32-33]。DNA甲基化为印迹基因表达所必需,卵母细胞中DNA甲基化同时也是抑制重复序列过度表达所必需。重复序列沉默失败会导致邻近基因的异常表达或基因组不稳定如DNA双链的断裂增加[34]。
小鼠排卵前3或5 d饲喂缺锌饲粮,收集GV期卵母细胞进行免疫荧光染色分析染色质和DNA甲基化水平,发现缺锌组卵母细胞体外受精和附植前的发育能力受损;在缺锌组卵母细胞中没有观察到三甲基化的组蛋白H3K4;总DNA甲基化检测发现与对照组相比缺锌组卵母细胞DNA甲基化程度大幅度下降;检测重复序列表达情况,与对照组相比缺锌组几种重复序列的转录水平显著增加,其中缺锌组卵母细胞池内A粒子(intracisternal A-particle,Iap,甲基化Iap可阻止临近的Agouti基因的不恰当表达,处于低甲基化时Iap活性增加使Agouti基因异位表达,导致小鼠肥胖和其他代谢疾病的产生)转录水平增加20倍,而Line1、Sineb1和Sineb2转录水平增加2~3倍[19]。体外培养来自缺锌组的卵母细胞,添加甲基供体后,IVM期间三甲基化组蛋白H3K4含量恢复,且成熟的卵母细胞体外受精能力较未添加甲基供体组成倍提高[19],表明缺锌引起的甲基化异常在补充甲基供体后可部分恢复。
由此表明,缺锌造成卵母细胞表观遗传缺陷,表现在组蛋白和DNA甲基化水平下降,同时伴有重复序列表达升高,进而影响卵母细胞质量。
4 小结细胞锌稳态主要通过金属硫蛋白和锌转运蛋白调控。锌通过影响MPF活性和Mos-MAPK信号通路影响卵母细胞减数分裂,并通过影响GSH水平进而影响卵母细胞的抗氧化能力,以及影响组蛋白和DNA甲基化水平改变卵母细胞表观遗传,从而影响雌性动物卵母细胞的质量。
| [1] |
徐盛玉, 吴德, 王定越. 卵母细胞质量评定方法[J]. 中国生物工程杂志, 2008, 28(7): 116-121. |
| [2] |
VALLEE B L, FALCHUK K H. The biochemical basis of zinc physiology[J]. Physiological Reviews, 1993, 73(1): 79-118. DOI:10.1152/physrev.1993.73.1.79 |
| [3] |
NIES D H. How cells control zinc homeostasis[J]. Science, 2007, 317(5845): 1695-1696. DOI:10.1126/science.1149048 |
| [4] |
KRE ZEL A, MARET W. Thionein/metallothionein control Zn (Ⅱ) availability and the activity of enzymes[J]. Journal of Biological Inorganic Chemistry, 2008, 13(3): 401-409. DOI:10.1007/s00775-007-0330-y |
| [5] |
MARET W, VALLEE B L. Thiolate ligands in metallothionein confer redox activity on zinc clusters[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(7): 3478-3482. DOI:10.1073/pnas.95.7.3478 |
| [6] |
COSTAS J. Comment on "current understanding of ZIP and ZnT zinc transporters in human health and diseases"[J]. Cellular and Molecular Life Sciences, 2015, 72(1): 197-198. DOI:10.1007/s00018-014-1746-5 |
| [7] |
臧猛. 猪锌转运蛋白基因的克隆与组织分布[D]. 硕士学位论文. 郑州: 河南农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10466-2009255273.htm
|
| [8] |
KAMBE T. Overview of and update on the physiological functions of mammalian zinc transporters[J]. Nihon Eiseigaku Zasshi, 2013, 68(2): 92-102. DOI:10.1265/jjh.68.92 |
| [9] |
JEON Y, YOON J D, CAI L, et al. Zinc supplementation during in vitro maturation increases the production efficiency of cloned pigs[J]. Journal of Reproduction and Development, 2016, 62(6): 635-638. DOI:10.1262/jrd.2016-072 |
| [10] |
CHOI Y H, GIBBONS J R, CANESIN H S, et al. Effect of medium variations (zinc supplementation during oocyte maturation, perifertilization pH, and embryo culture protein source) on equine embryo development after intracytoplasmic sperm injection[J]. Theriogenology, 2016, 86(7): 1782-1788. DOI:10.1016/j.theriogenology.2016.05.037 |
| [11] |
KIM A M, VOGT S, O'HALLORAN T V, et al. Zinc availability regulates exit from meiosis in maturing mammalian oocytes[J]. Nature Chemical Biology, 2010, 6(9): 674-681. DOI:10.1038/nchembio.419 |
| [12] |
BARRETT S L, ALBERTINI D F. Allocation of gamma-tubulin between oocyte cortex and meiotic spindle influences asymmetric cytokinesis in the mouse oocyte[J]. Biology of Reproduction, 2007, 76(6): 949-957. DOI:10.1095/biolreprod.106.057141 |
| [13] |
BRUNET S, MARO B. Cytoskeleton and cell cycle control during meiotic maturation of the mouse oocyte:integrating time and space[J]. Reproduction, 2005, 130(6): 801-811. DOI:10.1530/rep.1.00364 |
| [14] |
TIAN X, DIAZ F J. Zinc depletion causes multiple defects in ovarian function during the periovulatory period in mice[J]. Endocrinology, 2011, 153(2): 873-886. |
| [15] |
JEON Y, YOON J D, CAI L, et al. Zinc deficiency during in vitro maturation of porcine oocytes causes meiotic block and developmental failure[J]. Molecular Medicine Reports, 2015, 12(4): 5973-5982. DOI:10.3892/mmr.2015.4125 |
| [16] |
BERNHARDT M L, KONG B Y, KIM A M, et al. A zinc-dependent mechanism regulates meiotic progression in mammalian oocytes[J]. Biology of Reproduction, 2012, 86(4): 1-10. |
| [17] |
KONG B Y, BERNHARDT M L, KIM A M, et al. Zinc maintains prophase Ⅰ arrest in mouse oocytes through regulation of the MOS-MAPK pathway[J]. Biology of Reproduction, 2012, 87(1): 11. |
| [18] |
OCHSNER S A, DAY A J, RUGG M S, et al. Disrupted function of tumor necrosis factor-α-stimulated gene 6 blocks cumulus cell-oocyte complex expansion[J]. Endocrinology, 2003, 144(10): 4376-4384. DOI:10.1210/en.2003-0487 |
| [19] |
TIAN X, DIAZ F J. Acute dietary zinc deficiency before conception compromises oocyte epigenetic programming and disrupts embryonic development[J]. Developmental Biology, 2013, 376(1): 51-61. DOI:10.1016/j.ydbio.2013.01.015 |
| [20] |
JEON Y, YOON J D, CAI L, et al. Supplementation of zinc on oocyte in vitro maturation improves preimplatation embryonic development in pigs[J]. Theriogenology, 2014, 82(6): 866-874. DOI:10.1016/j.theriogenology.2014.06.021 |
| [21] |
KONG B Y, DUNCAN F E, QUE E L, et al. The inorganic anatomy of the mammalian preimplantation embryo and the requirement of zinc during the first mitotic divisions[J]. Developmental Dynamics, 2015, 244(8): 935-947. DOI:10.1002/dvdy.v244.8 |
| [22] |
JEON Y, YOON J D, CAI L, et al. Effect of zinc on in vitro development of porcine embryos[J]. Theriogenology, 2015, 84(4): 531-537. DOI:10.1016/j.theriogenology.2015.04.006 |
| [23] |
GERAVANDI S, AZADBAKHT M, POURMORADI M, et al. Zinc supplementation of vitrification medium improves in vitro maturation and fertilization of oocytes derived from vitrified-warmed mouse ovaries[J]. Cryobiology, 2017, 74: 31-35. DOI:10.1016/j.cryobiol.2016.12.007 |
| [24] |
TIAN X, ANTHONY K, NEUBERGER T, et al. Preconception zinc deficiency disrupts postimplantation fetal and placental development in mice[J]. Biology of Reproduction, 2014, 90(4): 83. |
| [25] |
ABRIEU A, DORÉE M, FISHER D. The interplay between cyclin-B-Cdc2 kinase (MPF) and MAP kinase during maturation of oocytes[J]. Journal of Cell Science, 2001, 114(2): 257-267. |
| [26] |
LUBERDA Z. The role of glutathione in mammalian gametes[J]. Developmental Biology, 2005, 5(1): 5-17. |
| [27] |
ORSI N M, LEESE H J. Protection against reactive oxygen species during mouse preimplantation embryo development:role of EDTA, oxygen tension, catalase, superoxide dismutase and pyruvate[J]. Molecular Reproduction and Development, 2001, 59(1): 44-53. DOI:10.1002/(ISSN)1098-2795 |
| [28] |
IWATA H, AKAMATSU S, MINAMI N, et al. Allopurinol, an inhibitor of xanthine oxidase, improves the development of IVM/IVF bovine embryos (> 4 cell) in vitro under certain culture conditions[J]. Theriogenology, 1999, 51(3): 613-622. DOI:10.1016/S0093-691X(99)00014-X |
| [29] |
DE MATOS D G, FURNUS C C. The importance of having high glutathione (GSH) level after bovine in vitro maturation on embryo development:effect of β-mercaptoethanol, cysteine and cystine[J]. Theriogenology, 2000, 53(3): 761-771. DOI:10.1016/S0093-691X(99)00278-2 |
| [30] |
KRE ZEL A, SZCZEPANIK W, SOKOŁOWSKA M, et al. Correlations between complexation modes and redox activities of Ni (Ⅱ)-GSH complexes[J]. Chemical Research in Toxicology, 2003, 16(7): 855-864. DOI:10.1021/tx034012k |
| [31] |
LIU J, ZHAO Y, GE W, et al. Oocyte exposure to ZnO nanoparticles inhibits early embryonic development through the γ-H2AX and NF-κB signaling pathways[J]. Oncotarget, 2017, 8(26): 42673-42692. |
| [32] |
KAGEYAMA S I, LIU H L, KANEKO N, et al. Alterations in epigenetic modifications during oocyte growth in mice[J]. Reproduction, 2007, 133(1): 85-94. DOI:10.1530/REP-06-0025 |
| [33] |
KIM J M, LIU H L, TAZAKI M, et al. Changes in histone acetylation during mouse oocyte meiosis[J]. The Journal of Cell Biology, 2003, 162(1): 37-46. DOI:10.1083/jcb.200303047 |
| [34] |
HEDGES D J, DEININGER P L. Inviting instability:transposable elements, double-strand breaks, and the maintenance of genome integrity[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2007, 616(1/2): 46-59. |



