随着水产养殖业的快速发展,培育大量健康、优质的苗种成为鱼类亲体培育的主要目标。亲体在性腺发育过程中,性腺特别是卵子需要积累大量的营养物质来满足胚胎和幼体早期的正常发育[1-3]。鱼类亲体脂类营养特别是多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)对鱼类性腺发育和卵子质量有重要影响[1-4]。高不饱和脂肪酸(highly unsaturated fatty acid, HUFA)是PUFA中碳链长度≥20,并且含有3个或3个以上双键的脂肪酸,如二十碳五烯酸(C20:5n-3, EPA)、二十二碳六烯酸(C22:6n-3, DHA)和花生四烯酸(C20:4n-6, AA),其中EPA和DHA被称为n-3 HUFA[5]。
n-3 HUFA是构成细胞膜磷脂的重要组成部分,同时供应能量并代谢产生重要的生物活性物质,在促进神经发育、调节水生动物代谢、提高机体免疫力方面有重要作用[6-7]。目前,关于HUFA对鱼类亲体营养研究主要集中在对亲体繁殖性能、机体营养组成和内分泌调控方面[8-10]。饲料中高水平n-3 HUFA促进了卵母细胞的生长和卵细胞的发育,调节雄激素的合成和精子的成熟[9-10]。饲料中n-3 HUFA稳定供应利于亲体的培育,n-3 HUFA主要来源于鱼油,由于世界鱼油产量下降,替代油源成为研究热点[11-12]。文章综述了鱼体内n-3 HUFA合成路径,n-3 HUFA对繁殖性能的影响,同时对n-3 HUFA来源和替代油源进行了分析,以期为水产养殖工作者提供参考。
1 n-3 HUFA在鱼类体内合成路径鱼类长链多不饱和脂肪酸(very long-chain polyunsaturated fatty acids, VLC-PUFA)合成路径见图 1。在鱼体内经过一系列去饱和酶和延长酶等的作用,亚麻酸(LAN,C18:3n-3)和亚油酸(LOA,C18:2n-6)分别生成n-3 HUFA和n-6 HUFA[7, 13-14]。EPA形成DHA有2个途径,一个途径为EPA经过延长酶作用,生成C22:5n-3,再经过Δ6脂肪酸去饱和酶去饱和作用和过氧化物酶体β-氧化形成DHA[15]。另一个途径首次在海水鱼黄斑篮子鱼(Siganus canaliculatus)中发现,C22:5n-3直接经过Δ4脂肪酸去饱和酶作用生成DHA[16]。随后,在塞内加尔鳎(Solea senegalensis)、墨西哥银汉鱼(Chirostoma estor)和泰国鳢(Channa striata)体内均发现具有Δ4脂肪酸去饱和酶途径[17-19]。不同鱼类VLC-PUFA合成能力不同,一般认为淡水鱼类和鲑鳟鱼类必需脂肪酸为C18:2n-6和C18:3n-3,海水鱼大多数不具有长链不饱和脂肪酸合成能力[5, 15, 20]。
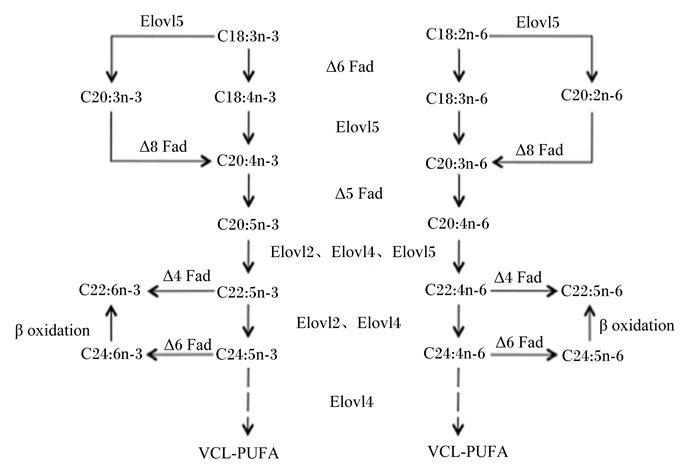
|
Δ4 Fad:Δ4脂肪酸去饱和酶Δ4 fatty acyl desaturase;Δ5 Fad:Δ5脂肪酸去饱和酶Δ5 fatty acyl desaturase;Δ6 Fad:Δ6脂肪酸去饱和酶Δ6 fatty acyl desaturase;Δ8 Fad:Δ8脂肪酸去饱和酶Δ8 fatty acyl desaturase;Elovl2:脂肪酸延长酶2 fatty acid elongase 2;Elovl4:脂肪酸延长酶4 fatty acid elongase 4;Elovl5:脂肪酸延长酶5 fatty acid elongase 5;β oxidation:β-氧化;VLC-PUFA:长链多不饱和脂肪酸very long-chain polyunsaturated fatty acids。 图 1 鱼类长链多不饱和脂肪酸合成路径 Figure 1 Pathways of VLC-PUFA biosynthesis in fish[12] |
繁殖性能主要通过亲体的性腺发育、卵子和精子质量、产卵量、受精率、仔鱼存活率、仔鱼机体组成等指标反映[6-7]。亲鱼种类不同,对饲料中HUFA需求量不同,饲料中适宜的HUFA水平利于亲鱼繁殖,水平不足和过量会产生不利的影响。
2.1 淡水鱼类Jaya-Ram等[21]通过配制不同油源的饲料(不同水平HUFA)对斑马鱼(Danio rerio)亲鱼进行饲喂试验,结果表明,斑马鱼的产卵量和孵化率在混合油组(鱼油:亚麻油=1:1)中最高,说明饲料中n-3和n-6系列脂肪酸对斑马鱼繁殖有重要影响。郭盼等[22]通过配制不同链长的脂肪酸对斑马鱼亲鱼进行饲喂,结果表明,n-3 HUFA组斑马鱼性腺中DHA和EPA水平显著高于对照组和中链脂肪酸组,雌鱼成熟系数、绝对繁殖力和相对繁殖力显著高于对照组,说明饲料中DHA和EPA利于提高斑马鱼繁殖性能。DHA和EPA可通过提高亲体卵子的质量提高卵子的受精率,Luo等[23]对西伯利亚鲟(Acipenser baeri)研究发现,饲料中高水平的DHA提高了卵子中EPA和DHA的水平,提高了卵子的受精率。不同淡水鱼类亲体对HUFA需求量不同,齐茜等[24]研究了不同脂肪源搭配的饲料对施氏鲟饲喂5个月后雌鱼繁殖性能及血清性类固醇激素的影响,结果表明n-3 HUFA添加量为2.5%时,亲鱼成熟度和仔鱼成活率较高。在对虹鳟亲体(Oncorhynchus mykiss)进行研究中发现,饲料中添加2% n-3 PUFA能够改善精子的质量利于繁殖[25]。盐度影响亲体对n-3 HUFA的需求,El-Sayed等[26]在不同盐度(0、7和14)条件下对罗非鱼(Oreochromis niloticus)亲鱼进行不同脂肪源(豆油、鱼油和豆油与鱼油的混合油)饲料饲喂,结果表明,在盐度为0时,不需要提供n-3 HUFA,但是在盐度为7和14时,只有提供n-3 HUFA才能满足罗非鱼繁殖需要,高盐度可能对n-3 HUFA形成过程中的酶产生了抑制作用。
2.2 海水鱼类Zakeri等[4]通过对黄鳍金枪鱼(Acanthopagrus latus)亲体进行研究,配制不同n-3 HUFA水平饲料(6.67%、4.26%和2.92%),对亲鱼进行投喂132 d,结果表明,相对繁殖力、油球上浮率、孵化率和孵化后3 d幼体存活率在高水平(6.67%)饲料下显著高于其他水平饲料组,说明饲料中高水平n-3 HUFA利于提高黄鳍金枪鱼的繁殖性能。Callan等[27]通过对3种n-3 HUFA水平(1.8%、2.9%和3.6%)饲料对神仙鱼(Centropyge loriculus)亲鱼饲喂5个月,发现高水平n-3 HUFA(3.6%)饲料提高了雌鱼繁殖性能,说明饲料中较高水平的n-3 HUFA利于繁殖。不同海水鱼类对n-3 HUFA需求量不同,适宜范围内,高水平n-3 HUFA利于提高繁殖性能,但是水平太高会降低亲鱼的繁殖性能。Furuita等[28]通过对褐牙鲆(Paralichthys olivaceus)研究发现,通过在亲鱼饲料中添加2.1%、4.8%和6.2% 3种不同水平的n-3 HUFA,在繁殖期内饲喂2个月,研究发现,高水平HUFA饲料组鱼类产卵量最高,然而卵子质量参数,例如孵化率、孵出正常幼体的孵化率在最低水平HUFA组显著高于其组,说明饲料中高水平n-3 HUFA对牙鲆亲鱼卵子质量产生了负面影响。Fernández-Palacios等[29]也得出了同样的结论,通过研究不同n-3 HUFA水平饲料对金头鲷(Sparus aurata)亲鱼卵子质量的影响,饲料1.6% n-3 HUFA组获得了较好的繁殖力、孵化率和幼体存活率。随着饲料中n-3 HUFA水平升高,卵子中n-3 HUFA水平升高,但是水平太高导致繁殖力下降,刚孵出幼体的卵黄囊肥大。Li等[30]通过配制1.12%、2.40%、3.70%和5.85% 5种不同n-3 HUFA水平饲料对花尾胡椒鲷亲体进行研究,结果表明,n-3 HUFA水平在2.4%和3.7%时,卵子上浮率、每千克雌鱼体重产生的卵子数量以及孵化后3 d幼体体长和存活率较高,低水平(1.12%)和高水平(5.85%)HUFA对卵子和幼体质量产生负面影响。
2.3 作用机制在鱼类性腺发育过程中,各种内源因子(性激素和其受体等)和外源因子(营养因子和环境因子等)通过作用于下丘脑-垂体-性腺轴,促使性腺产生性类固醇激素,并与相应的受体结合,进而促进性腺发育、排卵和排精[31-33]。卵泡分泌雌二醇(E2),E2经过血液运输到肝脏,与相应受体结合诱导卵黄蛋白原(Vg)的形成。n-3 HUFA是Vg重要组成成分,Vg的合成一方面需要n-3 HUFA,另一方面需要E2刺激,饲料中n-3 HUFA可能改变了鱼类机体中性类固醇激素水平,从而对鱼类的性腺发育进行调节[34]。研究表明,饲料中适宜水平的n-3 HUFA可以提高海水鱼类机体内性类固醇激素水平,从而促进精子和卵子的发生和成熟[35]。
在淡水鱼研究上,郭盼等[22]认为n-3 HUFA可能促进了性腺中对油酸的β-氧化作用,降低了性腺中油酸的相对水平,从而降低了性腺发育中油酸对其的抑制作用,利于繁殖。在海水鱼类研究上,Peng等[36]配制4种不同水平n-3 VLC-PUFA(5.18%、4.01%、3.02%和2.22%)对银鲳(Pampus argenteus)亲鱼进行饲喂,结果表明,在卵巢发育过程中,n-3 VLC-PUFA通过转变血液中促卵泡激素(FSH)和促黄体素(LH)水平和芳香化酶19A1α(Cyp19A1α)基因的表达影响卵巢性类固醇激素水平,饲料中较高水平的n-3 VLC-PUFA有助于增加E2分泌和Vg合成,从而刺激卵巢的发育。Luo等[23]通过对西伯利亚鲟研究也得出了同样的试验结果,饲料中高水平的DHA提高了雌鱼血液中E2水平。同时,Da Silva等[9]对欧洲鳗鲡(Anguilla anguilla)亲鱼进行研究表明,饲料中高水平DHA和EPA饲料促进了雌鱼卵母细胞的生长,促进了卵细胞的发育。饲料中n-3 HUFA通过调节E2和睾酮(T)分泌量影响繁殖性能。李远友等[35]通过在饲料中添加不同水平n-3 HUFA对花尾胡椒鲷进行投喂,发现HUFA水平过低和过高均降低血液中E2和睾酮水平,同时降低了亲鱼的产卵量、卵子的受精率和仔鱼的成活率。关于饲料中n-3 HUFA对雄鱼亲体繁殖的影响进行了相关研究。Baeza等[10]通过对欧洲鳗鲡雄鱼进行研究,表明饲料中EPA和DHA在雄鱼亲鱼性腺发育过程中调节雄激素的合成,特别是精子最后的成熟阶段。DHA和EPA从调节雄激素水平和保证精细胞膜适合的组成2个方面影响雄性个体配子的发育[37]。目前,关于n-3 HUFA如何影响鱼类性类固醇激素的分泌及促进亲体的繁殖性能提高机制有待进一步研究。
3 n-3 HUFA来源及替代油源鱼油是水产饲料n-3 HUFA主要来源,根据海洋原料组织(IFFO)2012年度报告,在世界范围内,从对鱼油使用上进行分析,水产养殖业对鱼油的使用量占75%;水产养殖中,在鱼类使用量上,鲑科鱼类占62%,海洋鱼类占19%[38]。由于鱼油产量的下降,寻找替代油源成为研究目标[12]。
淡水鱼类和鲑科鱼类具有从C18 PUFA合成EPA和DHA的能力,因此含有C18 PUFA的植物油可以作为鱼油的替代油源,植物油来源广泛,价格比较低[7]。植物油主要有菜籽油、亚麻油、葵花油、棕榈油、大豆油、橄榄油等。C18 PUFA能够部分替代鱼油促进HUFA合成,主要是促进了相关酶的转录[20]。此方面研究主要通过在饲料中添加不同比例单一植物油或者混合植物油替代鱼油,研究替代鱼油后对机体脂肪酸组成以及去饱和酶和延长酶等的影响,从分子机制上进行探讨,从而提高内源性HUFA合成能力。Afonso等[39]对塞内加尔鳎进行研究表明,混合植物油(50%豆油、25%菜籽油和25%亚麻籽油)50%替代鱼油,能够保证鱼肉的质量,满足人类健康需要。此方面研究在幼鱼较多,但是在亲体上研究较少。Izquierdo等[40]通过配制4种不同比例亚麻籽油替代鱼油饲料对金头鲷亲体进行饲喂,结果发现,亚麻籽油80%~100%替代鱼油,没有降低雌鱼的繁殖力和产卵量,同时对孵化后45 d和4个月幼体生长没有影响;然而,当4个月幼体饲喂低水平的鱼油时,亚麻油60%替代鱼油组饲喂的亲鱼生产的幼体比100%鱼油组饲喂的亲鱼生产的幼体具有较高的生长速度和饲料利用率,结果表明,亲体饲料中高比例亚麻籽油对后代有长期影响,早期对海洋鱼类亲体的营养策略有助于改善子代长期的生长性能,但是分子机制不是很清楚。
海洋微藻例如裂壶藻、微绿球藻(Nannochloris oculata)、三角褐指藻(Phaeodactylum tricornutum)等富含EPA或DHA,其脂肪酸组成与鱼油相似,可以作为鱼类饲料中HUFA的来源[41-42]。在对水产动物幼体研究中发现,饲料中添加微藻后,可以提高生长速度、提高机体的DHA水平、增强消化能力和鱼类的免疫力[41-42]。然而,由于微藻中含有大量的蛋白质、抗生素和毒素等,同时有些微藻细胞壁很难破碎,影响鱼体的消化吸收,此外,微藻在培养、采收和加工等方面存在成本高的现状,影响了在鱼类饲料中的应用。今后研究中,需要通过基因工程等技术开发优良的藻种,还需要在培养采收等方面进行研究,降低成本[43]。
4 小结n-3 HUFA对鱼类性腺发育、精子和卵子质量、产卵量、卵子受精率、孵化率和孵化幼体存活率等有重要影响,但是n-3 HUFA如何调节亲鱼的繁殖性能,在分子机制方面的研究较少。由于鱼油产量的下降,寻找n-3 HUFA的优良替代油源成为一项重要挑战。海洋微藻尽管有培养、采收等技术问题需要解决,仍然是是鱼油替代的一个良好途径,植物油来源较广,通过基因工程技术生产含油量高的植物也是解决鱼油替代油源的另一个途径。在鱼类亲体研究中,近些年,专家学者通过饲料和激素交互作用,对亲体进行研究,提高繁殖性能。另外,由于亲体培育时间长,为了节省鱼油使用量,同时保证和促进性腺发育和提高幼体质量,可以对亲体进行n-3 HUFA短期强化培育,对n-3 HUFA的最佳需求量、对亲体饲喂时间及强化方式等进行研究,提高亲体的繁殖性能。
| [1] |
贾玉东, 雷霁霖. 硬骨鱼类卵子质量研究进展[J]. 中国水产科学, 2012, 19(3): 545-555. |
| [2] |
MARCH B E. Essential fatty acids in fish physiology[J]. Canadian Journal of Physiology and Pharmacology, 1993, 71(9): 684-689. DOI:10.1139/y93-102 |
| [3] |
IZQUIERDO M S, FERNANDEZ-PALACIOS H, TACON A G J. Effect of broodstock nutrition on reproductive performance of fish[J]. Aquaculture, 2001, 197(1/2/3/4): 25-42. |
| [4] |
ZAKERI M, KOCHANIAN P, MARAMMAZI J G, et al. Effects of dietary n-3 HUFA concentrations on spawning performance and fatty acids composition of broodstock, eggs and larvae in yellowfin sea bream, Acanthopagrus latus[J]. Aquaculture, 2011, 310(3/4): 388-394. |
| [5] |
TOCHER D R. Fatty acid requirements in ontogeny of marine and freshwater fish[J]. Aquaculture Research, 2010, 41(5): 717-732. DOI:10.1111/are.2010.41.issue-5 |
| [6] |
许友卿, 刘晓丽, 安晓玲, 等. 高度不饱和脂肪酸对水生动物代谢的影响及其机理[J]. 饲料工业, 2017, 38(4): 1-7. |
| [7] |
吉红, 田晶晶. 高不饱和脂肪酸(HUFAs)在淡水鱼类中的营养作用研究进展[J]. 水产学报, 2014, 38(9): 1650-1665. |
| [8] |
谭青松, 吴凡, 杜浩, 等. 饲料营养对亲鱼生殖性能的影响研究进展[J]. 水生态学杂志, 2016, 37(4): 1-9. |
| [9] |
DA SILVA F F G, STØTTRUP J G, KJØRSVIK E, et al. Interactive effects of dietary composition and hormonal treatment on reproductive development of cultured female European eel, Anguilla Anguilla[J]. Animal Reproduction Science, 2016, 171: 17-26. DOI:10.1016/j.anireprosci.2016.05.007 |
| [10] |
BAEZA R, PEÑARANDA D S, VÍLCHEZ M C, et al. Exploring correlations between sex steroids and fatty acids and their potential roles in the induced maturation of the male European eel[J]. Aquaculture, 2015, 435: 328-335. DOI:10.1016/j.aquaculture.2014.10.016 |
| [11] |
TURCHINI G M, FRANCIS D S, KEAST R S J, et al. Transforming salmonid aquaculture from a consumer to a producer of long chain omega-3 fatty acids[J]. Food Chemistry, 2011, 124(2): 609-614. DOI:10.1016/j.foodchem.2010.06.083 |
| [12] |
TOCHER D R. Omega-3 long-chain polyunsaturated fatty acids and aquaculture in perspective[J]. Aquaculture, 2015, 449: 94-107. DOI:10.1016/j.aquaculture.2015.01.010 |
| [13] |
VAGNER M, SANTIGOSA E. Characterization and modulation of gene expression and enzymatic activity of delta-6 desaturase in teleosts:a review[J]. Aquaculture, 2011, 315(1/2): 131-143. |
| [14] |
EMERY J A, HERMON K, HAMID N K, et al. △-6 desaturase substrate competition:dietary linoleic acid (18:2n-6) has only trivial effects on α-linolenic acid (18:3n-3) bioconversion in the teleost rainbow trout[J]. PLoS One, 2013, 8(2): e57463. DOI:10.1371/journal.pone.0057463 |
| [15] |
SPRECHER H. Metabolism of highly unsaturated n-3 and n-6 fatty acids[J]. Biochimica et Biophysica:Molecular and Cell Biology of Lipids, 2000, 1486(2/3): 219-231. |
| [16] |
LI Y Y, MONROIG O, ZHANG L, et al. Vertebrate fatty acyl desaturase with △4 activity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(39): 16840-16845. DOI:10.1073/pnas.1008429107 |
| [17] |
MORAIS S, CASTANHEIRA F, MARTINEZ-RUBIO L, et al. Long chain polyunsaturated fatty acid synthesis in a marine vertebrate:ontogenetic and nutritional regulation of a fatty acyl desaturase with △4 activity[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2012, 1821(4): 660-671. DOI:10.1016/j.bbalip.2011.12.011 |
| [18] |
FONSECA-MADRIGAL J, NAVARRO J C, HONTORIA F, et al. Diversification of substrate specificities in teleostei Fads2:characterization of △4 and △6△5 desaturases of Chirostoma estor[J]. Journal of Lipid Research, 2014, 55(7): 1408-1419. DOI:10.1194/jlr.M049791 |
| [19] |
KUAH M K, JAYA-RAM A, SHU-CHIEN A C. The capacity for long-chain polyunsaturated fatty acid synthesis in a carnivorous vertebrate:functional characterisation and nutritional regulation of a Fads2 fatty acyl desaturase with △4 activity and an Elovl5 elongase in striped snakehead (Channa striata)[J]. Biochimica et Biophysica:Molecular and Cell Biology of Lipids, 2015, 1851(3): 248-260. |
| [20] |
谢帝芝, 陈芳, 张庆昊, 等. 鱼类LC-PUFA合成代谢调控机制研究进展[J]. 汕头大学学报(自然科学版), 2015, 30(2): 3-19. |
| [21] |
JAYA-RAM A, KUAH M K, LIM P S, et al. Influence of dietary HUFA levels on reproductive performance, tissue fatty acid profile and desaturase and elongase mRNAs expression in female zebrafish Danio rerio[J]. Aquaculture, 2008, 277(3/4): 275-281. |
| [22] |
郭盼, 周继术, 吉红, 等. 不同链长脂肪酸对斑马鱼的性腺脂肪酸组成、繁殖力与仔鱼成活率的影响[J]. 水生生物学报, 2017, 41(4): 766-773. DOI:10.7541/2017.95 |
| [23] |
LUO L, AI L C, LI T L, et al. The impact of dietary DHA/EPA ratio on spawning performance, egg and offspring uality in Siberian sturgeon (Acipenser baeri)[J]. Aquaculture, 2015, 437: 140-145. DOI:10.1016/j.aquaculture.2014.11.036 |
| [24] |
齐茜, 刘晓勇, 孙大江, 等. 饲料脂肪源搭配对施氏鲟雌鱼繁殖性能和血清性类固醇激素的影响[J]. 中国水产科学, 2014, 21(1): 118-124. |
| [25] |
KÖPRVCV K, YONAR M E, ÖZCAN S. Effect of dietary n-3 polyunsaturated fatty acids on antioxidant defense and sperm quality in rainbow trout (Oncorhynchus mykiss) under regular stripping conditions[J]. Animal Reproduction Science, 2015, 163: 135-143. DOI:10.1016/j.anireprosci.2015.10.008 |
| [26] |
EL-SAYED A F M, MANSOUR C R, EZZAT A A. Effects of dietary lipid source on spawning performance of Nile tilapia (Oreochromis niloticus) broodstock reared at different water salinities[J]. Aquaculture, 2005, 248(1/2/3/4): 187-196. |
| [27] |
CALLAN C K, LAIDLEY C W, KLING L J, et al. The effects of dietary HUFA level on flame angelfish (Centropyge loriculus) spawning, egg quality and early larval characteristics[J]. Aquaculture Research, 2014, 45(7): 1176-1186. DOI:10.1111/are.2014.45.issue-7 |
| [28] |
FURUITA H, TANAKA H, YAMAMOTO T et al. Effects of high levels of n-3 HUFA in broodstock diet on egg quality and egg fatty acid composition of Japanese flounder, Paralichthys olivaceus[J]. 2002, Aquaculture, 210(1/2/3/4): 323-333. http://www.sciencedirect.com/science/article/pii/S0044848601008559
|
| [29] |
FERNÁNDEZ-PALACIOS H, IZQUIERDO M S, ROBAINA L, et al. Effect of n-3 HUFA level in broodstock diets on egg quality of gilthead sea bream (Sparus aurata L.)[J]. Aquaculture, 1995, 132(3/4): 325-337. |
| [30] |
LI Y Y, CHEN W Z, SUN Z W, et al. Effects of n-3 HUFA content in broodstock diet on spawning performance and fatty acid composition of eggs and larvae in Plectorhynchus cinctus[J]. Aquaculture, 2005, 245(1/2/3/4): 263-272. |
| [31] |
温海深, 林浩然. 环境因子对硬骨鱼类性腺发育成熟及其排卵和产卵的调控[J]. 应用生态学报, 2001, 12(1): 151-155. |
| [32] |
LUBZENS E, YOUNG G, BOBE J, et al. Oogenesisin teleosts:how fish eggs are formed[J]. General and Comparative Endocrinology, 2010, 165(3): 367-389. DOI:10.1016/j.ygcen.2009.05.022 |
| [33] |
BRANSDEN M P, BATTAGLENE S C, GOLDSMID R M, et al. Broodstock condition, egg morphology and lipid content and composition during the spawning season of captive striped trumpeter, Latris lineate[J]. Aquaculture, 2007, 268(1/2/3/4): 2-12. |
| [34] |
彭士明, 李云莉, 施兆鸿, 等. 海水鱼类亲体必需脂肪酸营养的研究进展[J]. 海洋渔业, 2016, 38(1): 98-106. |
| [35] |
李远友, 陈伟洲, 孙泽伟, 等. 饲料中n-3 HUFA含量对花尾胡椒鲷亲鱼的生殖性能及血浆性类固醇激素水平季节变化的影响[J]. 动物学研究, 2004, 25(3): 249-255. |
| [36] |
PENG S M, GAO Q X, SHI Z H, et al. Effect of dietary n-3 LC-PUFAs on plasma vitellogenin, sex steroids, and ovarian steroidogenesis during vitellogenesis in female silver pomfret (Pampus argenteus) broodstock[J]. Aquaculture, 2015, 444: 93-98. DOI:10.1016/j.aquaculture.2015.03.031 |
| [37] |
DUPONT J, REVERCHON M, BERTOLO M J, et al. Nutritional signals and reproduction[J]. Molecular and Cellular Endocrinology, 2014, 382(1): 527-537. DOI:10.1016/j.mce.2013.09.028 |
| [38] |
IFFO. The marine ingredients organisation: Global standard for responsible supply (IFFO-RS)[J/OL]. 2012. http://www.iffo.net/.
|
| [39] |
AFONSO C, CARDODO C, FREIRE M, et al. The impact of alternative dietary lipids on the in vitro bioaccessibility of sole fillets for human consumption[J]. Aquaculture, 2017, 474(1): 66-74. |
| [40] |
IZQUIERDO M S, TURKMEN S, MONTERO D, et al. Nutritional programming through broodstock diets to improve utilization of very low fishmeal and fish oil diets in gilthead sea bream[J]. Aquaculture, 2015, 449: 18-26. DOI:10.1016/j.aquaculture.2015.03.032 |
| [41] |
潘瑜, 陈效儒, 马霞, 等. 裂殖壶菌替代鱼油对海鲈生长和抗氧化能力的影响[J]. 饲料工业, 2016, 37(4): 24-27. |
| [42] |
LI M H, ROBINSON E H, TUCKER C S, et al. Effects of dried algae Schizochytrium sp., a rich source of docosahexaenoic acid, on growth, fatty acid composition, and sensory quality of channel catfish Ictalurus punctatus[J]. Aquaculture, 2009, 292(3/4): 232-236. |
| [43] |
周俊宇, 杨志刚. 富含HUFA海洋微藻在水产饲料中的应用[J]. 饲料研究, 2017(7): 40-44. |



