肠道不仅是消化器官,也是体内最大的免疫器官,在维持正常营养代谢、免疫防御等方面发挥重要的作用。动物肠道中共生着一个庞大而复杂的微生物群,主要是细菌,也包含真菌、酵母菌、病毒和古细菌,这些微生物群与宿主协同进化、互相依存,构成一个微生态系统。这一微生态系统所包含的基因数目约是动物机体自身的100倍,具有机体自身不具备的免疫代谢功能。以人为例,正常成人肠道内的微生物数量高达1014个,其中包括约4 000株细菌构成了肠道重要的微生物菌群[1-2]。随着分子生物学技术的发展,人们逐渐意识到肠道菌群作为复杂的微生物群体在宿主健康和疾病方面起着重要调节作用。家禽是人类生物学研究中重要的动物模型,同时也是全球蛋白质产业的重要组成部分,具有重要的经济价值。在家禽养殖中,保持家禽肠道健康,是提高养殖效益的重要前提和保障。一方面,肠道调控营养物质的消化吸收为家禽生长提供必需的营养;另一方面,肠道是重要的潜在环境病原致病的风险承担者,可有效防御外源性致病因子的侵袭[3]。随着抗生素的限用或禁用,家禽肠道健康问题越来越突出,尤其是在蛋鸡养殖行业,近年来,家禽肠道健康问题越来越受到畜牧研究人员和养殖户的重视。本文重点对肠道微生物与肠道免疫系统的潜在调控机制以及肠道微生物在家禽免疫调控方面的影响进行综述。
1 家禽肠道微生物组成家禽的胃肠组织中定植了超过100万个微生物基因,相当于鸡全基因组的40~50倍。其中90%~95%的盲肠微生物并不能够在实验室培养,只能通过分子生物学方法进行分离,但是这些微生物在饲粮营养物质消化吸收以及家禽免疫代谢方面发挥重要作用。肠道菌群的多样性与家禽饲粮、性别、日龄以及个体情况均相关,且不同肠段微生物的分布也不相同。但是大量研究显示,乳杆菌科、链球菌科、梭菌科以及肠杆菌科是家禽不同部位胃肠微生物的主要组成部分,这些肠道菌群在肠道中有规律的分布定植,维持肠道菌群与家禽免疫代谢的“生态平衡”[4]。
嗉囊是家禽储存食物的第一个器官,其中定植了大量微生物,以乳酸杆菌为主,产生大量的乳酸和短链脂肪酸(short chain fatty acids,SCFAs)。嗉囊微生物的发酵是对食物的第1次消化,而有机酸的形成为抵御外来病原菌提供了很好的防护。前胃中的pH相对较低,它是营养消化尤其是蛋白质水解的重要场所,其中包含较高浓度的乳酸杆菌、肠球菌以及对起乳糖负调控作用的肠杆菌,至于这些肠道菌是原先就定植于肠道中的还是来自于食物还未得到明确定论。另外,家禽小肠中的微生物密度波动较大,主要是由乳酸菌、肠球菌、大肠杆菌和梭状芽孢杆菌组成,小肠中低浓度的微生物菌群更有利于营养物质的消化吸收,因为这样宿主与微生物之间的竞争就会相对减小。十二指肠中相对较低的pH、大量胆汁和胰腺分泌物的流入是降低肠道微生物密度的重要调控因子。研究显示小肠末端内容物中,总的细菌量为7~9 lg(CFU/g)内容物,其中以乳酸杆菌、肠杆菌和肠球菌为主[5]。盲肠是肠道微生物定植的主要部位,也是微生物厌氧发酵的主产区,厌氧菌在盲肠中的密度要明显高于上消化道,因而盲肠的饲料发酵能力要显著高于小肠[6]。盲肠中SCFAs的含量最高,主要是乙酸、丙酸和丁酸,而乳酸的含量相对较低[5]。这些肠道微生物规律性分布构成了家禽的胃肠消化免疫系统,维持家禽肠道健康。
2 家禽肠道健康的影响因素及调控措施尽管在过去十多年的时间里,人类医学和兽医科研工作者展开了大量关于肠道健康的研究,但是目前人们对肠道健康的认识依然非常有限。在畜禽研究中,肠道健康也是个重大的问题,生产上以坏死性肠炎和肠道菌群失衡为特征的细菌性肠炎的发生最为显著。坏死性肠炎主要是由产气荚膜杆菌、艾美球虫以及肠炎沙门氏菌等病原菌感染引起肠道炎症、坏死,导致家禽死亡。肠道菌群失衡是由肠道共生菌与致病菌失衡导致,通常无明显的临床症状,其形成原因目前尚不清晰。随着抗生素作为生长促进剂在全球范围内的限制或禁用,畜禽肠道问题日益突出,尤其在当前我国家禽养殖环境欠佳以及饲料营养、原料处理科学性欠缺的条件下,肠道疾病的发生率居高不下,家禽肠道健康问题给养殖者带来巨大经济损失。
2.1 影响因素引起家禽肠道问题的因素较多也较为复杂,主要包括:环境应激(高温高湿、啮齿类动物等)、饲料霉变(霉菌)、饮水细菌滋生、饲料营养(饲料黏性)、细菌性感染(弯曲杆菌、气荚膜杆菌、沙门氏菌)、球虫感染以及病毒感染(禽流感、支气管炎、呼吸道疾病等)。研究表明,热应激状况下家禽采食量下降,肠黏膜通透性增加,引起家禽肠道炎症和生长性能下降[7]。霉变的饲料会侵害家禽的肝脏和免疫系统,影响肠黏膜完整性和通透性,损害肠道屏障功能,降低家禽生长性能[8]。鸡感染产气荚膜杆菌、艾美球虫以及肠炎沙门菌等病原菌后,会导致鸡盲肠的微生物菌群结构发生变化,进一步调节家禽肠道白细胞介素-8(interleukin 8,IL-8)和白细胞介素-17(interleukin 17,IL-17)的表达[9-10]。此外,饲料营养成分也会影响肠道健康,研究显示饲料消化物黏性增加往往伴随着肠道产气夹膜梭状芽胞杆菌、弯曲杆菌和螺旋菌数量的增加[11-13]。用具有黏性的小麦代替玉米会增加家禽得病的风险。黏性饲料也会增加家禽感染寄生虫病的风险。最新研究显示,对育雏阶段的雏鸡给予抗生素会显著改变雏鸡肠道微生物组成,粪便微生物主要是变形菌门细菌,尤其是大肠杆菌的数量居多,而未利用抗生素处理的雏鸡粪便主要是厚壁菌门细菌,以乳酸杆菌和梭状芽胞杆菌居多,另外,雏鸡肠道菌群失衡会对后期育成和产蛋阶段鸡的适应性免疫能力造成影响[14]。由此可见,家禽肠道健康是一个相对较为复杂的问题,而解决家禽肠道健康问题需要多方面的综合技术措施。
2.2 调控技术肠道菌群是维持家禽肠道健康的重要健康调节因子,参与维持肠黏膜形态结构的完整和功能发挥。肠黏膜免疫系统对肠道菌群进行特异性识别将肠道共生菌群与致病菌区分开来,抵御致病菌的入侵,保护肠道健康。因此,通过调控肠道菌群,最大限度发挥有益菌的优势将是维持家禽肠道健康的一项重要措施。
目前有关家禽肠道健康调控研究,主要集中于营养调控技术的研究,概述起来主要是利用益生元[15]、益生菌[16-17](乳酸杆菌,双歧杆菌、地衣芽孢杆菌、酵母菌等)、酶制剂(木聚糖酶、葡聚糖酶、甘露聚糖酶)[18]、肠道微生物代谢产物(丁酸盐等)[19]、维生素和矿物质等,这些营养添加剂可以通过调节肠道微生物菌群,增加有益菌(乳酸杆菌和双歧杆菌)的定植,促进肠绒毛生长,降低病原菌在肠上皮表面细胞的定植,提高机体免疫能力,改善家禽的肠道健康。此外,饲粮中适量添加脱霉剂、沸石、铝硅酸盐等能提高家禽生长性能和抗病力,改变肠道菌群,促进肠道健康。在实际生产过程中,为了更有效达到促进家禽肠道健康的目的,除了进行营养调控措施外,同时需要关注家禽饲养环境和管理方式,加强生物安全防疫体系的建立,以降低家禽感染疾病的风险。
3 肠道微生物对肠道免疫的影响为了最大限度地发挥微生物在家禽肠道健康中的重要调节作用,深入了解肠道微生物与肠道免疫系统之间的潜在调节机制显得尤为重要。与哺乳动物类似,家禽的肠道免疫系统相对也比较复杂,由肠黏膜层、上皮细胞、共生微生物及免疫细胞共同组成肠道的免疫防御系统[20]。其中,肠道微生物是家禽先天免疫和适应性免疫的重要启动和调节因子。当机体遭遇致病因子时,会启动机体自身的先天免疫系统,先天性免疫系统的激活主要依赖于一类模式识别受体的激活,包括Toll样受体(Toll-like receptors,TLRs)和NOD样受体(NOD-like receptors,NLRs)。TLRs能特异性的识别病原分子,启动炎症反应,最终清除致病因子[21]。其作用的机制在于肠道共生微生物与病原微生物有着相似模式识别分子结构,这也就引出了一个问题,即在长期暴露于微生物刺激的情况下,宿主免疫系统是如何区分肠黏膜表面的共生菌和病原菌,具体的作用机制目前尚不清晰,关于肠道微生物对家禽免疫调节的分子机制,目前研究也相对较少,以下主要参考肠道微生物对人类免疫调节的研究进行综述。
3.1 肠道微生物源核酸宿主细胞启动先天免疫主要依赖于识别病原相关的分子模式,也就是病原微生物的保守区域的核酸结构。这些核酸结构域可被宿主的TLRs受体(TLR3、TLR7、TLR8和TLR9)和细胞内DNA传感器识别[22]。其中,TLR3由双链RNA激活,TLR7和TLR8由单链RNA激活,TLR9由单链DNA内的CpG基质激活。当宿主源TLR3和TLR7~9在细胞内检测到致病原时,它们可启动先天免疫系统自动清除病原。当TLRs与宿主自身的核酸相遇时,TLRs可绕开自身核酸或修饰自身核酸起到免疫保护的作用[23]。
此外,肠道菌群DNA中未甲基化的CpG二核苷酸的含量较为丰富,这些CpG二核苷酸可被TLR9识别,调控胃肠道T细胞的功能,表明肠道菌群DNA可作为免疫调节剂调节宿主肠道免疫功能[24]。目前关于肠道微生物调控宿主细胞免疫系统的机制有待进一步研究。普遍认为,微生物中包含的未甲基化的CpG可绕过抗原递呈细胞,刺激T细胞的分化形成。有研究证实,细菌DNA以及合成的寡核苷酸(富含未甲基化的CpG)可通过调节树突状细胞和巨噬细胞的细胞功能,有效调节动物的先天性和适应性免疫[25]。
另外,研究显示,肠道共生菌DNA中包含一段起抑制作用的DNA寡核苷酸片段,参与促进肠道免疫系统的稳态平衡过程。这些DNA寡核苷酸片段调节的宿主免疫应答具有种属特异性,且与肠道菌群中起免疫抑制作用的DNA序列出现的频率有关[26]。如,乳酸杆菌DNA中富含一段抑制性寡核苷酸片段,可在炎症状况下有效维持调节性T细胞的转换,抑制致病因子所诱发的炎症反应,保持肠道微生物中免疫抑制,促进微生物DNA结构的平衡,进而有效调节肠道免疫系统的稳态平衡[27]。
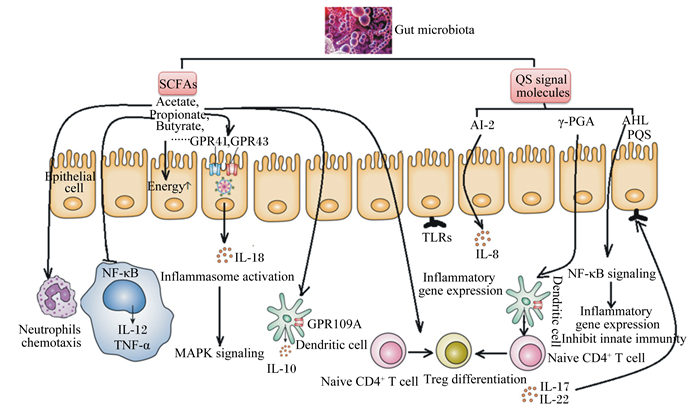
3.2 肠道微生物代谢产物在哺乳动物研究中发现,某些特定的肠道微生物在某些肠道免疫细胞的增殖分化方面起着至关重要的作用。如脆弱拟杆菌可促进IL-17的产生,进而促进辅助性T细胞(Th细胞)的生成[28]。乳酸杆菌可有效刺激低分子质量肽的产生,进而激活肠道免疫系统,增强肠道对疾病的防御能力[29]。肠道菌群还可产生大量的SCFAs,这些SCFAs通过直接或间接降低肠道pH,产生能够杀死细胞的细菌素,改变病原菌定植受体来杀死部分肠道菌,抵御致病菌的侵袭[30]。近年来,诸多研究证实微生物代谢产物(主要是小分子代谢物),如SCFAs(醋酸盐、丙酸盐和丁酸盐)、群体效应信号分子等,在微生物与宿主互作间发挥重要的化学信号调节作用(图 1)。
|
Gut microbiota:肠道微生物;SCFA:短链脂肪酸short chain fatty acid;Acetate:醋酸盐;Propionate:丙酸盐;Butyrate:丁酸盐;GPR41:G蛋白耦合受体41 G protein-coupled receptor 41;GPR43:G蛋白耦合受体43 G protein-coupled receptor 43;Epithelial cell:上皮细胞;Energy:能量;Neutrophils chemotaxis:中性粒细胞趋化性;NF-κB:核因子-κB nuclear factor-κB;IL-12:白细胞介素-12 interleukin-12;TNF-α:肿瘤坏死因子α tumor necrosis factor α;IL-18:白细胞介素-18 interleukin-18;Inflammasome activation:炎性体激活;MAPK signaling:活丝裂原活化蛋白激酶信号通路mitogen activated protein kinase signaling;IL-10:白细胞介素-10 interleukin-10;GPR109A:G蛋白耦合受体109A G protein-coupled receptor 109A;Dendritic cell:树突状细胞;QS signal molecules:自诱导因子信号分子quorum sensing signal molecules;AI-2:自诱导物2 autoinducer 2;γ-PGA:多聚-γ-谷氨酸poly-γ-glutamic acid;AHL:N-酰化高丝氨酸内酯类化合物N-acylhomoserine lactones;PQS:假单胞菌喹诺酮信号pseudomonas quinolone signal;TLRs:Toll样受体Toll-like receptors;IL-8:白细胞介素-8 interleukin-8;Inflammatory gene expression:炎症基因的表达;NF-κB signaling:核因子-κB信号通路signaling nuclear factor-κB signaling;Inhibit innate immunity:抑制先天免疫;Naive CD4+ T cell:初始CD4+ T细胞;Treg differentiation:T细胞分化;IL-17:白细胞介素-17 interleukin-17;IL-22:白细胞介素-22 interleukin-22。 图 1 肠道微生物代谢产物与肠黏膜免疫的关系 Figure 1 Relationship between intestinal microbial metabolites and intestinal mucosal immunity[51] |
醋酸盐主要被肝脏代谢吸收,而丙酸盐则释放进入边缘组织。肠道中醋酸盐和丙酸盐主要由拟杆菌代谢产生,丁酸盐则由厚壁菌代谢产生[31]。研究发现,丁酸盐通过抑制组蛋白去乙酰化酶的表达,可有效调节肠道巨噬细胞的免疫效应,弱化这些巨噬细胞对定植于盲肠中的微生物免疫反应[32]。目前,作为组蛋白去乙酰酶抑制剂和G蛋白偶联受体,丁酸盐已被视作调控宿主免疫应答的重要调控因子[33]。此外,丁酸盐可抑制核因子-κB(nuclear factor-κB,NF-κB)表达[34],诱导黏蛋白合成[35],继而改变肠黏膜层的组成,抑制白细胞介素-12(interleukin 12,IL-12)和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)的释放[36],起到抗炎作用。在应激状况下,丁酸盐能减缓细菌移位,通过加强紧密连接的装配,增强肠屏障功能[37-38]。另外,丁酸盐和丙酸盐均能诱导结肠黏膜中调节性T细胞的分化,改善结肠炎症状[39]。
另有研究证实,肠道微生物产生的SCFAs能够结合G蛋白耦合受体43(G protein-coupled receptor 43,GPR43),作用于表达GPR43的中性粒细胞,进而抑制炎症反应[40],同时这些SCFAs还可以调节肠内分泌细胞中胰高血糖素样肽的合成[41]。SCFAs激活肠上皮细胞中G蛋白耦合受体41(G protein-coupled receptor 43,GPR41)和GPR43的表达,进一步激活丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路,促进炎性细胞因子的释放[42]。其中,丁酸盐和丙酸盐能够促进糖质新生,调控宿主糖类和能量代谢平衡[43]。
3.2.2 群体感应信号分子肠道微生物还会代谢产生一些群体效应信号分子,如群体感应(quorum sensing,QS)自诱导因子和多聚-γ-谷氨酸(poly-γ-glutamic acid,γ-PGA)参与调控宿主免疫应答(图 1)。群体感应是细菌调控机制中的重要组成部分,是指细菌通过自身产生的自诱导因子,感知周围细菌的多寡或密度,当菌群数量达到一定的阀值后,启动一系列基因的表达,以调节菌体的群体行为[44-45]。它是一种细菌间的信息交流,在多种细菌的生长过程中扮演重要角色,参与细菌的诸多行为,如:生物发光、共生现象、生物膜形成、抗生素生产、群体移动性、孢子形成、基因交换以及发病机理等均受到群体感应的调节。
细菌的群体感应自诱导因子大致可以分为以下4类:1)革兰阴性菌的信号分子,多为N-酰化高丝氨酸内酯类化合物(N-acylhomoserine lactones,AHL),也称为1型自诱导物(auto-inducer 1,AI-1),这是一类水溶性、膜通透性分子,可自由出入细胞,故胞内胞外浓度一致。AHL由LuxⅠ类蛋白酶催化脂肪酸代谢途径中的酰基-酰基载体蛋白的酰基侧链与S-腺苷甲硫氨酸中高丝氨酸部分结合,并进一步内酯化而生成的[46],参与调控种内细菌的生物发光、孢子形成、结合、营养获取、生物膜形成、生物腐蚀、抗菌等过程[47];2)革兰阳性菌的信号分子,多为氨基酸和短肽类;3)呋喃硼酸二酯,也称为2型自诱导物(auto-inducer 2,AI-2),主要与其生物合成关键酶LuxS组成AI-2/LuxS系统,介导革兰氏阳性和革兰氏阴性菌的种内和种间信息交流[48];4)扩散信号因子(diffusible signal factor,DSF),如已在铜绿假单胞杆菌发现的喹诺酮类信号分子、吩嗪类信号分子[49]及大肠埃希菌的吲哚等[50]。
群体感应自诱导因子能够被病原菌用来激活病原分子的表达促进细菌生物膜的形成,进而促进病原菌的侵袭以及在宿主体内的定植。如条件性致病原绿脓杆菌,会导致囊肿性纤维化,绿脓杆菌会产生多种群体感应自诱导物因子,如AHL、喹诺酮类自诱导因子来协助其致病过程[49, 52-53]。绿脓杆菌产生的AHL信号分子能选择性地减少细胞NF-κB的功能,尤其是抑制NF-κB诱导的炎性细胞因子及免疫相关基因的表达,进而有利于细菌在宿主中的定植感染[53]。另外,绿脓杆菌的群体感应信号分子4-羟基-2-烷基喹啉是假单胞菌喹诺酮信号分子(pseudomonas quinolone signal,PQS)的衍生物,PQS能够抑制NF-κB与其受体的结合,下调NF-κB的靶基因,延迟NF-κB抑制因子(IκB)的降解,进而激活NF-κB信号通路,抑制宿主的先天免疫[52]。另外,肠道中的大肠杆菌也会产生群体感应自诱导物AI-2,能够促进炎性细胞因子IL-8的释放,刺激肠上皮细胞中免疫相关通路的转录,上调负调控因子,进而抑制宿主的炎症反应[53]。
肠道微生物也能产生γ-PGA,其主要存在于枯草杆菌中,但是在哺乳动物肠道中并不存在,大豆发酵会产生γ-PGA[54]。研究证实枯草杆菌产生的γ-PGA能够调控Th1/Th2细胞发育,尤其是喜好刺激树突状细胞发育成Th1型的初始CD4+T细胞,诱导IL-12和白细胞介素-6(interleukin 6,IL-6)的释放[55],刺激自然杀伤性细胞的抗肿瘤免疫效应[56]。另外,γ-PGA能够促进调节性T细胞的选择性分化,抑制Th17细胞的分化[57]。饲粮补充γ-PGA可以增加肠道乳酸杆菌的数目,降低肠道梭杆菌的数量[58],抑制过敏性皮炎小鼠血清Th2型细胞因子的释放,起到抗炎症反应的作用[59]。
4 肠黏膜免疫系统对肠道微生物的调节肠道免疫系统由大量弥散分布在肠黏膜上皮和固有层的免疫细胞、免疫分子以及肠相关性淋巴组织等组成。肠黏膜上皮是肠道抵御外来病原微生物的第一道防线,由至少7个不同的细胞组成,如肠细胞、杯状细胞、内分泌细胞、潘氏细胞等构成了肠道的物理和化学屏障。其中,物理屏障主要由肠黏膜层、黏蛋白以及细胞紧密连接构成,化学屏障主要由肠上皮细胞尤其是潘氏细胞分泌的防卫素,如抗菌肽、溶菌酶、α防卫素、β防卫素等组成。这些防卫素可被空肠和回肠中的同源基因所编码,通过识别微生物相关分子受体,进而识别肠道菌群的定植,一旦机体识别到病原菌以及共生菌的异常定植入侵,肠黏膜就会分泌防卫素抵御细菌的异常入侵[60]。同时,机体可以分泌免疫球蛋白,这些免疫球蛋白分子可以透过肠道屏障覆盖于微生物表面,参与调控肠道菌群的移位,刺激肠免疫细胞的吞噬作用[61]。研究显示,免疫球蛋白分泌减少的小鼠,肠屏障功能发生损伤,而多酚类食物可刺激免疫球蛋白A(immunoglobulin A,IgA)的分泌,抵御高脂膳食引起的肠道菌群失衡,修复肠道功能[62]。
肠黏膜中的免疫细胞(巨噬细胞、树突状细胞、中性粒细胞等)对肠道菌群的变化异常敏感,当肠道微生物由黏膜层向Peyer’s淋巴结移位时,这些免疫细胞可迅速捕获异常的细菌片段或微生物,并吞噬掉这些微生物[63]。最新研究显示,淋巴细胞在肠屏障表面,尤其是在肠上皮栅栏的炎性反应的启动过程中有着重要作用,淋巴细胞可刺激肠黏膜防卫素的分泌,以应对外源病原微生物感染和组织损伤[64],进而诱导炎性细胞因子IL-6、IL-17、白细胞介素-22(interleukin 22,IL-22)、巨噬细胞刺激因子、TNF-α等的释放。其中,IL-22是代谢性疾病中非特异性肠黏膜防御的直接调控因子,诱导肠黏膜防卫素的分泌[65]。核激素受体视黄酸相关孤独受体γ可诱导淋巴细胞中的促炎症过程,进而诱导淋巴细胞分化成Ⅰ型、Ⅱ型和Ⅲ淋巴细胞,其中Ⅲ型淋巴细胞在肠道中最为丰富,对细菌的应答也最为明显,主要参与阻止肠道共生菌的移位。Ⅲ型淋巴细胞分泌的IL-22和IL-17能够直接作用于肠上皮细胞,刺激抗菌肽的分泌,进而非特异性的作用于肠道共生菌。淋巴细胞还可以调节Tregs淋巴球,通过诱导白细胞介素-10(interleukin 10,IL-10)的产生起到抗炎作用[66]。
5 小结与哺乳动物肠道健康的研究相比,家禽肠道健康方面的研究相对较少,而在蛋鸡上的研究更少。目前,利用营养添加剂的方式调控家禽肠道健康的研究取得了一定的进展,但是不同的添加剂影响的肠道菌群的类别不尽相同,并且因家禽生理(肠道短)和健康状况、饲养环境等不同,往往会影响添加剂的预期效果,因而其在生产上的实际效果也不尽相同。考虑到肠道健康对家禽健康的重要意义,深入揭示不同的肠道微生物种类和调控机制,尤其是肠道菌群与肠黏膜免疫之间的调控机制,研究通过调控肠道特定菌群,最大潜力地发挥肠道先天性免疫功能,对维护畜禽健康、提高畜禽的生长性能与畜产品安全等有着重要意义。
| [1] |
LEY R E, PETERSON D A, GORDON J I. Ecological and evolutionary forces shaping microbial diversity in the human intestine[J]. Cell, 2006, 124(4): 837-848. DOI:10.1016/j.cell.2006.02.017 |
| [2] |
ATARASHI K, HONDA K. Microbiota in autoimmunity and tolerance[J]. Current Opinion in Immunology, 2011, 23(6): 761-768. DOI:10.1016/j.coi.2011.11.002 |
| [3] |
YEGANI M, KORVER D R. Factors affecting intestinal health in poultry[J]. Poultry Science, 2008, 87(10): 2052-2063. DOI:10.3382/ps.2008-00091 |
| [4] |
CHOCT M. Managing gut health through nutrition[J]. British Poultry Science, 2009, 50(1): 9-15. DOI:10.1080/00071660802538632 |
| [5] |
REHMAN H U, VAHJEN W, AWAD W A, et al. Indigenous bacteria and bacterial metabolic products in the gastrointestinal tract of broiler chickens[J]. Archives of Animal Nutrition, 2007, 61(5): 319-335. DOI:10.1080/17450390701556817 |
| [6] |
CHOI J H, KIM G B, CHA C J. Spatial heterogeneity and stability of bacterial community in the gastrointestinal tracts of broiler chickens[J]. Poultry Science, 2014, 93(8): 1942-1950. DOI:10.3382/ps.2014-03974 |
| [7] |
QUINTEIRO-FILHO W M, RIBERIO A, FERRAZ-DE-PAULA V, et al. Heat stress impairs performance parameters, induces intestinal injury, and decreases macrophage activity in broiler chickens[J]. Poultry Science, 2010, 89(9): 1905-1914. DOI:10.3382/ps.2010-00812 |
| [8] |
FRITZ J C, MISLIVEC P B, PLA G W, et al. Toxicogenicity of moldy feed for young chicks[J]. Poultry Science, 1973, 52(4): 1523-1530. DOI:10.3382/ps.0521523 |
| [9] |
VAN IMMERSEEL F, DE BUCK J, PASMANS F, et al. Clostridium perfringens in poultry:an emerging threat for animal and public health[J]. Avian Pathology, 2004, 33(6): 537-549. DOI:10.1080/03079450400013162 |
| [10] |
CRHANOVA M, HRADECKA H, FALDYNOVA M, et al. Immune response of chicken gut to natural colonization by gut microflora and to Salmonella enterica serovar enteritidis infection[J]. Infection and Immunity, 2011, 79(7): 2755-2763. DOI:10.1128/IAI.01375-10 |
| [11] |
BRANTON S L, LOTT B D, DEATON J W, et al. The effect of added complex carbohydrates or added dietary fiber on necrotic enteritis lesions in broiler chickens[J]. Poultry Science, 1997, 76(1): 24-28. DOI:10.1093/ps/76.1.24 |
| [12] |
FERNANDEZ F, SHARMA R, HINTON M, et al. Diet influences the colonisation of Campylobacter jejuni and distribution of mucin carbohydrates in the chick intestinal tract[J]. Cellular and Molecular Life Sciences, 2000, 57(12): 1793-17801. DOI:10.1007/PL00000659 |
| [13] |
PHILLIPS N D, LA T, PLUSKE J R, et al. A wheat-based diet enhances colonization with the intestinal spirochaete Brachyspira intermedia in experimentally infected laying hens[J]. Avian Pathology, 2004, 33(4): 451-457. DOI:10.1080/0307945042000260620 |
| [14] |
SIMON K, VERWOOLDE M B, ZHANG J, et al. Long-term effects of early life microbiota disturbance on adaptive immunity in laying hens[J]. Poultry Science, 2016, 95(7): 1543-1554. DOI:10.3382/ps/pew088 |
| [15] |
KIM G B, Seo Y M, KIM C H, et al. Effect of dietary prebiotic supplementation on the performance, intestinal microflora, and immune response of broilers[J]. Poultry Science, 2011, 90(1): 75-82. DOI:10.3382/ps.2010-00732 |
| [16] |
PENDER C M, KIM S, POTTER T D, et al. In ovo supplementation of probiotics and its effects on performance and immune-related gene expression in broiler chicks[J]. Poultry Science, 2017, 96(5): 1052-1062. |
| [17] |
KAREEM K Y, LOH T C, FOO H L, et al. Effects of dietary postbiotic and inulin on growth performance, IGF1 and GHR mRNA expression, faecal microbiota and volatile fatty acids in broilers[J]. BMC Veterinary Research, 2016, 12: 163. DOI:10.1186/s12917-016-0790-9 |
| [18] |
KIARIE E, ROMERO L F, NYACHOTI C M. The role of added feed enzymes in promoting gut health in swine and poultry[J]. Nutrition Research Reviews, 2013, 26(1): 71-88. DOI:10.1017/S0954422413000048 |
| [19] |
ZHANG W H, JIANG Y, ZHU Q F, et al. Sodium butyrate maintains growth performance by regulating the immune response in broiler chickens[J]. British Poultry Science, 2011, 52(3): 292-301. DOI:10.1080/00071668.2011.578121 |
| [20] |
RINTTILÄ T, APAJALAHTI J. Intestinal microbiota and metabolites-implications for broiler chicken health and performance[J]. The Journal of Applied Poultry Research, 2013, 22(3): 647-658. DOI:10.3382/japr.2013-00742 |
| [21] |
O'NEILL L A. The interleukin-1 receptor/toll-like receptor superfamily:10 years of progress[J]. Immunological Reviews, 2008, 226(1): 10-18. DOI:10.1111/imr.2008.226.issue-1 |
| [22] |
KAWASAKI T, KAWAI T, AKIRA S. Recognition of nucleic acids by pattern-recognition receptors and its relevance in autoimmunity[J]. Immunological Reviews, 2011, 243(1): 61-73. DOI:10.1111/imr.2011.243.issue-1 |
| [23] |
KRIEG A M, VOLLMER J. Toll-like receptors 7, 8, and 9:linking innate immunity to autoimmunity[J]. Immunological Reviews, 2007, 220(1): 251-269. DOI:10.1111/imr.2007.220.issue-1 |
| [24] |
HALL J A, BOULADOUX N, SUN C M, et al. Commensal DNA limits regulatory T cell conversion and is a natural adjuvant of intestinal immune responses[J]. Immunity, 2008, 29(4): 637-649. DOI:10.1016/j.immuni.2008.08.009 |
| [25] |
LAMPHIER M S, SIROIS C M, VERMA A, et al. TLR9 and the recognition of self and non-self nucleic acids[J]. Annals of the New York Academy of Sciences, 2006, 1082: 31-43. DOI:10.1196/annals.1348.005 |
| [26] |
BOULADOUX N, HALL J A, GRAINGER J R, et al. Regulatory role of suppressive motifs from commensal DNA[J]. Mucosal Immunology, 2012, 5(6): 623-634. DOI:10.1038/mi.2012.36 |
| [27] |
TROY E B, KASPER D L. Beneficial effects of Bacteroides fragilis polysaccharides on the immune system[J]. Frontiers in Bioscience, 2010, 15(1): 25-34. DOI:10.2741/3603 |
| [28] |
HORAI R, SEN H N, CASPI R R. Commensal microbiota as a potential trigger of autoimmune uveitis[J]. Expert Review of Clinical Immunology, 2017, 13(4): 291-293. DOI:10.1080/1744666X.2017.1288098 |
| [29] |
DEN BESTEN G, VAN EUNRN K, GROEN A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. Journal of Lipid Research, 2013, 54(9): 2325-2340. DOI:10.1194/jlr.R036012 |
| [30] |
MACFARLANE S, MACFARLANE G T. Regulation of short-chain fatty acid production[J]. Proceedings of the Nutrition Society, 2003, 62(1): 67-72. DOI:10.1079/PNS2002207 |
| [31] |
CHANG P V, HAO L M, OFFERMANNS S, et al. The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(6): 2247-2252. DOI:10.1073/pnas.1322269111 |
| [32] |
KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology:short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [33] |
SEGAIN J P, DE LA BLÉTIÈRE D R, BOURREILLE A, et al. Butyrate inhibits inflammatory responses through NF-κB inhibition:implications for Crohn's disease[J]. Gut, 2000, 47(3): 397-403. DOI:10.1136/gut.47.3.397 |
| [34] |
BROWN C T, DAVIS-RICHARDSON A G, GIONGO A, et al. Gut microbiome metagenomics analysis suggests a functional model for the development of autoimmunity for type 1 diabetes[J]. PLoS One, 2011, 6(10): e25792. DOI:10.1371/journal.pone.0025792 |
| [35] |
ARTIS D. Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut[J]. Nature Reviews Immunology, 2008, 8(6): 411-420. DOI:10.1038/nri2316 |
| [36] |
LEWIS K, LUTGENDORFF F, PHAN V, et al. Enhanced translocation of bacteria across metabolically stressed epithelia is reduced by butyrate[J]. Inflammatory Bowel Diseases, 2010, 16(7): 1138-1148. DOI:10.1002/ibd.21177 |
| [37] |
RAQIB R, SARKER P, MILY A, et al. Efficacy of sodium butyrate adjunct therapy in shigellosis:a randomized, double-blind, placebo-controlled clinical trial[J]. BMC Infectious Diseases, 2012, 12(1): 111. DOI:10.1186/1471-2334-12-111 |
| [38] |
ARPAIA N, CAMPBELL C, FAN X Y, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation[J]. Nature, 2013, 504(7480): 451-455. DOI:10.1038/nature12726 |
| [39] |
BROWN A J, GOLDSWORTHY S M, BARNES A A, et al. The orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids[J]. The Journal of Biological Chemistry, 2003, 278(13): 11312-11319. DOI:10.1074/jbc.M211609200 |
| [40] |
TOLHUSST G, HEFFRON H, LAM Y S, et al. Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via the G-protein-coupled receptor FFAR2[J]. Diabetes, 2012, 61(2): 364-371. DOI:10.2337/db11-1019 |
| [41] |
KIM M H, KANG S G, PARK J H, et al. Short-chain fatty acids activate GPR41 and GPR43 on intestinal epithelial cells to promote inflammatory responses in mice[J]. Gastroenterology, 2013, 145(2): 396-406.e10. DOI:10.1053/j.gastro.2013.04.056 |
| [42] |
DE VADDER F, KOVATCHEVA-DATCHARY P, GONCALVES D, et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J]. Cell, 2014, 156(1/2): 84-96. |
| [43] |
MILLER M B, BASSLER B L. Quorum sensing in bacteria[J]. Annual Review of Microbiology, 2001, 55(1): 165-199. DOI:10.1146/annurev.micro.55.1.165 |
| [44] |
WATERS C M, BASSLER B L. Quorum sensing:cell-to-cell communication in bacteria[J]. Annual Review of Cell and Developmental Biology, 2005, 21(1): 319-346. DOI:10.1146/annurev.cellbio.21.012704.131001 |
| [45] |
DIGGLE S P, WINZER K, LAZDUNSKI A, et al. Advancing the quorum in Pseudomonas aeruginosa:MvaT and the regulation of N-acylhomoserine lactone production and virulence gene expression[J]. Journal of Bacteriology, 2002, 184(10): 2576-2586. DOI:10.1128/JB.184.10.2576-2586.2002 |
| [46] |
KIMURA N. Metagenomic approaches to understanding phylogenetic diversity in quorum sensing[J]. Virulence, 2014, 5(3): 433-442. DOI:10.4161/viru.27850 |
| [47] |
XAVIER K B, BASSLER B L. LuxS quorum sensing:more than just a numbers game[J]. Current Opinion in Microbiology, 2003, 6(2): 191-197. DOI:10.1016/S1369-5274(03)00028-6 |
| [48] |
DIGGLE S P, MATTHIJS S, WRIGHT V J, et al. The Pseudomonas aeruginosa 4-quinolone signal molecules HHQ and PQS play multifunctional roles in quorum sensing and iron entrapment[J]. Chemistry & Biology, 2007, 14(1): 87-96. |
| [49] |
PIÑERO-FERNANDERZ S, CHIMEREL C, KEYSER U F, et al. Indole transport across Escherichia coli membranes[J]. Journal of Bacteriology, 2011, 193(8): 1793-1798. DOI:10.1128/JB.01477-10 |
| [50] |
KIM K, KIM Y U, KOH B H, et al. HHQ and PQS, two Pseudomonas aeruginosa quorum-sensing molecules, down-regulate the innate immune responses through the nuclear factor-kappaB pathway[J]. Immunology, 2010, 129(4): 578-588. DOI:10.1111/j.1365-2567.2009.03160.x |
| [51] |
BLACHER E, LEVY M, TATIROVSK E, et al. Microbiome-Modulated Metabolites at the Interface of Host Immunity[J]. The Journal of Immunology, 2017, 198(2): 572-580. DOI:10.4049/jimmunol.1601247 |
| [52] |
KRAVCHENKO V V, ULEVITCH R J, KAUFMANN G F. Modulation of mammalian cell processes by bacterial quorum sensing molecules[C]//RUMBAUGH K. Quorum Sensing. Methods in Molecular Biology. New York: Humana Press, 2011, 692: 133-145.
|
| [53] |
ZARGAR A, QUAN D N, CARTER K K, et al. Bacterial secretions of nonpathogenic Escherichia coli elicit inflammatory pathways:a closer investigation of interkingdom signaling[J]. mBio, 2015, 6(2): e00025-15. |
| [54] |
SHIH I L, VAN Y T. The production of poly-(γ-glutamic acid) from microorganisms and its various applications[J]. Bioresource Technology, 2001, 79(3): 207-225. DOI:10.1016/S0960-8524(01)00074-8 |
| [55] |
UTO T, WANG X, SATO K, et al. Targeting of antigen to dendritic cells with poly(γ-glutamic acid) nanoparticles induces antigen-specific humoral and cellular immunity[J]. Journal of Immunology, 2007, 178(5): 2979-2986. DOI:10.4049/jimmunol.178.5.2979 |
| [56] |
LEE S W, PARK H J, PARK S H, et al. Immunomodulatory effect of poly-gamma-glutamic acid derived from Bacillus subtilis on natural killer dendritic cells[J]. Biochemical and Biophysical Research Communications, 2014, 443(2): 413-421. DOI:10.1016/j.bbrc.2013.11.097 |
| [57] |
LEE K, HWANG S, PAIK D J, et al. Bacillus-derived poly-γ-glutamic acid reciprocally regulates the differentiation of T helper 17 and regulatory T cells and attenuates experimental autoimmune encephalomyelitis[J]. Clinical and Experimental Immunology, 2012, 170(1): 66-76. DOI:10.1111/cei.2012.170.issue-1 |
| [58] |
JIN H E, CHOI J C, LIM Y T, et al. Prebiotic effects of poly-gamma-glutamate on bacterial flora in murine gut[J]. Journal of Microbiology and Biotechnology, 2017, 27(1): 412-415. |
| [59] |
LEE T Y, KIM D J, WON J N, et al. Oral administration of poly-gamma-glutamate ameliorates atopic dermatitis in Nc/Nga mice by suppressing Th2-biased immune response and production of IL-17A[J]. The Journal of Investigative Dermatology, 2014, 134(1): 704-711. |
| [60] |
VORA P, YOUDIM A, THOMAS L S, et al. β-defensin-2 expression is regulated by TLR signaling in intestinal epithelial cells[J]. Journal of Immunology, 2004, 173(9): 5398-5405. DOI:10.4049/jimmunol.173.9.5398 |
| [61] |
PABST O, CERVOIC V, HORNEF M. Secretory IgA in the coordination of establishment and maintenance of the microbiota[J]. Trends in Immunology, 2016, 37(5): 287-296. DOI:10.1016/j.it.2016.03.002 |
| [62] |
TAIRA T, YAMAGUCHI S, TARKAHASHI A, et al. Dietary polyphenols increase fecal mucin and immunoglobulin A and ameliorate the disturbance in gut microbiota caused by a high fat diet[J]. Journal of Clinical Biochemistry and Nutrition, 2015, 57(3): 212-216. DOI:10.3164/jcbn.15-15 |
| [63] |
GARIDOU L, POMIÉ C, KLOPP P, et al. The gut microbiota regulates intestinal CD4 T cells expressing RORγt and controls metabolic disease[J]. Cell Metabolism, 2015, 22(1): 100-112. DOI:10.1016/j.cmet.2015.06.001 |
| [64] |
BOSTIC J W, ZHOU L. Innate lymphoid cells in intestinal immunity and inflammation[J]. Cellular and Molecular Life Sciences, 2016, 73(2): 237-252. DOI:10.1007/s00018-015-2055-3 |
| [65] |
WANG X T, OTA N, MANZANILLO P, et al. Interleukin-22 alleviates metabolic disorders and restores mucosal immunity in diabetes[J]. Nature, 2014, 514: 237-241. DOI:10.1038/nature13564 |
| [66] |
QIU J, ZHOU L. Aryl hydrocarbon receptor promotes RORγt+ group 3 ILCs and controls intestinal immunity and inflammation[J]. Seminars in Immunopathology, 2013, 35(6): 657-670. DOI:10.1007/s00281-013-0393-5 |




