2. 河北工程大学农学院, 邯郸 056021
2. College of Agriculture, Hebei University of Engineering, Handan 056021, China
家禽业为了提高单位面积的产出及其经济效益,一直以来都十分关注饲养密度[1]。虽然较高的饲养密度可以带来较高的生产利润,但却对家禽的生产性能、健康和福利等方面产生负面影响。已有研究报道饲养密度对肉鸡生长性能、行为、肠道菌群及福利水平等方面的影响。高饲养密度显著降低肉鸡体重、平均日增重以及平均日采食量[2];高饲养密度影响步态得分[3],且鸡只腿部容易发生皮炎[4-5];各饲养密度间(900、675、540、450和380 cm2/只)肉鸡盲肠菌群结构相似性较低(33.1%~65.4%),即各饲养密度条件下肉鸡盲肠肠道菌群差异较大[6]。挥发性脂肪酸也称短链脂肪酸,是菌群代谢的主要产物和重要信息分子,不仅起到稳定菌群结构的作用,还参与肠道免疫动力和肠上皮屏障的调节[7],短链脂肪酸可降低肠道pH,达到促进益生菌的生长增殖并抑制特定病原菌定植的目的[8-10]。另外有研究表明肠道菌群与脑肠肽的分泌是相互作用的[11],如双歧杆菌四联活菌片可显著升高血管活性肽(vasoactive intestinal polypeptide,VIP)的水平,降低P物质(substance P,SP)的水平[12]。现已发现5-羟色胺(5-HT)、VIP和SP等脑肠肽与胃肠活动相关[13],但是目前针对饲养密度对肉鸡血清脑肠肽、盲肠挥发性脂肪酸影响的研究鲜有报道。因此本试验旨在研究饲养密度对肉鸡血清脑肠肽、盲肠挥发性脂肪酸和菌群多样性的影响,以期为肉鸡合理饲养密度的确定提供理论依据。
1 材料与方法 1.1 试验设计试验采用单因素设计,选取22日龄健康、体重相近的爱拔益加肉鸡144只,随机分成3个组,每组6个重复(1个鸡笼即为1个重复)。将3个组的肉鸡转入环境温度为21 ℃、相对湿度为60%的环境控制舱适应7 d。29日龄时开始正式试验,单个鸡笼饲养面积为0.64 m2,饲养密度分别设置为每笼6只(公母各占1/2,Ⅰ组)、每笼8只(公母各占1/2,Ⅱ组)和每笼10只(公母各占1/2,Ⅲ组),环境温度为21 ℃,相对湿度为60%,试验条件维持至试验结束,共计14 d。试验在动物营养学国家重点实验室环境控制舱内进行,温度、相对湿度自动控制(精度分别为±1 ℃和±7%),无风,24 h光照。
1.2 试验饲粮采用玉米-豆粕型饲粮,所用饲粮为参照NRC(1994)营养需要配制的粉状配合饲粮,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as-fed basis) |
试验肉鸡均采用单层平养,所选用笼具为本实验室研发的单层平养笼具[14],自由采食与饮水,常规免疫。
1.4 测定指标与方法 1.4.1 血液采集与指标测定分别于试验第7天和第14天,每组随机选取6只肉鸡(公母各占1/2,每个重复1只肉鸡),采用静脉采血,静置2 h后,3 000 r/min低温离心10 min吸取血清,至-80 ℃冰箱保存。
采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法测定血清中5-HT、VIP和SP的含量。
1.4.2 盲肠内容物的采集与指标测定 1.4.2.1 盲肠内容物的采集分别于试验第7天和第14天,每组随机选取6只肉鸡(公母各占1/2,每个重复1只肉鸡),剪断颈静脉处死,全身消毒后剖开腹腔,分离肠道,结扎回盲交界处,剪下盲肠迅速移至超净工作台,用无菌剪刀剪开肠壁,收集盲肠内容物,装置无菌离心管中,液氮速冻,-80 ℃保存备用。
1.4.2.2 挥发性脂肪酸含量的测定称取2 g左右盲肠食糜置于离心管中,然后准确加入5 mL超纯水,旋涡振荡3~5 min,5 000×g离心10 min;取上清液1 mL置于塑料安培管中,加入0.2 mL的25%偏磷酸溶液,盖紧盖子,振荡摇匀,并置冰水浴中30 min;10 000×g离心10 min,取上清液,上机测定盲肠内容物中乙酸、丙酸、丁酸及戊酸的含量。
1.4.2.3 DNA的提取采用Fast DNATM SPIN Kit For Soil提取样品基因组DNA。
1.4.2.4 细菌16S rDNA片段的PCR扩增以样品基因组DNA为模板,采用细菌通用引物GC-338F和518R扩增样品16S rDNA高变区序列,引物信息见表 2。
|
|
表 2 引物信息 Table 2 Primer information |
PCR扩增体系(50 μL)为:10×PCR buffer 5 μL;dNTP Mixture(2.5 mmol/L)3.2 μL;ExTaq(5 U/μL)0.4 μL;GC-338F(20 μmol/L)1 μL;518R(20 μmol/L)1 μL;模板DNA 50 ng;补ddH2O至50 μL。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃复性45 s,72 ℃延伸1 min,30个循环;最终72 ℃延伸10 min。PCR产物采用OMEGA公司DNA Gel Extraction Kit纯化回收。PCR仪为Biometra公司生产的T-gradient,凝胶成像仪为Bio-Rad公司的Gel-Doc2000凝胶成像系统。
1.4.2.5 PCR产物的变性梯度凝胶电泳(DGGE)分析取10 μL PCR的产物进行DGGE分析。采用变性梯度为35%~55%、浓度为7%的聚丙烯酰胺凝胶在1×TAE缓冲液中150 V、60 ℃下电泳5 h。DGGE完毕后,采用银染法染色,步骤如下:1)固定液(乙醇50 mL、冰醋酸2.5 mL,定容至500 mL)固定15 min;2)Milli-Q纯水清洗20 s和2 min各1次;3)银染液(硝酸银1 g、37%甲醛0.75 mL,定容至500 mL)染色15 min;4)Milli-Q纯水清洗20 s和2 min各1次;5)显色液(氢氧化钠7.5 g、37%甲醛2.5 mL,定容至500 mL)显色5~7 min;6)最后用终止液(乙醇50 mL、冰醋酸2.5 mL,定容至500 mL)终止反应。
1.4.2.6 DGGE图谱中优势电泳条带的序列测定DGGE凝胶条带回收后,以338F/518R为引物进行PCR扩增,PCR产物纯化后连接到pMD18-T载体上,转化至DH5α感受态细胞中,筛选阳性克隆测序。测序结果与GenBank中的序列进行比对,得到条带所代表的细菌类型。每个回收条带选取3个克隆进行序列测定。
1.5 数据处理试验数据使用SAS 9.2统计分析软件进行单因素分析(one-way ANOVA),采用Duncan氏法进行多重比较,P < 0.05为差异显著;采用软件Quantity One分析DGGE图谱多样性。
2 结果与分析 2.1 肉鸡盲肠菌群多样性 2.1.1 肉鸡盲肠菌群PCR-DGGE扩增指纹图谱分析由图 1和图 2可知,试验第7天,Ⅰ组和Ⅲ组肉鸡盲肠菌群条带数高于Ⅱ组;试验第14天,Ⅲ组肉鸡盲肠菌群条带数高于Ⅰ组和Ⅱ组。由表 3可知,相同试验时间内不同饲养密度下肉鸡盲肠菌群相似性指数为54.0%~80.3%,其中试验第7天,Ⅰ组和Ⅲ组间菌群结构相似性最低,相似性指数仅为54.0%,而试验第14天,Ⅰ组和Ⅱ组间菌群结构相似性最高,相似性指数仅为80.3%。总体来看,随着肉鸡日龄的增长,饲养密度对肉鸡盲肠菌群结构的影响也随之发生变化,且Ⅲ组与Ⅰ组间比Ⅲ组与Ⅱ组间菌群结构相似性较低,表明Ⅲ组与Ⅰ组间比Ⅲ组与Ⅱ组间盲肠菌群结构差异大。
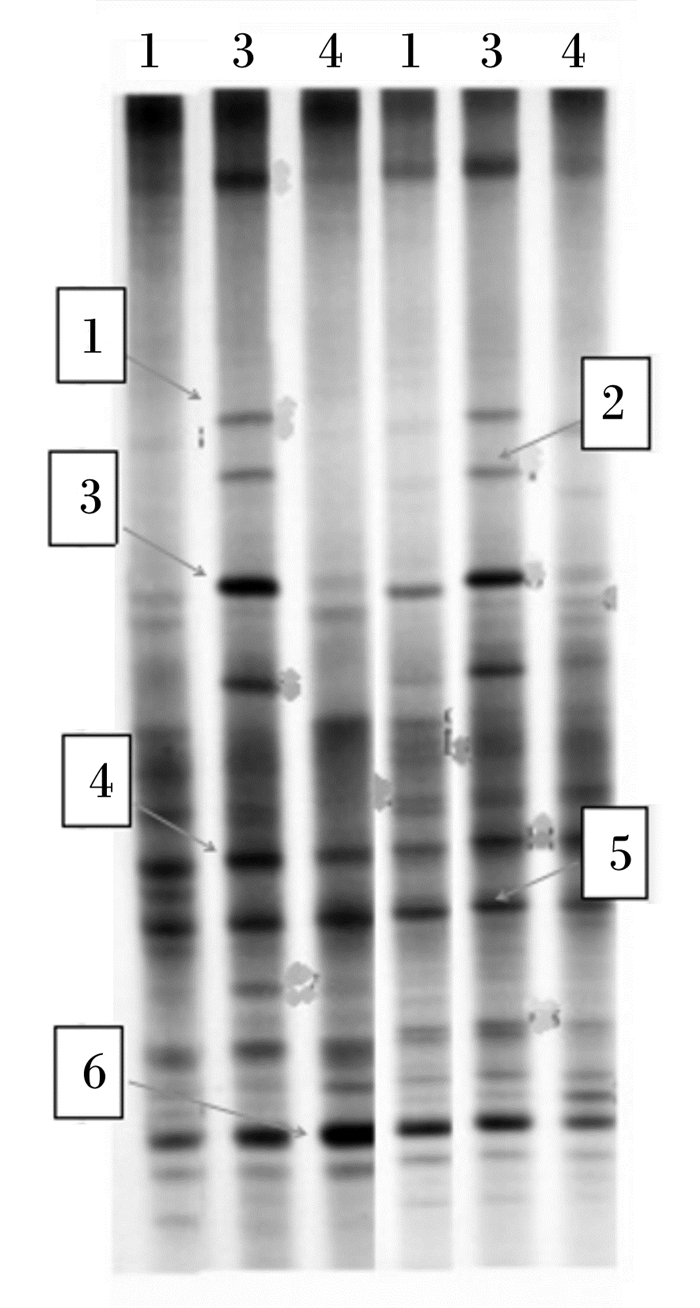
|
图谱左侧条带编号1、3和4分别为试验第7天Ⅰ组、Ⅲ组和Ⅱ组,图谱右侧条带编号1、3和4分别试验第14天Ⅰ组、Ⅲ组和Ⅱ组。 The left band numbered 1, 3 and 4 were groupsⅠ, Ⅲ and Ⅱ on the 7th day of the experiment, and the right band numbered 1, 3, 4 were groupsⅠ, Ⅲ and Ⅱ on the 14th day of the experiment, respectively. 图 1 肉鸡盲肠内容物菌群DGGE图谱 Figure 1 DGGE profiles of microflora in cecal contents of broilers |
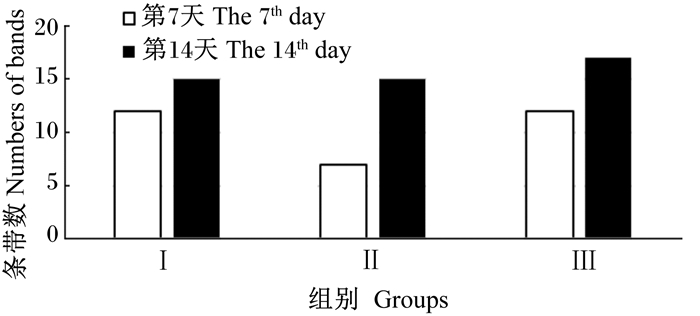
|
图 2 3个组间盲肠菌群条带数比较 Figure 2 Comparison of cecal microflora band number in three groups |
|
|
表 3 戴斯系数比较PCR-DGGE图谱的相似性 Table 3 Similarity of PCR-DGGE profiles compared by Deiss coefficient |
由表 4可知,饲养密度不同,肉鸡盲肠菌群多样性指数也不同。试验第7天,Ⅰ组肉鸡盲肠菌群香农指数和辛普森指数分别为2.441和0.910,Ⅱ组分别为1.921和0.850,Ⅲ组分别为2.453和0.912。试验第14天,Ⅰ组肉鸡盲肠菌群香农指数和辛普森指数分别为2.649和0.926,Ⅱ组分别为2.659和0.927,Ⅲ组分别为2.787和0.936。整个试验期间Ⅲ组肉鸡盲肠菌群香农指数和辛普森多样性指数均高于其他2个组。由此可见,饲养密度为每0.64 m2 10只时肉鸡盲肠菌群多样性和丰富度最佳。
|
|
表 4 肉鸡盲肠菌群结构多样性分析 Table 4 Analysis of the diversity of cecal microbial structure of broilers |
从肉鸡肠道菌群16S rDNA V3区PCR-DGGE指纹图谱中分别割胶回收了2条特异性条带和4条共性条带,由图 1和表 5可知,试验第7天和第14天3个组肉鸡盲肠内容物菌群中均检测出共性条带3号菌条带(Holdemanella biformis)、4号菌条带[单形拟杆菌(Bacteroides uniformis)]、5号菌条带(Eisenbergiella massiliensis)和6号菌条带(Ruminococcus faecis),仅Ⅲ组肉鸡盲肠内容物菌群检测出1号菌条带(Clostridium termitidis)和2号菌条带[普通拟杆菌(Bacteroides vulgatus)]。
|
|
表 5 DGGE图谱中条带的基因片段序列比对 Table 5 Comparison of genomic sequences of bands from DGGE profiles |
在6个测序结果中,条序列分布于厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),与GenBank数据库中细菌的相似度均在90%以上。
2.2 肉鸡盲肠挥发性脂肪酸含量由表 6可知,试验第7天和第14天,饲养密度对肉鸡盲肠挥发性脂肪酸含量的影响无显著差异(P>0.05)。但是总体分析,Ⅱ组肉鸡盲肠挥发性脂肪酸含量要略低于其他2组。
|
|
表 6 肉鸡盲肠挥发性脂肪酸含量 Table 6 The contents of volatile fatty acids in cecum of broilers |
由表 7可知,试验第7天,饲养密度对肉鸡血清5-HT、VIP和SP含量的影响无显著差异(P>0.05);试验第14天,Ⅲ组肉鸡血清VIP含量显著低于Ⅰ组和Ⅱ组(P < 0.05),而3个组间血清5-HT和SP含量无显著差异(P>0.05)。
|
|
表 7 肉鸡血清脑肠肽含量 Table 7 The contents of serum brain gut peptides of broilers |
肠道中的微生物对于宿主的营养消化吸收、免疫系统发育、机体能量代谢等具有重要的生理调节作用[15]。肠道菌群结构的平衡可有效地抑制病原微生物的侵袭,改善动物健康和生产性能[16]。但在应激(包括饲养密度过高或过低)条件下,肠道菌群平衡会被打破,可能会产生大量致病菌,容易致病,影响动物的健康生长[17]。Guardia等[18]报道,在3周龄时饲养密度显著影响肉鸡消化道菌群变化,变化最明显的是嗉囊和盲肠菌群(相似性分析R值分别为0.77和0.69);6周龄时饲养密度对嗉囊和盲肠菌群的影响存在显著差异(相似性分析R值分别为0.52和0.27)。本试验研究结果显示,Ⅲ组肉鸡盲肠菌群丰富度和多样性高于Ⅰ组和Ⅱ组,表明每0.64 m2 10只的饲养密度有利于肉鸡维持盲肠菌群生长与保持平衡。
鸡盲肠中细菌主要是厚壁菌门、拟杆菌门和变形菌门[19]。研究报道,随着饲养密度增加,即饲养密度高于450 cm2/只时,笼养蛋鸡十二指肠中有益菌(Lactobacillus gastricus和Lactobacillus alvi)消失,并对肠道菌群平衡产生不利影响[20]。本试验结果发现,Ⅲ组肉鸡盲肠中检测出特异性菌群Clostridium termitidis和Bacteroides vulgatus,而另外2个组并未发现。Clostridium termitidis属于厚壁菌门,研究表明,后肠微生物区系中的优势菌群是厚壁菌门,其含量占60%~70%,其中丁酸盐产生菌对肠上皮细胞的发育具有重要作用[21];Bacteroides vulgatus属于拟杆菌门,拟杆菌门是肠道革兰氏阴性菌中数量最大的一类细菌,产降解植物细胞壁的酶,参与植物细胞壁的降解,从而与肠道的消化功能有关[22]。
3.2 饲养密度对肉鸡盲肠挥发性脂肪酸含量的影响短链脂肪酸如乙酸、丙酸及丁酸等为肠道中碳水化合物及蛋白质发酵后的主要产物,肠道微生物产生的短链脂肪酸95%以上可被宿主吸收及代谢[23]。挥发性脂肪酸对宿主有着重要的生理功能,如调节肠道菌群,维持体液和电解质的平衡,给宿主提供能量,给肠道上皮细胞提供营养等[24]。而家禽的消化道中均有挥发性脂肪酸的存在,其中以盲肠为主要产生部位,且浓度较高[25]。本试验结果发现,饲养密度对肉鸡盲肠挥发性脂肪酸含量的影响无显著差异,但却发现Ⅱ组肉鸡盲肠挥发性脂肪酸含量要略低于其他2个组,其原因可能是Ⅱ组肉鸡盲肠中发酵产生挥发性脂肪酸的微生物要低于其他2组。
3.3 饲养密度对肉鸡血清脑肠肽含量的影响在胃肠和中枢神经系统中双重分布的神经肤类激素称为脑肠肽,作为神经传递介质或调节介质作用于胃肠道感觉神经末梢或平滑肌细胞的相应受体,调节胃肠道感觉与运动。其中血液循环中的脑肠肽类激素可随着血液,进入下丘脑,直接作用于弓状核相关化能受体,产生生物学效应[26-27]。
5-HT主要由肠内分泌细胞产生,参与调解肠道运动、感觉,直接或间接刺激肠道分泌。据报道,在生命早期缺乏菌群的时候,会导致血浆色氨酸水平的升高[11]。还有研究表明双歧杆菌则可以影响色氨酸的代谢[28],口服婴儿双歧杆菌可诱导大鼠神经递质多巴胺、5-HT血浆浓度升高[29]。VIP具有降低平滑肌紧张度、抑制胃肠运动和刺激胃肠分泌等作用[30],此外还能改善肠黏膜组织微循环及内环境,为肠上皮细胞提供营养物质和氧,并清除过多的氧自由基等有害物质[31],减少脂多糖对肠黏膜的损伤,促进有益菌的定殖使菌群比例恢复正常[32]。SP本身又是一种速激肽,可增加胃肠蠕动,强烈促消化道平滑肌收缩,加强结肠的集团推进运动,刺激小肠、结肠黏膜分泌水和电解质,使胃肠道的血管扩张,通透性增高,血浆外渗,并参与炎症过程和免疫反应[33]。
本研究发现,仅在试验第14天,Ⅲ组肉鸡血清VIP含量显著低于Ⅰ组和Ⅱ组,这可能与肠道内环境与菌群结构的变化相关,有待进一步探究;而适温条件21 ℃下,饲养密度对肉鸡血清5-HT和SP含量的影响无显著差异。
4 结论① Ⅲ组肉鸡盲肠菌群丰富度和多样性高于Ⅰ组和Ⅱ组,同时该组饲养密度有利于Clostridium termitidis和Bacteroides vulgatus的定植。
② 饲养密度对肉鸡盲肠发挥性脂肪酸含量的影响无显著差异。
③ Ⅲ组肉鸡血清VIP含量显著低于Ⅰ组和Ⅱ组,但饲养密度对肉鸡血清5-HT和SP含量的影响无显著差异。
| [1] |
张福锁. 中国养分资源综合管理策略和技术[C]//循环农业与新农村建设——2006年中国农学会学术年会论文集. 北京: 中国农学会, 2006: 371-374.
|
| [2] |
TONG H B, LU J, ZOU J M, et al. Effects of stocking density on growth performance, carcass yield, and immune status of a local chicken breed[J]. Poultry Science, 2012, 91(3): 667-673. DOI:10.3382/ps.2011-01597 |
| [3] |
ESTEVEZ I. Density allowances for broilers:where to set the limits?[J]. Poultry Science, 2007, 86(6): 1265-1272. DOI:10.1093/ps/86.6.1265 |
| [4] |
DOZIER W A, THAXTON J P, BRANTON S L, et al. Stocking density effects on growth performance and processing yields of heavy broilers[J]. Poultry Science, 2005, 84(8): 1332-1338. DOI:10.1093/ps/84.8.1332 |
| [5] |
ARNOULD C, FAURE J M. Use of pen space and activity of broiler chickens reared at two different densities[J]. Applied Animal Behaviour Science, 2003, 84(4): 281-296. DOI:10.1016/j.applanim.2003.07.003 |
| [6] |
赵乾宇. 饲养密度对笼养蛋鸡小肠组织结构和盲肠细菌种群的影响[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2015.
|
| [7] |
徐万里, 陆高, 梁世杰, 等. 短链脂肪酸介导的菌群-宿主互动与肠易激综合征的研究进展[J]. 世界华人消化杂志, 2015, 36(23): 5815-5822. |
| [8] |
ESWARAN S, MUIR J, CHEY W D. Fiber and functional gastrointestinal disorders[J]. The American Journal of Gastroenterology, 2013, 108(5): 718-727. DOI:10.1038/ajg.2013.63 |
| [9] |
SILK D B A, DAVIS A, VULEVIC J, et al. Clinical trial:the effects of a trans-galactooligosaccharide prebiotic on faecal microbiota and symptoms in irritable bowel syndrome[J]. Alimentary Pharmacology & Therapeutics, 2009, 29(5): 508-518. |
| [10] |
FUKUDA S, TOH H, HASE K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature, 2011, 469(7331): 543-547. DOI:10.1038/nature09646 |
| [11] |
白宇, 胡云霞, 陈俊伟, 等. 细菌-脑-肠轴理论体系的建立[J]. 东南大学学报(医学版), 2016, 35(5): 781-785. |
| [12] |
傅丽霞. 双歧杆菌四联活菌片治疗腹泻型肠易激综合征患者的疗效及对血清脑肠肽水平的影响[J]. 中国微生态学杂志, 2017, 29(2): 179-181. |
| [13] |
陈倩. 隔药灸脐法对脾气虚型肠易激综合征患者血清脑肠肽影响的临床研究[D]. 硕士学位论文. 济南: 山东中医药大学, 2011.
|
| [14] |
张敏红, 苏红光, 冯京海. 采集用于建立肉鸡生活环境舒适性评价模型数据的方法和专用装置: 中国, CN103404447A[P]. 2015-11-18. http://industry.wanfangdata.com.cn/yj/Detail/Patent?id=Patent_CN201310353837.X
|
| [15] |
PAN D, YU Z T. Intestinal microbiome of poultry and its interaction with host and diet[J]. Gut Microbes, 2014, 5(1): 108-119. DOI:10.4161/gmic.26945 |
| [16] |
肖英平, 杨彩梅, 代兵, 等. 基于高通量测序的丁酸梭菌对肉鸡盲肠菌群结构的影响[J]. 浙江农业学报, 2017, 29(3): 373-379. |
| [17] |
SEKELJA M, RUD I, KNUTSEN S H, et al. Abrupt temporal fluctuations in the chicken fecal microbiota are explained by its gastrointestinal origin[J]. Applied and Environmental Microbiology, 2012, 78(8): 2941-2948. DOI:10.1128/AEM.05391-11 |
| [18] |
GUARDIA S, KONSAK B, COMBES S, et al. Effects of stocking density on the growth performance and digestive microbiota of broiler chickens[J]. Poultry Science, 2011, 90(9): 1878-1889. DOI:10.3382/ps.2010-01311 |
| [19] |
QU A, BRULC J M, WILSON M K, et al. Comparative metagenomics reveals host specific metavirulomes and horizontal gene transfer elements in the chicken cecum microbiome[J]. PLoS One, 2008, 3(8): e2945. DOI:10.1371/journal.pone.0002945 |
| [20] |
于江明, 王秋菊, 刘勃麟, 等. 不同饲养密度对笼养蛋鸡十二指肠肠道菌群的影响[J]. 动物营养学报, 2016, 28(3): 899-907. |
| [21] |
PRYDE S E, DUNCAN S H, HOLD G L, et al. The microbiology of butyrate formation in the human colon[J]. FEMS Microbiology Letters, 2002, 217(2): 133-139. DOI:10.1111/fml.2002.217.issue-2 |
| [22] |
彭骞骞, 王雪敏, 张敏红, 等. 持续偏热环境对肉鸡盲肠菌群多样性的影响[J]. 中国农业科学, 2016, 49(1): 186-194. |
| [23] |
GIBSON G R, MACFARLANE G T. Human colonic bacteria:role in nutrition, physiology and pathology[M]. Boca Raton: CRC Press, 1995.
|
| [24] |
陈燕, 曹郁生, 刘晓华. 短链脂肪酸与肠道菌群[J]. 江西科学, 2006, 24(1): 38-40, 69. |
| [25] |
ANNISON E F, HILL K J, KENWORTHY R. Volatile fatty acids in the digestive tract of the fowl[J]. British Journal of Nutrition, 1968, 22(2): 207-216. DOI:10.1079/BJN19680026 |
| [26] |
DOCKRAY G J. Cholecystokinin and gut-brain signalling[J]. Regulatory Peptides, 2009, 155(1/2/3): 6-10. |
| [27] |
TOMITA R. Regulation of vasoactive intestinal peptide and substance P in the human pyloric sphincter[J]. Hepato-Gastroenterology, 2009, 56(94/95): 1403-1406. |
| [28] |
DESBONNET L, GARRETT L, CLARKE G, et al. The probiotic Bifidobacteria infantis:an assessment of potential antidepressant properties in the rat[J]. Journal of Psychiatric Research, 2008, 43(2): 164-174. DOI:10.1016/j.jpsychires.2008.03.009 |
| [29] |
DESBONNET L, GARRETT L, CLARKE G, et al. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression[J]. Neuroscience, 2010, 170(4): 1179-1188. DOI:10.1016/j.neuroscience.2010.08.005 |
| [30] |
HAMRMAR A J, FAHRENKRUG J, GOZES I, et al. Pharmacology and functions of receptors for vasoactive intestinal peptide and pituitary adenylate cyclase-activating polypeptide:IUPHAR review[J]. British Journal of Pharmacology, 2012, 166(1): 4-17. DOI:10.1111/j.1476-5381.2012.01871.x |
| [31] |
吴美玉, 胡团敏. 血管活性肠肽与消化系疾病的研究进展[J]. 世界华人消化杂志, 2012, 20(16): 1453-1457. |
| [32] |
CAMPOS-SALINAS J, CAVAZZUTI A, O'VALLE F, et al. Therapeutic efficacy of stable analogues of vasoactive intestinal peptide against pathogens[J]. Journal of Biological Chemistry, 2014, 289(21): 14583-14599. DOI:10.1074/jbc.M114.560573 |
| [33] |
陈晓敏, 张燕华, 吴跃龙. 肠易激综合征结肠黏膜P物质和血管活性肠肽变化的研究[J]. 实用临床医药杂志, 2008, 12(11): 31-33. |




